影响肝内胆管细胞癌预后高危因素的临床回顾分析
周恺乾 刘维峰 樊嘉 周俭 王征
影响肝内胆管细胞癌预后高危因素的临床回顾分析
周恺乾 刘维峰 樊嘉 周俭 王征
目的 探究影响肝内胆管细胞癌(ICC)手术预后的可能因素,为进一步改善ICC的预后提供借鉴。方法 对2009年1月至2011年12月期间103例行根治性手术切除的ICC病人临床病理特征进行生存率、无瘤生存率的单因素分析,并通过Cox多因素分析得到有独立意义的预后指标。结果 103例ICC病人术后1年、3年生存率为77.70%、45.76%,无瘤生存率为67.65%、40.75%。单因素分析提示性别、肿瘤数目、肿瘤大小、脉管侵犯、淋巴结转移、术前CEA影响病人的无瘤生存率及生存率。Cox多因素分析提示脉管侵犯、淋巴结转移和术前癌胚抗原(CEA)是影响ICC病人生存的独立因素;肿瘤大小、神经束侵犯、脉管侵犯和术前CEA是影响ICC病人无瘤生存的独立因素。结论 ICC的局部侵犯和淋巴结转移是影响ICC病人预后的重要因素,如何进一步规范ICC的治疗,包括术前评估、术中手术方式(是否需常规的淋巴结清扫)、术后辅助方案的制定,需要多中心随机对照研究结果的支持。
肝内胆管细胞癌;手术切除;预后因素
肝内肝管细胞癌(intrahepatic cholangio carcinoma,ICC)占原发性肝肿瘤的5%~30%[1],仅次于肝细胞肝癌。按肿瘤来源分类,ICC与肝门部胆管癌,远端胆管癌同属于胆管细胞癌[2]。据世界卫生组织的数据表明,ICC的死亡率在全球范围内呈上升趋势[3]。对于ICC的形成机制、关键因素、生物学和临床预后等方面的研究与肝细胞癌等还有较大差距。本研究旨在探求影响ICC预后的可能因素,为进一步改善ICC的预后提供借鉴。
资料与方法
一、研究对象
收集2009年1月至2011年12月期间,在复旦大学附属中山医院肝外科行根治性手术切除,术后病理证实为ICC,有完整随访记录的103例病人的临床资料。上述病人术前均未接受手术、放疗或介入等其它治疗。其中男性58例,女性43例,年龄33~81岁,平均(58.7±10.8)岁;肿瘤原发灶最大直径2~15 cm,平均(6.2±2.9) cm。
二、手术范围的选择
根据术前影像学证据所提示的信息,包括肿瘤部位、大小、侵犯程度等,结合病人基础条件和肝功能水平,并在术中按实际情况进行调整,施行部分肝切除术、半肝切除术、扩大半肝切除术和特殊肝段切除术等。依据术中探查有无淋巴结转移,决定是否行淋巴结清扫术。
三、随访及统计学分析
病人术后定期门诊或通讯随访,随访至2014年12月。所有资料应用SPSS(22.0版)统计软件处理,Kaplan-Meier方法计算术后生存率和无复发生存率,利用Cox比例风险模型进行单因素分析,筛选出有意义的变量,进入逐步回归的Cox多因素分析,P<0.05为差异有统计学意义。
结 果
截止至2014年12月,103例ICC病人术后1年、3年生存率分别为77.70%、45.76%,中位生存时间为30.7个月(图1);无瘤生存率分别为67.65%、40.75%,中位无瘤生存时间为26.5个月(图2)。

图1 ICC病人术后生存曲线
单因素分析显示(表1),性别(P=0.045)、肿瘤数目(P=0.043)、肿瘤大小(P=0.004)、肿瘤分化程度(P=0.028)、脉管侵犯(P=0.005)、淋巴结转移(P<0.001)、术前癌胚抗原(CEA)(P<0.001)是影响ICC手术切除病人生存的危险因素;而性别(P=0.024)、肿瘤数量(P=0.039)、包膜有无(P=0.049)、肿瘤大小(P=0.003)、神经束侵犯(P=0.003)、脉管侵犯(P=0.008)、淋巴结转移(P=0.003)、术前癌胚抗原(CEA)(P<0.001)是影响ICC手术切除病人无瘤生存的危险因素。
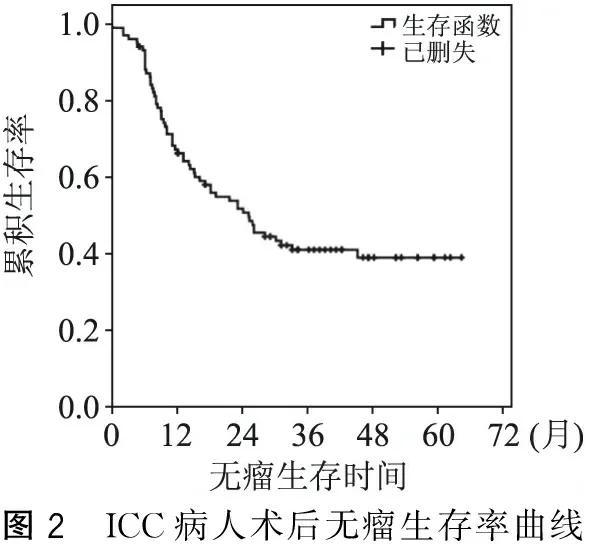
图2 ICC病人术后无瘤生存率曲线
Cox多因素分析提示,脉管侵犯(HR:4.32;95%CI:2.19~8.54;P<0.01)、淋巴结转移(HR:3.89;95%CI:1.58~9.58;P<0.003)和术前CEA(HR:4.16;95%CI:2.19~7.90;P<0.01) 是影响ICC手术切除病人生存的独立因素;肿瘤大小(HR:2.28;95%CI:1.26~4.13;P<0.01)、神经束侵犯(HR:6.68; 95%CI:1.73~25.74;P<0.01)、脉管侵犯(HR:3.07;95%CI:1.60~5.90;P<0.01)和术前CEA(HR:3.33;95%CI:1.77~6.26;P<0.01)是影响ICC手术切除病人无瘤生存的独立因素。
讨 论
随着医学影像学和外科技术的进展,ICC的手术切除率、术后生存率及生存质量均较前有一定的提高,但与其他肝脏肿瘤治疗相比,ICC的疗效还远不尽如人意。结合国内外的最新进展及共识,回顾我科近5年103例ICC外科治疗的临床经验,探究影响ICC预后的危险因素,以进一步提高ICC外科治疗的疗效。
肿瘤数目和肿瘤大小是描述肿瘤特性的常用指标。本研究中,肿瘤多发定义为多个病灶、包括子灶/卫星灶,占总病例数的29.1%(n=30)。多发肿瘤多见也预示了ICC易侵袭,术后易转移的特性。结果中虽仅肿瘤大小是影响ICC术后无瘤生存的独立因素,但在国外的文献中多次报道肿瘤大小及数目对预后的负面影响[4]。

表1 影响ICC预后的Cox单因素分析
注:HR:风险比;95%CI:95%可信区间;AFP:甲胎蛋白;CEA:癌胚抗原;ALT:丙氨酸转氨酶
肿瘤的生物学特性对预后具有决定性的意义。ICC具有对周围组织侵袭的特性,由于早期无明显临床症状,确诊时常常已发生胆管侵犯、脉管侵犯以及周围神经束侵袭。大量文献提示手术切缘阴性有助于改善预后[5],在切缘等级相同情况下本研究未提示进一步扩大手术切除的范围、提高根治率对改善预后有帮助,但术中快速病理达到R0根治是手术的最基本要求。
ICC病人易发生淋巴结转移,本研究亦提示淋巴结转移是影响术后生存的独立危险因素。13位病人在术中行淋巴结清扫术,占样本总数的12.6%,其中5例经术后病理确证为淋巴结转移,但5例病人术后1年生存率为0,中位生存时间仅7.5个月。如此低的生存率虽不能排除样本选择偏倚的存在,但可以认为手术切除对已发生淋巴结转移的ICC病例(即使仅有肝门淋巴结转移)获益十分有限。因此,建议对于ICC病人术前常规进行正电子发射计算机断层显像-CT(PET-CT)检查,以评估是否有淋巴结转移,再谨慎的决定治疗方式。对于术前无淋巴结转移的ICC病人,本研究发现淋巴结清扫对预后无帮助(P=0.446)。然而,是否需行常规的淋巴结清扫术,目前仍然存在很大争议。Morine等[6]的回顾性研究发现,相对于扩大手术(无论是否淋巴结转移,均在肝切除时联合预防性淋巴结清扫),接受个体化手术(根据淋巴结状态决定是否实施淋巴结清扫)的ICC病人术后3年生存率相似,因此他们认为常规淋巴结清扫并不必要。日本其他学者的观点与之相似。Shimada等[7]回顾性地研究了49例ICC术后的复发模式,发现23例复发的病人中,17例是肝内转移,另6例则是其他部位复发(主要是腹膜转移)。基于这点,笔者认为既然多数肿瘤在肝内复发,而淋巴结转移也不仅仅局限在局部淋巴结,故而常规淋巴结清扫并非必须。但近期意大利的一项多中心的前瞻性注册研究提出了不同的声音[8]。该研究具有目前最大ICC病例量(n=434),其中淋巴结转移的比例约36.9%,多数病人接受了系统性的淋巴结清扫(62.2%)。淋巴结清扫的潜在生存获益指数是5.9分(淋巴结转移病人的5年生存率×淋巴结转移的病人比例=15.9%×36.9%,根据经验,5.9分支持淋巴结清扫),故而笔者推荐,对于所有的ICC病人均应行淋巴结清扫。
ICC目前尚缺乏广泛认可的全身治疗手段,目前甚至缺少评估化疗有效性的III期随机对照试验,ICC根治后的辅助治疗则更加缺乏。ICC术后的辅助治疗一般可分为局部治疗和全身治疗,前者包括放疗、经动脉治疗(化学栓塞TACE、化学灌注TACI、放射性栓塞TARE)和消融[9],后者常用的药物有替吉奥和铂类化疗药等。本研究观察了17例手术切除术后行TACE病人的生存情况,与未行辅助治疗的病人相比差异无统计学意义(P=0.220)。Shen等[10]发现,ICC根治术后行TACE,虽未能延缓复发,但是可延长早期复发病人的总生存时间。Sur等[11]发现,切除术后的全身化疗,能够显著提高淋巴结阳性和切缘阳性的ICC病人生存获益。ICC术后合理的序贯治疗方案仍需设计合理的临床试验加以验证。
胆管上皮细胞以分泌CEA为特征,血清中CEA的变化能反映胆道疾病。在发现和监测肿瘤方面,CEA的敏感性和特异性已得到初步证实[12]。CEA在提示不良预后和选择手术策略方面也显示了一定的价值。然而,学术界就术前CEA水平是否与预后相关仍有争议。Miwa等[13]对此持否定意见。万春等[14]和徐瑞华等[15]的结论与本研究一致,都表明CEA是影响预后的独立危险因素。Luo等[16]还发现,CEA>100 μg/L的病人,其预后明显比CEA异常升高但未达到100 μg/L的病人更差。目前仍欠缺CEA与ICC预后的确切循证依据。现有研究表明CEA与肿瘤生成的病理生理过程有关系,例如:CEA与肿瘤的免疫防御、细胞黏附、细胞生存和转移及免疫微环境相关[17]。CEA能保护肿瘤细胞免受失巢凋亡,还能与肝Kupffer细胞结合,使其激活并分泌包括IL-1、 IL-10、IL-6和TNF-α在内的多种细胞因子,上调肝窦内皮细胞表面的黏附分子,利于肿瘤细胞滞留、侵袭[18]。ICC肝内转移灶常见,术后复发也大多为肝内复发,或许与这不无关系。
如何进一步规范ICC的治疗,包括术前评估、术中手术方式(是否需常规的淋巴结清扫)、术后辅助方案的制定,需要多中心随机对照研究结果的支持;ICC基础研究方面的突破则是进一步提高ICC疗效的关键。
1 Amini N,Ejaz A,Spolverato G,et al.Temporal trends in liver-directed therapy of patients with intrahepatic cholangiocarcinoma in the United States:A population-based analysis.J Surg Oncol,2014,110:163-170.
2 Nakeeb A,Pitt HA,Sohn TA,et al.Cholangiocarcinoma-A spectrum of intrahepatic,perihilar,and distal tumors.Ann Surg,1996,224:463-473.
3 Patel T.Worldwide trends in mortality from biliary tract malignancies.BMC Cancer,2002,2:10.
4 de Jong MC,Nathan H,Sotiropoulos GC,et al.Intrahepatic Cholangiocarcinoma:An international multi-institutional analysis of prognostic factors and lymph node assessment.J Clin Oncol, 2011,29:3140-3145.
5 Yamashita Y,Taketomi A,Morita K,et al.The impact of surgical treatment and poor prognostic factors for patients with intrahepatic cholangiocarcinoma:retrospective analysis of 60 patients. Anticancer Res,2008,28:2353-2359.
6 Morine Y,Shimada M,Utsunomiya T,et al.Clinical impact of lymph node dissection in surgery for peripheral-type intrahepatic cholangiocarcinoma.Surgery Today,2012,42:147-151.
7 Shimada M,amashita Y,Aishima S,et al.Value of lymph node dissection during resection of intrahepatic cholangiocarcinoma.Briti J Surg,2001,88:1463-1466.
8 Ribero D,Pinna AD,Guglielmi A,et al.Surgical approach for long-term survival of patients with intrahepatic cholangiocarcinoma: a multi-institutional analysis of 434 patients.Arch Surg,2012, 147:1107-1113.
9 Bridgewater J, Galle PR, Khan SA, et al. Guidelines for the diagnosis and management of intrahepatic cholangiocarcinoma. J Hepatol, 2014,60:1268-1289.
10Shen WF,Zhong W,Liu Q,et al.Adjuvant transcatheter arterial chemoembolization for intrahepatic cholangiocarcinoma after curative surgery:retrospective control study.World J Surg,2011, 35:2083-2091.
11Sur MD,In H,Sharpe SM,et al. Defining the benefit of adjuvant therapy following resection for intrahepatic cholangiocarcinoma. Ann Surg Oncol, 2014.
12Malaguarnera G,Paladina I,Giordano M,et al. Serum markers of intrahepatic cholangiocarcinoma. Dis Markers, 2013,34:219-228.
13Miwa S,Miyagawa S,Kobayashi A,et al. Predictive factors for intrahepatic cholangiocarcinoma recurrence in the liver following surgery.J Gastroenterol,2006,41:893-900.
14万春,陈孝平,赵玉亭.影响老年人肝内胆管细胞癌手术预后的因素分析.腹部外科,2009,22:238-240.
15徐瑞华,李方华,陈晓勤,等. 84例肝内胆管细胞癌患者预后因素分析.癌症, 2009,28:528-532.
16Luo X,Yuan L,Wang Y,et al. Survival outcomes and prognostic factors of surgical therapy for all potentially resectable intrahepatic cholangiocarcinoma: a large single-center cohort study. J Gastrointest Surg,2014,18:562-572.
17Arrieta O,Saavedra-Perez D,Kuri R,et al. Brain metastasis development and poor survival associated with carcinoembryonic antigen (CEA) level in advanced non-small cell lung cancer: a prospective analysis. BMC Cancer,2009,9:119.
18Thomas P,Forse RA,Bajenova O.Carcinoembryonic antigen (CEA) and its receptor hnRNP M are mediators of metastasis and the inflammatory response in the liver. Clin Exp Metastasis,2011,28:923-932.
Impact of surgical treatment and poor prognostic factors for patients with intrahepatic cholangiocarcinoma: a retrospective report of 103 patients
ZhouKaiqian,LiuWeifeng,FanJia,ZhouJian,WangZheng.
LiverCancerInstitute,AffiliatedZhongshanHospital,FudanUniversity,Shanghai200032,China
WangZheng,Email:wang.zheng@zs-hospital.sh.cn
Objective To provide rationales for improved outcomes of intrahepatic cholangiocarcinoma (ICC) by examining its prognostic factors after resection. Methods A total of 103 patients undergoing surgery for ICC with a curative intent between 2009 and 2011 were recruited. Their clinicopathological data associated with overall survival (OS) and disease free survival (DFS) were evaluated with univariate and multivariate analysis.Results The 1 and 3-year rates of OS were 77.7% and 45.8%. As to DFS, it was 67.65% and 40.75% respectively. Factors associated with adverse prognosis included gender, tumor number, tumor size, lymphovascular invasion, lymph node metastasis (LNM) and preoperative CEA according to univariate analysis. And multivariate analysis indicated that lymphovascular invasion, LNM and CEA influenced OS independently. And tumor size, perineural invasion, lymphovascular invasion and CEA could predict higher risks of recurrence.Conclusions Local invasion and LNM of ICC are important prognostic factors. Whether or not standards of care for ICC include preoperative examination, regular lymphadenectomy and adjuvant therapy requires the supports of randomized multi-center trials.
Intrahepatic cholangiocarcinoma; Curative resection; Prognostic factors
·论 著·(肝脏肿瘤专题)
国家自然基金面上项目(81372650)
200032 上海,复旦大学附属中山医院肝外科 复旦大学肝癌研究所
王征,Email:wang.zheng@zs-hospital.sh.cn
R735.7
A
10.3969/j.issn.1003-5591.2015.02.002
2015-03-05)

