肌肉萎缩盒F蛋白和肌肉特异性环指蛋白1对慢性肾脏病患者骨骼肌萎缩的调控机制
张月月 综述 袁伟杰 审校
·基础医学·
肌肉萎缩盒F蛋白和肌肉特异性环指蛋白1对慢性肾脏病患者骨骼肌萎缩的调控机制
张月月 综述 袁伟杰 审校
胰岛素抵抗、酸中毒、炎症状态等可导致慢性肾脏病患者骨骼肌萎缩,其主要原因可能与泛素溶酶体系统活性亢进有关。泛素溶酶体系统发挥作用需要3种成分:(1)E1连接酶,起活化泛素的作用;(2)E2连接酶,将活化的泛素转运到需要降解的蛋白质分子上;(3)E3连接酶,发挥将泛素准确转运到靶蛋白的调节作用。肌肉特异性环指蛋白1(MuRF1)和肌肉萎缩盒F蛋白 (MAFbx/atrogin-1) 是两种重要的骨骼肌特异性E3连接酶,其作用可受多种因子影响。探讨MuRF1、MAFbx/atrogin-1与其调控因子之间的相互作用可为骨骼肌萎缩的防治提供很好的思路。
骨骼肌萎缩 泛素溶酶体系统 肌肉特异性环指蛋白 肌肉萎缩盒F蛋白
骨骼肌功能正常是保证机体运动、维持正常生活和生存的基本条件。除了失用性萎缩症外,很多疾病如癌症、艾滋病、肾衰竭、充血性心力衰竭、慢性阻塞性肺病、脓毒症和烧伤等均可引起肌肉萎缩,导致恶病质。慢性肾脏病(CKD)患者尤其是老年患者和接受透析治疗的患者,由于脂肪和肌肉的丢失,肾功能衰竭进展速度加快[1],并发症和死亡风险明显增加。CKD患者肌肉萎缩的原因可能与食欲下降及限制蛋白饮食所导致的蛋白、能量摄入不足有关。胰岛素抵抗、炎症、糖皮质激素及代谢性酸中毒等所导致的高代谢状态均可促进蛋白降解,引起骨骼肌萎缩。此外,运动减少、生长激素/胰岛素样生长因子1(IGF-1)抵抗、睾酮缺乏也可导致蛋白合成减少,进一步导致骨骼肌萎缩。目前认为,上述原因致CKD患者肌萎缩现象均与泛素溶酶体途径(UPP)活化有关[2-3]。
UPP的作用
UPP是骨骼肌细胞内蛋白降解的主要通路,属真核细胞最复杂的蛋白降解机制,与骨骼肌短寿命蛋白和部分长寿命的肌纤维蛋白的降解有关,肾切除致CKD啮齿动物模型的肌肉萎缩常伴随着编码UPP不同成分的mRNA水平的增加。UPP首先通过一种热休克蛋白共作用因子——泛素与底物蛋白结合,而后26S的蛋白酶体识别需要被降解的蛋白,将靶蛋白降解为小肽片段。骨骼肌利用UPP降解靶蛋白需要3种成分:(1)E1连接酶,起活化泛素作用;(2)E2连接酶,与活化的泛素结合并将其转运至靶蛋白;(3)E3连接酶(泛素蛋白连接酶),发挥调节作用,以确保E2连接酶将泛素准确转运至靶蛋白。E3连接酶的几种结合位点,既可与靶蛋白结合,又可与E2泛素结合酶结合,同时至少有一种位点还与其他的泛素分子结合。E3连接酶需要其特异性的氨基酸序列和磷酸化结构域来特异识别靶蛋白,骨骼肌特异性的E3连接酶有两种:肌肉特异性环指蛋白1(MuRF1)和肌肉萎缩盒F蛋白 (MAFbx,也叫atrogin-1),它们分别是在对因饥饿或制动形成的肌萎缩的啮齿类动物进行转录分析时被首次发现的[4-5]。临床上MAFbx和 MuRF1在糖尿病、癌症、肾衰竭、去神经或糖皮质激素治疗等状态下可过表达,并特异性的作用于蛋白酶体的靶蛋白,促进蛋白质分解及肌肉萎缩,可作为肌肉萎缩的早期标志物。对肾切除鼠的观察也证实,腓肠肌MAFbx 和 MuRF1 mRNA的增加与蛋白降解增加及肌肉重量减少有关[6]。进一步研究基因敲除小鼠揭示,MuRF1-/-和MAFbx-/-小鼠体征正常,与对照组相比,其肌肉质量下降明显减少,提示这些萎缩相关基因“atrogenes”可在肌肉萎缩时发挥作用,MAFbx 或MuRF1的缺失可阻滞去神经诱导的肌肉萎缩[4]。
MAFbx MAFbx是一种SCF(Skp1、Cullin1 和 F-box包含蛋白)复合体。SCF复合体是由40个氨基酸组成的结构域,以F-box特征,可发挥E3泛素-蛋白连接酶的活性。另外,MAFbx还包含一种富含亮氨酸残基的结构域,可与PDZ结构域、细胞色素C结合位点和两种核局部的信号蛋白等几种蛋白结合。作为对萎缩刺激的应答,MAFbx作用底物首先被磷酸化,之后被MAFbx降解,MAFbx仅与转录后修饰(如磷酸化)后的作用底物结合[7]。近期一项对MAFbx-/-心肌的研究发现,MAFbx不仅促进肌肉降解,还可减少肌肉合成,在调节心肌质量方面发挥双重作用[8]。
MuRF1 E3连接酶环指结构是MuRF1的特征性结构,也是其主要活性部位,为一种含有E2连接酶作用位点的经典N末端环指结构域,它包括了锌指结构域 (B-box) 、富含亮氨酸螺旋结构域(允许MuRF1与其他MuRF蛋白形成同二聚体或异二聚体)和一种酸性C′末端尾部结构等MuRF家族的保守区域。如将MuRF1的环指蛋白结构域删除(MuRF1 RING-/-),这些动物仍会产生MuRF1的其他结构,并表现出MuRF1介导的蛋白-蛋白的相互作用,但MuRF1 RING-/-动物可表现出与MuRF1失功能动物相同的体征,即肌肉丢失减少。因此,进一步证实了MuRF1通过其E3泛素连接酶活性来促进骨骼肌萎缩[9]。
E3连接酶表达的调控
叉头转录因子(FoxO)磷酸化下调E3连接酶的表达 FoxO是一种转录因子家族,与细胞代谢、凋亡和细胞周期有关,FoxO转录因子去磷酸化后可进入细胞核,直接与小鼠肌肉的MAFbx基因促进子结合,使其转录增加,抑制细胞生长,促进凋亡,从而引起肌肉萎缩[10]。CKD 5期骨骼肌萎缩患者存在FoxO1的表达上调、磷酸化程度降低的现象[2],而FoxO1并非直接增加MAFbx 或 MuRF1的表达,而是通过阻断IGF-1发挥抑制作用。转录因子JunB可阻断FoxO3与MAFbx和MuRF1基因促进子的结合,从而抑制肌肉蛋白降解(图1)[11]。
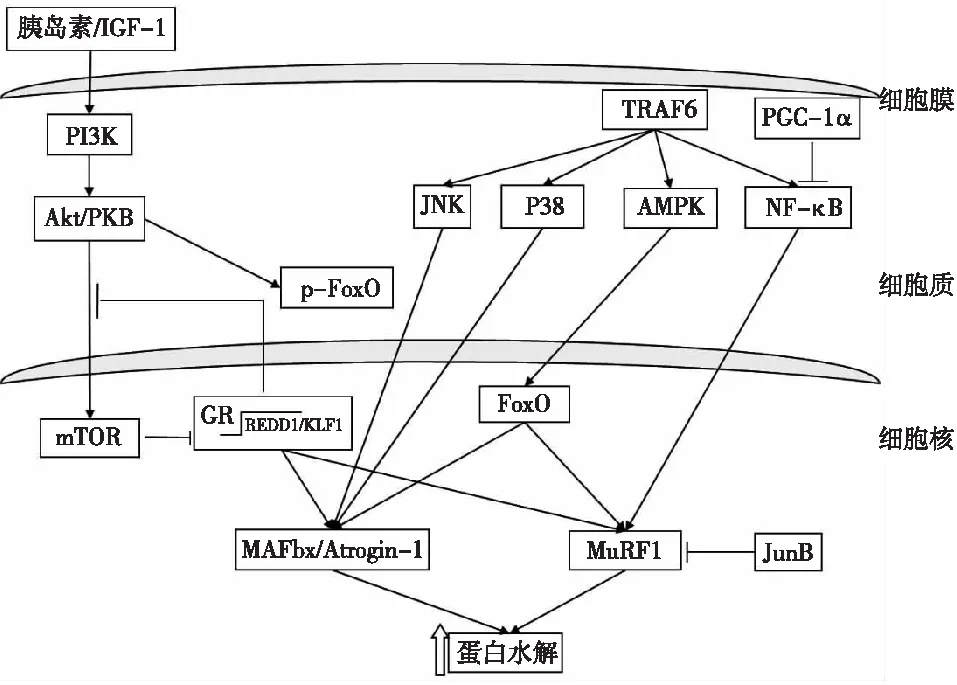
图1 E3泛素连接酶表达的调控IGF-1:胰岛素样生长因子1;PI3K:磷脂酰肌醇3激酶;Akt/PKB:丝氨酸/苏氨酸激酶(蛋白激酶B);mTOR:哺乳动物雷帕霉素靶蛋白;p-FoxO:磷酸化的叉头转录因子;FoxO:叉头转录因子;GR:糖皮质激素受体;REDD1:发育及DNA损伤反应调节基因1;KLF15:Kruppel样转录因子15;MuRF1:肌肉特异性环指蛋白1; MAFbx/atrogin-1:肌肉萎缩盒F蛋白;JunB:属原癌Jun蛋白家族;TRAF6:肿瘤坏死因子α受体调节蛋白6;PGC-1α:过氧化物酶体增殖物激活受体γ辅激活因子1α;JNK:c-Jun氨基末端激酶;AMPK:腺苷酸活化蛋白激酶;NF-B:核因子B;箭头(→)表示促进作用,末端带横杠的直线(─┤)表示抑制作用
胰岛素 /IGF1-Akt-mTOR抑制E3连接酶的表达 IGF-1是一种诱导骨骼肌质量增加的蛋白生长因子,可抑制MAFbx和MuRF1的表达,使下游蛋白合成增加,而CKD患者和动物模型常表现为胰岛素抵抗。提高磷脂酰肌醇3激酶(PI3K)活性可促进丝氨酸/苏氨酸激酶(Akt)的磷酸化,从而增加p-FoxO的产生。故胰岛素/IGF-1-Akt-mTOR通路能促进肌纤维生长和肌蛋白合成,抑制蛋白降解,而MuRF1 可通过作用c-Jun而抑制 IGF-I 信号,对此通路发挥负反馈调节作用。
在正氮平衡条件下,胰岛素和 IGF-1可通过PI3K使 Akt磷酸化,从而促进蛋白合成和FoxO的磷酸化。磷酸化的FoxO不能进入核内,使MAFbx 和MuRF1的转录减少,从而使肌肉蛋白分解减弱。负氮平衡时,胰岛素和(或)IGF-1的水平较低,PI3K不能磷酸化 Akt,蛋白合成受抑制。同时,非磷酸化的FoxO转录因子可进入核内,促进 MAFbx和MuRF1基因转录,导致蛋白分解速率的增高(图1)[11]。有研究发现,5氨基咪唑-4-甲酰胺核苷酸(5-aminoimidazole-4-carboxamide 1--d-ribofuranoside,AICAR)活化IGF-1时,可加强Akt 活化,但并不能抑制MAFBx和MuRF1活化[12]。
活化E3泛素连接酶的主要通路 CKD患者和动物模型常表现为核因子B(NF-B)、腺苷酸活化蛋白激酶(AMPK) 的活化。NF-B可引起MuRF1的表达增加,引起肌纤维蛋白水解,肌肉萎缩[13]。而过氧化物酶体增殖物激活受体γ辅激活酶1α(proliferator-activated receptor γ coactivator 1α,PGC-1)却可抑制肿瘤坏死因子样凋亡萎缩诱导剂( TNF-like weak inducer of apoptosis,TWEAK)诱导的 NF-B活化,从而减少萎缩基因MAFbx和 MuRF1的转录[14]。
AMPK也可增加MAFbx和MuRF1的表达,使蛋白分解和自噬增加。线粒体裂解和功能障碍可导致AMPK/ FoxO3的活化,从而加强溶酶体和蛋白酶体分解蛋白活性。但Tong等[12]研究发现,虽然存在Akt活化,AMPK活化仍可刺激MAFbx和 MuRF1表达。受细胞能量状态的影响,AMPK既可增加蛋白降解,也可抑制mTOR信号导致的蛋白合成降低。AMPK活化小管硬化蛋白2 (TSC2),使raptor-mTOR 复合体解离,从而抑制mTOR。
骨骼肌糖皮质激素受体(GR)的靶基因REDD1和KLF15分别通过活化TSC1/2而抑制mTOR的活性,活化的mTOR反过来也可抑制GR转录功能,对抗糖皮质激素导致的肌肉萎缩[15]。此外,KLF15可上调MAFbx和MuRF1的表达,导致肌纤维萎缩。肿瘤坏死因子α受体调节蛋白6 (TRAF6)是一种与多种信号通路受体介导的活化有关的蛋白,在肌肉萎缩时增加。TRAF6影响Jun 激酶 1/2、 p38分裂素活化蛋白激酶、AMPK和NF-B而导致MAFbx和MuRF1 在骨骼肌中表达增加(图1)。已证实,利用敲除TRAF6治疗肿瘤等疾病可抑制肌纤维蛋白分解,维持肌纤维大小和肌力[16]。
MicroRNA、Smad通路及肌肉抑制素(Myostatin)对E3泛素连接酶的调控作用 miR-1和miR-133等肌肉特异性microRNA 可直接作用于IGF-1,调节胰岛素/IGF-1 信号通路,促进肌肉细胞的生长和分化。同时, microRNA诱导的IGF-1改变也可下调胰岛素受体底物1(IRS-1)/Akt通路,导致肌肉蛋白降解。活化的IGF-1可通过FoxO3a刺激促进子增加miR-1的基因转录。观察地塞米松和myostatin诱导的骨骼肌萎缩发现,miR-1表达增加、 Akt磷酸化减少、FoxO3的活化增强,最终上调MuRF1 和MAFbx的表达[11]。而C2C12成肌细胞miR-133的过表达可显著抑制IGF-1受体转录后表达[17]。
将miR-486电穿孔到细胞可阻断地塞米松诱导的肌肉蛋白降解,而不影响蛋白合成,其作用机制与p-Akt和p-FoxO1增加、MuRF1活化受抑制、蛋白的降解减少有关[18]。miR-23a可抑制MAFbx和MuRF1的表达,从而抑制糖皮质激素诱导的骨骼肌萎缩[19]。
Smad3可通过活化FoxO3来调节MuRF1的转录[20],Smad3缺陷的小鼠由于myostatin活性增强可导致明显的MuRF1水平增加和肌肉萎缩[21]。myostatin 与IGF-1通路相互作用,抑制Akt-mTOR 通路,从而减少蛋白合成,抑制骨骼肌生长,上调FoxO促进蛋白降解[22]。
MAFbx 和 MuRF1的作用底物
MuRF1主要作用于肌纤维蛋白,而MAFbx的作用底物则不包括肌纤维蛋白。在骨骼肌中,成肌分化抗原(MyoD)和真核翻译起始因子3f(eIF3f)均为MAFbx的作用底物。MyoD是真核细胞中合成eIF3-f的一种起始因子,MAFbx-MyoD在细胞核相互作用,MAFbx的过表达可导致MyoD的多泛素化,并可抑制MyoD诱导的肌管分化和形成,而敲除MAFbx则可逆转MyoD导致的蛋白水解作用。eIF3-f是一种转录起始因子,也是MAFbx的主要效应器,其增加和减少则分别导致骨骼肌肥大和萎缩,其以MAFbx依赖的方式在肌管被泛素化和降解。eIF3-f在 mTOR活化、调节蛋白合成及肌肉生长中发挥关键作用。MAFbx的上调可降解eIF3f,提示MAFbx既可调节蛋白合成也可调节蛋白降解[23]。
MuRF1主要与结构蛋白相互作用。MuRF1作用于26S蛋白酶体时,可降解肌纤维蛋白;也可与肌纤维蛋白titin在M链结合,但还不清楚是否会导致titin泛素化。MuRF1在空腹和去神经状态下可降解肌球蛋白结合蛋白C、肌球蛋白轻链-1(MLC1)和MLC2。在地塞米松治疗后,MuRF1可与肌球蛋白重链(MHC)结合并将其降解。用免疫印迹标记证明, MuRF1与MHC存在免疫共沉淀,证实MHC是MuRF1的作用底物[24]。
小结:CKD患者同时存在着的胰岛素抵抗、炎症和糖皮质激素升高等状态,可激活多种不同通路,活化MAFbx和MuRF1而促进肌肉消耗,且这两种蛋白的下游通路也不尽相同。因此,探讨MAFbx 和 MuRF1调节通路之间的关系及对CKD患者的影响将有助于进一步明确其在骨骼肌生理功能和重塑中的作用,为今后临床寻找治疗靶点奠定基础。
1 Hanatani S,Izumiya Y,Araki S,et al.Akt1-mediated fast/glycolytic skeletal muscle growth attenuates renal damage in experimental kidney disease.J Am Soc Nephrol,2014,25(12):2800-2811.
2 殷俊,黄娟,袁伟杰,等.Foxo1及泛素溶酶体系统在慢性肾脏病致骨骼肌萎缩作用中的初步观察.中华内科杂志,2014,53(1):31-33.
3 Wang DT,Lu L,Shi Y,et al.Supplementation of ketoacids contributes to the up-regulation of the Wnt7a/Akt/p70S6K pathway and the down-regulation of apoptotic and ubiquitin-proteasome systems in the muscle of 5/6 nephrectomised rats.Br J Nutr,2014,111(9):1536-1548.
4 Bodine SC,Latres E,Baumhueter S,et al.Identification of ubiquitin ligases required for skeletal muscle atrophy.Science,2001,294 (5547):1704-1708.
5 Gomes MD,Lecker SH,Jagoe RT,et al.Atrogin-1,muscle-specific F-box protein highly expressed during muscle atrophy.Proc Natl Acad Sci USA,2001,98(25):14440-14445.
6 王嘉琳,谷立杰,袁伟杰,等.糖尿病肾病大鼠骨骼肌蛋白消耗及低蛋白联合-酮酸的作用.中华肾脏病杂志,2013,29(3):204-209.
7 Jackson PK,Eldridge AG.The SCF ubiquitin ligase:an extended look.Mol Cell,2002,9(5):923-925.
8 Baskin KK,Rodriguez MR,Kansara S,et al.MAFbx/Atrogin-1 is required for atrophic remodeling of the unloaded heart.J Mol Cell Cardiol,2014,72:168-176.
9 Cohen S,Brault JJ,Gygi SP,et al.During muscle atrophy,thick,but not thin,filament components are degraded by MuRF1-dependent ubiquitylation.J Cell Biol,2009,185(6):1083-1095.
10 Sandri M,Sandri C,Gilbert A,et al.Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy.Cell,2004,117(3):399-412.
11 Kukreti H,Amuthavalli K,Harikumar A,et al.Muscle-specific microRNA1 (miR1) targets heat shock protein 70 (HSP70) during dexamethasone-mediated atrophy.J Biol Chem,2013,288(9):6663-6678.
12 Tong JF,Yan X,Zhu MJ,et al.AMP-activated protein kinase enhances the expression of muscle-specific ubiquitin ligases despite its activation of IGF-1/Akt signaling in C2C12 myotubes.J Cell Biochem,2009,108(2):458-468.
13 Wu CL,Cornwell EW,Jackman RW,et al.NF-κB but not FoxO sites in the MuRF1 promoter are required for transcriptional activation in disuse muscle atrophy.Am J Physiol Cell Physiol,2014,306(8):C762-767.
14 Hindi SM,Mishra V,Bhatnagar S,et al.Regulatory circuitry of TWEAK-Fn14 system and PGC-1α in skeletal muscle atrophy program.FASEB J,2014,28(3):1398-1411.
15 Shimizu N,Yoshikawa N,Ito N,et al.Crosstalk between glucocorticoid receptor and nutritional sensor mTOR in skeletal muscle.Cell Metab,2011,13(2):170-182.
16 Paul PK,Gupta SK,Bhatnagar S,et al.Targeted ablation of TRAF6 inhibits skeletal muscle wasting in mice.J Cell Biol,2010,191(7):1395-1411.
17 Huang MB,Xu H,Xie SJ,et al.Insulin-like growth factor-1 receptor is regulated by microRNA-133 during skeletal myogenesis.PLoS One,2011,6(12):e29173.
18 Xu J,Li R,Workeneh B,et al.Transcription factor FoxO1,the dominant mediator of muscle wasting in chronic kidney disease,is inhibited bymicroRNA-486.Kidney Int,2012,82(4):401-411.
19 Wada S,Kato Y,Okutsu M,et al.Translational suppression of atrophic regulators by microRNA-23a integrates resistance to skeletal muscle atrophy.J Biol Chem,2011,286(44):38456-38465.
20 Bollinger LM,Witczak CA,Houmard JA,et al.SMAD3 augments FoxO3-induced MuRF-1 promoter activity in a DNA-binding-dependent manner.Am J Physiol Cell Physiol,2014,307(3):C278-287.
21 Ge X,McFarlane C,Vajjala A,et al.Smad3 signaling is required for satellite cell function and myogenic differentiation of myoblasts.Cell Res,2011,21(11):1591-1604.
22 Lokireddy S,Wijesoma IW,Bonala S,et al.Myostatin is a novel tumoral factor that induces cancer cachexia.Biochem J,2012,446(1):23-36.
23 Lagirand-Cantaloube J,Offner N,Csibi A,et al.The initiation factor eIF3-f is a major target for atrogin1/MAFbx function in skeletal muscle atrophy.EMBO J,2008,27(8):1266-1276.
24 Clarke BA,Drujan D,Willis MS,et al.The E3 Ligase MuRF1 degrades myosin heavy chain protein in dexamethasone-treated skeletal muscle.Cell Metab,2007,6(5):376-385.
(本文编辑 青 松)
Mechanism of the MAFbx and MuRF1 in muscular atrophy of the patients with chronic kidney disease
ZHANGYueyue,YUANWeijie
DepartmentofNephrology,ShanghaiJiaotongUniversityAffiliatedFirstPeople’sHospital,Shanghai200080,China
Muscle atrophy is a frequent complication of chronic kidney disease (CKD) and is associated with increasing morbidity and mortality.The processes causing loss of muscle mass are also present in several catabolic conditions, such as insulin resistance, acidosis, and inflammation.The main reasons may involve in activation of ubiquitin proteasome pathway (UPP).Three distinct components are required for muscle breakdown using the UPP.E1 ligases which activate ubiquitin, E2 ligases that are responsible for transferring the activated ubiquitin to the protein molecule that is then targeted for degradation and the E3 ligases which regulate the actual transfer of ubiquitin to the protein.Two important skeletal muscle specific ubiquitin E3 ligases are Muscle-specific RING Finger protein 1 (MuRF1) and Muscle Atrophy F-box (MAFbx/atrogin-1), which could be affected by several pathways.Understanding the pathogenesis of CKD-induced muscle loss could lead to therapeutic interventions that prevent muscle wasting in CKD.
Skeletal muscle atropy ubiquitin proteasome pathway muscle-specific RING Finger protein1 muscle Atrophy F-box
上海交通大学附属第一人民医院肾内科(上海,200080)
2014-11-13

