蛋白磷酸酶2Ac介导Smad3中间连接区去磷酸化促肾小管上皮细胞间充质转分化的研究
庾楠楠 李 华 李 军 肖 争 向玉琼 赵祝叶 尤燕华 刘 虹 孙 林 彭佑铭 刘伏友 李 瑛
蛋白磷酸酶2Ac介导Smad3中间连接区去磷酸化促肾小管上皮细胞间充质转分化的研究
庾楠楠*李 华*李 军 肖 争 向玉琼 赵祝叶 尤燕华 刘 虹 孙 林 彭佑铭 刘伏友 李 瑛
目的:通过蛋白磷酸酶2Ac(PP2Ac)过表达和小干扰RNA质粒转染人肾小管上皮细胞(HK-2细胞)后予以转化生长因子β1(TGF-β1)刺激,观察PP2Ac对细胞外基质合成、肾小管上皮细胞间充质转分化(EMT)和Smad3中间连接区磷酸化的影响,探讨PP2Ac促肾间质纤维化的机制。 方法:常规培养HK-2细胞,分为对照组、TGF-β1组和质粒转染+TGF-β1组。采用RT-PCR和Western Blot法检测PP2Ac、纤维连接蛋白(FN)、Ⅰ型胶原(Col-Ⅰ)、α平滑肌肌动蛋白(α-SMA)和E选择素(E-cadherin)表达水平。采用Western blot法检测Smad3、Smad3中间连接区pSmad3-L(pSer204)和pSmad3-L(pSer208)表达情况。 结果:RT-PCR和Western Blot结果均显示:PP2Ac过表达质粒转染HK-2细胞再予TGF-β1刺激24h后,PP2Ac表达较TGF-β1组升高,同时FN、Col-Ⅰ和a-SMA表达明显上调,E-cadherin表达下调;而PP2Ac小干扰RNA转染HK-2细胞后再予TGF-β1刺激24h,较TGF-β1组,PP2Ac表达降低,FN、Col-Ⅰ和α-SMA表达减少,E-cadherin表达增高(P<0.05)。Western Blot结果显示:TGF-β1刺激HK-2细胞1h时PP2Ac和Smad3中间区磷酸化的蛋白表达均达到峰值;HK-2细胞转染PP2Ac过表达质粒再予TGF-β1刺激1h后,与单纯TGF-β1刺激组比较,核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)表达均下降;而PP2Ac小干扰RNA转染HK-2细胞再予TGF-β1刺激1h后,核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)蛋白表达均增加(P<0.05)。 结论:PP2Ac促进肾小管上皮细胞外基质的生成及EMT;PP2Ac介导肾小管上皮细胞Smad3中间连接区去磷酸化。
蛋白磷酸酶2Ac 去磷酸化 细胞外基质合成 EMT Smad3中间连接区
转化生长因子β1(TGF-β1)被认为是调节肾小管间质纤维化最重要的因子之一[1],其主要通过TGF-β/Smad经典信号通路调控肾间质纤维化,而Smad3被认为是介导TGF-β 信号转导的关键因子[2]。Smad3蛋白c末端磷酸化可正向调控TGF-β 信号转导。然而,新近研究发现,曾认为无特殊功能的Smad3中间连接区(linker region L区)亦可通过非Smad途径磷酸化,抑制TGF-β信号的转导,阻断下游靶基因的转录[3-4]。蛋白磷酸酶(PP)可发挥去磷酸化作用而参与可逆性磷酸化这一蛋白翻译后修饰方式。Heikkinen等[5]通过在缺氧环境下培养宫颈癌上皮细胞(Hela细胞)发现,PP2A在缺氧环境下可特异性使Smad3中间连接区去磷酸化。PP2Ac为PP2A催化亚基,我们前期实验通过构建梗阻性肾病模型表明PP2Ac与肾脏的梗阻程度呈正相关[6];体内和体外实验均显示,予以PP2Ac的阻断剂冈田酸干预后梗阻性肾组织和TGF-β1刺激的人近端肾小管上皮细胞株(HK-2细胞)细胞外基质的生成和上皮细胞间充质转分化(EMT)均受到抑制(未发表资料)。为进一步验证PP2Ac对肾间质纤维化的作用及分子机制, 本研究采用PP2Ac过表达及沉默技术,通过体外实验探讨PP2Ac对肾小管上皮细胞外基质合成和EMT的影响及其对Smad3中间连接区去磷酸化的作用。
材料与方法
材料与试剂 HK-2细胞,购于美国ATCC。重组人TGF-β1(美国Pepro Tech),E选择素(E-cadherin)、纤维连接蛋白(FN)、PP2Ac抗体(美国Santa Cruz),α平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原(Col-Ⅰ)抗体、Smad3抗体 (美国Gene Tex公司),Smad3(S423/S425)抗体、pSmad3-L(pSer204)抗体、pSmad3-L(pSer208)抗体、PCNA抗体(美国Abcam),β-actin抗体(北京康为世纪),辣根过氧化物酶(HRP)标记山羊抗小鼠 IgG和山羊抗兔IgG(北京中杉金桥),蛋白磷酸酶抑制剂(瑞士Roche公司),RevertAid TM First Strand cDNA Synthesis Kit(加拿大Ferments),PCR引物(上海生工),FBS、DMEM/F12、胰酶(美国Gibco)。
细胞培养、干预及分组 HK-2细胞用含10%FBS的DMEM/F12培养液,在37℃、5%CO2条件下培养、传代,接种至六孔板,分为三部分:(1)细胞随机分为3组:空白对照组、TGF-β1组(TGF-β1 5 ng/ml干预24h)、PP2Ac小干扰RNA或过表达质粒+TGF-β1组(质粒转染成功后TGF-β1 5 ng/ml干预24h),每组设3个复孔。收集细胞提取蛋白及mRNA行Western Blot和实时荧光定量PCR(RT-PCR)检测PP2Ac、FN、Col-Ⅰ、α-SMA和E-cadherin 表达;(2)细胞随机分为7组,TGF-β1分别干预0h、0.5h、1h、3h、6h、12h及24h;提取不同时间点的细胞核蛋白测定PP2Ac和Smad3、Smad3中间连接区pSmad3-L(pSer204)、pSmad3-L(pSer208)的含量。(3)细胞随机分为3组:空白对照组、TGF-β1组(TGF-β1 5 ng/ml干预1h)、PP2Ac小干扰RNA或过表达质粒+TGF-β1组(质粒转染成功后TGF-β1 5 ng/ml干预1h),每组设3个复孔。收集细胞提取蛋白Western Blot检测Smad3、Smad3中间连接区pSmad3-L(pSer204)、pSmad3-L(pSer208)蛋白的表达。
Western Blot印迹 收集细胞加裂解液30 min后离心,取5~10 μl上清BCA法测定蛋白浓度。每上样孔加30 μg总蛋白行8%~12% SDS-PAGE胶电泳。湿转法电转移至PVDF膜,5%BSA室温封闭1h后,分别加FN(1∶ 1 000)、Col-Ⅰ(1∶ 2 000)、E-cadherin(1∶ 1 000)、α-SMA(1∶ 2 000)、PP2Ac(1∶ 500)、Smad3(S423/S425)(1∶ 300)、pSmad3-L(pSer204)(1∶ 500)、pSmad3-L(pSer208)(1∶ 200)一抗4℃过夜。HRP标记的二抗(1∶ 3 000)室温孵育1h,化学发光剂ECL反应1 min,曝光,扫描蛋白条带。以β-actin及PCNA为内参照,采用Labwork 4.0图像分析软件进行半定量分析。
RT-PCR 采用Trizol提取细胞总RNA,测定总RNA质量,取2.5 μg按RevertAidTM First Strand cDNA Synthesis Kit合成cDNA。基因序列从Genebank中查阅,采用Primer 7软件设计。引物序列见下表(表1)。PCR扩增的反应程序为:50 ℃,2 min;95℃,40s;55℃,40s,72℃,50s,共30个循环;72℃,10 min终止反应。实时反应结束后制作终产物的溶解曲线,以GAPDH或β-actin为管家基因,采用2-△△Ct方法分析相关基因的表达水平。

表1 基因引物序列
FN:纤维连接蛋白;Col-Ⅰ:Ⅰ型胶原;E-cadherin:E选择素;α-SMA:α平滑肌肌动蛋白;PP2Ac:蛋白磷酸酶2Ac;β-actin:β肌动蛋白
统计学处理 应用SPSS 15.0进行统计分析,结果以均数标准差表示。计量资料采用单因素方差分析(one-way ANOVA),两样本均数的多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
结 果
PP2Ac过表达质粒和小干扰RNA转染对TGF-β1刺激的HK-2细胞基质合成及EMT的影响
PP2Ac过表达质粒和小干扰RNA转染对TGF-β1刺激的HK-2细胞PP2Ac表达的影响 PP2Ac过表达质粒和小干扰RNA分别转染HK-2细胞后,通过荧光显微镜观察、RT-PCR及Western Blot检测表明质粒转染成功(图1A)。RT-PCR和Western blot分别从mRNA和蛋白水平表明,TGF-β1刺激HK-2细胞24h后,PP2Ac表达上调;PP2Ac过表达质粒转染再予TGF-β1刺激24h后,HK-2细胞PP2Ac的表达较TGF-β1组明显升高。PP2Ac小干扰RNA质粒转染再予TGF-β1刺激24h后,HK-2细胞PP2Ac表达较TGF-β1组减少(图 1B)。
PP2Ac过表达质粒和小干扰RNA转染对TGF-β1刺激的HK-2细胞FN、Col-Ⅰ、E-cadherin、α-SMA表达的影响 Western Blot及RT-PCR分别从mRNA和蛋白水平显示,TGF-β1刺激24h后HK-2细胞FN、Col-Ⅰ及α-SMA表达明显增加,E-cadherin表达下调(P<0.05)。PP2Ac过表达质粒转染后再予TGF-β1刺激24h后FN、Col-Ⅰ及α-SMA表达较TGF-β1组显著增加,E-cadherin表达进一步下调。 然而,PP2Ac小干扰RNA质粒转染后再予TGF-β1刺激24h组FN、Col-Ⅰ及α-SMA表达较TGF-β1组显著减少,E-cadherin表达上调(图2)。
PP2Ac介导HK-2细胞Smad3中间连接区去磷酸化
TGF-β1刺激的HK-2细胞Smad3磷酸化指标检测最佳时间点的选择 Western Blot显示PP2Ac的表达随着时间的延长逐渐升高后缓慢下降,在1h出现高峰(P<0.05);各时间点Smad3表达无明显差异;pSmad3-L(pSer204)在1h表达达到高峰,pSmad3-L(pSer208)在30 min达到高峰后逐渐下降,在1h pSmad3-L(pSer208)的表达仍明显,与0.5h无显著差异(P>0.05)(图3)。综上结果,在TGF-β1干预1h时,PP2Ac及Smad3磷酸化指标均处于相对高峰期,故之后的实验中采用TGF-β1干预1h检测实验中Smad3磷酸化指标的变化。
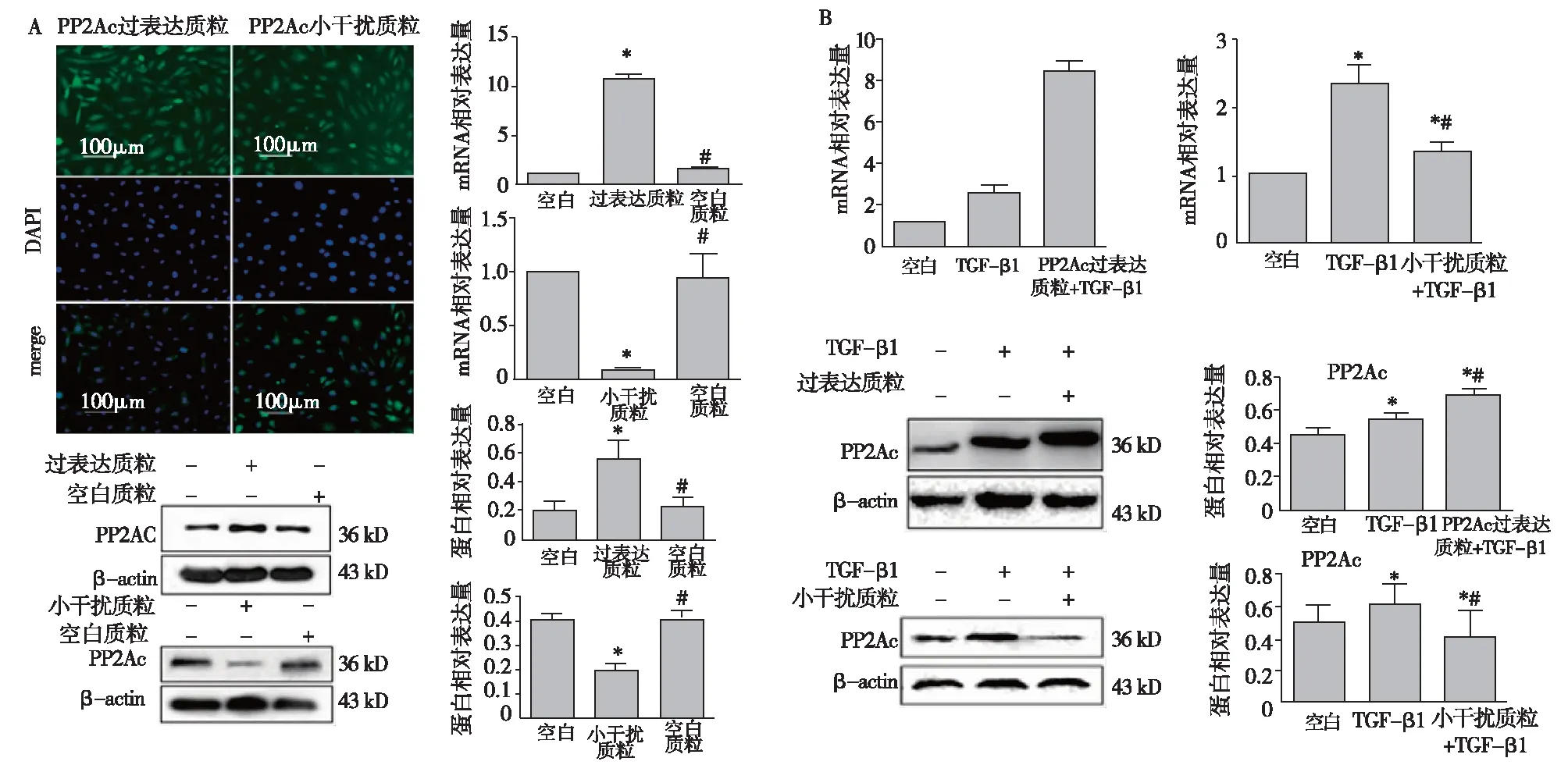
图1 PP2Ac过表达质粒和小干扰RNA转染对TGF-β1刺激的HK-2细胞PP2Ac表达的影响PP2Ac:蛋白磷酸酶2Ac;HK-2细胞:人近端肾小管上皮细胞株;TGF-β1:转化生长因子β1;β-actin:β肌动蛋白;A:PP2Ac过表达和小干扰质粒转染HK-2细胞(免疫荧光,绿色荧光为转染成功的细胞,蓝色荧光为核染色);B:PP2Ac过表达和小干扰质粒对HK-2细胞PP2Ac表达的影响;*:与空白组相比,P<0.05; #:与质粒转染组相比,P<0.05
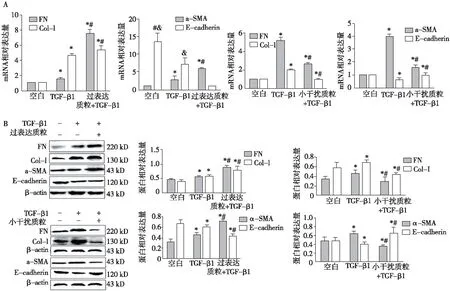
图2 PP2Ac过表达和小干扰质粒对HK-2细胞FN、Col-Ⅰ、E-cadherin 、α-SMA表达的影响PP2Ac:蛋白磷酸酶2Ac;HK-2细胞:人近端肾上管上皮细胞株;FN:纤维连接蛋白;CoI-Ⅰ:Ⅰ型胶原;E-cadherin:E选择素;α-SMA:α平滑肌肌动蛋白;β-actin:β肌动蛋白;A:RT-PCR;B:Western Blot;*:与空白组相比,P<0.05;#:与TGF-β1组相比,P<0.05;&:与PP2Ac过表达组相比,P<0.05
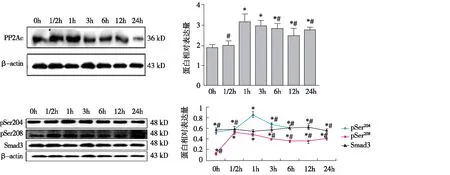
图3 PP2Ac蛋白及Smad3中间连接区磷酸化蛋白在TGF-β1刺激的HK-2细胞不同时间表达情况(Western Blot)PP2Ac:蛋白磷酸酶2Ac;TGF-β1:转化生长因子β1;HK-2细胞:人近端肾小管上皮细胞株;β-actin:β肌动蛋白;*:与0h组相比,P<0.05; #:与1h组比较,P<0.05
PP2Ac过表达和小干扰RNA质粒对TGF-β1刺激的HK-2细胞核中Smad3中间区磷酸化蛋白表达的影响 与空白组比较,TGF-β1组核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)的表达上调(P<0.05);过表达质粒转染HK-2细胞再予TGF-β1刺激1h后,PP2Ac的表达升高的同时核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)的表达均减少(P<0.05)。然而,PP2Ac小干扰RNA质粒转染HK-2细胞再予TGF-β1刺激1h后,相较于TGF-β1组,PP2Ac的减少的同时核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)的表达均增加(P<0.05)(图4)。
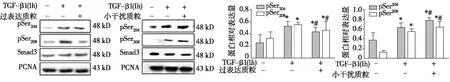
图4 PP2Ac过表达和小干扰质粒抑制TGF-β1诱导的HK-2细胞中Smad3中间连接区蛋白磷酸化入核(Western Blot)PP2Ac:蛋白磷酸酶2Ac;TGF-β1:转化生长因子β1;HK-2细胞:人近端肾小管上皮细胞株;β-actin:β肌动蛋白;*TGF-β1组与空白组比较,P<0.05;#:质粒转染组与TGF-β1组相比,P<0.05
讨 论
慢性肾脏病(CKD)及其引起的终末期肾病(ESRD)是一组严重威胁人类生命和健康的常见慢性进展性疾病。近年来CKD的发病率逐年升高,位列第三位,仅次于心血管疾病及肿瘤[7],而肾脏纤维化是各种不同病因的CKD进展到ESRD的共同病理过程。在众多促肾脏纤维化的因子中, TGF-β1被认为是最重要的因子之一[8-9]。
Smads是TGF-β1信号从细胞膜传递到细胞核的最重要的细胞内信号介导分子,是目前所知的最重要的TGF-β受体(TβR)胞内激酶的底物[10]。Smad3是其中的关键性因子,它包含两个守恒的多肽片段MH1和MH2以及一个相对不保守的中间连接区(linker region L区),中间连接区包涵丰富的丝氨酸和苏氨酸[11]。大量研究表明,很多纤维化发生的标记(如胶原蛋白)和EMT指标(如α-SMA和E-cadherin)都是Smad3依赖性或者Smad3直接结合其DNA序列来调节的[12],敲除Smad3基因可出现肾纤维化和炎症的减弱[13]。这些结果均表明Smad3在TGF-β1介导的细胞基质合成及EMT过程中至关重要,但具体机制并不清楚。研究表明,Smad3-C末端磷酸化后可正向调控TGF-β信号转导,进而促进成纤维细胞产生细胞外基质[11]。然而,随着对Smads的进一步研究发现,Smad中间连接区在Smad的功能调节中亦十分重要[14]。Smad3中间连接区可被丝裂原活化蛋白激酶(MAPKs)、细胞周期蛋白依赖激酶(CDKs)、c-Jun氨基末端激酶(JNKs)、糖原合成酶激酶3(GSK3)等磷酸化,在Smad3介导的细胞反应中发挥负向或正向的调控作用[15-17];Bae等[18]通过转染小鼠肾小管上皮细胞Smad3-C末端(Ser422、Ser423、Ser425)和中间连接区(Ser204、Ser208等)突变体研究发现,经过TGF-β刺激后,HK2细胞的E-cadherin表达下降,α-SMA表达增加,显著增强了肾小管上皮细胞EMT,表明Smad3中间连接区磷酸化在TGF-β信号传导中起负向调控作用,有助缓解EMT进而延缓肾间质纤维化。
PP2A是一种重要的丝氨酸/苏氨酸蛋白磷酸酶,可对发生磷酸化的蛋白进行可逆磷酸化的修饰。PP1、PP2A和PP2B作为丝/苏氨酸蛋白磷酸酶的主要家族成员,均可抑制Smad3-C末端的磷酸化,负向调控TGF-β信号[19]。然而,近年来对PP2A调控TGF-β信号的作用却有不一样的看法,Bengtsson等[20]发现,PP2A可不依赖TβR,直接介导Smad1中间连接区去磷酸化,从而正向调控TGF-β/Smad1信号通路[20]。Heikkinen等[5]发现PP2A在缺氧环境下可特异性使皮肤和宫颈癌上皮细胞Smad3中间连接区去磷酸化。我们前期通过体内及体外研究表明,通过PP2A阻断剂抑制PP2A后可减少细胞外基质的产生,并下调α-SMA、增加E-cadherin,阻止EMT过程,推测PP2A可正向调控TGF-β,促进肾间质纤维化,并推测其作用可能与PP2A介导Smad3中间连接区去磷酸化有关(未发表资料)。PP2Ac为PP2A催化亚基,本实验通过体外研究采用PP2Ac过表达和小干扰RNA转染TGF-β1刺激的HK-2细胞,结果表明TGF-β1刺激HK-2细胞24h致PP2Ac表达上调的同时,FN、Col-Ⅰ及α-SMA表达也升高,E-cadherin表达下调,提示细胞外基质沉积及EMT增加;转染PP2Ac过表达质粒使TGF-β1刺激的HK-2细胞PP2Ac的表达进一步上调的同时FN、Col-Ⅰ和α-SMA表达进一步升高,而E-cadherin表达下降,细胞外基质沉积及EMT较TGF-β1组明显加重。然而,PP2Ac小干扰RNA转染HK-2细胞后,PP2Ac的表达减少,同时FN、Col-Ⅰ、α-SMA表达下调,E-cadherin表达上调,HK-2细胞细胞外基质沉积及EMT较单纯TGF-β,刺激组减轻,表明PP2Ac可促进肾小管上皮细胞中细胞外基质的合成和EMT。进一步实验表明,TGF-β1刺激HK-2细胞1h后PP2Ac表达上调,同时细胞核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)表达亦增加,转染PP2Ac过表达质粒后,PP2Ac表达进一步上调,细胞核蛋白中的pSmad3-L(pSer204)和pSmad3-L(pSer208)则明显下调;然而,转染PP2Ac 小干扰RNA后,相对于TGF-β1组,PP2Ac表达受抑制的同时核蛋白中pSmad3-L(pSer204)和pSmad3-L(pSer208)蛋白表达均增加。表明PP2Ac可介导肾小管上皮细胞Smad3中间连接区去磷酸化。
小结:PP2Ac可促进肾小管上皮细胞基质沉积及EMT和肾小管上皮细胞Smad3中间连接区去磷酸化,结合前期的体内实验,我们推测,PP2Ac可能通过介导Smad3中间连接区去磷酸化促进肾间质纤维化。通过研究PP2Ac在肾间质纤维化中的作用机制,将为进一步研发抗肾间质纤维化药物提供新靶点。
1 Lan HY.Diverse roles of TGF-β/Smads in renal fibrosis and inflammation.Int J Biol Sci,2011,7(7):1056-1067.
2 Meng XM,Huang XR,Chung AC,et al.Smad2 protects against TGF-beta/Smad3-mediated renal fibrosis.J Am Soc Nephrol,2010,21(9):1477-1487.
3 Burch ML,Zheng W,Little PJ.Smad linker region phosphorylation in the regulation of extracellular matrix synthesis.Cell Mol Life Sci,2011,68(1):97-107.
4 Millet C,Yamashita M,Heller M,et al.A negative feedback control of transforming growth factor-beta signaling by glycogen synthase kinase 3-mediated Smad3 linker phosphorylation at Ser-204.J Biol Chem,2009,284(30):19808-19816.
5 Heikkinen PT,Nummela M,Leivonen SK,et al.Hypoxia-activated Smad3-specific dephosphorylation by PP2A.J Biol Chem,2010,285(6):3740-3749.
6 尤燕华,刘玉平,李瑛.去甲斑蝥素通过抑制蛋白磷酸酶2Ac抗肾间质纤维化.中华肾脏病杂志,2014,30(4):293-298.
7 Ayodele OE,Alebiosu CO.Burden of chronic kidney disease:an international perspective.Adv Chronic Kidney Dis,2010,17(3):215-224.
8 O’Connor JW,Gomez EW.Biomechanics of TGFβ-induced epithelial-mesenchymal transition:implications for fibrosis and cancer.Clin Transl Med,2014,3:23.
9 Samarakoon R,Overstreet JM,Higgins PJ.TGF-β signaling in tissue fibrosis:redox controls,target genes and therapeutic opportunities.Cell Signal,2013,25(1):264-268.
10 Lan HY,Chung AC.TGF-β/Smad signaling in kidney disease.Semin Nephrol,2012,32(3):236-243.
11 Lan HY,Chung AC.Transforming growth factor-β and Smads.Contrib Nephrol,2011,170:75-82.
12 Masszi A,Kapus A.Smaddening complexity:the role of Smad3 in epithelial-myofibroblast transition.Cells Tissues Organs,2011,193(1-2):41-52.
13 Inazaki K,Kanamaru Y,Kojima Y,et al.Smad3 deficiency attenuates renal fibrosis,inflammation,and apoptosis after unilateral ureteral obstruction.Kidney Int,2004,66(2):597-604.
14 Cohen-Solal KA,Merrigan KT,Chan JL,et al.Constitutive Smad linker phosphorylation in melanoma:a mechanism of resistance to transforming growth factor-β-mediated growth inhibition.Pigment Cell Melanoma Res,2011,24(3):512-524.
15 Alarcón C,Zaromytidou AI,Xi Q,et al.Nuclear CDKs Drive Smad Transcriptional Activation and Turnover in BMP and TGF-beta Pathways.Cell,2009,139(4):757-769.
16 Matsuura I,Wang G,He D,et al.Identification and characterization of ERK MAP kinase phosphorylation sites in Smad3.Biochemistry,2005,44(37):12546-12553.
17 Kamato D,Burch ML,Piva TJ,et al.Transforming growth factor-β signalling:role and consequences of Smad linker region phosphorylation.Cell Signal,2013,25(10):2017-2024.
18 Bae E,Kim SJ,Hong S,et al.Smad3 linker phosphorylation attenuates Smad3 transcriptional activity and TGF-β1/Smad3-induced epithelial-mesenchymal transition in renal epithelial cells.Biochem Biophys Res Commun,2012,427(3):593-599.
19 Kim SI,Kwak JH,Wang L,et al.Protein phosphatase 2A is a negative regulator of transforming growth factor-beta1-induced TAK1 activation in mesangial cells.J Biol Chem,2008,283(16):10753-10763.
20 Bengtsson L,Schwappacher R,Roth M,et al.PP2A regulates BMP signalling by interacting with BMP receptor complexes and by dephosphorylating both the C-terminus and the linker region of Smad1.J Cell Sci,2009,122(8):1248-1257.
(本文编辑 青 松 加 则 春 江)
PP2Ac phosphorylation mediated between Smad3 linker region to promote renal tubular epithelial cells to mesenchymal transdifferentiation
YUNannan*,LIHua*,LIJun,XIAOZheng,XIANGYuqiong,ZHAOZhuye,YOUYanhua,LIUHong,SUNLin,PENGYouming,LIUFuyou,LIYing
DepartmentofNephrology,SecondXiangyaHospital,CentralSouthUniversity,Changsha410011,China
*YuNannanandLiHuaareconsidertobefirstauthor
LIYing(E-mail:liyingdoctor@163.com)
Objective:To observed the effect of PP2Ac on accumulation of extracellular matrix and EMT by PP2Ac overexpression plasmid and PP2Ac siRNA transfected with Human kidney proximal tubular epithelial cell line(HK-2) cells, and to explore the role of PP2Ac in tubulointersitial firosis. Methodology:1.HK-2 cells were incubated and randomly divided into 3 groups including TGF-β1 group(treated with TGF-β1 5 ng/ml for 24h or 1h), plasmid transfection plus TGF-β1 stimulation group(treated with TGF-β1 5 ng/ml for 24 h or 1 h after HK-2 cells transfected with PP2Ac over expression or SiRNA plasmid)and control group (only FBS-free DMEM/F12) RT-PCR and Western blot were used to detect the mRNA and protein expression of PP2Ac, fibronectin, collagen I, α-SMA and E-cadherin.The expression of Smad3 and pSmad3-L (pSer204), and protein of pSmad3-L (pSer208) in nucleus were tested by Western blot. Results:1.RT-PCR and Western blot showed that the expression of PP2Ac was significantly increased in HK-2 cells stimulated with TGF-β1.Furthermore, fibronectin, collagen I and α-SMA expression was also increased while the E-cadherin expression was decreased.Compared with TGF-β1 group, PP2Ac expression was increased significantly by incubation with TGF-β1 after transfection of PP2Ac over expression plasmid.Moreover, the expression of fibronectin, collagen I and α-SMA was upregulated while E-cadherin was downregulated.Howeover, after transfected with the PP2Ac siRNA plasmid, fibronectin, collagen I and α-SMA expression was reduced, but E-cadherin was increased.2.After HK-2 cells stimulated with TGF-β1 for 1 h, the expression of pSmad3-L (pSer204) and protein of pSmad3-L (pSer208) in nucleus was elevated, both of which were furtherly downregulated when HK-2 cells were transfected with PP2Ac over expression plasmid.While they were upregulated when HK-2 cells were transfected with PP2Ac SiRNA plasmid compared with that in TGF-β1 stimulation group. Conclusion:PP2Ac promoted the accumulation of extracellular matrix and epithelial-mesenchymal transition (EMT) in HK2 cells, which could contribute to regulate the dephosphorylation of Smad3 linker region.
protein phosphatase 2Ac accumulation of extracellular matrix dephosphorylation epithelial-mesenchymal transition (EMT) Smad3 link region
国家自然科学基金资助项目(81100486、81370792);湖南省科技计划项目(2013SK3036);中华医学会临床医学专项资金(13030400425)
中南大学湘雅二医院肾内科(长沙,410011),*庾楠楠和李 华为共同第一作者
李 瑛(E-mail:liyingdoctor@163.com)
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
2015-01-28

