磷酸化表皮生长因子受体与鼻咽癌患者预后关系的研究*
吴伟
鼻咽癌是我国南方常见的恶性肿瘤,放化疗是其最主要治疗方法,近年来,随着肿瘤基础研究的不断深入,分子靶向治疗越来越广泛地应用于鼻咽癌的个体化治疗体系当中。头颈部恶性肿瘤存在表皮生长因子 受 体(epidermal growth factor receptor,EGFR)超表达现象,鼻咽癌也不例外,很多研究表明,表皮生长因子高表达与鼻咽癌预后有关,磷酸化EGFR(phosphorylated EGFR,pEGFR)是EGFR的活性形式,有学者认为,EGFR在鼻咽癌的发生发展中的作用并非受体高表达,而活性受体才是癌细胞增殖的关键因素。本研究对2012年1月-2013年6月在本院治疗的107例鼻咽癌患者的病理标本行pEGFR检测,观察pEGFR不同表达患者的生存情况是否有差异,现具体报道如下。
1 资料与方法
1.1 一般资料 选择2012年1月-2013年6月在本院经病理和影像学资料证实为鼻咽癌,病理类型为鼻咽未分化型非角性癌患者107例作为研究对象,其中男77例,女30例,年龄18~77岁,中位年龄50岁。根据pEGFR检测结果分为两组,阴性组47例,阳性组60例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者临床特征比较
1.2. 方法
1.2.1 放化疗 阴性组有41例患者行诱导化疗,阳性组有50例患者行诱导化疗,诱导化疗采用“顺铂+5-氟尿嘧啶”或“多西他赛+顺铂+5-氟尿嘧啶”方案,其中多西他赛60 mg/m2d1;顺铂30 mg/m2d1~5;5-氟尿嘧啶500 mg/m2d1~5。所有患者均接受根治性三维适形放射治疗,采用直线加速器面颈联合野照射,50 GY以后采用面颈分野放射,放疗总剂量:鼻咽68~74 GY/34~37次,颈部(N1~3)66~70 GY/33~35次,颈部(N0)50~54 GY/25~27次,放疗期间均配合化疗药物增敏,化疗药物采用单药“DDP”方案,1次/周,30 mg/(m2·次)。
1.2.2 pEGFR检测
1.2.2.1 试剂 鼠抗人pEGFR单克隆抗体购买自美国Abcam公司,二抗及DAB显色液来自购买自福州迈新公司的Elivision Super DAB检测试剂盒。
1.2.2.2 免疫组化检测方法 免疫组织化学染色采用SP二步法。所有标本组织均采用4%中性甲醛液固定,常规包埋、4 μm切片、脱蜡水化,进行高温高压抗原修复,加3%过氧化氢阻断内源性过氧化物酶,依次滴加一抗、二抗,DAB显色、苏木素复染。操作步骤严格按照说明书进行,用乳腺癌标本作为阳性对照,用PBS代替一抗作为阴性对照。
1.2.2.3 结果判断 由两位高年资病理医生独立阅片。pEGFR染色主要定位于细胞浆,染色强度计分:0分(无染色)、1分(淡黄色),2分(棕黄色)、3分(棕褐色);染色范围计分:0分(无阳性细胞)、1分(阳性细胞1%~25%),2分(阳性细胞26%~50%)、3分(阳性细胞51%~75%)、4分(阳性细胞76%~100%)。两者相加得分0~7分,以大于等于3分为阳性,3分以下为阴性。
1.3 观察指标 所有患者均进行随访,观察两组患者的总生存率、无进展生存率和无局部区域复发生存率。
1.4 统计学处理 应用SPSS 18.0软件包对所得数据进行统计学处理,计数资料比较采用 字2检验,用Kaplan-Meier法计算生存率及比较生存情况,进行Log-rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组总生存率比较 随访截止时间2015年5月,随访率96.3%,中位随访时间31个月(23~40个月)。阴性组3年总生存率为77.6%,阳性组3年总生存率为69.4%,两组3年总生存率比较,差异无统计学意义( 字2=2.431,P=0.119),见图 1。
2.2 两组无进展生存率比较 阴性组3年无进展生存率为70.5%,阳性组3年无进展生存率为62.9%,两组3年无进展生存率比较,差异无统计学意义( 字2=2.065,P=0.151),见图 2。
2.3 两组无局部区域复发生存率比较 阴性组3年无局部区域复发生存率为86.0%,阳性组3年无局部区域复发生存率为65.7%,阴性组3年无局部区域复发生存率高于阳性组,比较差异有统计学意义( 字2=4.303,P=0.038),见图 3。
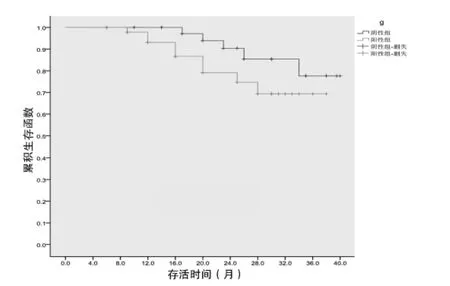
图1 两组总生存率比较

图2 两组无进展生存率比较

图3 两组无局部区域复发生存率比较
3 讨论
鼻咽癌(nasopharyngeal carcinoma,NPC)是发生在鼻咽部的一种恶性肿瘤,是我国最常见的恶性肿瘤之一,恶性程度较高,其发病机制尚未完全明确[1-2]。近年来对于影响研究鼻咽癌的预后因素的研究越来越多。其中,pEGFR的研究更为研究者所关注。
EGFR为酪氨酸激酶受体,属于Ⅰ型受体酪氨酸激酶超家族,在体内通过多种信号途径在肿瘤的发生发展中发挥重要作用[3]。EGFR在哺乳动物组织中,尤其是在其上皮、间质、神经源性器官中广泛表达,在头颈肿瘤中表达较为常见,87.5%(35/40)的口腔鳞癌,89%(48/54)的鼻咽癌,93.3%(42/45)的喉癌组织均有EGFR 的过表达[4-6]。EGFR是涉及细胞增殖和肿瘤发生、发展中的极为重要的受体信号系统,和肿瘤的侵袭、转移、恶性程度及预后密切相关。有成熟的研究也显示了EGFR控制了癌症的表型,有促进肿瘤细胞增殖以及转移的作用,同时可以促进血管的生成和抑制肿瘤细胞的凋亡等作用。自身磷酸化是EGFR的活性主要调节方式,EGFR通过磷酸化的酪氨酸残基与下游底物酶反应而传递信号。其下游主要的信号通路包括Ras-Raf-MEK-erk/MAPK信号通路、PI3K-Akt信号通路和JAK/STAT信号通路等。
张小鹏等[7]的研究认为COX-2和EGFR在鼻咽癌患者的组织和血清中都有较高的浓度,同时其浓度的高低和鼻咽癌患者的分期有相关性,故可以成为鼻咽癌患者的诊断和预后的参考指标。EGFR过表达与鼻咽癌进程、放疗抗拒性和预后差有关[8-11]。pEGFR是EGFR的活性形式。EGFR与细胞内其他的细胞因子,例如EGF、TGF-α相结合以后,使EGFR本身磷酸化而使其活化,进一步开启了MAPK通路,MAPK通路的作用可以使细胞外的信号调节激酶发生了核转位进而活化,最后促使靶基因进行转录。并且,在临床上的相关实验也证明了干扰EGFR进行磷酸化可以抑制其下游通路的发生,进而使细胞周期发生阻滞和延迟肿瘤的生长速度。有研究已经证实了在非小细胞肺癌患者中,pEGFR的高表达和临床预后差有明显的关系[12]。也有研究表明pEGFR低表达鼻咽癌患者无转移生存明显优于高表达患者,故pEGFR可能在鼻咽癌的转移中起着重要作用[13]。袁太泽等[14]的研究显示pEGFR高表达患者5年无转移生存率显著低于pEGFR低表达者(P=0.012)。也有学者认为EGFR表达与患者生存无关[15]。
本研究的结果显示,两组3年总生存率与无进展生存率比较,差异均无统计学意义(P>0.05),阴性组3年无局部复发生存率高于阳性组,比较差异有统计学意义(P=0.038)。pEGFR与患者的预后差相关联,本验的研究结果在临床方面进一步证实了pEGFR的过表达与鼻咽癌患者的局部控制差相关。这一研究结论在临床有一定的实际应用价值,可作为鼻咽癌患者预后的一个推测指标。但有关pEGFR导致鼻咽癌患者预后差的分子机制,本试验未做相关研究,可在以后的研究中进一步探索。
[1]Lu J J,Cooper J S,Lee A W M.Nasopharyngeal cancer:multidisciplinary management[M].Germany:Springer Verlag,Heidelberg,2010:1-7.
[2]赵平.中国肿瘤临床年鉴[M].北京:中国协和医科大学出版社,2010:2.
[3]Heuckmann J M,Rauh D,Thomas R K.Epidermal growth factor receptor(EGFR)signaling and covalent EGFR inhibition in lung cancer[J].Clin Oncol,2012,30(27)∶ 3417-3420.
[4]Sarkis S A,Abdullah B H,Majeed B A,et al.Immunohistochemical expression of epidermal growth factor receptor (EGFR)in oral squamous cell carcinoma in relation to proliferation,apoptosis,angiogenesis and lymphangiogenesis[J].Head Neck Oncol,2010,2(13):1-8.
[5]Chua D T,Nicholls J M,Sham J S,et al.Prognostic value of epidermal growth factor receptor expression in patients with advanced stage nasopharyngeal carcinoma treated with induction chemotherapy and radiotherapy[J].Int J Radiation Oncology Biol Phys,2004,59(1):11-20.
[6]Starska K,Glowacka E,Lewy-Trenda I,et al.EGFR immunoexpression and peripheral blood cytokine secretion as potential biomarkers of tumor behavior in laryngeal squamous cell carcinoma[J].Med Sci Monit,2009,15(10):518-527.
[7]张小鹏,边枫,王丽新.环氧合酶-2及表皮生长因子受体在鼻咽癌中的表达及相关性[J].山东大学耳鼻喉眼学报,2014,28(3):23-27.
[8]Wissing J,Jansch L,Nimtz M,et al.Proteomics analysis of protein kinases by target class-selective prefractionation and tandem mass spectrometry[J].Mol Cell Proteomics,2007,6(3):537-547.
[9]Knight Z A,Schilling B,Row R H,et al.Phosphospecific proteolysis for mapping sites of protein phosphorylation[J].Nat Biotechnol,2003,21(9):1047-1054.
[10]McLachlin D T,Chait B T.Improved beta-elimination-based affinity purification strategy for enrichment of phosphopeptides[J].Anal Chem,2003,75(24):6826-6836.
[11]Tseng H C,Ovaa H,Wei N J,et al.Phosphoproteornic analysis with a solid-phase capture-release-tag approach[J].Chem Biol,2005,12(7):769-777.
[12]Sonnweber B,Dlaska M,Skvortsov S,et al.Highpredictive value of epidermal growth factor receptor phosphorylation but not of EGFR vmutationin resected stage non-smallcell lung cancer(NSCLC)[J].J Clin Pathol,2006,59(3):255-259.
[13]Ma B B,Poon T C,To K F,et al.Prognostic significance of tumor angiogenesis,Ki67,p53 oncoprotein,epidermal growth factor receptor and HER2 receptor protein expression in undifferentiated nasopharyngeal lcarcinoma-a prospective study[J].Head Neck,2003,25(10):864-872.
[14]袁太泽,李晓霞,曹云.表皮生长因子受体活化与鼻咽癌患者无转移生存的关系[J].癌症,2008,27(5):449-454.
[15]Leong J L,Loh K S,Putti T C,et al.Epidermal growth factor receptor in undifferentiated carcinoma of the nasopharynx[J].Laryngoscope,2004,114(1):153-157.

