葛根素治疗慢性疼痛的作用机制
刘清珍,朱四海 综述,李伟彦 审校
(本文编辑:齐 名)
神经病理性疼痛(neuropathic pain,NP)是由躯体感觉神经系统的损伤或疾病直接引起的疼痛,与损伤区域触觉和感觉反应异常有关[1],包括一系列疼痛综合征,如复杂的区域疼痛综合征、幻肢痛、癌性疼痛、AIDS痛、三叉神经痛和带状疱疹后神经痛等。神经病理性疼痛的治疗方法包括神经调节术、神经消融术、静态磁场疗法等,药物是主要治疗方法。目前常用的治疗药物有抗惊厥药、三环类抗抑郁药、局部麻醉药、中枢性镇痛药曲马多和阿片类药物[2-4]等。这些药物的治疗都有一定局限性,如特异性不高、镇痛效果较差等。药物的不良反应有依赖、呼吸抑制、恶心、呕吐、幻觉等,影响患者依从性。
葛根素(puerarin,Pue)是从葛根中提取的异黄酮化合物,化学结构式如图 1[5-7],化学名为 8-β-D-葡萄吡喃糖-4',7-二羟基异黄酮。
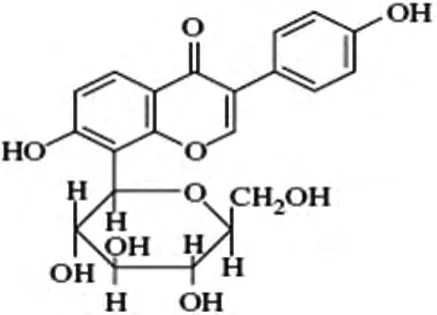
图1 葛根素的化学结构式
葛根素在治疗脑血管疾病有一定的疗效,可扩张脑血管,改善微循环,用于脑缺血再灌注引起脑损伤的治疗,对神经细胞损伤和星型胶质细胞损伤均有保护作用[8-10]。近年来研究发现,葛根素治疗神经病理性疼痛具有一定的效果[11],其作用特点为半衰期长,起效慢,所需镇痛剂量小,阈下镇痛剂量无明显毒副作用,因此有望成为治疗神经病理性疼痛的新型药物。本文综述和探讨葛根素的镇痛作用。
1 钠离子通道阻断剂的镇痛作用
神经病理性疼痛的病因多种多样,发病机制较为复杂。其发病机制包括脑干和大脑、脊髓、外周神经系统的改变等[12-14]。外周神经损伤后,在神经损伤区及相应的感觉神经元细胞产生大量自发性放电—异位放电。放电引起神经病理性疼痛的症状主要通过长期轰击脊髓,引起脊髓水平的敏感化。损伤区或脊髓背根神经节(dorsal root ganglion,DRG)神经元胞体膜上存在电压依赖性离子通道,如Na+、K+、Ca2+通道,这些通道的改变也会引起异位放电,产生神经病理性疼痛症状。在异位放电中,Na+的改变受到关注,可能成为研究神经病理性疼痛的新靶点。在Na+通道中,神经营养因子具有重要作用[15]。阻断Na+通道的药物对神经病理性疼痛均有一定治疗作用[16]。
电压门控钠离子通道可以分为河豚毒素敏感(TTX-sensitive,TTX-S)和河豚毒素不敏感(TTX-resistant,TTX-R)两大类。DRG大直径神经元(>50 μm)主要表达TTX-S钠通道,DRG小直径神经元(< 30 μm)两者均可以表达。Navl.5、Nav1.8 和Na、1.9 亚单位为 TTX-R 钠通道,Nav1.1、Navl.2、Navl.6及 Navl.7为 TTX-S钠通道。DRG受损后,由于Na1.3亚单位的表达增加,可见DRG小直径神经元中TTX-S通道电流明显增大,而Na1.8和Na1.9亚单位的表达下调[17],使得TTX-R电流减小,从而导致神经病理性疼痛。由Na1.3表达上调所引起的异位放电可能是神经病理性疼痛的基础。
Na+阻断剂可通过与其相应的受体位点结合降低神经兴奋性,从而抑制神经兴奋的发生和传导,达到镇痛的作用。葛根素是Na+通道阻断剂,可发挥一定镇痛作用,部分抑制TTX-R钠电流激活过程,剂量依赖性减弱大鼠DRG神经元细胞的TTX-R的钠电流,按照去极化方向改变1/2最大电导及激活曲线,从而实现对钠电流激活过程[18]。进一步研究表明,葛根素通过抑制大鼠DRG神经元细胞以及外周血单核细胞的ATP受体P2X3和P2X2/3的表达,对烧伤引起的急性疼痛大鼠模型发挥镇痛作用[19]。
2 调节炎症因子
炎症因子可分为促炎症细胞因子和抗炎症细胞因子两种类型,是由机体的免疫或非免疫细胞合成并分泌的多肽类物质,调节多种细胞生理功能,并在创伤、疼痛、感染等应激过程中起重要作用[20]。目前已知的炎性介质有白细胞介素(interleukin,IL)、干扰素(interferon,IFN)、肿瘤坏死因子(tumor necrosis factor,TNF)、神经生长因子(nerve growth factor,NGF)等。其中,白细胞介素-1(IL-1)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)、TNF等是促炎症细胞因子,白细胞介素-4(IL-4)和白细胞介素-10(IL-10)是抗炎症细胞因子[21-23]。正常生理情况下,促炎症细胞因子和抗炎症细胞因子通过机体的调控维持精细的平衡。Rittner等[24]报道,当组织破坏激活疼痛感受器,炎症因子的变化就会引起疼痛。
炎症因子在神经病理性疼痛的发生起重要作用[25]。5羟色胺、缓激肽、P物质、组胺等化学介质的释放均可导致炎症因子的激活,使高阈值的伤害性感受器化学致敏,传导低强度的痛觉刺激。
葛根素以剂量依赖性方式抑制炎性因子,通过提高大鼠T淋巴细胞增殖能力和 NK细胞活性,增强大鼠巨噬细胞吞噬功能。其中T细胞、NK细胞和单核巨噬细胞与IL-1、IL-6和TNF-α等多种炎症因子的合成和释放有关,这些炎症因子作为致痛物质,主要作用于初级传入神经,导致伤害性神经递质的释放,促使脊髓背角和大脑神经元的兴奋,从而引起疼痛。
研究表明不同浓度的葛根提取物对TNF-α、IL-l、IL-2 影响不同[26]。浓度为 0.08 ~2 μg/mL 的葛根素对TNF-α的分泌无影响,对IL-1、IL-2有抑制作用。10 μg/mL 的葛根素对 TNF-α、IL-1、IL-2 的分泌均呈抑制作用。实验表明葛根素可以显著抑制TNF-α和IL-1β的分泌,显著降低前列腺素E2的含量,从而减轻神经病理性疼痛[27]。
3 保护神经细胞
细胞主要有两种死亡形式:坏死与凋亡。细胞凋亡的概念于1972年由Kerr首次提出。细胞凋亡不同于细胞坏死,细胞凋亡是自身启动,主动控制,由基因调控而使细胞自动消亡的过程,又称程序性细胞死亡[28]。外周神经损伤可引起脊髓背角神经元细胞周亡,导致脊髓背角结构和功能的改变,使机械痛刺激与热痛刺激表现下降,产生痛觉过敏。凋亡对于细胞损伤及神经病理性疼痛具有重要意义。周围神经损伤可引起细胞改变,引起线粒体膜电位失衡,导致线粒体结构及功能障碍,使得存在于线粒体内的细胞色素C通过线粒体上的转化通道,释放到细胞质中,继而与细胞凋亡相关蛋白因子结合形成复合物,进一步裂解及活化与细胞凋亡相关的半胱氨酸-天冬氨酸蛋白酶(cysteine-containing aspartate-specific protease,caspase),引发一系列凋亡级联反应。通过药物干预抑制细胞凋亡,可以减轻痛觉过敏,从而达到治疗神经病理性疼痛的目的。
葛根素对神经细胞保护作用。其机制可能与葛根素抗细胞凋亡,增加Bcl-2的表达有关。Bcl-2基因编码细胞凋亡抑制因子,其作用是调节神经细胞的凋亡。在神经细胞损伤前后,机体通过调节Bcl-2蛋白的表达量来对抗凋亡。葛根素通过上调Bcl-2蛋白、下调Bax蛋白的表达来抑制神经细胞凋亡。张相彤等[29]研究表明,葛根素作用于损伤的神经细胞7 d后,以浓度效应关系改善创伤性损伤神经细胞的病理改变,可以减轻细胞的凋亡程度,增加Bcl-2的表达,从而降低Bax/Bcl-2比率,且与葛根素的浓度呈一定的剂量依赖性,提示葛根素对损伤的神经细胞具有神经保护作用。曹建中等[30]认为葛根素对神经细胞损伤的保护作用可能与葛根素上调Bcl-2蛋白的表达、下调Bax蛋白的表达,从而抑制神经细胞凋亡,发挥神经元的保护作用。因此,推测葛根素通过对神经细胞的保护达到治疗神经病理性疼痛的目的。
研究表明葛根素可以减轻缺血性大鼠脑细胞的损伤,这一作用主要通过提高热休克蛋白70(HSP70)表达水平来实现。葛根素可诱导细胞表达HSP70而对损伤的神经细胞起保护作用[31]。葛根素还可抑制caspase-3活性,抑制细胞凋亡从而保护缺血性脑损伤。
如上所述,葛根素具有阻断钠离子通道、调节细胞因子表达、保护神经细胞等药理作用。这些都可以解释葛根素用于治疗神经病理性疼痛的确切疗效。但是由于神经病理性疼痛的发病机制极其复杂,而葛根素的成分并不单一,临床使用时往往多药并用,所以其治疗神经病理性疼痛确切的机制尚待进一步研究。
[1]Baron R,Binder A,Wasner G.Neuropathic pain:diagnosis,pathophysiological mechanisms,and treatment[J].Lancet Neurol,2010,9(8):807-819.
[2]舒海华,安 珂,李桥波,等.神经病理性疼痛的药物治疗[J].实用疼痛学杂志,2011,7(2):127-133.
[3]赵序利,许永广,宋文阁,等.抗癫痫药物治疗神经病理性疼痛的对照研究[J].中国疼痛医学杂志,2012,18(2):73-77.
[4]李 咏,陈冠容,宋红萍.普瑞巴林治疗神经性疼痛的研究进展[J].中国医院药学杂志,2011,31(19):1633-1635.
[5]Wu L,Qiao H,Li Y,et al.Protective roles of puerarin and Danshensu on acute ischemic myocardial injury in rats[J].Phytomedicine,2007,14(10):652-658.
[6]苑程鲲,沈文娟,吴效科,等.葛根素临床应用新进展[J].中医药信息,2012,28(6):125-127.
[7]黄帧桧,程慧珍,张年宝,等.葛根素对左室局部AngⅡ水平的影响及对左室肥厚的逆转作用[J].实用药物与临床,2010,13(3):161-163.
[8]臧 霖,王 帅,孟宪生,等.大孔吸附树脂对葛根中葛根素的分离纯化工艺研究[J].亚太传统医药,2013,9(2):9-11.
[9]赵莹莲.葛根素的药理作用及临床应用进展[J].安徽医药,2010,14(12):1377-1379.
[10]马 晔,马建芳,陈宏等.葛根素治疗老年人椎-基底动脉供血不足及对血液流变学影响的临床观察[J].东南国防医药,2006,8(2):111-112.
[11]罗敬华,曾晓艳,范桂香,等.葛根素对神经病理性痛模型小鼠的镇痛作用[J].西北药学杂志,2013,28(1):48-50.
[12]王东吉,尚改萍,李 婷,等.葛根素对蟾蜍离体坐骨神经干电生理特性的影响[J].长治医学院学报,2014,28(1):13-16.
[13]韩济生.神经病理性疼痛热点谈[J].医学研究杂志,2012,40(11):1-2.
[14]张翠英,李 卉,张 英,等.神经病理性疼痛发病机制及多学科综合治疗研究进展[J].内蒙古医学院学报,2012,34(2):157-162.
[15]Li X,Zhang J,Gao Y,et al.Puerarin alleviates burn-related procedural pain mediated by P2X3 receptors[J].Purinergic Signal,2011,7(4):489-497.
[16]Tarnawa I,Bolcskei H,Kocsis P.Blockers of voltage-gated sodium channels for the treatment of central nervous system diseases[J].Recent Pat CNS Drug Discov,2007,2(1):57-78.
[17]Gold MS,Weinreich D,Kim CS,et al.Redistribution of Nav1.8 in uninjured axons enables neuropathic pain[J].J Neurosci,2003,23(1):158-166.
[18]孟祥雪,赵明沂,张景海.电压门控钠离子通道与疼痛[J].沈阳药科大学学报,2011,28(8):658-662.
[19]Liang S,Xu C,Li G,et al.P2X receptors and modulation of pain transmission:focus on effects of drugs and compounds used in traditional Chinese medicine[J].Neurochem Int,2010,57(7):705-712.
[20]郭现辉,王 珂,王 鑫,等.电针对慢性坐骨神经结扎性损伤模型大鼠外周血清中 TNF-α,IL-1β,IL-6 表达的影响[J].上海中医药杂志,2013(9):66-69.
[21]Wu X,Lu Y,Dong Y,et al.The inhalation anesthetic isoflurane increases levels of proinflammatory TNF-α,IL-6,and IL-1β[J].Neurobiol Aging,2012,33(7):1364-1378.
[22]Patanella AK,Zinno M,Quaranta D,et al.Correlations between peripheral blood mononuclear cell production of BDNF,TNF-alpha,IL-6,IL-10 and cognitive performances in multiple sclerosis patients[J].J Neurosci Res,2010,88(5):1106-1112.
[23]梅厚连,罗天友.强痛定联合对乙酰氨基酚对神经病理性疼痛大鼠模型促炎因子的影响[J].中国医药导报,2013,10(19):34-36.
[24]Rittner HL,Brack A,Stein C.Pain and the immune system:friend or foe?[J]Der Anaesthesist,2002,51(5):351-358.
[25]张世栋,田首元,王 杰,等.鞘内注射右美托咪定对大鼠慢性神经病理性痛形成的影响[J].中国中西医结合急救杂志,2013,20(4):244-247.
[26]杜德极,聂 梅.葛根提取物体外对 TNF、IL-1及IL-2产生的影响[J].中草药,1997,28(3):160-162.
[27]Kerr JF,Wyllie AH,Currie AR.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].Br J Cancer,1972,26(4):239-257.
[28]周 军,方素萍,齐 云,等.葛根汤对佐剂性关节炎大鼠关节液炎症介质的影响[J].中国实验方剂学杂志,2001,7(3):29.
[29]张相彤,尚振德,谢春成,等.葛根素对成年大鼠创伤性脑损伤神经细胞的保护作用[J].创伤外科杂志,2007,9(3):241-244.
[30]曹建中,刘书山,杨光田.鼠急性全脑缺血再灌注后葛根素对海马CA1区 Bcl-2,Bax表达的影响[J].中国药理学通报,2003,19(11):1281-1283.
[31]陈 瑜,刘翠萍,茅晓东,等.糖基化终产物诱导小鼠足细胞内质网应激和细胞凋亡的研究[J].医学研究生学报,2013,26(11):1129-1133.

