超声波协同α淀粉酶提取野生山药多糖工艺研究
◎吉仙枝
(三门峡职业技术学院食品园林学院,河南三门峡472000)
超声波协同α淀粉酶提取野生山药多糖工艺研究
◎吉仙枝
(三门峡职业技术学院食品园林学院,河南三门峡472000)
以野生山药为原材料,采用超声波辅助提取α淀粉酶浸提的方法分别研究了超声功率、超声时间、超声温度和α淀粉酶浸提阶段的α淀粉酶用量对野生山药多糖提取效果的影响;并通过正交实验得出超声波协同α淀粉酶提取野生山药多糖的最佳工艺参数。结果表明:各因素对野生山药多糖得率的影响次序为:超声功率>超声时间>超声温度>α淀粉酶用量。最佳参数组合是:固液比1g:50mL,前期超声提取阶段功率1000W,时间选定60min,温度70℃;后期α淀粉酶浸提阶段α淀粉酶用量0.2%,酶促反应体系温度60℃,pH为6.0,浸提时间为30min。按最佳工艺参数提取,野生山药多糖得率为11.5%。
野生山药;多糖;超声波辅助提取;α淀粉酶
山药,即薯蓣,别名怀山药、淮山药、土薯、山薯、山芋、玉延。多年生蔓型草本植物,根茎圆柱形,直生,长可达1米。根茎含淀粉和蛋白质,具有营养滋补、诱生搅扰素、调度内排泄、补气通脉、增强机体免疫力、镇咳祛痰、平喘等作用,因此,山药是食药两用植物。中国主产于河南省北部(焦作境内,含博爱、沁阳、武陟、温县等县),山东(单县、苍山、寿光、兖州、嘉祥、泰安、桓台、邹平等)、河北、山西及中南、西南等地区也有栽培。
山药的栽培历史悠久,普通山药和田薯是主要的栽培品种。普通山药中以古代怀庆府(位于河南省焦作境内,地域涵盖沁阳、武陟、博爱、温县等)出产的最为著名,习称“怀山药”,外部特征为块茎较其他山药小,营养丰富。药理学研究认为,怀山药不仅营养滋补,它所富含的山药多糖能诱生干扰素、活跃机体的免疫系统功能、调整新陈代谢、改善循环系统功能,其对于慢性气管炎、冠心病、心绞痛等均有辅助治疗作用。目前,河南焦作的“铁棍山药”、山东省菏泽的“陈集山药”、湖北武穴的“佛手山药”、江西瑞昌市南阳乡的山药已申请了国家地理标志保护产品[1]。本文采用超声波协同α淀粉酶辅助提取野生山药多糖,选用苯酚-硫酸法测定野生山药多糖含量,选择不同超声频率、超声温度、超声时间、α淀粉酶用量等条件展开研究。并且在前人研究的基础上[2][3][4],将超声波辅助提取和α淀粉酶浸提分开进行,使超声功率的选择不再受酶活性的限制,很好地提高了野生山药多糖的提取率,为进一步开发利用野生山药资源提供了理论依据。
1 材料与方法
1.1 主要仪器和试剂
1.1.1 主要仪器
DHG-9030A电热恒温鼓风干燥箱(上海一恒科技有限公司)
722N型可见分光光度计(上海天普分析仪器有限公司)
HH-S11-8-S电热恒温水浴锅(金坛市华特实验仪器有限公司)
FA2204B型电子天平(上海精密仪器仪表有限公司)
高速组织捣碎机(上海乔跃电子有限公司)
1.1.2 试剂
硫酸、苯酚、无水氯化钙和葡萄糖均为分析纯试剂
α淀粉酶(郑州康源化工产品有限公司)
本实验用水均为蒸馏水
1.1.3 材料
山药(野生,采挖于河南省修武县)
1.2 葡萄糖标准液的配制
用FA2204B型电子天平称取分析纯干燥恒重的葡萄糖100mg,溶解后定容至100ml,配得1mg/ml的葡萄糖储备液,再用移液管准确量取10.00ml储备液后定容至100ml,即得到0.1mg/ml的葡萄糖标准液。
1.3 苯酚溶液的配制
取100g无色针状的苯酚晶体,90℃水浴中保温至融化,加入0.05gNaOH进行蒸馏提纯,取178-182℃的馏出液9.375g加入150ml蒸馏水中,制得26.25%的苯酚溶液,棕色瓶中储存备用。
2 试验方法
2.1 山药的预处理
取适量新鲜山药,洗净,去皮,切薄片,于电热恒温鼓鼓风干燥箱中105℃充分烘干并用研钵粉碎。
2.2 山药多糖的提取
操作流程如下图所示。
准确称取5份已粉碎的山药样品2g,置于5个已加入100ml蒸馏水的锥形瓶中,选择不同超声波功率、超声温度、超声时间和α淀粉酶用量来分别进行单因素实验,离心分离后取出浸提液进行水溶性糖含量测定,进行正交分析确定超声波功率、超声温度、超声时间和α淀粉酶用量的最佳组合。

超声波协同α淀粉酶提取野生山药多糖工艺流程图
2.3 山药多糖含量的测定方法
采用苯酚-硫酸法。
2.3.1 绘制标准曲线[5]
准确移取0.1mg/ml的葡萄糖标准液0.1、0.2、0.4、0.8、1.6ml,分别放置于10ml的比色管中,分别补加蒸馏水至2ml,另取一支比色管直接加蒸馏水至2ml作为空白对照。在以上比色管中均加入6.25%的苯酚溶液1.0ml,摇匀后各加浓硫酸5.0ml,再次摇匀,冷却至室温,490nm可见光处测量吸光度。根据测量数据绘制标准曲线并计算,得出回归方程为:A=10.51C(mg/ml)+0.0123,相关系数r=0.9991。
2.3.2 测定野生山药多糖含量
将2.2操作中,按照不同超声波功率、超声温度、超声时间和α淀粉酶用量等参数条件进行的野生山药提取液,准确移取0.1ml,分别置入10ml的比色管中,补加蒸馏水至2ml,测定其吸光度,并计算出不同加热温度和时间水溶性糖的含量[6-7]。
3 结果与讨论
3.1 超声波协同α淀粉酶提取野生山药多糖工艺的单因素实验
3.1.1 超声辅助提取时超声功率的选择
按照2.2操作的方法,因为这里采用了先超声提取再酶解的方式,不用考虑酶的耐受温度,故选定超声提取温度70℃,提取时间为50min。之后的α淀粉酶辅助提取阶段,α淀粉酶(2000u/g)添加量按照厂家提供的一般使用量加入,同时加入0.2%无水氯化钙(按原料重量计算),选用该酶的最适反应温度和最适反应pH,进行浸提,使用沸水浴灭活酶,离心分离后取出浸提液进行野生山药多糖含量测定。测定结果如表1。
由表1可知,超声功率在700W-1100W之间时,由于超声波作用于细胞后,野生山药多糖溶出率与超声功率呈现正相关,随着超声功率的增大,多糖得率逐渐提高。但在选择超声功率时,需要考虑到大功率的超声波会造成部分多糖的分解等一些负面影响[8],结合数据分析,超声功率大于900W后,对野生山药多糖得率的影响没有之前明显。
3.1.2 超声辅助提取温度的选择
按照2.2操作的方法,选定超声功率为900W,提取时间为50min。以上几个条件不变的情况下,考虑到淀粉的糊化和老化,超声辅助提取温度不宜超过70℃。之后的α淀粉酶辅助提取阶段操作与3.1.1同。超声温度对测定结果的影响如表2。
由表2分析可知,由于植物多糖难溶于冷水,在所选定的温度范围内,开始时随温度升高,测得的野生山药多糖含量逐步升高,但是温度升高也伴随着淀粉的糊化程度增加,当温度大于60℃后,测得的野生山药多糖含量增加幅度降低,得率增加值减缓。
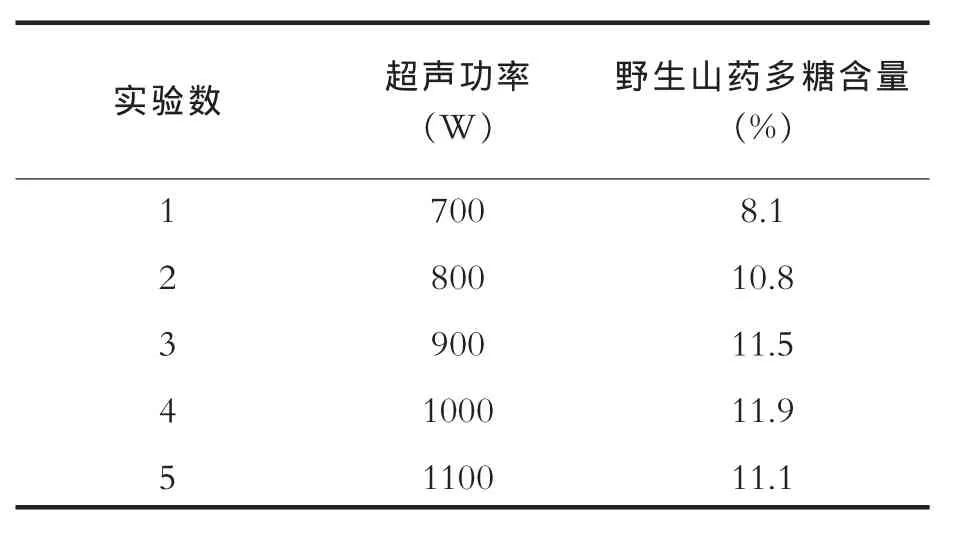
表1 超声功率对提取效果的影响
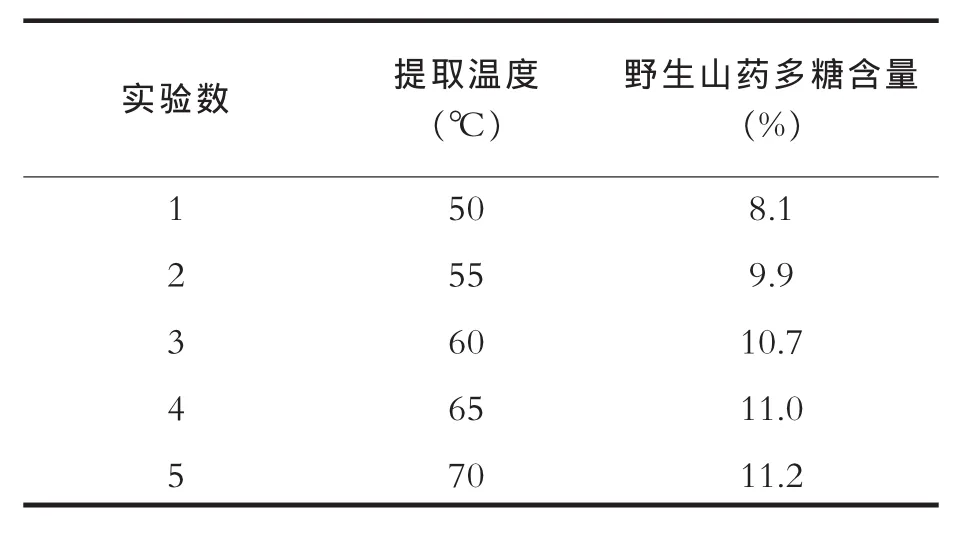
表2 超声温度对提取效果的影响
3.1.3 超声辅助提取时间的选择
按照2.2操作的方法,选定超声功率为900W,超声温度为70℃。之后的α淀粉酶辅助提取阶段操作与3.1.1同。以上几个条件不变的情况下,超声辅助提取时间对野生山药多糖含量测定结果的影响如表3。
由表3可知,随着超声辅助提取时间的延长,所测得野生山药多糖含量逐步升高,当超声辅助提取时间达到50min后,野生山药多糖得率的增高趋势不明显,50min至90min的区段内,野生山药多糖得率基本处于一个稳定的数值,不再增加。
3.1.4 α淀粉酶用量的选择
按照2.2操作的方法,超声辅助提取阶段选定为超声功率900W,提取时间为50min,提取温度70℃。结束后,待溶液温度降至60℃(α淀粉酶的最适反应温度),将溶液pH调至6.0(所用的α淀粉酶的最适pH由厂家提供),进行时间为30min的α淀粉酶辅助提取。在其他条件不变的情况下,加入不同量的α淀粉酶(2000u/g)和0.2%无水氯化钙(按原料重量计算)进行浸提,按照2.2操作的方法,进行野生山药多糖含量测定,确定超声波协同α淀粉酶提取野生山药多糖工艺的最佳加酶量。α淀粉酶用量对测定结果的影响如表4。
根据酶促反应的特点分析,在反应体系中其他成分不变的情况下,酶促反应的特定底物与酶的接触机会随着酶浓度上升而增加,伴随这个过程野生山药多糖在被分离出来。但是,当酶浓度升高至所有的底物分子都能与酶分子结合后,酶分子就处于过饱和状态,底物被水解的速度不再与酶分子的增加呈现正相关。由表4可知,α淀粉酶量低于4mg时,野生山药多糖得率随α淀粉酶用量的增加而增大。当加酶量高于4mg后,多糖得率逐渐减小。
3.2 超声波协同α淀粉酶提取野生山药多糖工艺超声辅助提取阶段实验条件优化
在单因素实验的基础上,选取超声时间、超声温度、超声功率和α淀粉酶用量四个因素,以野生山药多糖得率为指标,设计4因素3水平的正交实验见表5,对超声波协同α淀粉酶提取野生山药多糖工艺参数进行优化。
由表5的极差分析结果可知,实验所选的4个因素对多糖得率的影响次序是:超声功率>超声时间>超声温度>α淀粉酶用量。超声波协同α淀粉酶提取野生山药多糖工艺的最佳参数组合为:超声功率1000W,超声提取时间60min,超声提取温度70℃,α淀粉酶用量5mg。综合考虑单因素实验的数据,最终选择α淀粉酶用量4mg为最佳工艺参数。按最佳工艺参数重复提取,野生山药多糖得率为11.5%。
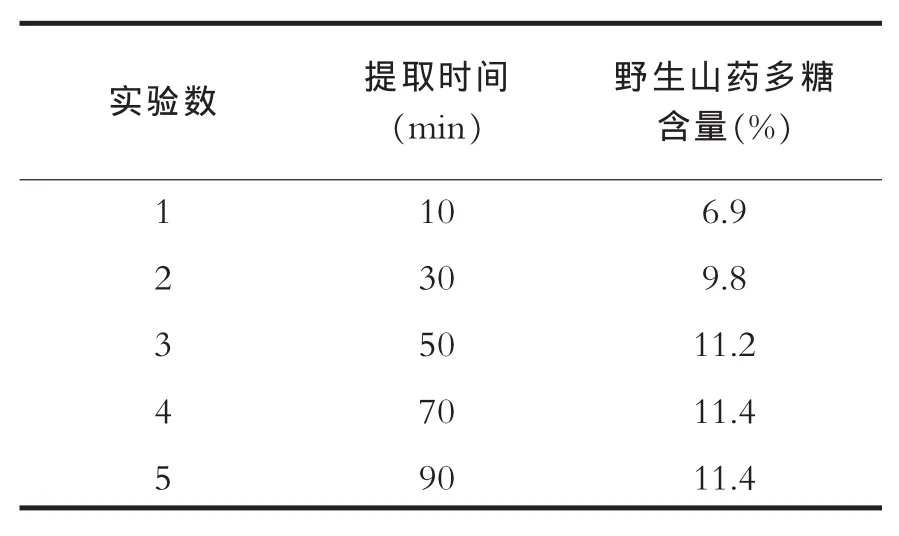
表3 超声时间对提取效果的影响
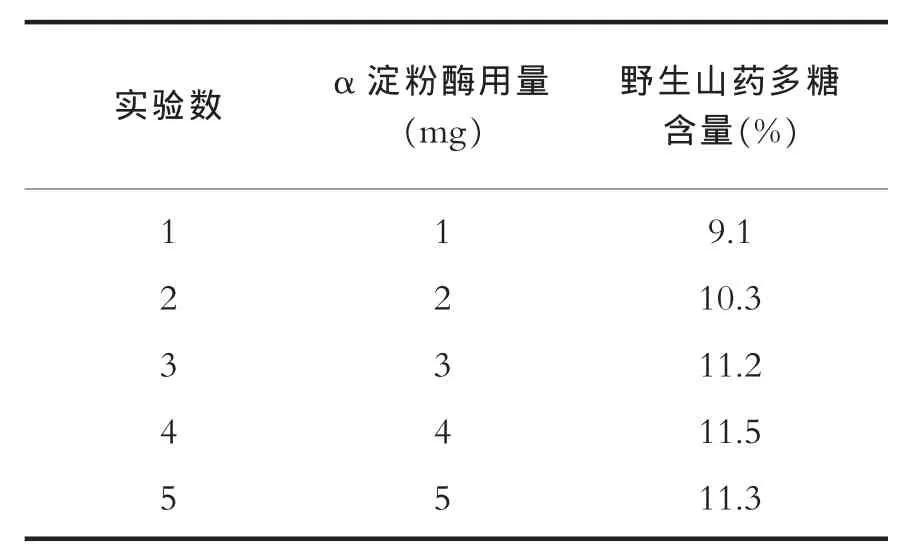
表4 α淀粉酶用量对提取效果的影响
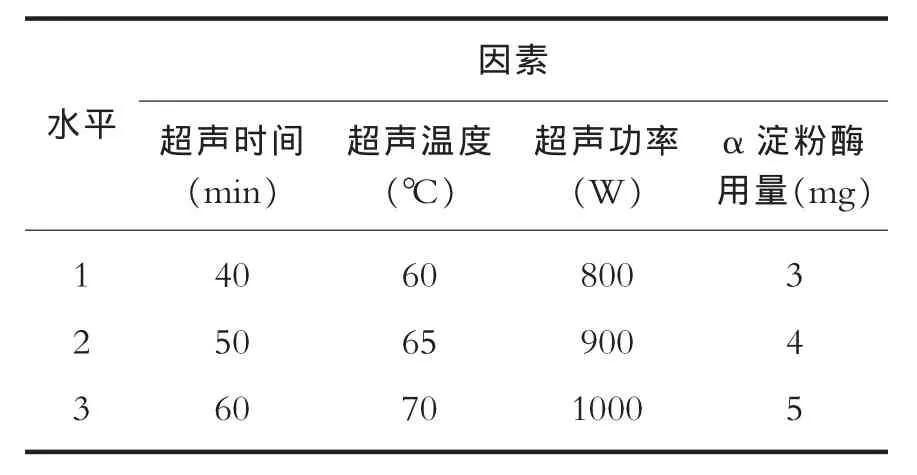
表5 超声波协同α淀粉酶提取野生山药多糖工艺参数优化正交实验设计
4 结论
本研究表明,超声波协同α淀粉酶提取野生山药多糖工艺的最佳参数组合为:前期超声提取阶段的超声功率1000W,超声提取时间选定60min,超声提取温度70℃;后期α淀粉酶浸提阶段α淀粉酶用量4mg,酶促反应体系温度60℃,pH为6.0,浸提时间为30min。这一工艺设计将超声波和α淀粉酶两个辅助因素进行阶段性的分离,回避了超声功率对酶活性的不良影响[9],更好地发挥了两者在野生山药多糖提取过程中的有利作用,较好地提高了野生山药多糖的提取率。可见,超声波协同α淀粉酶提取野生山药多糖工艺对更好地开发野生山药资源,尤其对山药多糖生产具有一定的应用价值。
[1]王洪新,王远辉.山药多糖研究进展[J].食品与生物技术学报,2011,30(03):321-327.
[2]宋爱新,张经纬,李明静,等.热分析方法对几种不同产地山药的鉴别[J].中草药,2003(02):169-171.
[3]李金钟,马海乐,吴沿友.超声波提取山药多糖的研究[J].粮油食品科技,2005,13(05):14-15.
[4]张元,林强,魏静娜,等.酶法提取山药中多糖的工艺研究[J].中国中药杂志,2008,33(04):374-377.
[5]尚晓娅,任锦,曹刚.山药多糖的制备及其体外抗氧化活性[J].化学研究,2011,21(02):72-76.
[6]齐建红.山药的化学成分及其生物活性[J].西安文理学院学报:自然科学版,2010,13(04):12-15.
[7]李宏睿,姚树林,陈云超,等.山药多糖提取工艺的优化及抗氧化活性的测定[J].安徽农业科学,2011(06):3322-3324.
[8]陈少青,蒋旭钢,汪财生,等.紫山药多糖超声波辅助提取工艺优化及抗氧化性能研究[J].江苏农业科学,2009 (05):231-234.
[9]曾凡梅,张恒,孔明航.超声波协同纤维素酶提取山药多糖的工艺及组分测定研究[J].江西食品工业,2010(02):32-34.
(责任编辑 卞建宁)
TS218
A
1671-9123(2015)01-0140-05
2015-01-17
吉仙枝(1979-),女,河南义马人,三门峡职业技术学院食品园林学院讲师。

