纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响
龙奕,刘珊珊,王萌,马陶武
吉首大学生物资源与环境科学学院,吉首 416000
纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响
龙奕,刘珊珊,王萌,马陶武*
吉首大学生物资源与环境科学学院,吉首 416000
金属氧化物纳米颗粒的广泛应用导致它们大量地释放到水环境中,其独特的理化性质有可能改变水环境中其他共存污染物(如重金属)的生态毒性。为评价沉积物中纳米氧化铝(Al2O3-NPs)对重金属Cd生态毒性的影响,采用底栖生物慢性暴露研究了Al2O3-NPs存在条件下Cd在底栖动物铜锈环棱螺体内生物积累的变化和Cd对肝胰脏抗氧化防御系统关键成分超氧化物歧化酶(SOD)与脂质过氧化指标丙二醛(MDA)以及Ⅱ相反应的关键酶谷胱甘肽-S-转移酶(GST)的影响。结果表明,低Cd浓度(5 μg·g-1)时,Al2O3-NPs对Cd生物积累没有影响;中、高Cd浓度(25、100 μg·g-1)时,Al2O3-NPs显著促进Cd的生物积累,Al2O3-NPs对Cd的生物转运具有明显的携带效应。低Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的SOD活性与对照组相比均没有显著差异;中Cd浓度时,SOD活性显著升高,而高Cd浓度时,SOD活性显著下降,而且Al2O3-NPs处理组的SOD活性显著低于无Al2O3-NPs处理组,Al2O3-NPs的存在加重了Cd对肝胰脏细胞的氧化胁迫或损伤。高Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的MDA水平均显著升高,但Al2O3-NPs处理组的MDA水平显著低于无Al2O3-NPs处理组,进一步证明Al2O3-NPs对Cd氧化损伤的增强作用。中、高Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的GST活性均显著下降,但Al2O3-NPs处理组的GST活性均显著低于无Al2O3-NPs处理组,同样说明了Al2O3-NPs对Cd毒性的增强作用。本研究提供了在沉积物-底栖动物体系中Al2O3-NPs促进重金属生物积累的证据,而且Cd毒性的变化与肝胰脏中Cd的生物积累水平的变化基本一致,在中、高Cd浓度下,由于Al2O3-NPs的存在显著促进了Cd的生物积累,因而增强了Cd对铜锈环棱螺的生态毒性。
Cd;Al2O3-NPs;铜锈环棱螺;底栖动物;沉积物;SOD;MDA;GST
随着人工纳米颗粒(engineering nanoparticles, ENPs)在生产过程和消费品中日益广泛的使用,ENPs势必会大量地进入水环境中[1],其对水生生物的潜在威胁已经引起高度关注[2],了解其环境生物学效应显得非常重要。研究显示,很多ENPs不仅自身对水生生物表现出毒性[3],而且无论是存在于水相或沉积物中的ENPs,由于其较大的比表面积使得它们能够与其它污染物(如持久性有机污染物和重金属)发生相互作用(如吸附)[4-5],从而改变与ENPs共存的其它污染物的生物有效性、生物积累特征和生态毒性[6-7]。因此,在ENPs的水生态毒理学研究中,探讨ENPs与持久性有毒污染物的复合污染的生态毒理学效应对于正确理解ENPs的潜在生态风险具有十分重要的意义。目前,一些学者开始关注ENPs与持久性有毒污染物的复合污染的生态毒理学效应,但这些研究大多是基于水相的[8-9],而基于沉积物-底栖动物体系的研究相对较少[10]。沉积物不仅是底栖动物的食物来源,而且是各种污染物的最终沉积库,ENPs进入水环境中后会快速积聚在沉积物中,因此研究沉积物中ENPs和持久性有毒污染物复合污染对底栖动物的生态毒性显得尤为重要。很显然,沉积物栖居型底栖动物是研究ENPs生态毒性以及ENPs与其它污染物相互作用的重要测试生物[7-11]。铜锈环棱螺(Bellamya aeroginosa)是腹足纲田螺科的一种典型的沉积物栖居型底栖软体动物,广泛分布在我国淡水水体中,它对一些持久性有毒物质的胁迫表现出较高的敏感性,适于沉积物毒性测试[12-17]。
金属氧化物纳米颗粒是应用最广泛的一类ENPs,其潜在生态风险受到广泛关注[2]。迄今为止,已有一些有关纳米二氧化钛(TiO2-NPs)和重金属Cd复合污染对一些水生生物(如大型溞、四膜虫和鱼类等)的生态毒理学效应的研究报道,这些研究显示在无毒性浓度TiO2-NPs存在的条件,Cd的生物有效性、生物积累和毒性受到明显的影响[7, 18-21]。然而,在沉积物-底栖动物体系中,有关金属氧化纳米颗粒与重金属复合污染对沉积物栖居型底栖软体动物的生态毒理学研究还很少报道。不同的金属氧化物纳米颗粒往往具有不同理化性质,因此它们与其它污染物相互作用后可能表现出不同的生态毒理学效应。纳米氧化铝(Al2O3-NPs)在工业上应用较多,如在光学器件和珠宝抛光中用作涂层和磨料[21]以及用在微电子器件上和作为化学催化剂[23]。
本研究以Al2O3-NPs作为研究对象,用铜锈环棱螺作为实验动物,选择Cd作为模型污染物,采用沉积物慢性生物测试的方法,研究在无毒性浓度Al2O3-NPs存在时沉积物中Cd在铜锈环棱螺体内的生物积累规律和Cd对肝胰脏抗氧化防御系统关键成分超氧化物歧化酶(SOD)与脂质过氧化指标丙二醛(MDA)以及Ⅱ相反应的关键酶谷胱甘肽-S-转移酶(GST)的影响,以期为合理评价沉积物中Al2O3-NPs与Cd复合污染的生态风险提供科学依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
UV-757CRT紫外可见分光光度计(上海精科);TGL-16M台式高速冷冻离心机(长沙平凡);电感耦合等离子体发射光谱仪(ICP-OES,iCAP6300 Radial,Thermo Fisher Scientific,USA);玻璃匀浆器,小型搅拌机。纳米氧化铝(Al2O3-NPs,购自北京博宇高科新材料技术有限公司):粒径13 nm,纯度99.9%;醋酸镉(Cd(CH3COO)2·2H2O,分析纯)购自天津市科密欧化学试剂有限公司。
1.2 试验材料
本实验所用的实验动物为采自武汉植物园干净池塘内的铜锈环棱螺成螺。按Ma等的方法[14]在光温氧可控的循环水培养系统中驯化培养60 d后,挑选大小均匀的健康个体,壳长为(20.72 ± 1.77) mm,体重为(2.10 ± 0.33) g。实验所用沉积物为以采自湖南吉首市德夯自然保护区内的无污染土壤制作的人工沉积物,采集与处理方法见文献[14]。
1.3 沉积物生物测试
实验共设8个处理组,每个处理设3个重复,包括Cd单独处理组(5、25、100 μg·g-1,以沉积物干重计)、Al2O3-NPs(无毒性添加浓度0.05 g·kg-1)[22]单独处理组以及分别与3种Cd浓度的组合处理、以及1个空白对照组。
人工沉积物加标处理方法:对于每个处理,先将1 800 g干沉积物(过100目尼龙筛)和90 mg Al2O3-NPs粉末混合在一起,在搅拌机中连续搅拌1 h,然后转入带盖小塑料桶中。然后用Cd(CH3COO)2·2H2O配制2 mg·mL-1(以纯Cd计)的Cd储备液,按沉积物与Cd溶液1:1的体积比进行混合(Cd储备液的体积不足部分以去离子水补足),用干净的小木铲搅拌至少24 h。对照组沉积物除不加Cd及Al2O3-NPs外,按相同方式处理。加标完成后在室温下静置14 d。
将每组处理好的沉积物均分到3个重复测试缸(4 L)中,按沉积物与上覆水1: 4的体积比,沿缸壁小心加入去离子水,然后将所有测试缸置于1个水浴控温的有机玻璃容器中,静置3 d。暴露开始时,将所选实验螺随机分组,放入测试缸中,每个测试缸内放10只,以静水充氧的方式暴露21 d,光照周期为12 h(白昼)∶12 h(黑暗),水温为(24 ± 1)℃,对每个测试缸加盖尼龙网,中间留1个直径为5 cm的圆孔,方便喂食。每3天更新1次上覆水并投喂少许观赏鱼饵料(三元牌)。暴露结束后,取出实验螺,用钳子夹破螺壳,从内脏团中分离出肝胰脏,称重,一部分立即放入液氮中保存,用于生化测定,另一部分放入烘箱中80 ℃下烘干至恒重,用于Cd含量的测定。
1.4 测定
1.4.1 肝胰脏中Cd含量的测定
采用HNO3-HClO4消解法消解铜锈环棱螺的肝胰脏样品,然后采用ICP-OES测定Cd含量[12]。采用相同程序分析生物成分分析标准物质贻贝(GBW08571,北京世纪奥科生物技术有限公司)以进行分析方法的质量控制,结果表明该方法具有良好的准确度和精密度。
1.4.2 生化测定
取冷冻的、已知重量的肝胰脏样品,按1: 9(g: mL)的比例加入含0.0001 mol·L-1EDTA-2Na、0.01 mol·L-1蔗糖和0.8%(质量百分数)NaCl的Tris-HCl缓冲液(0.01 mol·L-1、pH=7.4),同时加入0.001 mol·L-1蛋白酶抑制剂PMSF溶液。用玻璃匀浆器在冰浴下制成匀浆,然后转入0.5 mL离心管,于4 ℃、2 500 r·min-1,离心10 min,先取上清液20 μL(即10%匀浆上清液),用匀浆介质稀释到1%,用于测SOD活性;再取上清液220 μL,用于测GST活性;剩余的匀浆液在10 000 r·min-1继续离心20 min,取上清液,稀释到1%,用于测定MDA含量。SOD活性采用氯化硝基四氮唑蓝(NBT)光化还原法测定,以活力单位表示SOD活性值,在550 nm下测吸光度,以50%抑制率的酶量为1个活力单位(U·mg-1蛋白);GST活性采用CDNB法测定,在340 nm下测吸光度,活力单位以U·mg-1蛋白表示;MDA含量采用硫代苯巴比妥酸(TBA)比色法测定,在532 nm下测定吸光值,活力单位以nmol·mg-1蛋白表示;采用考马斯亮蓝染色法在595 nm下测定蛋白含量[14]。
1.5 数据处理与统计分析
实验数据采用SPSS20.0进行统计分析。对实验数据先进行正态分布检验,然后利用单因素方差分析法(ANOVA)和多重比较检验法(LSD)进行组间差异显著性检验,差异显著性水平为0.05。
2 结果与分析(Results and analysis)
2.1 Al2O3-NPs对铜锈环棱螺肝胰脏中Cd生物积累的影响
Cd和Al2O3-NPs加标沉积物21 d暴露后铜锈环棱螺肝胰脏中Cd生物积累的变化如图1所示。无论是在无Al2O3-NPs的处理组还是在Al2O3-NPs的处理组,铜锈环棱螺肝胰脏中Cd的生物积累均显著高于对照组,而且随沉积物Cd浓度的增加而显著升高。在低Cd(5 μg·g-1)浓度下,Al2O3-NPs对Cd生物积累没有影响。在中、高Cd(25、100 μg·g-1)浓度下,Al2O3-NPs显著促进Cd的生物积累,Al2O3-NPs处理组的Cd生物积累分别比无Al2O3-NPs处理组提高了约35%和62%。
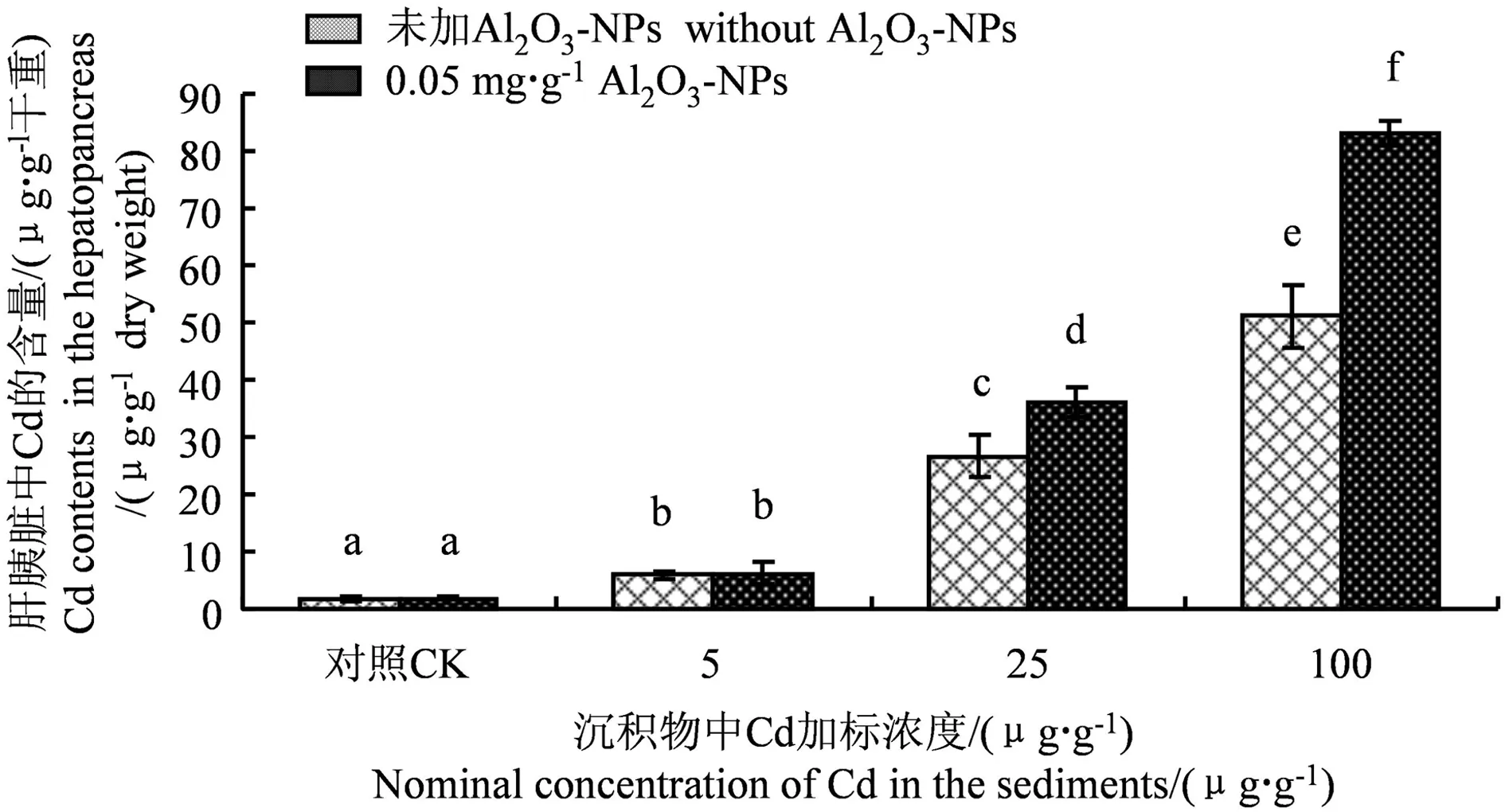
图1 Cd和Al2O3-NPs加标沉积物21 d暴露后 铜锈环棱螺肝胰脏中Cd的含量注:各处理间无相同字母表示差异显著,P<0.05,下同。Fig. 1 Hepatopancreatic Cd contents in Bellamya aeruginosa following 21-d exposure to Cd- and Al2O3-NPs-spiked sedimentsNote: Treatments labeled with different letters differed significantly, P<0.05. The same below.
2.2 Al2O3-NPs存在条件下Cd对铜锈环棱螺肝胰脏SOD活性的影响
Cd和Al2O3-NPs加标沉积物21 d暴露后铜锈环棱螺肝胰脏SOD活性的变化如图2所示。在无Al2O3-NPs处理组和Al2O3-NPs处理组,铜锈环棱螺肝胰脏SOD活性随沉积物Cd浓度的增加均表现为先升后降的变化趋势。在低Cd(5 μg·g-1)浓度下,无Al2O3-NPs处理组和Al2O3-NPs处理组的SOD活性与对照组相比均没有显著差异。在中Cd(25 μg·g-1)浓度下,无Al2O3-NPs处理组和Al2O3-NPs处理组的SOD活性均被显著诱导,与对照组相比,分别上升了约56%和41%,Al2O3-NPs处理组的SOD活性显著低于无Al2O3-NPs处理组。在高Cd(100 μg·g-1)浓度下,无Al2O3-NPs处理组和Al2O3-NPs处理组的SOD活性均被显著抑制,与对照组相比,分别下降了约32%和43%,Al2O3-NPs处理组的SOD活性同样显著低于无Al2O3-NPs处理组。
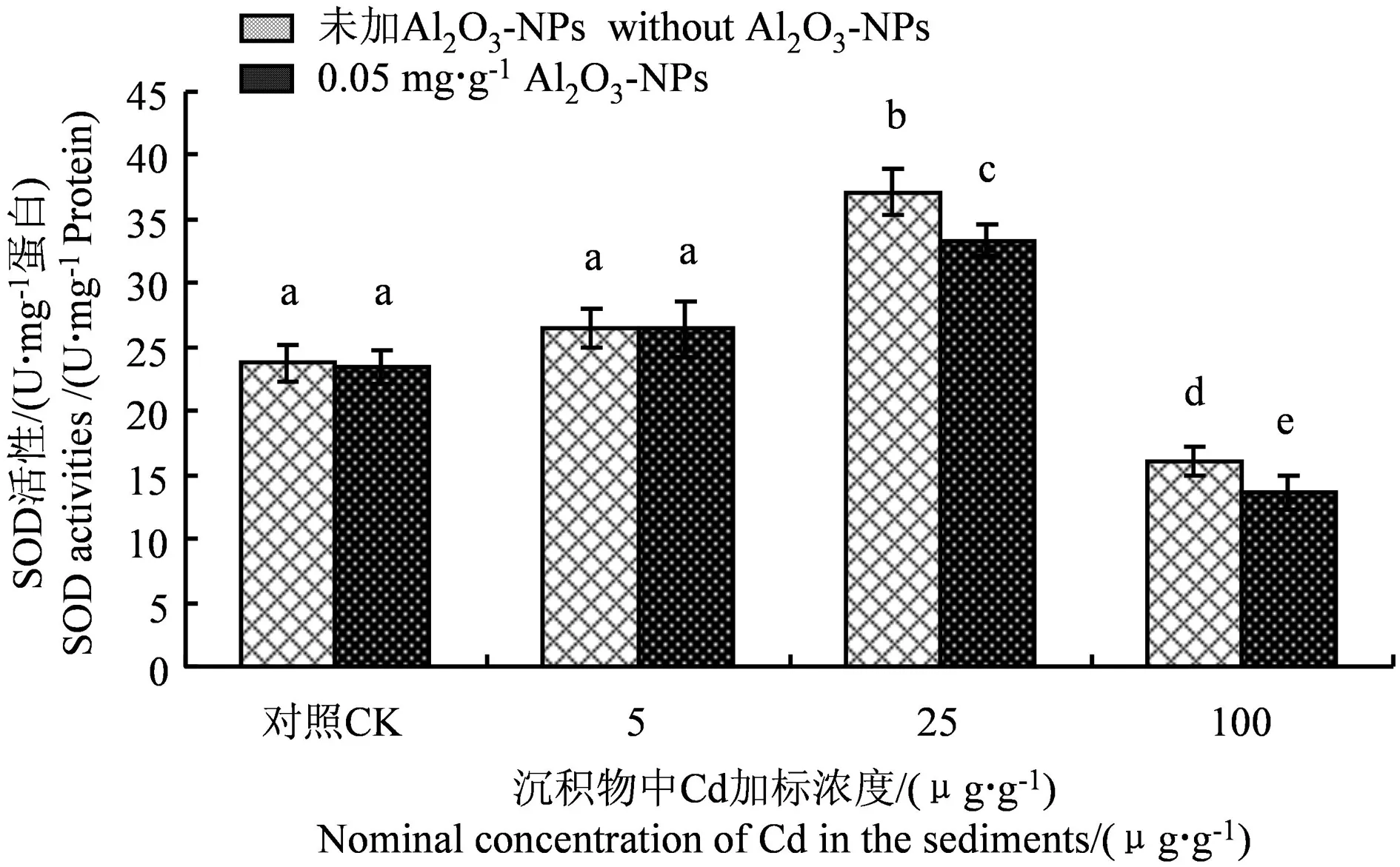
图2 Cd和Al2O3-NPs加标沉积物21 d暴露后 铜锈环棱螺肝胰脏SOD活性Fig. 2 Hepatopancreatic SOD activities in Bellamya aeruginosa following 21-d exposure to Cd- and Al2O3-NPs-spiked sediments
2.3 Al2O3-NPs存在条件下Cd对铜锈环棱螺肝胰脏MDA含量的影响
Cd和Al2O3-NPs加标沉积物21 d暴露后铜锈环棱螺肝胰脏MDA水平的变化如图3所示。由图可知,在低、中Cd(5、25 μg·g-1)浓度下,无Al2O3-NPs处理组和Al2O3-NPs处理组的MDA水平与对照组相比均没有显著差异。在高Cd(100 μg·g-1)浓度下,无Al2O3-NPs处理组和Al2O3-NPs处理组的MDA水平均显著升高,与对照组相比,分别上升了约283%和170%,Al2O3-NPs处理组的MDA水平显著低于无Al2O3-NPs处理组。
2.4 Al2O3-NPs存在条件下Cd对铜锈环棱螺肝胰脏GST活性的影响
Cd和Al2O3-NPs加标沉积物21 d暴露后铜锈环棱螺肝胰脏GST活性的变化如图4所示。可以看出,除低Cd浓度(5 μg·g-1)下,Al2O3-NPs处理组的GST活性与对照组相比显著升高外,其他处理组的GST活性随沉积物Cd浓度的增加均表现为显著下降的变化趋势。在中、高Cd(25、100 μg·g-1)浓度下,无Al2O3-NPs处理组的GST活性与对照组相比分别下降了约23%和35%;Al2O3-NPs处理组的GST活性与对照组相比分别下降了约30%和48%,Al2O3-NPs处理组的GST活性均显著低于无Al2O3-NPs处理组。
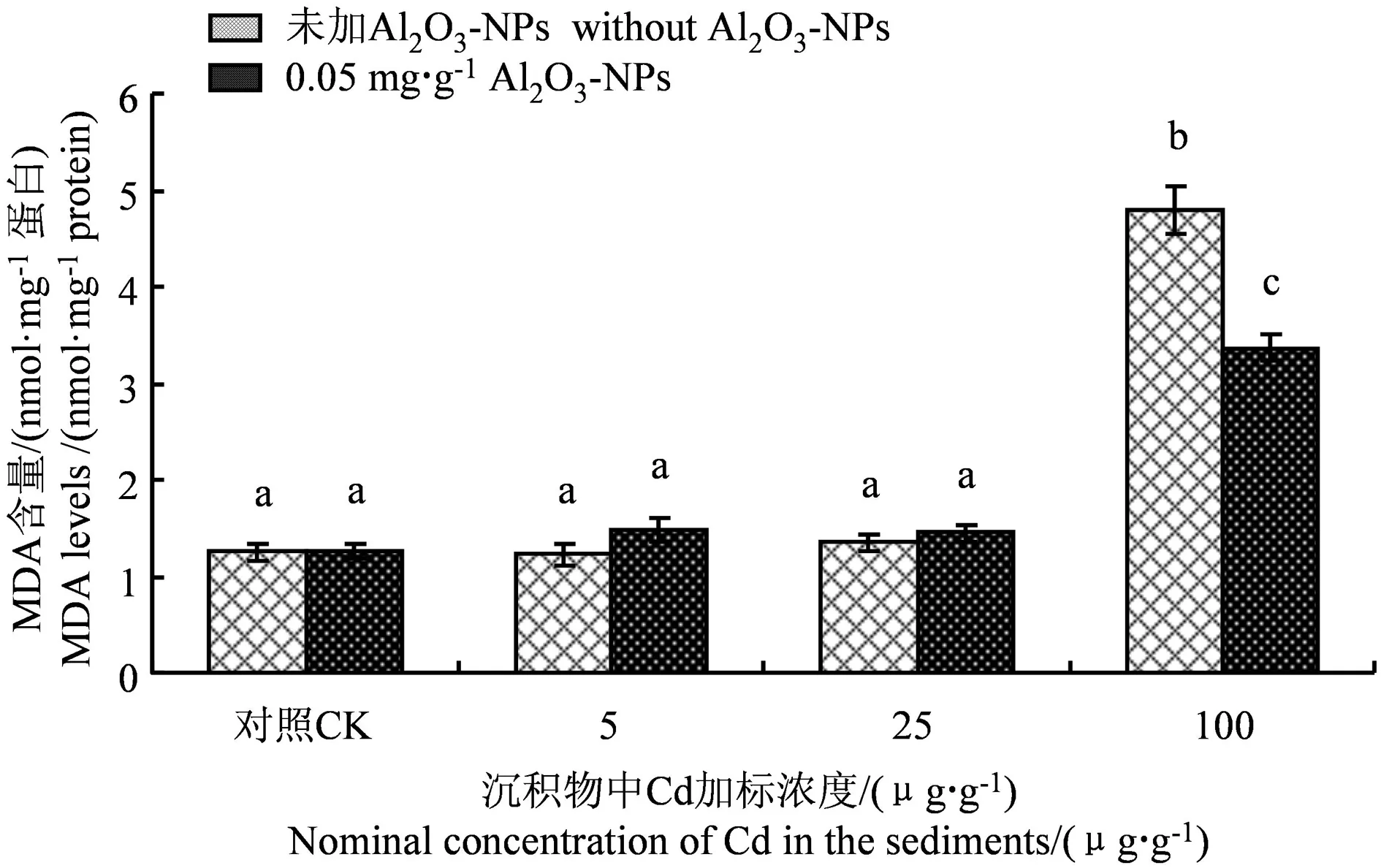
图3 Cd和Al2O3-NPs加标沉积物21 d 暴露后铜锈环棱螺肝胰脏MDA水平Fig. 3 Hepatopancreatic MDA levels in Bellamya aeruginosa following 21-d exposure to Cd- and Al2O3-NPs-spiked sediments
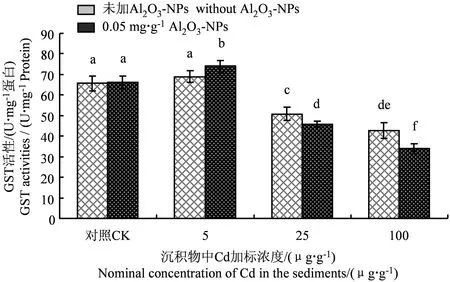
图4 Cd和Al2O3-NPs加标沉积物21 d 暴露后铜锈环棱螺肝胰脏GST活性Fig. 4 Hepatopancreatic GST activities in Bellamya aeruginosa following 21-d exposure to Cd- and Al2O3-NPs-spiked sediments
3 讨论(Discussion)
3.1 Al2O3-NPs对Cd生物积累的影响
ENPs与常规材料相比具有小尺寸、大表面积和高表面能等特点,导致它们对其他污染物具有强烈的吸附能力,随之可能改变其他污染的生物有效性和生态毒性[24]。目前对Al2O3-NPs潜在生态风险的研究主要关注Al2O3-NPs自身的毒性[25-26],而关于Al2O3-NPs对其他污染物的生物积累和生态毒性的影响则未见报道。
在本研究中,我们通过沉积物生物测试研究了Al2O3-NPs存在情况下Cd在底栖动物铜锈环棱螺肝胰脏中的生物积累和氧化胁迫的变化规律。结果发现,低Cd浓度(5 μg·g-1)时,Al2O3-NPs对Cd的生物积累没有影响,当沉积物中的Cd处于中、高水平(25、100 μg·g-1)时,Al2O3-NPs显著促进Cd的生物积累,Al2O3-NPs对Cd的生物转运具有明显的携带效应。本研究的结果与一些研究者针对TiO2-NPs基于水介质的生物测试结果是相似的,Zhang等[6]发现在水介质中由于TiO2-NPs对Cd具有较强的吸附作用,极大地增强了Cd在鲤鱼(Cyprinus carpio)体内的生物积累,积累的Cd包括游离的Cd和与TiO2-NPs结合的Cd,增加的Cd积累主要来自后者;Tan等[18]的研究表明当Cd和Zn被TiO2-NPs吸附后,大型溞(Daphnia magna)对Cd和Zn的吸收显著增加;Tan等[19]进一步指出,TiO2-NPs能够促使大型溞从溶解相中吸收的Cd显著增加,主要是由于进入大型溞肠道中的TiO2-NPs为Cd离子提供了大量的结合位点,即当大型溞从水中吸收溶解Cd时,肠道中的TiO2-NPs吸附这些Cd离子,导致更多的Cd离子积累在大型溞体内,因此认为TiO2-NPs不仅作为载体将Cd转运到体内,而且在肠道中TiO2-NPs还提供Cd吸附结合位点;同样,Yang等[20]的研究也表明,TiO2-NPs可以充当Cd在原生动物四膜虫(Tetrahymena thermophila)体内积累的载体,Cd可以以自由离子或Cd-TiO2-NPs复合物的形式被吸收,其中以复合体形式吸收的占46.3%。然而还有一些研究显示,TiO2-NPs对Cd的生物积累没有影响,例如,TiO2-NPs不影响Cd在海生紫贻贝(Mytilus galloprovincialis)组织中Cd的积累[27],这与淡水生物不同,可能与测试介质的理化性质有关,如由于ENPs的团聚和沉淀作用并不显著增加对Cd的吸附;此外,Vale等[28]指出TiO2-NPs对Cd在淡水双壳类河蚬(Corbicula fluminea)体内的生物积累没有影响,这可能与河蚬的取食方式(滤食)有关。因此,在水介质中,金属氧化物ENPs促进重金属生物积累的潜在机制至少体现在3个方面:一是,ENPs吸附重金属离子形成复合体物,这种吸附了大量ENPs的复合物更容易被水生生物摄取,因而引起重金属离子积累增加;二是,由于ENPs容易被生物吸收,进入肠道的ENPs可以吸附更多的重金属离子,增加其生物积累;三是,虽然ENPs可以吸附重金属离子,但由于ENPs在水环境中能够快速聚集并沉降(特别是受到离子强度的影响)[29],并不能有效地吸附重金属离子,抑或即使吸附了一些重金属离子,但测试生物并不能有效地摄取,当测试介质中重金属离子浓度较低时,ENP不会对重金属产生影响,而当重金属离子浓度相对较高时,ENPs的吸附作用降低测试介质中重金属离子浓度,反而会降低生物积累,如TiO2-NPs的存在使Cu在大型溞体内的积累量降低14倍[30]。铜锈环棱螺是1种沉积物栖居型、以鳃呼吸的底栖动物,主要从沉积物中取食[14],在本研究中采用的上覆水是去离子水,因而离子强度的影响可以忽略,因此在沉积物测试介质中,铜锈环棱螺可能同时从间隙水和包含有大量Al2O3-NPs与Cd的复合体中摄取Cd,而增加的Cd积累主要来自复合体。本研究提供了在沉积物-底栖动物体系中Al2O3-NPs促进重金属生物积累的重要证据,但Al2O3-NPs存在时重金属的生物转运机制还有待进一步考证。
3.2 Al2O3-NPs对Cd毒性的影响
当生物机体受到外源性化学物质胁迫时,作为机体抗氧化防御系统的重要组分的SOD可以通过将O2-·歧化为H2O2来降低或消除氧化胁迫以维持活性氧自由基的平衡,是机体对抗活性氧自由基的第一道防线,但过多的活性氧自由基则会激活或抑制SOD活性;MDA水平是衡量机体脂质过氧化程度和细胞氧化损伤的指示,因此,细胞SOD活性和MDA含量的改变体现了机体保护自身免受毒害的1种防护机制,因此它们常常被当作指示和评价污染物潜在生态毒性的良好生物标志物[31-32]。本研究表明,低Cd浓度(5 μg·g-1)时,无Al2O3-NPs处理组和Al2O3-NPs处理组的SOD活性与对照组相比均没有显著差异,说明没有造成活性氧自由基积累和氧化胁迫;中Cd浓度(25 μg·g-1)时,SOD活性显著升高,表明已经引起明显的氧化胁迫;高Cd浓度(100 μg·g-1)时,SOD活性显著下降,则表明已经引起严重的氧化损伤,而且,与无Al2O3-NPs处理组相比,Al2O3-NPs处理组的SOD活性显著下降,说明Al2O3-NPs加重了Cd对肝胰脏细胞的氧化胁迫或损伤,在高Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的MDA水平均显著升高,且Al2O3-NPs处理组的MDA水平显著低于无Al2O3-NPs处理组,进一步证明了Al2O3-NPs对Cd氧化损伤的增强效应。
GST是一种在机体Ⅱ代谢中参与亲电性化合物解毒的关键酶,它同时也参与细胞的抗氧化防御,污染胁迫时GST活性的改变体现了机体对污染物的生物转化和抗氧化功能,GST同样可以作为指示和评价污染物潜在生态毒性的敏感生物标志物[33]。本研究显示,中、高Cd(25、100 μg·g-1)浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的GST活性均显著下降,说明在较高浓度Cd长期胁迫下,细胞中GST活性直接被抑制或在对Cd的解毒过程中被大量消耗[34];而且Al2O3-NPs处理组的GST活性均显著低于无Al2O3-NPs处理组,也说明了Al2O3-NPs对Cd毒性的增强作用。其他一些有关金属氧化物ENPs对重金属毒性影响的研究也显示ENPs的确可以通过增加重金属的生物积累而显著增强生物毒性,例如,在浮游动物中,TiO2-NPs可以使Ag对大型溞幼体的毒性增加40%[30];TiO2-NPs同样可以显著增强Cu对大型溞的毒性[35];TiO2-NPs显著增强As对网纹溞(Ceriodaphnia dubia)的毒性[36]。然而在浮游植物中得到的结果却相反,TiO2-NPs降低Cd对淡水绿藻月牙藻(Pseudokirchneriella subcapitata)的毒性[7];TiO2-NPs可以降低Cd对莱茵衣藻(Chlamydomonas reinhardtii)的生物积累和毒性[37-38];TiO2-NPs同样降低Cd对铜绿微囊藻的毒性[39],这可能与不同类型生物吸收TiO2-NPs和Cd的方式不同有关,在浮游植物测试体系中,由于TiO2-NPs对Cd离子的吸附作用,水中游离态Cd离子浓度降低,而Cd与TiO2-NPs的复合物难以被浮游植物吸收,从而降低毒性对Cd离子对藻的毒性明显降低。
总的来看,在本研究中,沉积物中Al2O3-NPs存在的情况下,Cd对铜锈环棱螺肝胰脏SOD活性、MDA含量和GST活性的影响与肝胰脏中Cd的生物积累水平的变化是一致的,在中、高Cd浓度下,Al2O3-NPs显著促进了Cd的生物积累,因而增强了Cd的生态毒性。因此,在以后的研究中,不仅要关注Al2O3-NPs本身的环境转归和毒性,更要关注Al2O3-NPs与其他污染物共存时对其他污染物的协助转运和联合毒性效应,同时还要考虑环境因子的影响,这样才能全面了解Al2O3-NPs的潜在生态风险。
[1] Gondikas A P, von der Kammer F, Reed R B, et al. Release of TiO2nanoparticles from sunscreens into surface waters: A one-year survey at the old Danube Recreational Lake [J]. Environmental Science & Technology, 2014, 48(10): 5415-5422
[2] Kahru A, Dubourguier H C. From ecotoxicology to nanoecotoxicology [J]. Toxicology, 2010, 269(2-3): 105-119
[3] Xiong D, Fang T, Yu L, et al. Effects of nano-scale TiO2, ZnO and their bulk counterparts on zebrafish: Acute toxicity, oxidative stress and oxidative damage [J]. Science of the Total Environment, 2011, 409(8): 1444-1452
[4] Sun K, Zhang Z, Gao B, et al. Adsorption of diuron, fluridone and norflurazon on single-walled and multi-walled carbon nanotubes [J]. Science of the Total Environment, 2012, 439(22): 1-7
[5] Velzeboer I, Kwadijk C J, Koelmans A A. Strong sorption of PCBs to nanoplastics, microplastics, carbon nanotubes, and fullerenes [J]. Environmental Science & Technology, 2014, 48(9): 4869-4876
[6] Zhang X Z, Sun H W, Zhang Z Y, et al. Enhanced bioaccumulation of cadmium in carp in the presence of titanium dioxide nanoparticles [J]. Chemosphere, 2007, 67(1): 160-166
[7] Hartmann N B, Legros S, Von der Kammer F, et al. The potential of TiO2nanoparticles as carriers for cadmium uptake in Lumbriculus variegatus and Daphnia magna [J]. Aquatic Toxicology, 2012, 118-119: 1-8
[8] Kim K T, Klaine S J, Lin S, et al. Acute toxicity of a mixture of copper and single-walled carbon nanotubes to Daphnia magna [J]. Environmental Toxicology and Chemistry, 2010, 29(1): 122-126
[9] Su Y, Yan X, Pu Y, et al. Risks of single-walled carbon nanotubes acting as contaminants-carriers: Potential release of phenanthrene in Japanese medaka (Oryzias latipes) [J]. Environmental Science & Technology, 2013, 47(9): 4704-4710
[10] Xia X, Chen X, Zhao X, et al. Effects of carbon nanotubes, chars, and ash on bioaccumulation of perfluorochemicals by Chironomus plumosus larvae in sediment [J]. Environmental Science & Technology, 2012, 46(22): 12467-12475
[11] Baun A, Hartmann N B, Grieger K, et al. Ecotoxicity of engineered nanoparticles to aquatic invertebrates: A brief review and recommendations for future toxicity testing [J]. Ecotoxicology, 2008, 17(5): 387-395
[12] 马陶武, 周科, 朱程, 等. 铜锈环棱螺对镉污染沉积物慢性胁迫的生物标志物响应[J]. 环境科学学报, 2009, 29(8): 1750-1756
Ma T W, Zhou K, Zhu C, et al. Biomarker responses of Bellamya aeruginosa to the chronic stress of cadmium-contaminated sediment [J]. Acta Scientiae Circumstantiae, 2009, 29(8): 1750-1756 (in Chinese)
[13] 马陶武, 朱程, 周科, 等. 铜锈环棱螺对铅污染沉积物慢性胁迫的繁殖响应和氧化应激反应敏感性[J]. 生态学报, 2009, 29(10): 5350-5357
Ma T W, Zhu C, Zhou K, et al. The reproductive reaction and oxidative stress responses sensitivity of Bellamya aeruginosa to the chronic exposure of lead-contaminated sediments [J]. Acta Ecologica Sinica, 2009, 29(10): 5350-5357 (in Chinese)
[14] Ma T W, Gong S J, Zhou K, et al. Laboratory culture of the freshwater benthic gastropod Bellamya aeruginosa (Reeve) and its utility as a test species for sediment toxicity [J]. Journal of Environmental Sciences, 2010, 22(2): 304-313
[15] 马陶武, 朱程, 周科, 等. Cd、Pb单一及复合污染沉积物对铜锈环棱螺肝胰脏SOD和MT的影响[J]. 农业环境科学学报, 2010, 29(1): 30-37
MA T W, Zhu C, Zhou K, et al. Effects of Cd, Pb and combined contaminated sediments on hepatopancreatic SOD and MT in Bellamya aeruginosa [J]. Journal of Agro-Environment Science, 2010, 29(1): 30-37 (in Chinese)
[16] 周科, 马陶武, 朱程, 等. 2,2’,4,4’-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报, 2010, 30(8): 1666-1673
Zhou K, Ma T W, Zhu C, et al. Effects of 2,2’,4,4’-tetra-bromodiphenylether (BDE-7)-contaminated sediments on SOD, CAT, and EROD activities in the hepatopancreas of Bellamya aeruginosa [J]. Acta Scientiae Circumstantiae, 2010, 30(8): 1666-1673 (in Chinese)
[17] 彭巾英, 刘佳, 马陶武, 等. 沉积物中三丁基锡对铜锈环棱螺肝胰脏抗氧化防御系统的影响[J]. 上海环境科学, 2012, 31(3): 97-101
Peng J, Liu J, Ma T W, et al. Effects of sediment-associated tributyltin (TBT) on the hepatopancreatic antioxidant defense system of Bellamya aeruginosa [J]. Shanghai Environmental Sciences, 2012, 31(3): 97-101 (in Chinese)
[18] Tan C, Fan W H, Wang W X. Role of titanium dioxide nanoparticles in the elevated uptake and retention of cadmium and zinc in Daphnia magna [J]. Environmental Science & Technology, 2011, 46(1): 469-476
[19] Tan C, Wang W X. Modification of metal bioaccumulation and toxicity in Daphnia magna by titanium dioxide nanoparticles [J]. Environmental Pollution, 2014, 186: 36-42
[20] Yang W W, Wang Y, Huang B, et al. TiO2nanoparticles act as a carrier of Cd bioaccumulation in the ciliate Tetrahymena thermophila [J]. Environmental Science & Technology, 2014, 48(13): 7568-7575
[21] Hu X, Chen Q, Jiang L, et al. Combined effects of titanium dioxide and humic acid on the bioaccumulation of cadmium in zebrafish [J]. Environmental Pollution, 2011, 159(5): 1151-1158
[22] Stanley J K, Coleman J G, Weiss C A W Jr, et al. Sediment toxicity and bioaccumulation of nano and micron-sized aluminum oxide [J]. Environmental Toxicology and Chemistry, 2010, 29(2): 422-429
[23] U.S. Environmental Protection Agency. Final nanotechnology white paper. EPA100/B-07/001. [R]. Washington D C: US EPA, 2007
[24] Baun A, Hartmann N, Grieger K, et al. Ecotoxicity of engineered nanoparticles to aquatic invertebrates: A brief review and recommendations for future toxicity testing [J]. Ecotoxicology, 2008, 17(5): 387-395
[25] Strigul N, Vaccari L, Galdun C, et al. Acute toxicity of boron, titanium dioxide, and aluminum nanoparticles [J]. Desalination, 2009, 248(1-3): 771-782
[26] Coleman J G, Johnson D R, Stanley J K, et al. Assessing the fate and effects of nano aluminum oxide in the terrestrial earthworm, Eisenia fetida [J]. Environmental Toxicology and Chemistry, 2010, 29(7): 1575-1580
[27] Balbi T, Smerilli A, Fabbri R, et al. Co-exposure to n-TiO2and Cd2+results in interactive effects on biomarker responses but not in increased toxicity in the marine bivalve Mytilus galloprovincialis [J]. Science of the Total Environment, 2014, 493: 355-364
[28] Vale G, Franco C, Diniz M S, et al. Bioavailability of cadmium and biochemical responses on the freshwater bivalve Corbicula fluminea-the role of TiO2nanoparticles [J]. Ecotoxicology and Environmental Safety, 2014, 109: 161-168
[29] Van Hoecke K, De Schamphelaere K A C, Van der Meeren P, et al. Aggregation and ecotoxicity of CeO2nanoparticles in synthetic and natural waters with variable pH, organic matter concentration and ionic strength [J]. Environmental Pollution, 2011, 159(4): 970-976
[30] Rosenfeldt R R, Seitz F, Schulz R, et al. Heavy metal uptake and toxicity in the presence of titanium dioxide nanoparticles: A factorial approach using Daphnia magna [J]. Environmental Science & Technology, 2014, 48(12): 6965-6972
[31] McCord J M, Fridovich I. Superoxide dismutase: An enzymatic function for erythrocuprein (hemocuprein) [J]. Journal of Biological Chemistry, 1969, 244(22): 6049-6055
[32] Almeida J A, Diniz Y S, Marques S F G. The use of the oxidative stress responses as biomarkers in Nile tilapia (Oreochromis niloticus) exposed to in vivo cadmium contamination [J]. Environment International, 2002, 27(8): 673-679
[33] Espin S, Martinez-Lopez E, Jimenez P, et al. Effects of heavy metals on biomarkers for oxidative stress in Griffon vulture (Gyps fulvus) [J]. Environmental Research, 2014, 129(2): 59-68
[34] 王重刚, 陈奕欣, 郑微云, 等. 苯并(a)芘、芘及其混合物暴露对梭鱼肝脏谷胱甘肽硫转移酶活性的影响[J]. 海洋环境科学, 2004, 28(3): 40-43
Wang C G, Chen Y X, Zhen W Y, et al. The effect of exposure of benzo(a)pyrene, pyrene and their mixture on hepatic glutathione-S-transferases activity in Mugil soiuy [J]. Marine Sciences, 2004, 28(3): 40-43 (in Chinese)
[35] Fan W, Cui M, Liu H, et al. Nano-TiO2enhances the toxicity of copper in natural water to Daphnia magna [J]. Environmental Pollution, 2011, 159(3): 729-734
[36] Wang D, Hu J, Irons D R, et al. Synergistic toxic effect of nano-TiO2and As(V) on Ceriodaphnia dubia [J]. The Science of the Total Environment, 2011, 409(7): 1351-1356
[37] Yang W W, Li Y, Miao A J, et al. Cd2+toxicity as affected by bare TiO2nanoparticles and their bulk counterpart [J]. Ecotoxicology and Environmental Safety, 2012, 85(3): 44-51
[38] Yang W W, Miao A J, Yang L Y. Cd2+Toxicity to a green alga Chlamydomonas reinhardtii as influenced by its adsorption on TiO2engineered nanoparticles [J]. PloS one, 2012, 7(3): e32300
[39] 辛元元, 陈金媛, 程艳红, 等. 纳米TiO2与重金属Cd对铜绿微囊藻生物效应的影响[J]. 生态毒理学报, 2013, 8(1): 23-28
Xin Y Y, Chen J Y, Cheng Y H, et al. Ecological effects of nano-TiO2and heavy metal Cd on M. aeruginosa [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 23-28 (in Chinese)
◆
Effects of Cd and Al2O3-NPs Co-exposure on Bioaccumulation of Cd and Antioxidase Enzyme Activities inBellamyaaeroginosa
Long Yi, Liu Shanshan,Wang Meng, Ma Taowu*
College of Biology and Environmental Science, Jishou University, Jishou 416000, China
16 October 2014 accepted 21 November 2014
The widespread applications of metal oxide nanoparticles lead to unintentional release of these materials into aquatic environments, the unique physico-chemical properties may potentially alter the ecotoxicity of co-existing contaminants, such as heavy metals. In this work, the dynamics of Cd accumulation and the effects of Cd on two key components of antioxidant defense system, superoxide dismutase (SOD) and lipid peroxidation index malondialdehyde (MDA), and phase Ⅱ biotransformation enzyme glutathione-S-tansferase (GST) in the hepatopancreas of Bellamya aeroginosa, a benthic macroinvertebrate, were investigated in the presence of aluminum oxide nanoparticles (Al2O3-NPs) by applying chronic exposure to assess the impacts of Al2O3-NPs on ecotoxicity of Cd. The results showed that Al2O3-NPs had no significant effect on Cd bioaccumulation at low Cd concentration (5 μg·g-1). By contrast, Cd bioaccumulation was significantly enhanced by Al2O3-NPs at medium and high Cd concentration (25 and 100 μg·g-1), indicating obvious carrier effect of Al2O3-NPs on Cd biotransport. At low Cd concentration, SOD activities in treatments with or without Al2O3-NPs, had no significant difference compared to the controls; at medium Cd concentration, SOD activities in all treatments significantly increased. But at high Cd concentration SOD activities significantly decreased, and moreover SOD activities in treatments with Al2O3-NPs were statistically lower than those in treatments without Al2O3-NPs, indicating the presence of Al2O3-NPs aggravated oxidative stress or damage caused by Cd. For MDA, at high Cd concentration, MDA levels in treatments with or without Al2O3-NPs significantly increased, but MDA levels in treatments with Al2O3-NPs were lower than those in treatments without Al2O3-NPs, which further testified the enhancement of Al2O3-NPs on oxidative damage by Cd. As for GST, at medium and high Cd concentration, GST activities in treatments with or without Al2O3-NPs significantly decreased, but GST activities in treatments with Al2O3-NPs were significantly lower than those in treatments without Al2O3-NPs, which also confirmed above enhancement effects. Overall, our study provided the evidence that Al2O3-NPs enhanced Cd bioaccumulation in the sediment-zoobenthos system, and the change of Cd toxicity coincided with the body burden of Cd, at medium and high Cd concentration, high levels of Cd bioaccumulation enhanced ecotoxicity of Cd on B. aeroginosa.
Cd; Al2O3-NPs; Bellamya aeruginosa; zoobenthos; sediment; SOD; MDA; GST
国家自然科学基金项目(41171383)
龙奕(1989-),女,硕士,研究方向为生态毒理学,E-mail: long12202008@163.com;
*通讯作者(Corresponding author), E-mail: mtw922@163.com
10.7524/AJE.1673-5897.20141016001
2014-10-16 录用日期:2014-11-21
1673-5897(2015)2-216-08
X171.5
A
马陶武(1968-),男,博士,教授,主要研究方向为水生态毒理学,发表论文40余篇。
龙奕, 刘珊珊, 王萌, 等. 纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响[J]. 生态毒理学报, 2015, 10(2):216-223
Long Y, Liu S S, Wang M, et al. Effects of Cd and Al2O3-NPs co-exposure on bioaccumulation of Cd and antioxidase enzyme activities in Bellamya aeroginosa [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 216-223 (in Chinese)

