敌百虫致小鼠外周血淋巴细胞DNA-蛋白质交联作用研究
张勇,何琦,卢黎,杨红
1. 贵州大学 动物科学学院 高原山地动物遗传育种与繁殖省部共建教育部重点实验室,贵阳550025 2. 贵阳市花溪区农业局,贵阳 550025
敌百虫致小鼠外周血淋巴细胞DNA-蛋白质交联作用研究
张勇1,*,何琦2,卢黎1,杨红1
1. 贵州大学 动物科学学院 高原山地动物遗传育种与繁殖省部共建教育部重点实验室,贵阳550025 2. 贵阳市花溪区农业局,贵阳 550025
为探讨敌百虫致DNA-蛋白质交联作用,以昆明小鼠为受试动物,敌百虫按0、20、40、60 mg·kg-14个剂量水平,灌胃染毒小鼠2周。第5组以提取的正常小鼠外周血淋巴细胞经50 μmol·L-1的H2O2处理为阳性对照组。采用经改进的彗星试验方法来检测染毒后外周血淋巴细胞DNA-蛋白质交联效应。结果表明,与空白组相比,各敌百虫染毒组都能引起DNA损伤作用(P<0.01)并引起一定程度的DNA-蛋白质交联效应,在较高浓度(40、60 mg·kg-1)时DNA-蛋白质交联尤为明显,存在一定的潜在突变风险。
敌百虫;小鼠;遗传毒性;DNA-蛋白质交联;DNA断裂;彗星试验
敌百虫作为一种毒性低、杀虫谱广的有机磷农药和兽药,被广泛应用于家畜寄生虫、卫生害虫防治,但其具有强烈的胃毒作用和一定的触杀作用,使用不当,也会造成畜禽急慢性中毒,威胁畜禽以至人类健康[1-2],已有资料报道了敌百虫的毒性效应[3-4]。DNA-蛋白质交联(DNA-protein crosslinks, DPC)是DNA与蛋白质形成的稳定的共价化合物,正常细胞中存在一定量的DPC,这是DNA与核蛋白的正常联系或代谢结果,对维持细胞的正常生理活动具有重要作用。当有外来物理、化学因素作用时,会诱导产生过量的DPC,破坏染色体结构,影响基因表达[5]。与其他类型DNA损伤相比,DPC较难修复或易于发生易错修复,在细胞周期中维持时间较长[6]。因此,WHO(世界卫生组织)指出,DPC可作为机体潜在突变的分子标记物[7]。有研究表明,彗星试验可用于检测DNA交联[8]。本试验以小鼠外周血淋巴细胞为研究对象,用不同剂量敌百虫进行体内染毒处理,通过改良单细胞凝胶电泳试验检测细胞DNA损伤和DPC情况,揭示敌百虫对小鼠外周血淋巴细胞的毒性效应,评价敌百虫对生态环境和人体健康可能存在的危害和影响。
1 材料与方法(Materials and methods)
1.1 试验动物
4周龄普通级昆明系小白鼠,由贵阳医学院实验动物中心提供(合格证SCXK2013-0001)常规饲养,观察1周后,健康者供试验用。
1.2 试验仪器与试验试剂
高速冷冻离心机(Centrifage 5415R),德国Eppendorf公司;恒温水浴锅,天津市泰斯特仪器有限公司;纯水仪(Molatom 1810c),上海摩勒科学仪器有限公司;倒置荧光显微操作系统(C-SHG1),日本Nikon公司;电子分析天平(FC204),上海天平仪器厂;水平板电泳槽及电泳仪(DYY-2C),北京六一仪器厂。
质量百分数为90%敌百虫原药购自山东大成农药股份有限公司;低熔点琼脂糖、Tris-base、Na2EDTA、D-Hanks溶液、二甲基亚砜(DMSO)、20 mg·mL-1蛋白酶K溶液购自上海生工生物工程有限公司,分析纯;TritonX-100、Goldview染色剂、Tris-HCL、噻唑蓝购自北京鼎国生物技术有限责任公司,分析纯;正常熔点琼脂糖,购自BIOWEST公司;小鼠淋巴细胞分离液,购自天津灏洋生物制品科技有限责任公司;硼酸,购自北京化工厂,分析纯;裂解液(2.5 mol·L-1NaCl、100 mmol·L-1Na2EDTA、10 mmol·L-1Tris,pH=10),用前按体积百分比加入1% TritonX-100和10% DMSO;碱性电泳液(1 mmol·L-1Na2EDTA、300 mmol·L-1NaOH,pH=13);中和液(0.4 mol·L-1Tris-HCL,pH=7.5);TE缓冲液(10 mmol·L-1Tris,1 mmol·L-1EDTA,pH=10);5×TBE溶液(445 mmol·L-1Tris Base,10 mmol·L-1EDTA,445 mmol·L-1硼酸,加水至1 L)。
1.3 动物分组与处理
4周龄昆明系小白鼠50只随机分成5组,每组10只,雌雄各半。用新鲜且pH≤5.5双蒸水溶解敌百虫,涡旋混匀,以灌胃方式对小鼠连续染毒2周。①空白组:A组和A1组小鼠常规饲养,不用敌百虫染毒。②低剂量染毒组:B组和B1组小鼠染毒剂量为每天20 mg·kg-1。③中等剂量染毒组:C组和C1组小鼠染毒剂量为每天40 mg·kg-1。④高剂量染毒组:D组和D1组小鼠染毒剂量为每天60 mg·kg-1。⑤H2O2处理组:E组和E1组提取常规饲养小鼠外周血淋巴细胞经50 μmol·L-1的H2O2于37 ℃处理15 min。A组、B组、C组、D组和E组为对照组;A1组、B1组、C1组、D1组和E1组为试验组。
1.4 检测原理
化合物通过作用于细胞DNA造成链断裂,形成带负电荷的DNA碎片,在电场作用下形成彗星图像,碎片越小迁移越远;若发生交联效应,可使某些蛋白质与DNA碎片附着在一起,使DNA分子量增加,在电场中泳动的距离相应缩短。通过加入蛋白酶K以去除与DNA交联的蛋白质,使DNA迁移率上升。通过对比未添加蛋白酶K组与添加蛋白酶K组的彗星试验结果,即可判断该药物是否具有交联作用。
1.5 外周血淋巴细胞悬液制备
用眼眶静脉采血法采集0.5 mL小鼠血液于肝素钠抗凝管中,按照Ficoll密度梯度法,取0.5 mL全血加于0.5 mL淋巴细胞分离液上,待其形成明显界面,380 g离心20 min,吸出中间白色淋巴细胞层于1.5 mL离心管,并加D-Hanks至1.5 mL,500 g离心20 min,重复洗涤细胞2次。用D-Hanks重悬细胞,再将细胞浓度调至2×106个·mL-1左右后置于4 ℃冰箱待用,用苔盼蓝染色,各组细胞存活率接近90%。每一染毒浓度制备2组细胞,其中对照组用于分析敌百虫引起的细胞DNA断裂损伤,试验组分析敌百虫引起DNA-蛋白质交联。
1.6 彗星试验
将100 μL正常熔点琼脂糖(0.75 g/100 mL 1×TBE)均匀铺在载玻片上,盖上盖玻片,4 ℃凝固10 min后轻轻移去盖玻片,此为第一层胶。然后将20 μL分离所得淋巴细胞悬液与100 μL低熔点琼脂糖(1 g/100 mL 1×TBE)充分混合,铺于第一层胶上,4 ℃凝固10 min。置入预冷1 h的裂解液中4 ℃下避光裂解1.5 h。电泳前将裂解好的玻片放入新配制的碱性电泳液中4 ℃下避光解旋20 min,然后将玻片放于水平电泳槽中,20 V、200 mA、4 ℃电泳20 min。电泳结束后,将玻片置于4 ℃预冷的中和液中和15 min,最后用Goldview (按体积比1∶1000 与1×TBE稀释液混合)染色,上述过程均在暗处黄色灯光下操作,以避免引起额外的DNA损伤。
1.7 DNA-蛋白质交联检测
裂解后,试验组用冰冷的TE缓冲液冲洗载玻片5 min,在0.5 mg·mL-1的蛋白酶K溶液中,37 ℃恒温过夜,其余步骤同彗星试验。将试验组所得彗星图像与未添加蛋白酶K的对照组彗星图像进行比较。
1.8 彗星试验图像采集和数据分析
用日本Nikon C-SHG1倒置荧光显微镜观察Goldview染色凝胶,放大倍数为10×20倍,拍摄细胞图像,用CASP软件对所得各组彗星图像进行分析,每个处理组随机分析30个细胞的彗尾长度、彗尾DNA含量和Olive尾距数据。最后,用SPSS 13.0对所得数据进行方差分析。
2 结果与分析(Results and analysis)
由图1可见,A组及A1组细胞DNA致密,边缘光滑,无明显拖尾,表明DNA无明显损伤。敌百虫对照组(B组、C组和D组)和试验组(B1组、C1组和D1组)经单细胞凝胶电泳后形成彗星图形,头部DNA集中,亮度较强,尾部由DNA碎片组成,表明细胞DNA受损。
由表1可见,对照组彗星试验结果表明,与A组相比,敌百虫染毒组可引起小鼠外周血淋巴细胞DNA损伤(P<0.01)。敌百虫染毒组中彗尾DNA含量、彗尾长度和Olive尾距随着染毒剂量增加而变大。但在C组和D组中,彗尾DNA含量、彗尾长度和Olive尾距增加趋势减缓,DNA碎片迁移率和产生DNA碎片数量增加不明显,可能产生了可将DNA碎片附着在一起的化合物,影响了DNA迁移率。
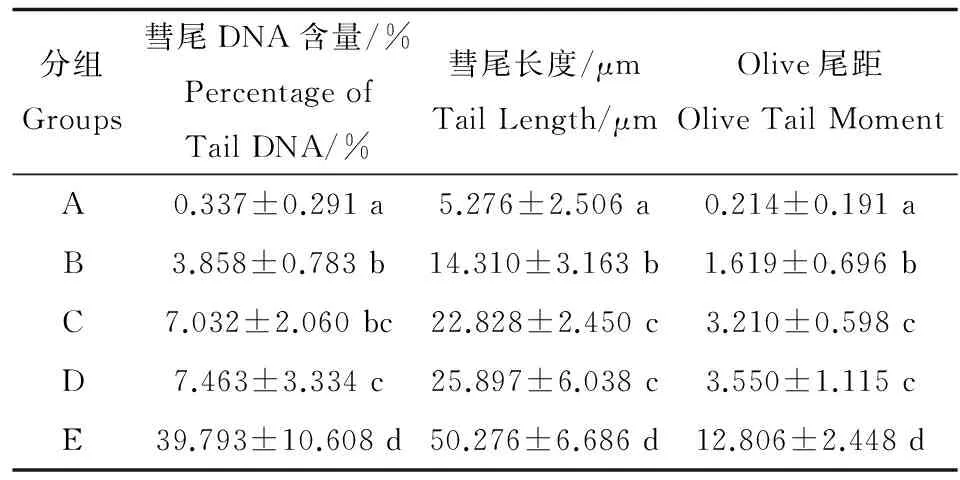
表1 敌百虫对照组小鼠外周血淋巴细胞DNA损伤Table 1 DNA damage of mice peripheral blood lymphocytes in the control groups induced by trichlorfon
注:A,0 mg·kg-1敌百虫组;B,20 mg·kg-1敌百虫组;C,40 mg·kg-1敌百虫组;D,60 mg·kg-1敌百虫组;E,H2O2组; a,b,c,d,e表示同列中不同字母组间数据差异显著(P<0.01)。
Note: A, 0 mg·kg-1trichlorfon group; B, 20 mg·kg-1trichlorfon group; C, 40 mg·kg-1trichlorfon group; D, 60 mg·kg-1trichlorfon group; E, 50 μmol·L-1H2O2group; a,b,c,d,e means with different letters across in the same column are significantly different (P<0.01).

图1 不同浓度敌百虫对小鼠外周血淋巴细胞DNA-蛋白质交联(DPC)作用彗星图像(10x20倍)注:A,0 mg·kg-1敌百虫组;B,20 mg·kg-1敌百虫组;C,40 mg·kg-1敌百虫组;D,60 mg·kg-1敌百虫组;E,H2O2组; A1,B1,C1,D1,E1(A、B、C、D、E分别用0.5 mg·mL-1的蛋白酶K溶液浸泡处理)。Fig. 1 Images of DNA-protein crosslinks (DPC) examined by comet assay in mice peripheral blood lymphocytes treated by different doses of trichlorfon (10x20 times)Note: A, 0 mg·kg-1 trichlorfon group; B, 20 mg·kg-1 trichlorfon group; C, 40 mg·kg-1 trichlorfon group; D, 60 mg·kg-1 trichlorfon group; E, 50 μmol·L-1 H2O2 group. A1, B1, C1, D1, E1 (A, B, C, D, E were treated respectively with 0.5 mg·mL-1 protease K).
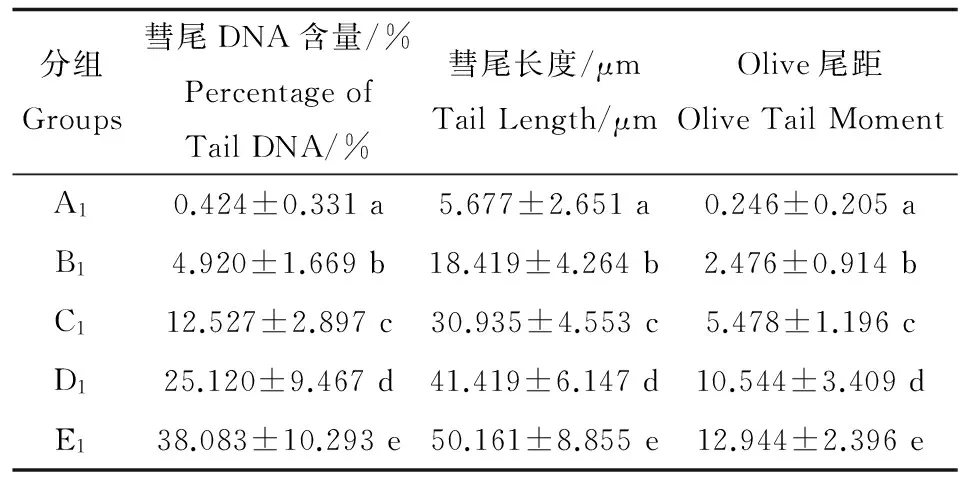
表2 敌百虫试验组小鼠外周血淋巴细胞DNA损伤Table 2 DNA damage of mice peripheral blood lymphocytes in the experimental groups induced by trichlorfon
注:A,0 mg·kg-1敌百虫组;B,20 mg·kg-1敌百虫组;C,40 mg·kg-1敌百虫组;D,60 mg·kg-1敌百虫组;E,H2O2组; a,b,c,d,e表示同列中不同字母组间数据差异显著(P<0.01)。
Note: A, 0 mg·kg-1trichlorfon group; B, 20 mg·kg-1trichlorfon group; C, 40 mg·kg-1trichlorfon group; D, 60 mg·kg-1trichlorfon group; E, 50 μmol·L-1H2O2group; a,b,c,d,e means with different letters across in the same column are significantly different (P<0.01).
由表2可见,经蛋白酶K处理后的试验组中彗尾DNA含量、彗尾长度和Olive尾距均随着浓度增加而显著性增加(P<0.01),表明经蛋白酶K处理后,由于与淋巴细胞DNA交联的蛋白质被蛋白酶K所消化,分子量变小,迁移率增加。
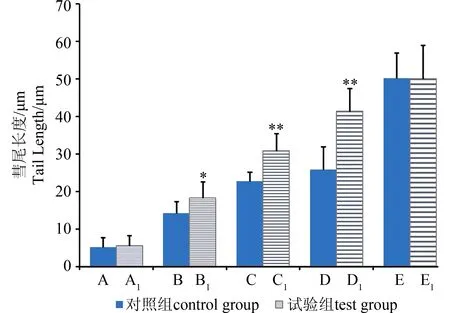
图2 通过彗尾长度观察敌百虫致小鼠外周血淋巴 细胞DNA-蛋白质交联效应注:与对照组比较,**P<0.01,*P<0.05。Fig. 2 DPC of mice peripheral blood lymphocytes in tail length induced by trichlorfonNote:**P<0.01, *P<0.05, compared to the control group.
由图2可见,经过蛋白酶K处理后,空白组和H2O2处理组DNA彗尾长度与对照组相比无明显变化;而各敌百虫试验组与对照组相比,细胞的DNA彗尾长度都有一定程度增加,尤其是在较高浓度水平时(40、60 mg·kg-1),彗尾长度明显增加。如图3和图4所示,彗尾DNA含量和Olive尾距2项数据也得出一致结果,提示在高浓度敌百虫染毒情况下发生DNA-蛋白质交联从而抑制了DNA迁移率。
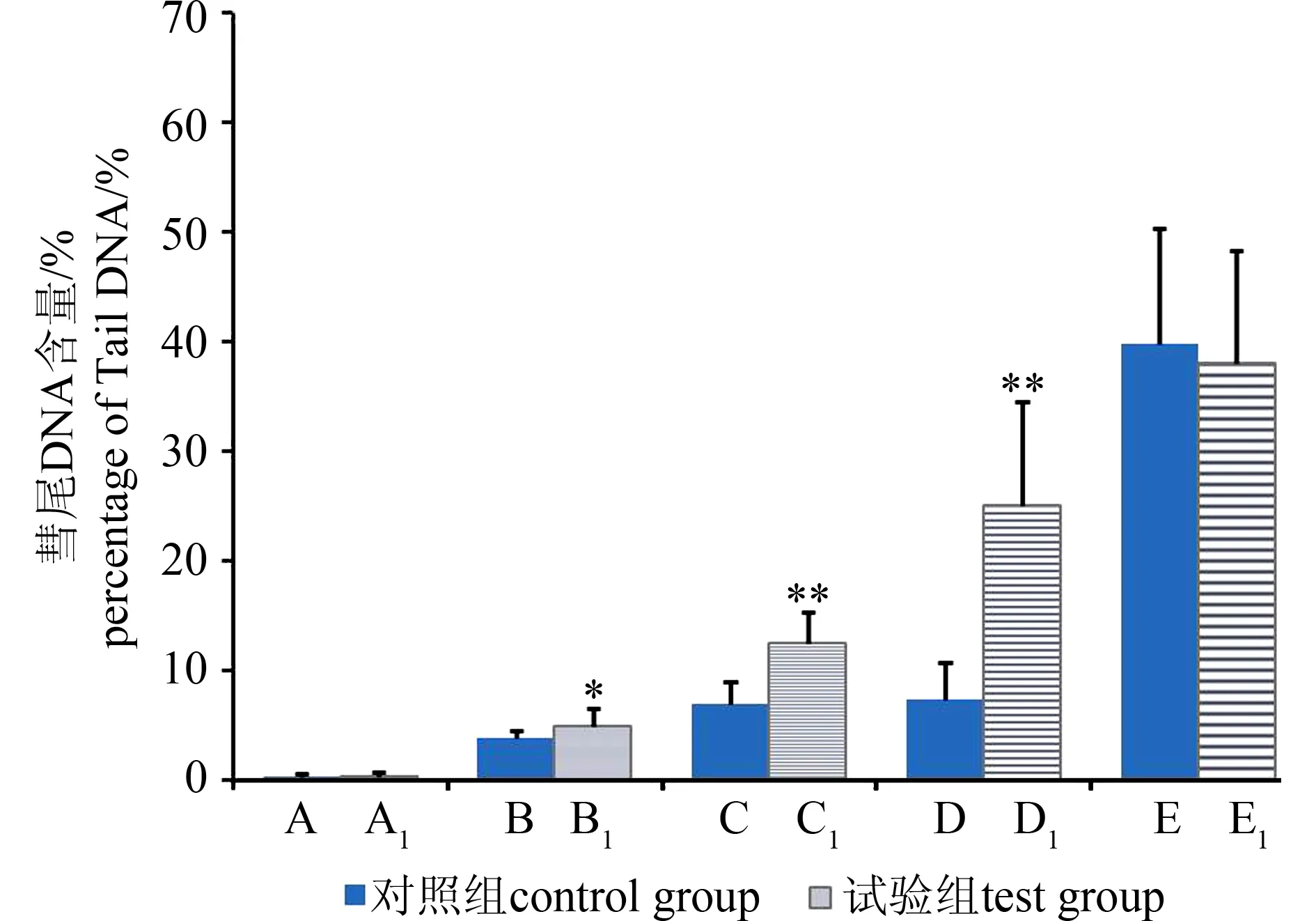
图3 通过彗尾DNA百分含量观察敌百虫致小鼠外周 血淋巴细胞DNA-蛋白质交联效应注:与对照组比较,**P<0.01,*P<0.05。Fig. 3 DPC of mice peripheral blood lymphocytes in percentage of tail DNA induced by trichlorfon Note: **P<0.01, *P<0.05, compared to the control group.
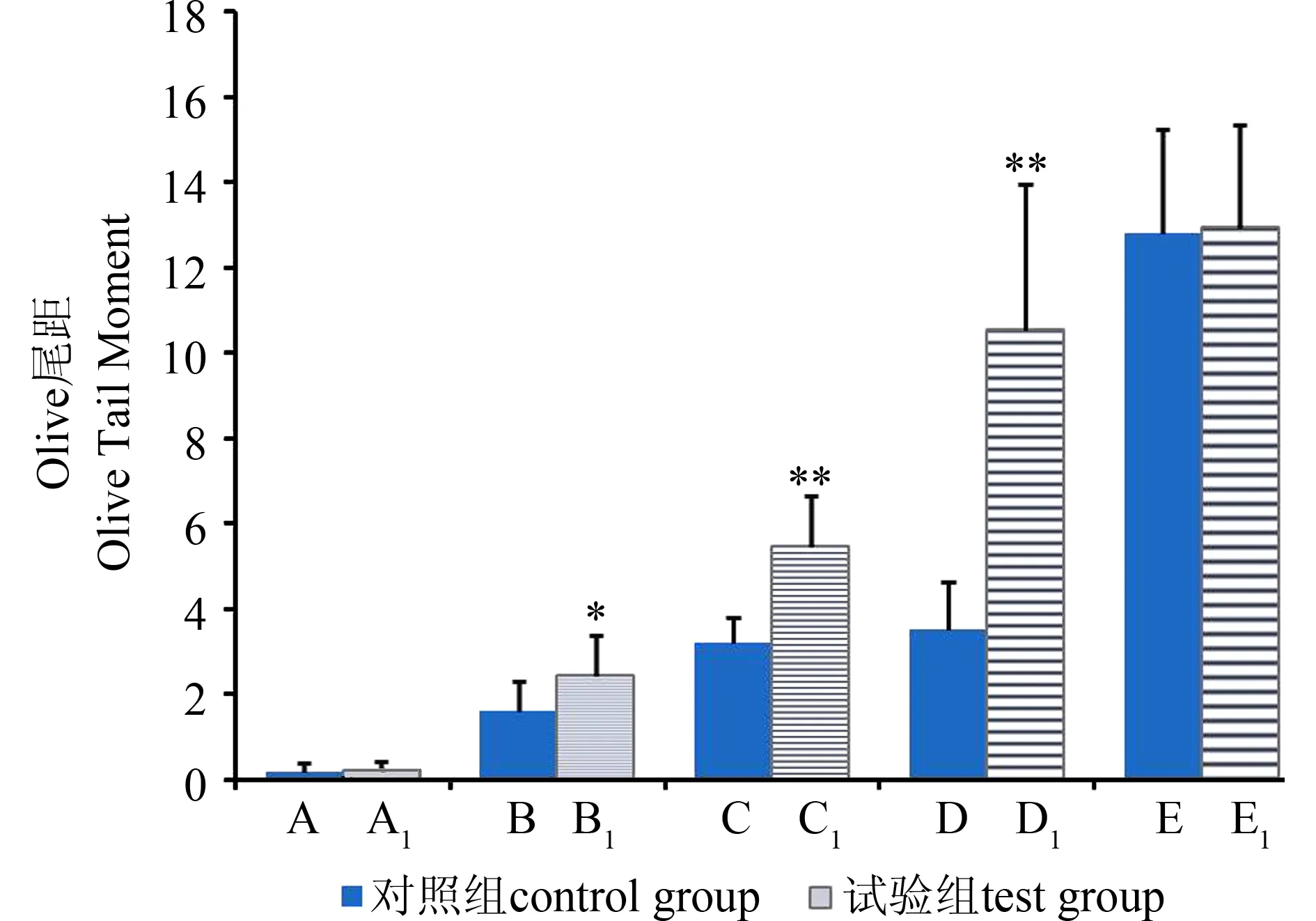
图4 通过Olive尾距观察敌百虫致小鼠外周血淋巴 细胞DNA-蛋白质交联效应注:与对照组比较,** P<0.01,*P<0.05。Fig. 4 DPC of mice peripheral blood lymphocytes in tail Olive moment induced by trichlorfonNote: **P<0.01, *P<0.05, compared to the control group.
3 讨论(Discussion)
DPC是DNA与核蛋白的正常联系或其代谢的结果[9],生物体内会存在一定量的DPC,这对于维持细胞的正常活动具有重要作用。当有外来因素作用时,会诱导出现过量的DNA-蛋白质交联,由于DPC的形成会对DNA构象和功能产生严重影响,因此,与其他DNA损伤类型相比,DPC较难修复,易导致某些疾病的发生。大量研究表明敌百虫具有潜在的遗传毒性[10-13]。在体内和体外研究中发现,敌百虫可引起机体谷氨酸甘肽(GSH)含量下降[14],抑制谷氨酸甘肽过氧化物酶和超氧化物歧化酶活性[15]。敌百虫可能通过释放大量自由基损害生物体抗氧化系统或作为抗氧化酶的抑制剂,使羟自由基和氧自由基清除能力下降,间接导致DNA-蛋白质交联产物的增加[16]。
目前,进行DPC测定时,多数使用氯化钾-十二烷基硫酸钠(KCL-SDS)沉淀法,而KCl-SDS沉淀法仅局限于确定DPC作用本试验可在相同试验条件下,通过彗星试验同时观察到DNA断裂损伤作用和DPC作用。根据张遵真等[17-18]的研究,彗星试验检测DPC时选用H2O2作为标准断裂剂比其他断裂剂更方便和有效。
本试验通过彗星试验检测证明连续灌服低剂量敌百虫可引起小鼠外周血淋巴细胞DNA损伤(P<0.01)。同时,本试验在前人研究的基础上,通过设置空白组和标准断裂剂H2O2处理组作参照,并加入一定量蛋白酶K处理使试验组细胞在电泳时产生更大的迁移,来判断是否发生蛋白质交联效应。空白组和H2O2处理组经蛋白酶K处理后,与未添加蛋白酶K处理的试验组所得彗星试验结果相比无明显区别;而各敌百虫试验组细胞的彗尾DNA含量、彗尾长度和Olive尾距与对照组相比,都有一定程度的增加,尤其是在较高浓度(40、60 mg·kg-1)水平时,增加明显,表明在高浓度敌百虫染毒下小鼠外周血淋巴细胞出现了DPC效应。DPC可引起遗传表达及染色体结构异常,这可能是敌百虫介导的遗传毒性的重要机制。通过检测DPC作用,对探讨敌百虫遗传毒性的分子机制有着重要作用。且本试验方法简便快速,不需放射性标记,不需要昂贵仪器、设备,有利于推广应用。
[1] Wu M L, Deng J F. Acute hemolysis caused by incidental trichorfon exposure [J]. Journal of the Chinese Medical Association, 2009, 72(4): 214-218
[2] Thomaz J M, Martins N D, Monteiro D A, et al. Cardio respiratory function and oxidative stress biomarkers inNiletilapiaexposed to the organophosphate insecticide trichlorfon [J]. Ecotoxicology and Environmental Safety, 2009, 72(5): 1413-1424
[3] 周好乐, 于国辉, 郑明霞, 等. 敌百虫的遗传毒性效应及维生素C的拮抗作用[J]. 内蒙古医学院学报, 2008, 2(1): 20-22
Zhou H L, Yu G H, Zheng M X, et al. Effect of dipterex on genetic toxicology and antagonistic action of vitamin C on genrtic damage induced by dipterex [J]. Journal of Inner Mongolia Medical College, 2008, 2(1): 20-22 (in Chinese)
[4] Tian Y, Zhou S F, Gao Y, et al. Effects of repeated maternal oral exposure to low levels of trichlorfon on development and cytogenetic toxicity in 3-day mouse embryos [J]. Food and Chemical Toxicology, 2011, 49(10): 2655-2659
[5] 李曙光, 何新星, 吴大蔚, 等. 苯致模拟失重大鼠肝细胞DNA-蛋白质交联的研究[J]. 航空航天医学杂志, 2012, 8: 932-934
Li S G, He X X, Wu D W, et al. Study on DNA-protein crosslinks induced by benzene in the liver of rats weightlessness simulated by tail-suspension [J]. Journal of Aerospace Medicine, 2012, 8: 932-934 (in Chinese)
[6] 苏来, 宋宏宇. 检测DNA-蛋白质交联的新方法[J]. 遗传, 2008, 30(5): 659-662
Su L, Song H Y. Detection of DNA-protein crosslinks with modified comet assay [J]. Hereditas, 2008, 30(5): 659-662 (in Chinese)
[7] WHO. Concise Internation Chemical Assessment Document 40: Formaldehyde [S]. Geneva: World Health Organization, 2002: 12-16
[8] Mouron S A, Grillo C A, Dulout F N, et al. Induction of DNA strand breaks, DNA-protein crosslinks and sister chromatid exchanges by arsenite in a human lung cell line [J]. Toxicology in Vitro, 2006, 20(3): 279-285
[9] 彭光银, 刘英帅, 段丽菊, 等. 甲醛所致DNA断裂和DNA交联的作用[J]. 公共卫生与预防医学, 2005, 16(2): 35-37
Peng G Y, Liu Y S, Duan L J, et al. Study on the effects of DNA strand break and DNA crosslink induced by fromaldehyde [J]. Journal of Public Health and Preventive Medicine, 2005, 16 (2): 35-37 (in Chinese)
[10] 丁瑜, 周淑芳, 沈莉, 等. 敌百虫暴露对孕鼠脏器及胎鼠DNA和生长发育的影响[J]. 上海交通大学学报, 2009, 29(3): 248-251
Ding Y, Zhou S F, Shen L, et al. Effects of trichlorfon exposure on maternal organ, fetal DNA and development in mice [J]. Journal of Shanghai Jiao Tong University, 2009, 29(3): 248-251 (in Chinese)
[11] 戴斐, 田英, 沈莉, 等. 敌百虫暴露对小鼠及胎鼠生殖发育影响[J]. 中国公共卫生, 2007, 23(5): 595-596
Dai F, Tian Y, Shen L, et al. Analysis on reproductive and developmental effects on mice and fetuses after maternal exposure of trichlorfon [J]. Chinese Journal of Public Health, 2007, 23(5): 595-596 (in Chinese)
[12] 龙鼎新, 伍一军. 敌百虫对人成神经瘤细胞SH-SY5Y增殖与分化的影响[J]. 中南医学科学杂志, 2011, 39(6): 607-610
Long D X, Wu Y J. Effect of trichlorfon on proliferation and differentiation of SH-SY5Y human neuroblastoma cells [J]. Journal of Medical Science in Central South China, 2011, 39(6): 607-610 (in Chinese)
[13] 刘学忠, 李丹, 袁燕, 等. 敌百虫对大鼠大脑皮质神经细胞的形态学损伤[J]. 中国兽医学报, 2012, 3(32): 457-462
Liu X Z, Li D, Yuan Y, et al. Morphological damage of trichlorfon on nerve cells of rat cerebral cortex [J]. Chinese Journal of Veterinary Science, 2012, 3(32): 457-462 (in Chinese)
[14] 朱友芳, 洪万树. 敌百虫对中国花鲈的毒性效应[J]. 生态学杂志, 2011, 30(7): 1484-1490
Zhu Y F, Hong W S. Toxic effects of trichlorfon on perch Lateolabrax maculates [J]. Chinese Journal of Ecology, 2011, 30(7): 1484-1490 (in Chinese)
[15] 李丹. 敌百虫对大鼠大脑皮质神经细胞毒性的研究[D]. 扬州: 扬州大学, 2010: 50
Li D. Studies on the toxicology of trichlorfon to rat cortical neuron [D]. Yangzhou: Yangzhou University, 2010: 50 (in Chinese)
[16] Merk O, Reiser K, Speit G, et al. Analysis of chromate-induced DNA-protein crosslinks with the comet assay [J]. Mutation Research, 2000, 471(1): 71-80
[17] 张遵真, 衡正昌, 贺芳, 等. 彗星试验检测DNA交联的研究[J]. 卫生研究, 2001, 30(3): 146-148
Zhang Z Z, Heng Z C, He F, et al. Detection of DNA crosslinks with comet assay [J]. Journal of Hygiene Research, 2001, 30(3): 146-148 (in Chinese)
[18] 张遵真, 衡正昌. 彗星试验检测DNA交联及其修复效应的研究[J]. 卫生毒理学杂志, 2001, 15(4): 262-264
Zhang Z Z, Heng Z C. Detection of DNA crosslinks and repair effect with comet assay [J]. Journal of Health Toxicology, 2001, 15(4): 262-264 (in Chinese)
◆
Study on DNA-Protein Crosslinks Induced by Trichlorfon in Peripheral Blood Lymphocyte of Mice
Zhang Yong1,*, He Qi2, Lu Li1, Yang Hong1
1. Key Laboratory of Animal Genetics, Breeding and Reproduction in the Plateau Mountainous Region of Ministry of Education and Guizhou Province, College of Animal Science, Guizhou University, Guiyang 550025, China 2. Huaxi Agriculture Bureau of Guiyang, Guiyang 550025, China
26 November 2013 accepted 19 April 2014
In order to study DNA-protein crosslinks(DPC) of trichlorfon on peripheral blood lymphocyte in mice, mice were orally administrated with trichlorfon daily for 14 days at the concentrations of 0, 20, 40, 60 mg·kg-1respectively. The fifth group as positive control group was established by extracting the peripheral blood in mice treated with 50 μmol·L-1hydrogen peroxide. The DPC effects of trichlorfon were measured by comet assay. The results indicated that every group can cause the DNA damaged (P<0.01) and lead to DPC effects compared with the blank group. Moreover, DPC is highly obvious when at high concentrations (40, 60 mg·kg-1), which suggested there was a risk of potential mutation.
trichlorfon; mice; DNA damage; DNA-protein crosslinks; genotoxicity; comet assay
贵州省农业科技攻关项目“绿色富硒猪肉全程质量控制配套技术研究示范项目”[黔科合NY(2007)字(3007)号];贵州省自然科学基金“分子印迹技术应用于猪肉中阿维菌素类药物残留的检测研究”[黔科合J字(2008)2128];贵州大学青年科技基金项目“肉品中农药等有毒有害物质的快速检测及其遗传毒性研究”[贵大自青基合字(2007)074]
张勇(1975-),男,博士,副教授,硕士生导师,研究方向为动物育种及健康养殖, E-mail:as.yzhang@gzu.edu.cn;
10.7524/AJE.1673-5897.20131126003
2013-11-26 录用日期:2014-04-19
1673-5897(2015)2-210-06
X171.5
A
张勇, 何琦, 卢黎, 等. 敌百虫致小鼠外周血淋巴细胞DNA-蛋白质交联作用研究[J]. 生态毒理学报, 2015, 10(2): 210-215
Zhang Y, He Q, Lu L, et al. Study on DNA-protein crosslinks induced by trichlorfon in peripheral blood lymphocyte of mice [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 210-215 (in Chinese)

