BDE-47对人胚肾细胞HEK293的毒理效应及作用机制
曹璐璐,李斐,吴惠丰,赵建民
1. 中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室,烟台 264003 2. 中国科学院大学,北京 100049
BDE-47对人胚肾细胞HEK293的毒理效应及作用机制
曹璐璐1,2,李斐1,*,吴惠丰1,#,赵建民1
1. 中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室,烟台 264003 2. 中国科学院大学,北京 100049
2,2’,4,4’-四溴联苯醚(BDE-47)是生物体中含量最高且毒性最强的PBDEs之一,有关BDE-47对肾细胞的毒性及其作用机制的研究仍有待补充。选取3个剂量组(低:10-6mol·L-1、中:10-5mol·L-1、高:10-4mol·L-1)及溶剂对照组,研究了BDE-47对人胚肾细胞(HEK293)的细胞凋亡率及活性氧(ROS)水平的影响;并从分子水平对细胞氧化损伤、凋亡相关蛋白(APE1及p53)及凋亡相关基因mRNA (p53、Bax、Caspase 3、Caspase 8)的表达量进行测定。实验结果显示:与对照组相比,中、高剂量组细胞凋亡率显著增加(P<0.05);ROS水平在中剂量组显著上升(P<0.01);随BDE-47浓度的变化,APE1蛋白表达量与细胞ROS水平存在一致性;p53、Bax、Caspase 8 mRNA表达量与BDE-47的浓度间存在剂量-效应关系。结果表明,BDE-47可诱导HEK293细胞凋亡及氧化应激,APE1可能是细胞ROS升高与细胞凋亡间重要的中介因子;BDE-47可以通过影响Caspase 8及线粒体途径中p53及Bax的表达诱导细胞凋亡。
2,2’,4,4’-四溴联苯醚(BDE-47);人胚肾细胞;细胞凋亡;氧化损伤;p53;Bax
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一类溴代芳香族化合物,现今作为阻燃剂被广泛应用[1]。由于其难以降解且可远距离迁移,目前,已经从多种环境介质及生物体中检测到PBDEs的存在,如土壤、大气、沉积物、室内空气、贻贝、鱼类、家禽及人体组织、体液等[2-4]。研究者综合分析了全球已公布的人群监测结果,认为2,2’,4,4’-四溴联苯醚(2,2’,4,4’-tetra-bromodiphenyl ether, BDE-47)是与人群关系最密切的PBDEs同系物之一,而且它也是分布最广、在生物体中含量最高、对人体和动物毒性最强的PBDEs之一[5]。因此,BDE-47对于人体的潜在毒性作用受到了国内外研究者的广泛关注。体内及体外实验表明,BDE-47具有神经毒性、肝肾毒性、生殖毒性及内分泌干扰作用[6-13]。围绕BDE-47细胞毒性的研究工作也已展开。那广水等[14]研究发现,BDE-47浓度达20 μg·mL-1以上便会对人肝细胞(L02)的增殖造成抑制。此外,有研究报道,一定剂量的BDE-47(>20 μmol·L-1)可引起L02细胞乳酸脱氢酶(LDH)漏出率增加、细胞丙二醛(MDA)含量增加、谷胱甘肽-S-转移酶(GST)以及超氧化物歧化酶(SOD)活力降低,表明BDE-47可诱导L02细胞出现氧化应激[13]。He等[15]研究发现,BDE-47对于人成神经细胞瘤细胞(SH-SY5Y)存在毒物兴奋效应,且不同浓度BDE-47(1、2、4、8 μg·mL-1)暴露细胞24 h后,细胞在8 μg·mL-1表现出明显的凋亡、氧化应激及DNA损伤现象。Yan等[16]通过研究指出,BDE-47诱导的细胞凋亡现象可能与活性氧(reactive oxygen species, ROS)水平增高所造成的线粒体功能障碍有关。李晋等[17]则认为,BDE-47导致的细胞周期阻滞与凋亡可能与p53蛋白表达水平增加有关。肾脏是重要的排毒器官,若肾脏细胞受损,很可能影响肾脏功能的正常发挥[18-19]。目前,关于BDE-47的肾细胞毒性的研究尚不充分,且其毒性机制尚不明晰,本实验以人胚肾细胞(HEK293)为研究对象,采用低、中、高3种剂量BDE-47对其进行暴露,观察BDE-47对HEK293细胞凋亡及细胞内ROS水平的影响,并从分子水平初步探究这一系列毒理效应的作用机制,为进一步开展BDE-47的毒性作用机制研究提供实验数据。
1 材料与方法(Materials and methods)
1.1 实验细胞
HEK293细胞,由烟台毓璜顶医院中心实验室连培文博士赠予。
1.2 仪器与试剂
仪器:SW-CJ-1FD型洁净工作台(上海博迅实业有限公司);INCO2/108型二氧化碳培养箱(德国Memmert公司);XDS-1B型倒置生物显微镜(重庆光学仪器厂);YXQ-LS-50SII立式压力蒸汽灭菌锅(上海博迅实业有限公司);5804R台式高速冷冻离心机(德国Eppendorf公司);FACSAria流式细胞仪(美国BD公司);Nanodrop2000微量紫外分光光度计(美国Thermo公司);7500Fast实时荧光定量PCR仪(美国Applied Biosystems公司);MiniVE电泳及转膜装置(美国GE公司)。
试剂:BDE-47(纯度为99.5%,美国Chem Service公司);胎牛血清、DMEM培养基、胰蛋白酶、青霉素及链霉素溶液(双抗)以及磷酸盐溶液(PBS)均购自美国Hyclone公司;二甲基亚砜(dimethyl sulfoxide,DMSO,纯度>99%,美国MP Biomedicals公司);BCA蛋白浓度测定试剂盒、Annexin V-FITC细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司;2’,7’-二氯荧光素双乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA,美国Sigma公司);TRIzol总RNA提取试剂(日本宝生物工程株式会社);SYBR Green实时定量PCR试剂盒(美国Applied Biosystems公司);脱嘌呤/脱嘧啶核酸内切酶-1(APE1)兔抗人多克隆抗体购自美国Abcam公司;p53及甘油醛-3-磷酸脱氢酶(GAPDH)兔抗人多克隆抗体购自美国Cloud-clone Corp公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(杭州华安生物技术有限公司);HRP-DAB底物显色试剂盒(天根生化科技北京有限公司);脱脂奶粉(纯度>99%)及聚偏二氟乙烯膜(PVDF)均购自北京索莱宝科技有限公司。其他试剂均为国产分析纯,实验用水为超纯水。
1.3 实验方法
1.3.1 细胞培养
HEK293细胞复苏后,培养在含10%(体积百分数)胎牛血清、1%(体积百分数)双抗的DMEM培养基中,培养条件为:37 ℃、5% CO2、相对湿度95%。3~4 d进行传代,直至细胞达到对数生长期。
1.3.2 BDE-47暴露溶液的配制
称取适量的BDE-47溶于DMSO制成标准储备液(0.2 mol·L-1),于暴露前用DMEM培养基稀释成不同浓度的BDE-47暴露溶液,溶剂对照组则向培养基中加入等量的DMSO,各浓度组中DMSO的终浓度为0.1%(体积百分数)。
1.3.3 细胞暴露及收集
结合以往研究[15, 20-23],BDE-47暴露浓度共分4组,即溶剂对照组和低、中、高剂量组(10-6、10-5、10-4mol·L-1),每组设3个平行样。将处于对数生长期细胞接种于直径为10 cm的培养皿中,接种密度约为105个·mL-1,当细胞融合度达到80%时,吸弃上清培养液,加入不同浓度BDE-47暴露溶液;经24 h暴露培养后吸弃上清溶液,用胰蛋白酶消化细胞2 min,加胎牛血清终止消化后加入PBS吹打洗涤细胞2次,离心收集细胞团块于1.5 mL离心管中,进行相关指标检测。
1.3.4 细胞凋亡及ROS水平检测
细胞凋亡:经暴露收集后,取约1×105个细胞,加入500 μL凋亡试剂盒缓冲液使其重悬;将5 μL Annexin V-FITC加入细胞悬液中,混匀,室温(18~20 ℃)避光孵育5 min;之后加入5 μL碘化丙啶(PI)混匀,再次室温避光孵育5 min。使用流式细胞仪于500 nm激发波长和530 nm发射波长下检测,计数1×104个细胞,用Cell Quest软件获取数据并分析细胞凋亡率。
细胞内ROS水平:经暴露收集后,取约1×105个细胞,加入500 μL PBS缓冲液使其重悬;向细胞悬液中加入5×10-4mol·L-1的DCFH-DA溶液5 μL,混匀,18 ℃避光孵育1 h。使用流式细胞仪测定细胞内DCFH荧光强度,激发波长为488 nm,发射波长为525 nm。
1.3.5 细胞内APE1及p53蛋白的表达量检测
选取与细胞氧化应激及细胞凋亡有关的2个分子标记蛋白APE1及p53,采用蛋白免疫印迹(Western Blot)检测BDE-47对这些蛋白表达量的影响。细胞经暴露收集,加入200 μL预冷的细胞裂解液吹打混匀,4 ℃裂解20 min后,经14 000×g离心10 min,吸取上清液;使用BCA蛋白定量试剂盒测定蛋白浓度并调整各组蛋白浓度一致,按体积比例(蛋白∶上样缓冲液 = 7∶1)加入十二烷基磺酸钠(SDS)上样缓冲液后,煮沸变性10 min,室温冷却后,4 ℃保存备用。蛋白上样量为每孔50 μg,采用12% SDS聚丙烯酰胺凝胶电泳分离蛋白质,并通过电转将蛋白转移至PVDF膜上;PVDF膜经5%脱脂奶粉室温封闭2 h后,分别加入5 mL目的蛋白及内参蛋白(GAPDH)的一抗稀释液(APE1一抗稀释比例为1∶1 000,p53为1∶500,GAPDH为1∶2 000),4 ℃过夜。次日,用含0.05%吐温-20的PBS缓冲液(PBST)漂洗PVDF膜3次,每次10 min;加入含HRP标记的羊抗兔IgG二抗的PBST缓冲液,室温孵育1 h,再用PBST缓冲液漂洗PVDF膜3次;使用HRP-DAB底物显色试剂盒孵育10 min显色,扫描后用凝胶定量分析软件(Gel-Pro Analyzer,Version 3.0)对蛋白结果进行分析。采用目的条带与内参条带灰度值的比值作为结果,将对照组的值设为1,其余各组以相对倍数表示。
1.3.6 细胞凋亡相关基因的转录水平表达量检测
采用实时荧光定量PCR法(quantitative real-time PCR, qRT-PCR)检测BDE-47对细胞凋亡相关基因mRNA表达量的影响。细胞经暴露收集,利用TRIzol法提取总RNA,采用微量紫外分光光度计测定总RNA质量,A260/280在1.8~2.0为宜;总RNA经70 ℃热变性5 min后,通过反转录获取cDNA,反应条件为:42 ℃,1 h;95 ℃,5 min。以SYBR Green作为染料,经实时荧光定量PCR仪,采用两步法进行PCR扩增,所得数据采用2-ΔΔCT分析法进行相对定量分析。目的基因及内参基因(HPRT1)的引物序列见表1。
1.4 数据整理与统计分析
采用SPSS 16.0统计分析软件,对各组实验数据进行单因素方差分析(One-Way ANOVA),显著性检测采用最小显著差数法(LSD),以P<0.05为差异具有统计学意义。
2 结果(Results)
2.1 BDE-47暴露对HEK293细胞凋亡及ROS水平的影响
细胞凋亡率及ROS水平如表2所示。与对照组相比,中、高剂量组细胞凋亡率显著增加,差异具有统计学意义(P<0.05)。中剂量组细胞内的ROS水平显著高于对照组(P<0.01),而在高剂量组中,ROS含量则显著降低(P<0.01)。
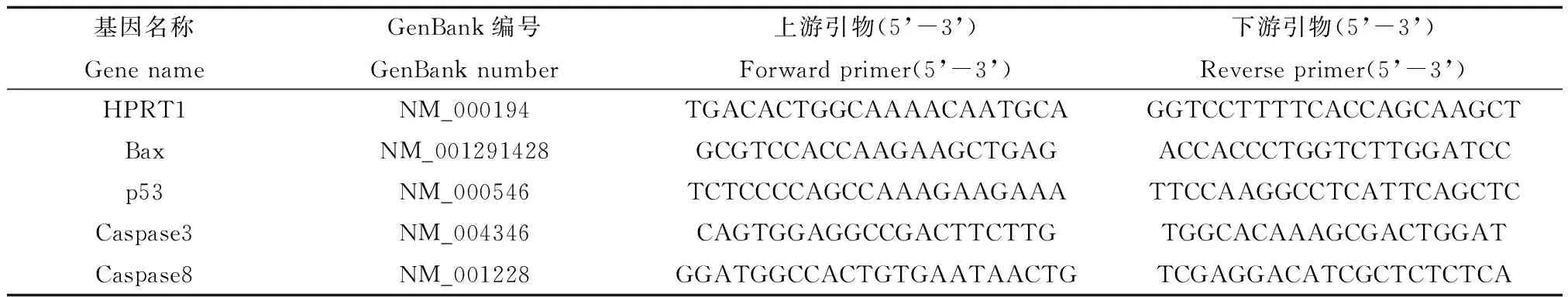
表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
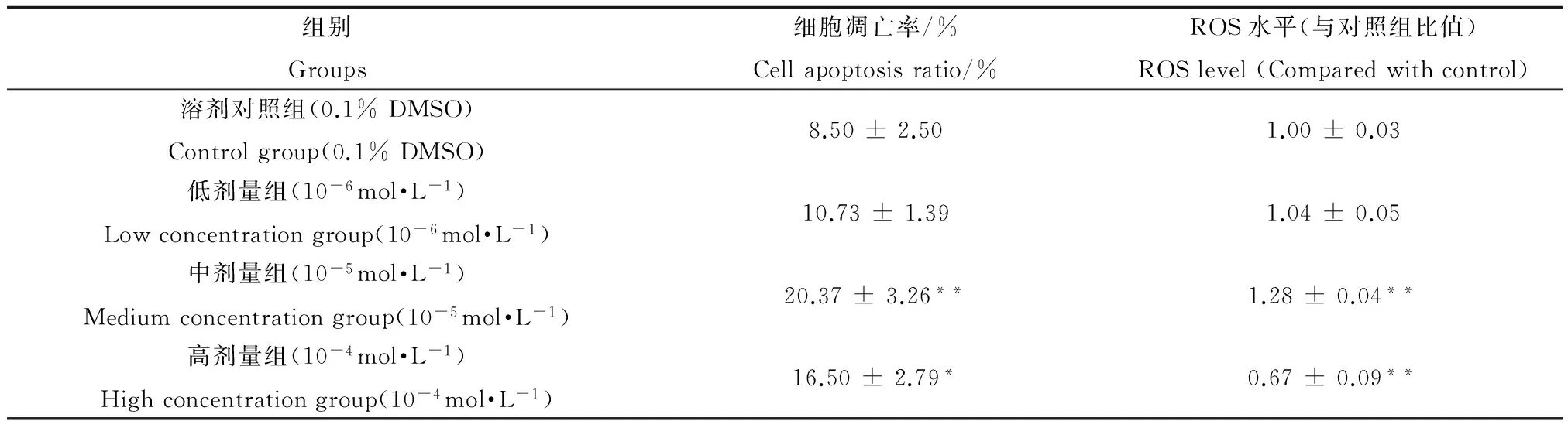
表2 BDE-47对HEK293细胞凋亡率及ROS(活性氧)水平的影响Table 2 Effects of BDE-47 on HEK293 cells apoptosis and ROS (reactive oxygen species) level
注:与溶剂对照组相比,*P<0.05,**P<0.01。
Notes: The level of significance is set at*P<0.05,**P<0.01 vs. control.
2.2 BDE-47暴露对HEK293细胞中APE1及p53蛋白表达水平的影响 BDE-47暴露对HEK293细胞氧化应激及细胞凋亡途径产生影响,并且与浓度相关。由图1中可以看出,相比对照组,APE1仅在中剂量组表达量较对照组显著升高(P<0.01);而p53蛋白的表达量随浓度的升高表现出先增加后减少的现象(P<0.05)。2.3 BDE-47暴露对HEK293细胞凋亡相关基因转录水平的影响
BDE-47对凋亡相关基因mRNA表达量的影响如表3所示。与对照组相比,Caspase 3 mRNA表达水平并未随BDE-47浓度而产生明显变化,而其他基因的mRNA表达量随BDE-47浓度的升高而逐渐增加。Bax mRNA的表达水平在高剂量组中明显升高(P<0.05);而p53 mRNA的表达量在中、高剂量组均显著增加(P<0.05);此外,Caspase 8 mRNA在高剂量组的表达量显著高于对照组(P<0.05)。
3 讨论(Discussion)
细胞凋亡是由基因调控的细胞自主程序性死亡,用以保障生命的稳定性[24]。诱导细胞凋亡的信号通路复杂多样,而ROS作为细胞凋亡相关信号通路的重要参与者,亦引起了国内外学者的广泛研究[13,15-16]。本实验结果显示,在BDE-47中剂量组中,细胞凋亡率与细胞内ROS水平均有所上升。结合以往研究成果[15],推测BDE-47暴露使HEK293细胞内ROS水平升高,导致DNA损伤,进而诱发细胞凋亡现象。而高剂量的BDE-47使细胞凋亡增加,但细胞内ROS水平显著降低,这可能由于过高剂量的BDE-47造成大量细胞死亡并形成细胞碎片,造成细胞内ROS无法被检测。
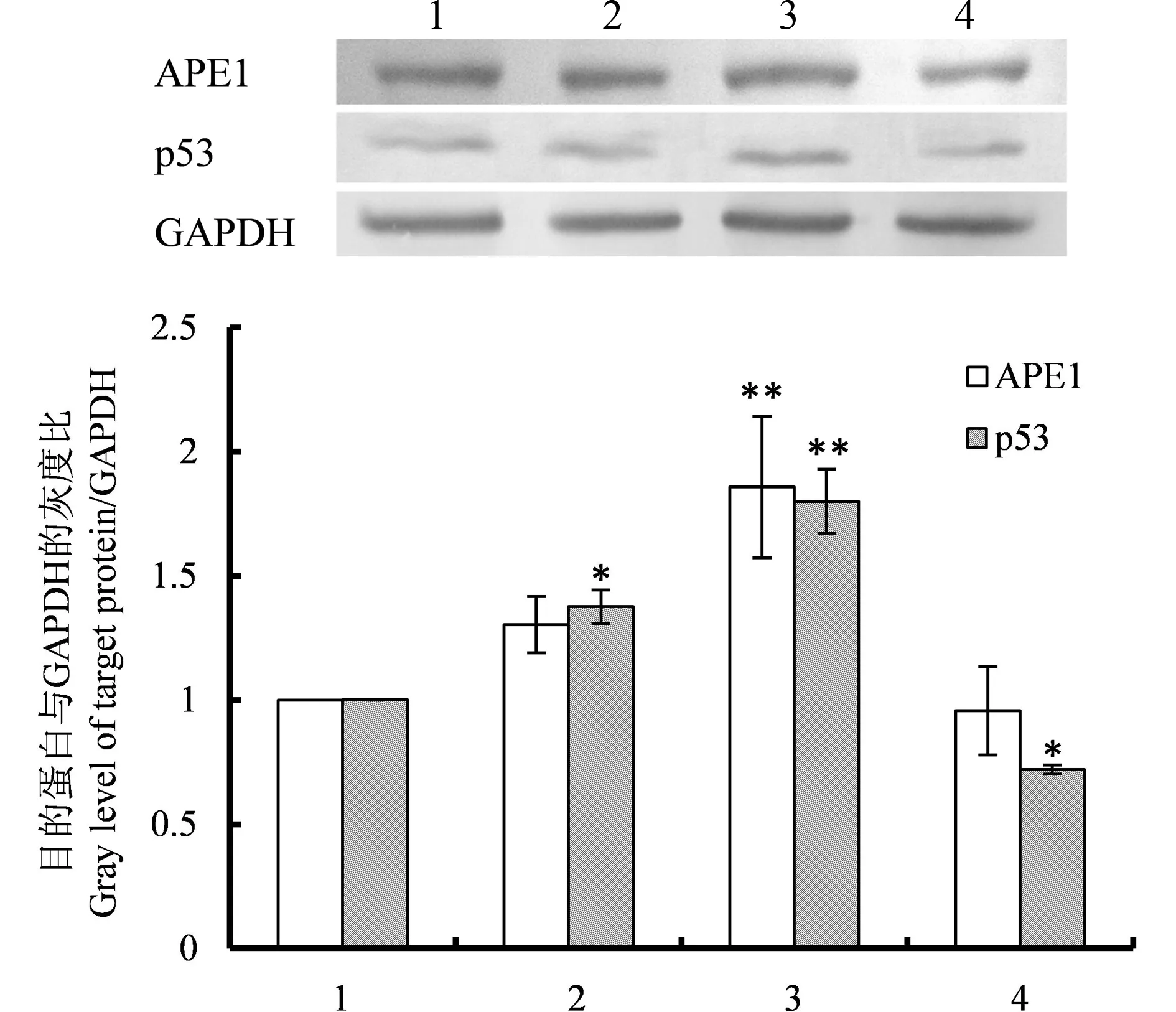
图1 BDE-47对HEK293细胞中APE1及p53 蛋白表达水平的影响注:图中1为溶剂对照组(0.1% DMSO),2为低剂量 组(10-6 mol·L-1),3为中剂量组(10-5 mol·L-1),4为高剂 量组(10-4 mol·L-1);与对照组相比,*P<0.05,**P<0.01。Fig. 1 Effects of BDE-47 on proteins (APE1 and p53) expression level in HEK293 cells Notes: 1 is control group (0.1% DMSO), 2 is low concentration group (10-6 mol·L-1), 3 is medium concentration group (10-5 mol·L-1) and 4 is high concentration group (10-4 mol·L-1). The level of significance is set at *P<0.05, **P<0.01 vs. control.
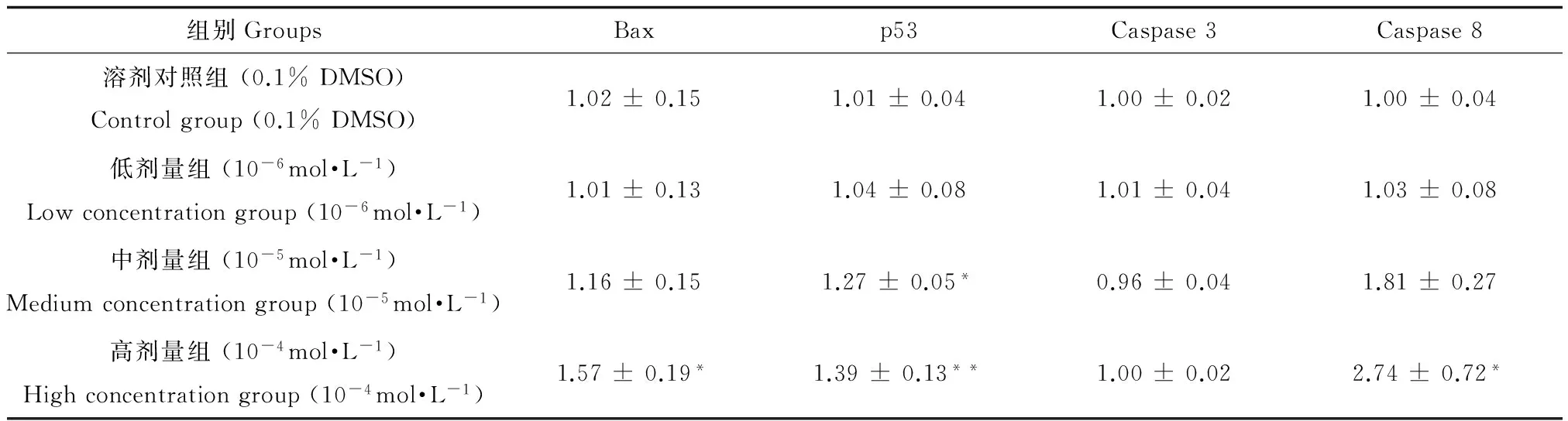
表3 BDE-47对HEK293细胞中凋亡相关基因mRNA表达量的影响Table 3 Effects of BDE-47 on apoptosis-related genes mRNA expression level in HEK293 cells
注:与溶剂对照组相比,*P<0.05,**P<0.01。
Notes: The level of significance is set at*P<0.05,**P<0.01 vs. control.
结合细胞水平的毒理效应表现,从分子水平进一步研究了BDE-47对细胞氧化应激及凋亡相关的两个蛋白(APE1及p53)表达量的影响及对细胞凋亡相关基因(p53、Bax、Caspase 3、Caspase 8)转录水平的影响,以系统阐明BDE-47对HEK293细胞的毒性作用机制。APE1作为重要的氧化还原因子,可以通过改变半胱氨酸残基在DNA中的定位,激活受控转录因子而发挥重要的生理作用,这些转录因子涉及细胞增殖、分化和凋亡等重要细胞效应[25]。已有研究指出,APE1在细胞中受ROS调控,氧化应激状态的细胞中APE1表达量明显增加[26]。在本实验中,APE1蛋白的表达量与细胞内ROS水平在不同的剂量组中存在一致性,推测细胞内ROS水平的上升造成APE1表达量上调。此外,随细胞功能状态的不同,APE1既可发挥抑制凋亡的作用又可发挥促凋亡作用。其促凋亡机制主要通过激活下游的转录因子AP-1及p53蛋白介导凋亡[27-28]。本实验中,中剂量组同时检测到APE1、p53蛋白表达量的上调与细胞凋亡率的上升,推测APE1的高表达可能促进p53依赖的细胞凋亡。
p53是重要的细胞周期与细胞凋亡的调控者,当外源污染物刺激或内源ROS升高导致细胞DNA损伤无法修复时,p53可通过多种途径诱导细胞凋亡[29];Bax作为Bcl-2家族成员之一,具有促凋亡作用,其基因启动子区域有p53的结合位点,所以p53能够促进Bax的表达[30]。已有研究指出,在1~10 μmol·L-1范围内,SH-SY5Y细胞中p53及BaxmRNA表达量与BDE-47剂量呈现正向剂量效应关系[31],本实验在10-6~10-4mol·L-1检测到相似现象,推测BDE-47暴露使HEK293细胞内p53水平上调,进而促进Bax的表达,Bax转移至线粒体与Bcl-2家族成员协同调节使通透性转换孔(PTP)开放,造成线粒体中凋亡相关因子(细胞色素c或凋亡诱导因子AIF等)被释放至胞质中,激活下游凋亡因子,诱导细胞凋亡[32-33]。p53蛋白与mRNA在高剂量组的表达水平存在差异,推测为翻译后修饰的结果。Caspase家族是凋亡的主要参与者,Caspase 8属于凋亡启动因子,位于凋亡级联效应的顶端,几乎可以激活所有下游的Caspase[34];同时,Caspase 8也可以启动线粒体凋亡途径,其可将Bid (Bcl-2家族促凋亡因子)剪切为tBid,tBid转移定位于线粒体,与Bcl-2家族其他成员共同作用促使凋亡的进行[35-36]。已有研究指出,一定剂量(5、10 μmol·L-1)的BDE-47可导致SH-SY5Y细胞中Caspase 8 mRNA表达量上调[37],与本实验结果具有一致性,说明外源死亡受体途径激活Caspase 8后,其可能通过Caspase家族的凋亡级联效应或线粒体途径参与HEK293的细胞凋亡过程。线粒体除释放细胞色素c激活Caspase依赖的凋亡途径外,还可通过释放AIF等启动非Caspase依赖的凋亡途径[38]。凋亡执行因子Caspase3 mRNA表达量在各剂量组中均无明显变化,指示HEK293细胞在凋亡最后的执行阶段,可能通过Caspase家族其他凋亡执行因子(Caspase 6及Caspase 7)或非Caspase依赖的途径实现细胞凋亡。
综上所述,一定剂量的BDE-47可诱导HEK293细胞凋亡产生ROS;结合翻译水平及转录水平结果推测:ROS的产生可诱导APE1的上调,进而激活下游转录因子p53;p53可促使Bax高表达并转移至线粒体,造成其中凋亡相关因子的释放;Caspase 8可启动HEK293细胞凋亡,但其是否通过线粒体途径介导凋亡仍有待进一步研究。本实验揭示了BDE-47对HEK293细胞的毒理效应,并初步探究了效应机制,为BDE-47的肾细胞毒理效应研究提供了理论支持。
[1] Shin J H, Boo H O, Bang E, et al. Development of a cleanup method for polybrominated diphenyl ether (PBDE) in fish by freezing-lipid filtration [J]. European Food Research and Technology, 2012, 235(2): 295-301
[2] Chen D, Hale R C. A global review of polybrominated diphenyl ether flame retardant contamination in birds [J]. Environment International, 2010, 36(7): 800-811
[3] Shen H T, Yu C, Ying Y, et al. Levels and congener profiles of PCDD/Fs, PCBs and PBDEs in seafood from China [J]. Chemosphere, 2009, 77(9): 1206-1211
[4] Talsness C E. Overview of toxicological aspects of polybrominated diphenyl ethers: A flame-retardant additive in several consumer products [J]. Environmental Research, 2008, 108(2): 158-167
[5] Hites R A. Polybrominated diphenyl ethers in the environment and in people: A meta-analysis of concentrations [J]. Environmental Science & Technology, 2004, 38(4): 945-956
[6] Costa L G, Giordano G. Developmental neurotoxicity of polybrominated diphenyl ether (PBDE) flame retardants [J]. Neurotoxicology, 2007, 28(6): 1047-1067
[7] Viberg H, Ponten E, Eriksson P, et al. Neonatal ketamine exposure results in changes in biochemical substrates of neuronal growth and synaptogenesis, and alters adult behavior irreversibly [J]. Toxicology, 2008, 249(2-3): 153-159
[8] He P, He W H, Wang A G, et al. PBDE-47-induced oxidative stress, DNA damage and apoptosis in primary cultured rat hippocampal neurons [J]. Neurotoxicology, 2008, 29(1): 124-129
[9] 叶细标, 傅华. 多溴联苯醚的环境暴露及健康危害[J]. 环境与职业医学, 2007, 24(1): 95-101
Ye X B, Fu H. Environmental exposure and health risks of polybrominated diphenyl ethers(PBDEs) [J]. Journal of Environmental & Occupational Medicine, 2007, 24(1): 95-101 (in Chinese)
[10] 张慧慧, 于国伟, 牛静萍. 多溴联苯醚健康效应的研究进展[J]. 环境与健康杂志, 2011, 28(12): 1124-1127
Zhang H H, Yu G W, Niu J P. Health effects of polybrominated diphenyl ethers: A review of recent studies [J]. Journal of Environment and Health, 2011, 28(12): 1124-1127 (in Chinese)
[11] Zhou T, Ross D G, DeVito M J, et al. Effects of short-terminvivoexposure to polybrominated diphenyl ethers on thyroid hormones and hepatic enzyme activities in weanling rats [J]. Toxicological Sciences, 2001, 61(1): 76-82
[12] 王兴华, 张照祥, 丁书姝, 等. PBDE-209致小鼠肝脏病理学改变及其氧化应激机制研究[J]. 中华疾病控制杂志, 2012, 16(3): 187-190
Wang X H, Zhang Z X, Ding S S, et al. Study on pathological changes in mice liver induced by PBDE-209 and the mechanism of oxidative stress [J]. Chinese Journal of Disease Control Prevention, 2012, 16(3): 187-190 (in Chinese)
[13] 贾晓栋, 张建清, 黄海燕. 2,2’,4,4’-四溴联苯醚的肝细胞氧化损伤毒性效应研究[J]. 毒理学杂志, 2012, 26(2): 117-120
[14] 那广水, 孙丽娟, 张雯雯, 等. 溴阻燃剂对肝细胞的毒性[J]. 生态毒理学报, 2012, 7(5): 570-573
Na G S, Sun L J, Zhang W W, et al. Hepatotoxicity of brominated flame retardants [J]. Asian Journal of Ecotoxicology, 2012, 7(5): 570-573 (in Chinese)
[15] He W H, He P, Wang A G, et al. Effects of PBDE-47 on cytotoxicity and genotoxicity in human neuroblastoma cellsinvitro[J]. Mutation Research, 2008, 649(1-2): 62-70
[16] Yan C, Huang D J, Zhang Y M. The involvement of ROS overproduction and mitochondrial dysfunction in PBDE-47-induced apoptosis on Jurkat cells [J]. Experimental and Toxicologic Pathology, 2011, 63(5): 413-417
[17] 李晋, 匡刚, 赵国栋, 等. 2,2’,4,4’-四溴联苯醚对人神经母细胞瘤SH-SY5Y细胞周期、凋亡及p53蛋白表达的影响[J]. 环境与健康杂志, 2012, 29(8): 675-678
Li J, Kuang G, Zhao G D, et al. Effects of PBDE-47 on cell cycle, apoptosis and p53 protein expression in human neuroblastoma SH-SY5Y cells [J]. Journal of Environment and Health, 2012, 29(8): 675-678 (in Chinese)
[18] 袁海平, 陈佩杰, 史仍飞, 等. 运动性蛋白尿与肾脏细胞凋亡及氧自由基代谢关系的研究[J]. 中国运动医学杂志, 2003, 22(3): 254-257
Yuan H P, Chen P J, Shi R F, et al. Studies on the association of the exertional proteinuria with apoptosis and oxidative free radical metabolism of renal cells [J]. Chinese Journal of Sports Medicine, 2003, 22(3): 254-257 (in Chinese)
[19] 刘祥梅, 谭军, 吴宇强, 等. 前健脾后补肾对力竭运动大鼠肾功能和肾细胞凋亡的影响[J]. 中医杂志, 2007, 48(12): 1116-1118
Liu X M, Tan J, Wu Y Q, et al. Effect of strengthening the spleen and tonifying the kidney on the function and apoptosis of kidney in rats after exhaustive exercise [J]. Journal of Traditional Chinese Medicine, 2007, 48(12): 1116-1118 (in Chinese)
[20] Shao J, White C C, Dabrowski M J, et al. The role of mitochondrial and oxidative injury in BDE 47 toxicity to human fetal liver hematopoietic stem cells [J]. Toxicological Sciences, 2008, 101(1): 81-90
[21] An J, Yin L L, Shang Y F, et al. The combined effects of BDE47 and BaP on oxidatively generated DNA damage in L02 cells and the possible molecular mechanism [J]. Mutation Research, 2011, 721(2): 192-198
[22] Zhong Y F, Wang L L, Yin L L, et al. Cytotoxic effects and oxidative stress response of six PBDE metabolites on human L02 cells [J]. Journal of Environmental Science and Health Part A, 2011, 46(12): 1320-1327
[23] Hua X Z, Hua D C, Xu Y. Effects of tetrabrominated diphenyl ether and hexabromocyclododecanes in single and complex exposure to hepatoma HepG2cells [J]. Environmental Toxicology and Pharmacology, 2009, 27(3): 327-337
[24] Kerr J F, Wyllie A H, Currie A R. Apoptosis: A basic biological phenomenon with wide-ranging implications in tissue kinetics [J]. British Journal of Cancer, 1972, 26(4): 239-257
[25] McNeill D R, Wong H K, Narayana A, et al. Lead promotes abasic site accumulation and co-mutagenesis in mammalian cells by inhibiting the major abasic endonuclease Ape1 [J]. Molecular Carcinogenesis, 2007, 46(2): 91-99
[26] 李梦侠, 王东. APE1/Ref-1基因结构及其表达调控[J]. 医学分子生物学杂志, 2006, 3(5): 350-353
Li M X, Wang D. Genetic structure and expression regulation of APE1/Ref-1 [J]. Journal of Medical Molecular Biology, 2006, 3(5): 350-353 (in Chinese)
[27] Shaulian E, Karin M. AP-1 as a regulator of cell life and death [J]. Nature Cell Biology, 2002, 4(5): E131-E136
[28] Evans A R, Limp-Foster M, Kelley M R. Going APE over ref-1 [J]. Mutation Research-DNA Repair, 2000, 461(2): 83-108
[29] Fridman J S, Lowe S W. Control of apoptosis by p53 [J]. Oneogene, 2003, 22(4): 9030-9040
[30] Haupt S, Berger M, Goldberg Z, et al. Apoptosis-the p53 network [J]. Journal of Cell Science, 2003, 116(20): 4077-4085
[31] Zhang S, Kuang G, Zhao G D, et al. Involvement of the mitochondrial p53 pathway in PBDE-47-induced SH-SY5Y cells apoptosis and its underlying activation mechanism [J]. Food and Chemical Toxicology, 2013, 62: 699-706
[32] Wolter K G, Hsu Y T, Smith C L, et al. Movement of Bax from the cytosol to mitochondria during apoptosis [J]. Journal of Cell Biology, 1997, 139(5): 1281-1292
[33] Daugas E, Susin S A, Zamzami N, et al. Mitochondrio-nuclear translocation of AIF in apoptosis and necrosis [J]. Faseb Journal, 2000, 14(5): 729-739
[34] 袁长青, 丁振华. Caspase的活化及其在细胞凋亡中的作用[J]. 生理科学进展, 2002, 33(3): 220-224
Yuan C Q, Ding Z H. Activation and function of Caspases in apoptosis [J]. Progress in Physiological Sciences, 2002, 33(3): 220-224 (in Chinese)
[35] Kim K H, Fisher M J, Xu S Q, et al. Molecular determinants of response to TRAIL in killing of normal and cancer cells [J]. Clinical Cancer Research, 2000, 6(2): 335-346
[36] Li H L, Zhu H, Xu C J, et al. Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis [J]. Cell, 1998, 94(4): 491-501
[37] 高丽娟. Fas/FasL途径在PBDE-47致SH-SY5Y细胞凋亡中的作用[D]. 武汉: 华中科技大学, 2009: 20-21
Gao L J. The effect of Fas/FasL pathway on PBDE-47-induced apoptosis in SH-SY5Y cells [D]. Wuhan: Huazhong University of Science & Technology, 2009: 20-21 (in Chinese)
[38] Norberg E, Orrenius S, Zhivotovsky B. Mitochondrial regulation of cell death: Processing of apoptosis-inducing factor (AIF) [J]. Biochemical and Biophysical Research Communications, 2010, 396(1): 95-100
◆
The Toxicological Effects and Mechanisms of BDE-47 on HEK293 Cells
Cao Lulu1,2, Li Fei1,*, Wu Huifeng1,#, Zhao Jianmin1
1. Key Laboratory of Coastal Environmental Processes and Ecological Remediation of Chinese Academy of Sciences, Yantai Institute of Coastal Zone Research (YIC), Chinese Academy of Sciences, Yantai 264003, China 2. University of Chinese Academy of Sciences, Beijing 100049, China
5 December 2014 accepted 5 January 2015
Three BDE-47 concentration groups (low: 10-6mol·L-1, medium: 10-5mol·L-1, high: 10-4mol·L-1) and one control group were chosen to investigate the toxic effects of BDE-47 on HEK293 cells, including cell apoptosis ratio and ROS level. Furthermore, the abundance of several proteins (APE1 and p53) and expression level of p53, Bax, Caspase 8 were also detected at molecular level. It was found that cell apoptosis was significantly increased in the medium and high concentration groups (P<0.05) compared with the control. ROS level also increased significantly in the medium concentration group (P<0.01). With the increase of BDE-47 concentrations, the variation trend of APE1 abundance was coincident with that of ROS level. Moreover, the mRNA expression level of apoptosis-related genes (p53, Bax and Caspase 8) was up-regulated with the increase of BDE-47 concentrations. These results showed that BDE-47 could cause several toxic effects on HEK293 cells, including induction of cell apoptosis and oxidative stress. APE1 was perhaps an important mediator of cell apoptosis and oxidative stress. BDE-47 could induce cell apoptosis by affecting the expression of Caspase 8 and p53, Bax through the mitochondria signal pathway.
BDE-47; HEK293; cell apoptosis; oxidative damage; p53; Bax
国家自然科学基金(21107136);国际科学基金(F/5230-1); 中国科学院重点部署项目(KZZD-EW-14); 中国科学院战略性先导科技专项(A类)(XDA11020405)
曹璐璐(1989-),女,学士,研究方向为海洋生态毒理,E-mail: llcao1026@126.com;
*通讯作者(Corresponding author), E-mail: fli@yic.ac.cn
10.7524/AJE.1673-5897.20141205002
2014-12-05 录用日期:2015-01-05
1673-5897(2015)2-236-07
X171.5
A
李斐(1982-),女,工学博士,助理研究员,主要从事生态毒理与计算毒理学方面的研究。
吴惠丰(1977-),男,理学博士,研究员,主要从事海洋生态毒理方面的研究。
# 共同通讯作者(Co-corresponding author),E-mail: hfwu@yic.ac.cn
曹璐璐, 李斐, 吴惠丰. BDE-47对人胚肾细胞HEK293的毒理效应及作用机制[J]. 生态毒理学报, 2015, 10(2): 236-242
Cao L L, Li F, Wu H F. The toxicological effects and mechanisms of BDE-47 on HEK293 cells [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 236-242 (in Chinese)

