酚类化合物短期暴露对小麦和大麦苗期根伸长的影响
王珊,苏玉红,乔敏
1. 新疆大学化学化工学院,乌鲁木齐 830046 2. 中国科学院生态环境研究中心,北京 100085
酚类化合物短期暴露对小麦和大麦苗期根伸长的影响
王珊1,2,苏玉红1,*,乔敏2
1. 新疆大学化学化工学院,乌鲁木齐 830046 2. 中国科学院生态环境研究中心,北京 100085
采用小麦和大麦为受试作物,以其在受试化合物污染的土壤中培育3 d后获得的根伸长的半数抑制浓度(IC50)评价了12种酚类化合物的毒性效应。结果表明,在所设浓度范围内,酚类对作物根伸长均存在剂量-效应关系。小麦对受试酚类的IC50范围为:12.92~231.76 mg·kg-1,其中邻苯二酚只在最高浓度500 mg·kg-1时对小麦的毒性效应显著。大麦对受试化合物的IC50范围为:7.15~478.31 mg·kg-1。小麦对3-甲基酚、双酚A、2-萘酚和壬基酚相对敏感,而其它8种化合物则是大麦相对更敏感。酚类化合物对小麦和大麦的毒性强度整体趋势一致。
酚类化合物;小麦;大麦;根伸长;植物毒性
酚类物质是指芳香环与羟基相连的一大类有机化合物,被广泛地应用于石油化工、炼焦、制药、造纸、颜料合成、木材防腐、塑料制造、皮革等工业部门[1-2],是重要的化工原料之一,也是有毒化学物质。酚类化合物具有致癌、致畸和致突变的潜在毒性[3]。它们经空气及水传播,可长期残留于土壤中,会对生态环境和人体健康造成严重的危害。20世纪70年代中期,美国国家环保局(Environmental Protection Agency, EPA)就将11种酚类化合物列入129种环境优先污染物之中[4]。中国也将6种酚类化合物确定为优先控制有机污染物[5],世界各国对于酚类化合物的环境污染和生态效应都给予了普遍的关注和高度的重视。
然而,单纯的化学分析不足以评估污染土壤的潜在生态影响,因此,利用生物对污染土壤进行生态毒性评估获得了广泛的关注[6]。自20世纪80年代以来,研究人员广泛开展生态毒理试验方法的研究,其中土壤生态毒理诊断通过选择敏感物种(如,土壤微生物、陆生植物、土壤中脊椎动物、与土壤接触的无脊椎动物等)作为毒性诊断的指标,提供土壤污染的信息。高等植物是生态系统中的基本组成部分,利用其生长状况诊断土壤污染,是土壤质量评价的重要方法之一。目前已建立的高等植物毒理试验方法有根伸长抑制试验、种子发芽试验和植物幼苗早期生长试验[7]。试验的评价指标一般选择种子发芽率、根伸长抑制率、芽伸长抑制率、生物量(鲜重、干重)等。其中植物根因与土壤直接接触,常常能快速敏感的反映污染物毒性,多项研究结果也表明对外源污染物的敏感性短期内通常表现为根伸长抑制率大于芽伸长等其他评价指标[8-10]。
小麦作为全球最主要的粮食作物之一,常被用来进行根分生组织细胞遗传学测试[11]及表征化学品生态毒性效应[12-13]。大麦在我国栽培作物中分布最广泛,也常被用于生态风险评估测试[14]。本研究选择典型须根系作物小麦和大麦作为供试作物,采集自然土样进行作物早期生长实验,观察酚类化合物污染土壤对小麦和大麦苗期根伸长抑制率的影响,确定小麦和大麦根伸长对不同酚类物质的敏感程度,为快速评价酚类污染土壤的潜在生态风险提供科学依据。
1 材料与方法(Materials and methods)
1.1 供试材料和仪器
试剂:2,4,6-三氯酚,2,4-二氯酚,2-氯酚,双酚A(纯度均为98%,北京伊诺凯科技有限公司),4-硝基酚,3-甲基酚,2,4-二甲基酚,苯酚,间苯二酚(纯度均为99%,百灵威化学技术有限公司),邻苯二酚(纯度为99%,梯希爱(上海)化成工业发展有限公司),壬基酚(纯度为98%,阿达玛斯试剂有限公司),2-萘酚(纯度为99%,德国Dr. Ehrenstorfer GmbH公司),丙酮为国产色谱纯。上述试剂均避光保存。
供试土壤和种子:供试土壤黄棕壤,采自北京市大兴区黄村镇耕地区0~20 cm表层黄棕壤(风干,过2 mm筛,无明显植物残体),土壤理化性质见表1。小麦(Triticum aestivum,中国春),大麦(Hordeum vulgare,ZDM09906,〔京〕306)种子购自中国农业科学院。
仪器:RXZ-430B型培养箱(宁波东南仪器有限公司),AR224CN型万分之一天平(OHAUS公司)。
1.2 实验方法
1.2.1 预备实验
称取100 g风干土,直接取配置成0、0.1、1、5、10、50 mg·mL-16个不同浓度梯度的酚类化合物的丙酮溶液1 mL先与少量土壤混合,通过递增土壤、多次混合的方法以达到均匀染毒的效果。将染毒后的土壤放于通风橱,至溶剂挥发完全[15]。
将染毒后的土壤依次加入直径为15 cm的培养皿中,调节水土比为1∶5[15]。取200粒种子,先用10%的H2O2消毒10 min,再用去离子水冲洗干净,然后放入25 ℃人工气候箱中催芽24 h,挑选出发芽一致的种子,用镊子将其均匀播种于土壤中,在恒温培养箱中25 ℃黑暗培养3 d[16],实验结果用名义浓度表示,为了防止水分流失和挥发损失,培养过程中用封口膜密封培养皿,实验设3个重复。确定根伸长抑制浓度(IC)达到0%~60%抑制率的区间后,开始正式试验。
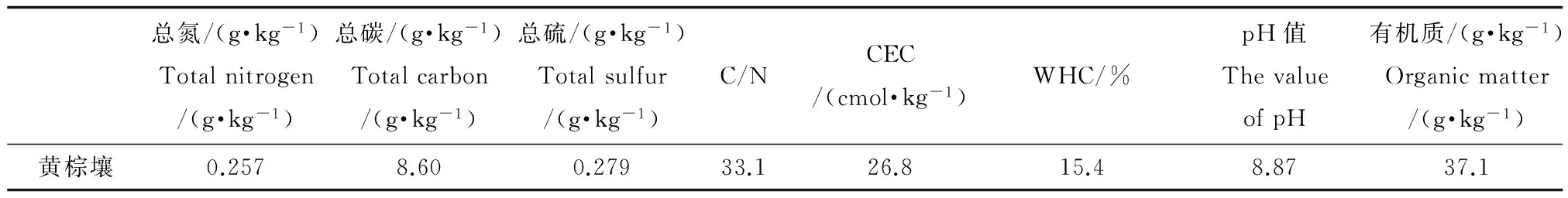
表1 土壤理化性质Table 1 Physical and chemical properties of soil
注:C/N表示碳氮比,CEC表示阳离子交换量,WHC表示土壤持水量。
Note: C/N is the ratio of total carbon and total nitrogen, CEC is short for cation exchange capacity, WHC is short for water holding capacity.
1.2.2 正式实验
根据预备试验结果,设置至少6个不同处理浓度,每个处理放入10粒种子。在与预备试验相同的温度、水分等条件下,培养3 d。实验结束时,记录下各处理土壤中种子根伸长(根长的测定以胚轴与根之间的过度点开始),实验设3个重复。各化合物正式实验设置浓度列于表2,其中苯酚对小麦的毒性效应实验加设了200 mgkg-1浓度。
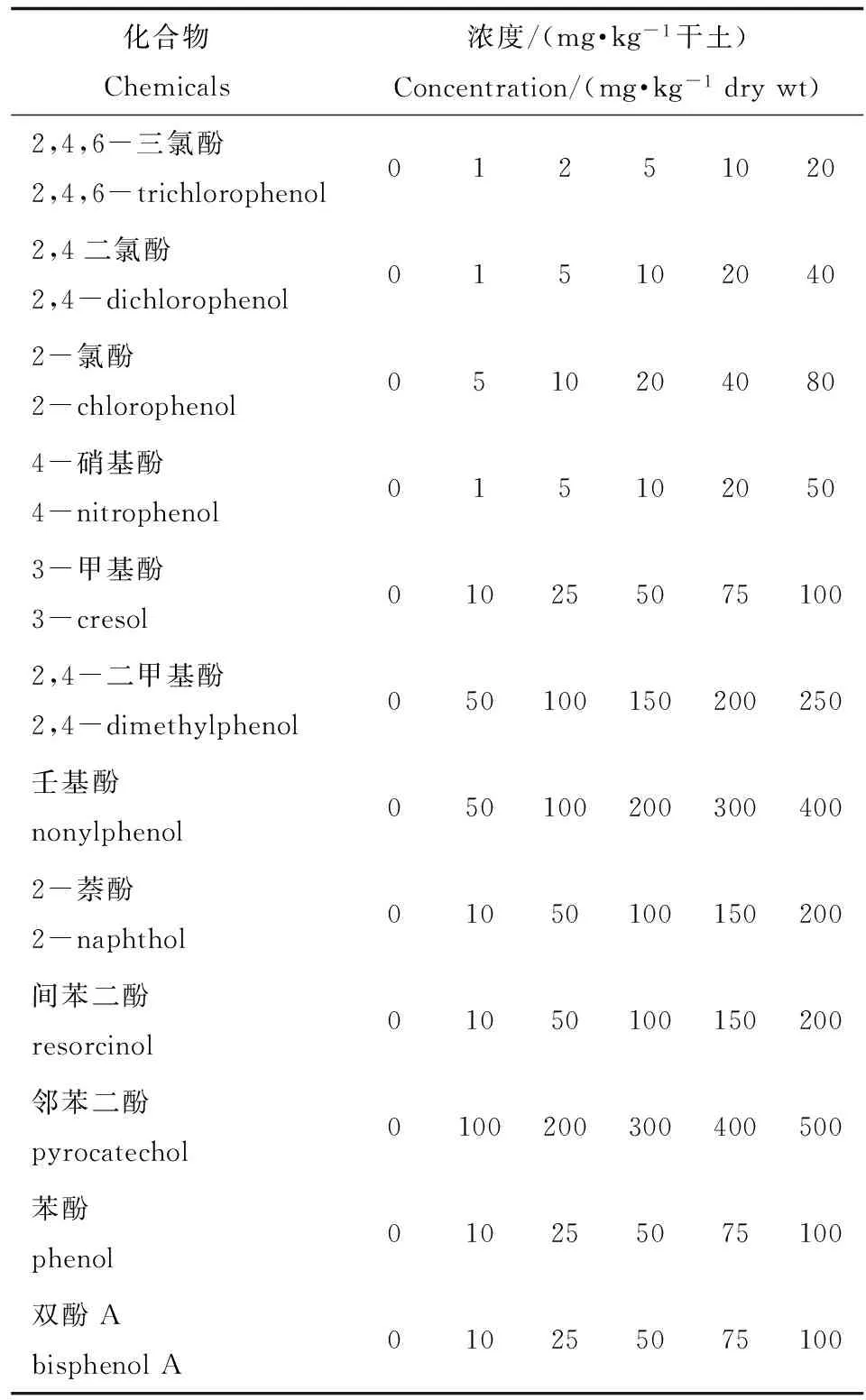
表2 12种酚类化合物植物毒性正式试验浓度设置Table 2 Test concentrations of 12 phenols
1.3 数据分析
采用Sigma Plot 10.0对各评价指标抑制率与供试污染物浓度进行拟合,SPSS 13.0对实验数据进行单因素方差分析和相关分析,并且所有数据显著性差异水平设置为P<0.05。
2 结果(Results)
2.1 酚类对植物根伸长的毒性
实验中发现酚类物质在低浓度时对作物根伸长影响不显著甚至促进根伸长,高浓度时则存在抑制作用。随着浓度的进一步升高,抑制作用逐渐增强。例如壬基酚,在其浓度为1、10、50 mg·kg-1时,对大麦根伸长的抑制率分别为-5.42%、-7.51%、-3.29%,当其浓度高于50 mg·kg-1时,对大麦根伸长抑制率随浓度升高,抑制作用也越强,在最高设定浓度500 mg·kg-1,抑制率达到75.72%。与相关文献中酚类对植物生长影响作用趋势结论一致[17]。
将小麦和大麦根伸长抑制率与酚类化合物设定的浓度进行拟合,得到酚类化合物对小麦(表3)和大麦(表4)根伸长抑制的IC50值。对比不同酚类化合物作用于同种作物的IC50值,发现除双酚A、2-萘酚和2,4-二甲基酚外,酚类化合物对两种作物的毒性趋势一致,均是2,4,6-三氯酚>2,4二氯酚> 4-硝基酚>2-氯酚>3-甲基酚>苯酚>间苯二酚>壬基酚>邻苯二酚。并且由回归方程及其相关系数(R)可以看出酚类对小麦和大麦毒性存在明显剂量-效应关系。
12种酚类化合物中3-甲基酚、壬基酚、2-萘酚和双酚A共4种化合物对小麦的IC50值分别为62.40、38.83、63.59、175.70 mg·kg-1,低于大麦相应的IC50值,可见小麦对这4种物质相对敏感,而其它8种化合物则是大麦相对更敏感。
3 讨论(Discussion)
本研究以小麦和大麦根伸长为评价指标,分析了12种酚类化合物的生态毒性。结果表明,酚类化合物毒性整体趋势为氯酚>甲基酚>苯酚>二元酚,4-硝基酚毒性介于2,4-二氯酚和2-氯酚之间,壬基酚毒性介于间苯二酚和邻苯二酚之间,双酚A和2-萘酚因其对2种作物的IC50值有显著不同,故不适用此规律。 本研究发现在最低设定浓度下,2,4二氯酚、2-氯酚、双酚A、2,4-二甲基酚、间苯二酚和2-萘酚化合物对作物根伸长影响与空白对照没有显著差异;2,4,6-三氯酚表现出显著抑制作用;3-甲基酚、苯酚、壬基酚、4-硝基酚、邻苯二酚均表现刺激根伸长效应。

表3 酚类化合物浓度对小麦根伸长抑制率的回归方程和IC50值Table 3 Regression equation between phenols concentration and inhibition rate of root elongation for wheat and the calculated IC50 values
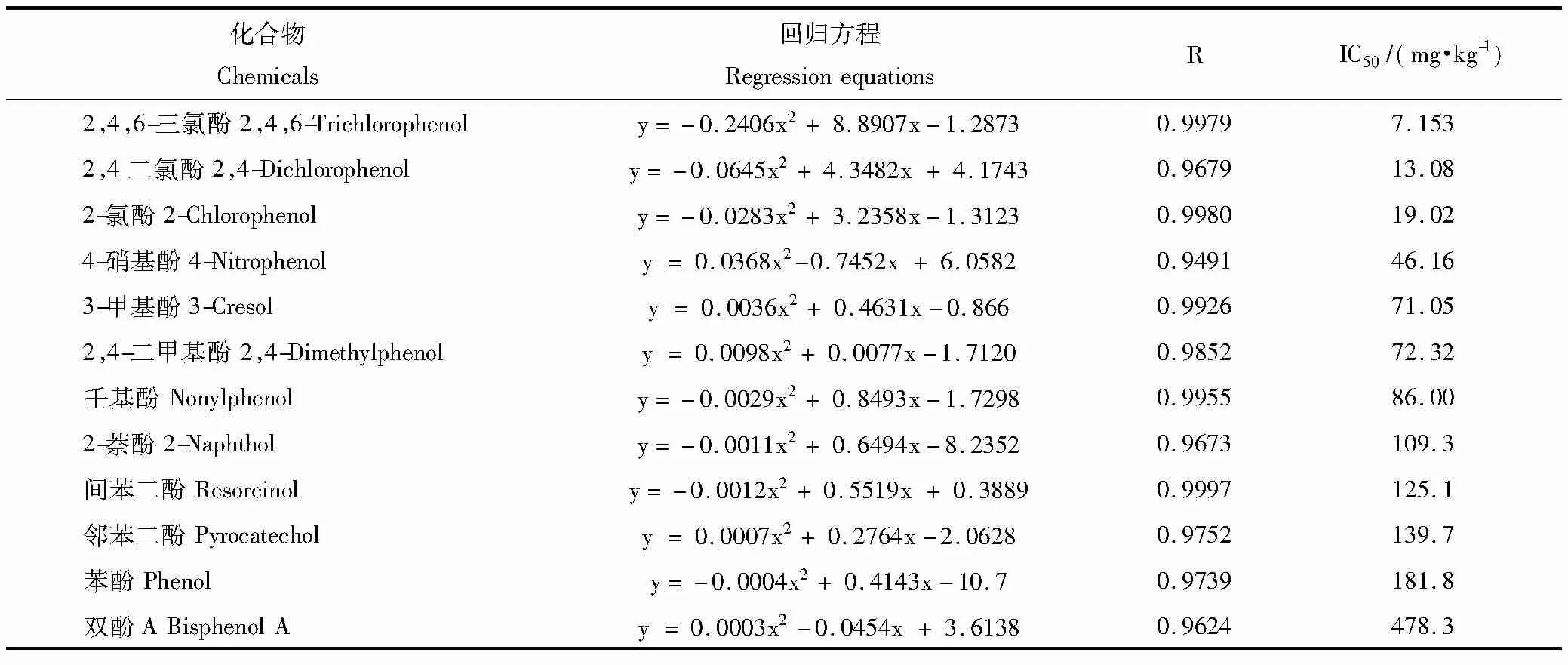
表4 酚类化合物浓度对大麦根伸长抑制率的回归方程和IC50值Table 4 Regression equation between phenols concentration and inhibition rate of root elongation for barley and the calculated IC50 values
而在在高浓度范围内所有酚类均表现出显著抑制作用。这种毒物在较低的浓度下表现出对植物生长的刺激作用,在高浓度时则表现出对植物生长的抑制作用的双相剂量-效应关系被称为毒物刺激效应(hormesis效应),又称毒物兴奋效应。有研究认为化学兴奋效应广泛存在于不同种属、不同结构的化学物质中以及各种生命终点[18-19]。Calabrese等[18]统计了1 450篇文献中约5 600个剂量效应关系,建立了毒物刺激效应库,发现在重金属、抗生素、有机物等化学物质中均存在这种刺激效应。关于毒物刺激效应机制也引起广泛关注,在少有的相关研究报道中,普遍认为低浓度范围内自由基(活性氧)含量升高,可以激活蛋白酶,调节合成以及诱导基因表达等,进而导致细胞增殖,表现为生长刺激效应[20-21]。
4-硝基酚是一种重要的有机合成原料,还是医药工业和染料工业的重要中间体。酚类化合物对枯草芽孢杆菌[22]和大鼠肝细胞[23]的毒性研究比较发现:2,4-二氯酚>4-硝基酚>2-氯酚,本研究以小麦和大麦根伸长的IC50值为评价指标,测得3种化合物对2种作物的毒性大小顺序同样为:2,4-二氯酚>4-硝基酚>2-氯酚,与上述结论相符。
氯酚化合物是芳香族化合物中用途最广、毒性较大、污染较严重的一类化合物,通常包括一个羟基和不同数目的氯原子取代苯环上的氢原子。有研究指出,氯酚的分子结构如氯化的程度以及氯原子和羟基基团的位置对毒性都有较大影响[24]。董克虞等[25]研究了氯代酚类污染物结构与冬小麦、萝卜、油菜等作物毒性的关系,结果表明氯代酚毒性都大于苯酚,其毒性随苯环上氢原子被氯取代个数的增加而增大,且取代个数相同时,不同取代部位的毒性不同,邻位取代毒性最大,与本研究趋势一致。
甲基酚化合物被广泛用作染料、表面活性剂、杀虫剂、农药、酚醛树脂和黏合剂等。目前,国内外已利用鱼类、细菌和海藻等实验生物[26-27]的不同指标,对不同的甲基酚类化合物进行了毒性实验,然而涉及其植物毒性的研究较少。有研究采用月牙藻对苯酚、氯酚和甲基酚类化合物毒性进行分析,发现氯酚和甲基酚毒性均高于苯酚,且相同取代位置上氯酚毒性均高于甲基酚[26],与本研究结论相符。刘征涛等[27]研究甲基酚类化合物对发光菌的毒性,结果表明甲基酚毒性排序为:2,4-二甲基酚>2,6-二甲基酚>2-甲基酚>3-甲基酚。本实验反而是3-甲基酚高于2,4-二甲基酚,可能是因为采用不同生物,小麦及大麦对两种化合物敏感程度和月牙藻不同。
间苯二酚与邻苯二酚作为重要的精细化工中间体,被广泛应用于塑料、农药、抗氧化剂、染料、涂料等精细化工产品的生产中。研究表明,间苯二酚对黄瓜的毒性比苯酚低[28],本研究也得出相同结果。王洪斌等[29]研究间苯二酚对3种海洋微藻的毒性发现随其浓度的升高对藻类的毒性增强,本实验间苯二酚对小麦和大麦的毒性趋势与之一致,且间苯二酚毒性高于邻苯二酚。
壬基酚是非离子表面活性剂壬基酚聚氧乙烯醚的主要的生物代谢产物。目前,研究人员就壬基酚对鱼类、藻类、哺乳动物的毒害作过大量的研究[30-31],但有关其对陆生植物的毒性效应的研究相对很少。Domene等[32]以油菜和黑麦草的发芽率及生物量鲜重为评价指标,对壬基酚毒性进行分析,发现黑麦草的生物量鲜重对其毒性最敏感,IC50值为1 449.1 mg·kg-1。比本实验小麦和大麦根伸长IC50值175.70 mg·kg-1和181.75 mg·kg-1高出8倍之多。
双酚A作为环境激素类物质,在众多工业产品中被广泛使用。有研究以大豆幼苗地上部各组织为评价指标对双酚A毒性进行分析,发现其浓度为1.5 mg·L-1时,对各指标均有促进作用,在浓度为7.0~50 mg·L-1时,随浓度升高,抑制作用增强[33],与本实验结果一致。
2-萘酚是一种典型的酚类化合物,主要用于有机合成原料及染料中间体,也是橡胶防老剂、选矿剂、杀菌剂、防霉剂、防腐剂、防治寄生虫和驱虫药物等的原料。本研究获得2-萘酚对小麦和大麦根伸长IC50值分别为63.59 mg·kg-1和139.71 mg·kg-1。有报道2-萘酚对黄瓜根伸长抑制的IC50值为69.2 mg·L-1[28]。
综上所述,可以得到以下结论:(1)低浓度酚类物质对小麦和大麦苗期生长影响不显著甚至促进根伸长,高浓度酚类物质对其生长存在抑制作用。(2)酚类化合物取代基的种类影响其对小麦和大麦的毒性,整体表现为:氯酚>甲基酚>苯酚>二元酚。氯酚对小麦和大麦的毒性随其氯化程度的增加而增大。(3)小麦对3-甲基酚、双酚A、2-萘酚和壬基酚4种化合物污染较敏感,而对于其他受试化合物则是大麦更敏感。
[1] 朱丽波, 徐能斌, 张颖, 等. 水体中酚类化合物分析方法的比较研究[J]. 中国环境监测, 2012, 28(6): 49-54
Zhu L B, Xu N B, Zhang Y, et al. Comparative study on analytical methods of phenolic compounds in water [J]. Environmental Monitoring in China, 2012, 28(6): 49-54 (in Chinese)
[2] 许文武, 孟菁, 胡威, 等. 5种酚类化合物对3种水生生物的毒性作用[J]. 环境化学, 2011, 30(10): 1751-1756
Xu W W, Meng J, Hu W, et al. The toxic effects of five phenol compounds to three different aquatic organisms [J]. Environmental Chemistry, 2011, 30(10): 1751-1756 (in Chinese)
[3] 宋瀚文, 王东红, 徐雄, 等. 我国24个典型饮用水源地中14种酚类化合物浓度分布特征[J]. 环境科学学报, 2014, 34(2): 355-362
Song H W, Wang D H, Xu X, et al. Occurrence of 14 phenols in 24 typical drinking water sources of China [J]. Acta Scientiae Circumstantiae, 2014, 34(2): 355-362 (in Chinese)
[4] 田芹, 江林, 王丽平. 水体中挥发酚测定中的流动注射分光光度法研究进展[J]. 岩矿测试, 2010, 29(2): 161-168
Tian Q, Jiang L, Wang L P. Progresses and application of flow injection analysis spectrophotometric determination of volatile phenols in water [J]. Rock and Mineral Analysis, 2010, 29(2): 161-168 (in Chinese)
[5] 周文敏, 傅德黔, 孙宗光. 中国水中优先控制污染物黑名单的确定[J]. 环境科学研究, 1991, 4(6): 9-12
Zhou W M, Fu D Q, Sun Z G. Determination of black list of China’s priority pollutants in water [J]. Research of Environmental Sciences, 1991, 4(6): 9-12 (in Chinese)
[6] Banks M K, Schultz K E. Comparison of plants for germination toxicity tests petroleum-contaminated soils [J]. Water, Air, and Soil Pollution, 2005, 167(1): 211-219
[7] Organization for Economic Cooperation and Development (OECD). OECD Guidelines for Testing of Chemicals-Terrestrial Plant Test: Seedling Emergence and Seedling Growth Test [R]. Paris: European Committee, 2006
[8] 晁雷, 周启星, 崔爽, 等. 铅与对二氯苯复合污染对小麦和大白菜种子发芽及幼苗期生长的毒性[J]. 生态学杂志, 2006, 25(8): 944-949
Chao L, Zhou Q X, Cui S, et al. Joint toxicity of Pb2+and PDB on seed germination and seedling growth of Triticum aestiuce and Brassica pekimensis [J]. Chinese Journal of Ecology, 2006, 25(8): 944-949 (in Chinese)
[9] 李彦文, 黄献培, 向垒, 等. 典型微囊藻毒素对白菜种子发芽的生态毒性[J]. 农业环境科学学报, 2012, 31(10): 1879-1883
Li Y W, Huang X P, Xiang L, et al. Ecotoxicity of microcystins to seed germination of Chinese cabbage [J]. Journal of Agro-Environment Science, 2012, 31(10): 1879-1883 (in Chinese)
[10] Liu X L, Zhang S Z, Shan X Q, et al. Toxicity of arsenate and arsenite on germination, seedling growth and amylolytic activity of wheat [J]. Chemosphere, 2005, 61(2), 293-301
[11] Li G K, Yun Y, Li H Y, et al. Effect of landfill leachate on cell cycle, micronucleus, and sister chromatid exchange in Triticum aestivum [J]. Journal of Hazardous Materials, 2008, 155(1-2): 10-16
[12] Jin C X, Chen Q Y, Sun R L, et al. Eco-toxic effects of sulfadiazine sodium, sulfamonomethoxine sodium and enrofloxacin on wheat, Chinese cabbage and tomato [J]. Ecotoxicology, 2009, 18(7): 878-885
[13] Wang M E, Zhou Q M. Effects of herbicide chlorimuron-ethyl on physiological mechanisms in wheat (Triticum aestivum) [J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 190-197
[14] 李敏, 骆永明, 宋静, 等. 污泥-铜尾矿体系下pH、盐分和重金属对大麦根伸长的生态毒性效应[J]. 土壤, 2006, 38(5): 578-583
Li M, Luo Y M, Song J, et al. Ecotoxicologicaleffects of pH, salinity and heavy metals on the barley root elongation in mixture of copper mine tailings and biosolids [J]. Soil, 2006, 38(5): 578-583 (in Chinese)
[15] 范飞, 周启星, 王美娥. 基于小麦种子发芽和根伸长的麝香酮污染毒性效应[J]. 应用生态学报, 2008, 19(6): 1396-1400
Fan F, Zhou Q X, Wang M E. Toxic effect of musk ketone based on the determinations of wheat (Triticum aestivum) seed germination and root elongation [J]. Chinese Journal of Applied Ecology, 2008, 19(6): 1396-1400 (in Chinese)
[16] 吕振娥, 苏玉红, 乔敏. 全氟辛烷磺酸短期暴露对不同作物苗期生长的影响[J]. 生态毒理学报, 2013, 8(5): 695-701
Lv Z E, Su Y H, Qiao M. Influence of short-term exposure of PFOS on seedling growth of different plants [J]. Asian Journal of Ecotoxicology, 2013, 8(5): 695-701 (in Chinese)
[17] 林开敏, 叶发茂, 林艳, 等. 酚类物质对土壤和植物的作用机制研究进展[J]. 中国生态农业学报, 2010, 18(5): 1130-1137
Lin K M, Ye F M, Lin Y, et al. Research advances of phenolic functional mechanisms in soils and plants [J]. Chinese Journal of Eco-Agriculture, 2010, 18(5): 1130-1137 (in Chinese)
[18] Calabrese E J, Blain R. The occurrence of hormetic dose responses in the toxicological literature, the hormesis database: An overview [J]. Toxicology and Applied Pharmacology, 2005, 202(3): 289-301
[19] Calabrese E J, Blain R. Hormesis and plant biology [J]. Environmental Pollution, 2009, 157(1): 42-48
[20] 谢荣, 唐学玺, 李永祺, 等. 丙溴磷影响海洋微藻生长机理的初步研究[J]. 环境科学学报, 2000, 20(4): 473-477
Xie R, Tang X X, Li Y Q, et al. Preliminary study on mechanism of profenofos on marine microalgae proliferation [J]. Acta Scientiae Circumstantiae, 2000, 20(4): 473-477 (in Chinese)
[21] 黄健, 唐学玺, 宫相忠, 等. 低浓度毒物对海洋微藻生长刺激效应的初步研究[J]. 应用生态学报, 2002, 13(11): 1516-1518
Huang J, Tang X X, Gong X Z, et al. Preliminary study on the growth stimulation of marine microalgae stimulated by low level of toxicant [J]. Chinese Journal of Applied Ecology, 2002, 13(11): 1516-1518 (in Chinese)
[22] 丁钰力, 王学江, 贺莹, 等. 基于枯草芽孢杆菌微生物传感器的毒性分析[J]. 中国环境科学, 2010, 30(3): 405-409
Ding Y L, Wang X J, He Y, et al. Acute toxicity analysis based on Bacillus subtilis microbial biosensor [J]. China Environmental Science, 2010, 30(3): 405-409 (in Chinese)
[23] Moridani M Y, Siraki A, O’Brien P J. Quantitative structure toxicity relationships for phenols in isolated rat hepatocytes [J]. Chemico-Biological Interactions, 2003, 145(2): 213-223
[24] 金小伟, 查金苗, 许宜平, 等. 氯酚类化合物对青鱼和细鳞斜颌鯝幼鱼的毒性[J]. 环境科学学报, 2010, 30(6): 1235-1242
Jin X W, Zha J M, Xu Y P, et al. Acute and chronic toxicities of three chlorophenols to Mylopharyngodon piceus and Plagiognathops microlep is at early life stage [J]. Acta Scientiae Circumstantiae, 2010, 30(6): 1235-1242 (in Chinese)
[25] 董克虞, 林春野, 王征. 氯代苯酚结构与农作物毒性关系的研究[J]. 土壤与环境, 2000, 9(2): 96-98
Dong K Y, Lin C Y, Wang Z. Study on the relationship between the structure of chlorobenzene and its toxicity to crops [J]. Soil and Environmental Sciences, 2000, 9(2): 96-98 (in Chinese)
[26] Aruoja V, Sihtmäe M, Dubourguier H C, et al.Toxicity of 58 substituted anilines and phenols to algae Pseudokirchneriella subcapitata and bacteria Vibrio fischeri: Comparison with published data and QSARs [J]. Chemosphere, 2011, 84: 1310-1320
[27] 刘征涛, 张颖, 徐镜波, 等. 烷基酚类化合物对发光菌的定量构效相关研究[J]. 环境科学研究, 2001, 14(6): 5-8
Liu Z T, Zhang Y, Xu J B, et al. Research on QSAR of alkyl phenolic compound to Photobacterium phosphoreum [J]. Research of Environmental Sciences, 2001, 14(6): 5-8 (in Chinese)
[28] Wang X D, Sun C, Wang Y, et al. Quantitative structure-activity relationships for the inhibition toxicity to root elongation of Cucumis sativus of selected phenols and interspecies correlation with Tetrahymena pyriformis [J]. Chemosphere, 2002, 46(2): 153-161
[29] 王洪斌, 花文凤, 李信书, 等. 硝基苯和间苯二酚对3种海洋微藻的毒理效应[J]. 海洋科学, 2013, 37(5): 39-44
Wang H B, Hua W F, Li X S, et al.The toxicological effects of nitrobenzene and dihydroxy-benzene on three kinds of marine microalgae [J]. Marine Sciences, 2013, 37(5): 39-44 (in Chinese)
[30] 管超, 孙志伟, 安民, 等. 壬基酚对球形棕囊藻的生态毒性效应[J]. 生态环境学报, 2011, 20(4): 640-645
Guan C, Sun Z W, An M, et al.The ecological toxic effects of nonylphenol on Phaeocystis globosa [J]. Ecology and Environmental Sciences, 2011, 20(4): 640-645 (in Chinese)
[31] 黄晔, 任华, 孙竹筠, 等. 壬基酚和双酚A对雄性斑马鱼(Danio rerio)卵黄蛋白原mRNA的诱导效应[J]. 生态毒理学报, 2008, 3(3): 274-279
Huang Y, Ren H, Sun Z Y, et al. Vitellogenin mRNA expression in male zebrafish (Danio rerio) induced by nonylphenol and bisphenol A [J]. Asian Journal of Ecotoxicology, 2008, 3(3): 274-279 (in Chinese)
[32] Domene X, Ramírez W, Solà L, et al. Soil pollution by nonylphenol and nonylphenol ethoxylates and their effects to plants and invertebrates [J]. Journal of Soils and Sediments, 2009, 9(6): 555-567
[33] Qiu Z Y, Wang L H, Zhou Q. Effects of bisphenol A on growth, photosynthesis and chlorophyll fluorescence in above-ground organs of soybean seedlings [J]. Chemosphere, 2013, 90(3): 1274-1280
◆
Effect of Short-term Exposure of Phenols on Root Elongation of Wheat and Barley
Wang Shan1,2, Su Yuhong1,*, Qiao Min2
1. College of Chemistry and Chemical Engineering, Xinjiang University, Urumqi 830046, China 2. Research Center for Eco-environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
7 March 2014 accepted 9 May 2014
To evaluate the toxic effects of 12 phenols, the root elongation of wheat and barley after exposure to different concentrations of phenols were investigated. Results showed that root elongation was significantly inhibited with the increasing of phenol concentration. The IC50(half maximal inhibitory concentration of root elongation) was used as an indicator. The IC50values ranged from 12.92 to 231.76 mg·kg-1for wheat and between 7.15 and 478.31 mg·kg-1for barley. For pyrocatechol, significant inhibition of root elongation for wheat was observed only under the highest concentration of 500 mg·kg-1. Wheat was relatively more sensitive to 3-cresol, bisphenol A, 2-naphthol and nonylphenol, while barley was more sensitive to other phenols. In general, the rank of phenols toxicity on wheat was similar to that of barley.
phenols; wheat; barley; root elongation; phytotoxicity
国家高技术研究发展计划(863)项目(2012AA06302);国家自然科学基金(21377154)
王珊(1989-),女,硕士,研究方向为毒理学,E-mail: wangshan870325@163.com;
*通讯作者(Corresponding author), E-mail: yuhong_su2010@sina.com
10.7524/AJE.1673-5897.20140307001
2014-03-07 录用日期:2014-05-09
1673-5897(2015)2-283-07
X171.5
A
苏玉红(1973-),女,博士,教授,主要研究方向为有机污染物在植物体内的迁移、转化、过程及机制,发表学术论文40余篇。
王珊, 苏玉红, 乔敏. 酚类化合物短期暴露对小麦和大麦苗期根伸长的影响[J]. 生态毒理学报, 2015, 10(2): 283-289
Wang S, Su Y H, Qiao M. Effect of short-term exposure of phenols on root elongation of wheat and barley [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 283-289 (in Chinese)

