肾移植术后血和尿中BKV、JCV的检测及意义
尚丽红,游瑞君,武小桐,王振兴,张文艳
(山西省第二人民医院肾移植中心,山西 太原030012)
多瘤病毒属于乳多空病毒属,其中BK病毒(BKV)和JC病毒(JCV)可以使人类致病。在肾移植病人,免疫功能低下[1-3],多瘤病毒的潜伏感染率较高。约有10%~60%的肾移植患者可再次激活多瘤病毒,但不影响肾功能;1%~10%的肾移植患者可发生多瘤病毒相关性肾病(Polyomavirus-associated nephropathy,PVAN)[4]。
BKV是导致PVAN的主要原因[5],与JCV具有75%的序列同源性[6]。据报道[6],大约3%的JCV感染患者可导致PVAN的发生;但如果JCV与BKV同时发生感染的患者,PVAN发生的机率将上升到15%[7]。目前,尚无有效的抗病毒药物。普遍的处理方法是恰当地调整免疫抑制剂的类型和用量以减少病毒的复制,但又增加引发排斥反应的风险。因此,建立快速、有效的检测方法,对PVAN的早期预测和诊断对肾移植患者预后有着重要的临床意义。
目前,常用的检测方法[8,9]有:(1)尿液诱耳细胞(decoy细胞)细胞学检测;(2)尿液、血液中PCR检测DNA;(3)免疫组化检查。近年来,人们推崇无创性检测方法,即采用PCR检测体液病毒DNA作为筛选。利用PCR方法检测这两种病毒具有更高的灵敏度和特异性,对监测肾移植术后患者多瘤病毒的感染、及早发现和治疗都具有指导作用。
因此,本文利用荧光定量PCR(探针法)方法,检测肾移植术后患者体内的BKV和JCV含量,为患者的临床诊断和治疗方案提供重要依据。
1 材料与方法
1.1 研究对象 分别收集山西省第二人民医院肾移植中心2013年6月至2014年5月期间肾移植术后患者尿液标本153例、血液标本155例,其中男性92例,女性61例。所有患者自愿接受BKV、JCV病毒的检测。
1.2 实验标本和试剂 在患者行肾移植术后,收集尿液和血液。具体收集方法如下:(1)血浆样本采集:用无菌注射器在受检者手臂弯曲处或手背处抽取静脉血3~5ml,注入含有EDTA的无菌收集管,立即轻轻颠倒混匀,室温放置不超过4h,待样本自行析出血浆或直接室温1600rpm离心5min分离出血浆,转移到1.5ml灭菌离心管中备用。(2)尿液样本采集:留取中段晨尿10~20ml(不超过容器体积的2/3)密封送检。(3)样本保存:样本应尽快检测,4℃保存不超过24h,-20℃条件下可以保存数月,-70℃条件下可以长期保存,但不可反复冻融。BK/JC病毒核酸定量检测试剂盒(PCR-荧光探针法)购自于北京鑫诺美迪基因检测技术有限公司。
1.3 方法
1.3.1 DNA模板提取 (1)血浆或血清①在1.5ml离心管中加入100μl待测样本,然后加入50μl浓缩液,振荡15s混匀;②将上述离心管放入台式离心机,13000r/min离心10min后取出;③小心吸出150μl上清液(尽量吸干上清液,但不要触及沉淀)并弃去,保留沉淀;④向离心管中分别加入25μl裂解液,然后用吸头对准沉淀所在位置,将其挑离管底,并吹洗5次(关键步骤);⑤振荡15s将沉淀充分打散;⑥100℃条件下温育10min;⑦13000r/min离心10min后将上清液转移至新的离心管,该上清液即纯化的DNA溶液。(2)尿液将尿液送检管振荡15s,彻底混匀(关键步骤);取其中 1ml至 1.5ml离心管中,13000r/min离心10min后弃去上清;加入50μl裂解液,然后用吸头对准沉淀所在位置,将其挑离管底,并吹洗5次(关键步骤);之后参照上述血浆或血清样本操作5~7步骤。
1.3.2 定量PCR检测肾移植患者术后BKV和JCV感染 (1)试剂配制:确定反应数N,N=待检样本数(n)+定量标准品(4)+阴性质控品(1)+1。计算加到反应混合物中的各个试剂的量,分别添加BKVPCR反 应 液 8.5μl×N、BKV 酶 混 合 物 0.5μl×N、BKV PCR 增强剂 10μl×N、BKV 内标模板 1μl×N。 取无菌离心管配制反应体系,试剂全部加入后振荡15秒,2000r/min离心15s。然后将上述混合液 20μl/管分装至PCR反应管中。(2)PCR反应:分别取BKV/JCV阴性质控品、已处理样本和BKV定量标准品I~IV 5μl加入 PCR 反应管中,盖紧管盖,2000r/min离心15s将管壁上的液体全部甩至管底,如有气泡轻弹管壁将气泡弹出,再次离心去除气泡,然后立即进行PCR扩增反应。具体设置程序见表1。

表1 PCR反应条件和程序
1.3.3 PCR数据分析 扩增PCR产物进行凝胶电泳检测目的片段,并分析荧光扩增检测结果。
2 结果
2.1 PCR扩增结果 尿液和血液中BKV-DNA和JCV-DNA PCR扩增产物进行凝胶电泳检测,结果见图1。
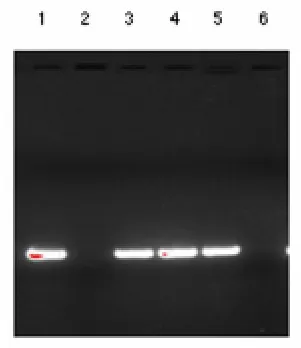
A BKV-DNA PCR扩增产物
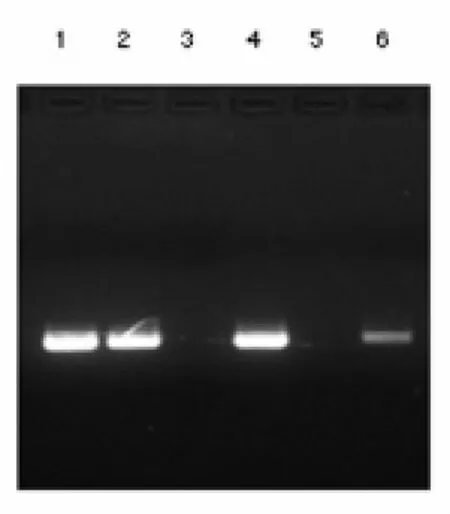
图1 尿液和血液中BKV、JCV的PCR扩增产物
2.2 尿液、血液中BKV-DNA和JCV-DNA定量检测结果 BKV和JCV定量PCR检测,用4个体外纯化质粒作为定量标准品,进行PCR扩增并绘制标准曲线,且标准曲线的相关系数|R|(|r|)均大于0.99。肾移植术后患者BKV和JCV检测的最低检测限为 2×103copies/ml, 线性检测范围为 5×103~5×108copies/ml。
BKV-DNA在尿中的检出率为33.3%(51/153),载量在 1.15×103~6.00×1011copies/ml之间, 血液中检出率 为 34.8%(54/155), 载 量 在 1.3×103~6.06×105copies/ml之间。JCV-DNA在尿中的检出率为31.3%(47/150),载量在 1.15×103~6.00×1011copies/ml之间,血液中检出率为34.6%(54/156),载量在1.3×103~6.06×105copies/ml之间。发生病毒尿症的中位时间为6.1月,发生病毒血症的中位时间为4.9月。定量PCR检测的标准曲线和扩增曲线,见图2。
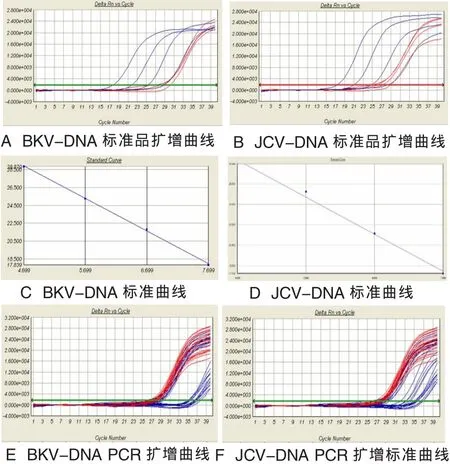
图2 尿液和血液中BKV-DNA、JCV-DNA的PCR扩增曲线
2.3 PCR方法的灵敏度和特异性 BKV尿液和血液样本灵敏度分别为98.31%和99.22%,特异性分别为100%和99.79%;JCV尿液和血液样本灵敏度分别为97.90%和98.60%,特异性均为100%。本检测方法对BKV和JCV检测具有较高的特异性和灵敏度。见表2。

表2 BK病毒和JC病毒检测试剂的灵敏度和特异性
3 讨论
多瘤病毒属乳多空病毒属,目前已发现的多瘤病毒成员有13个,其中BKV、JCV和SV40与人类有关。BKV可引起移植肾功能异常或丧失;JCV可引起进行性多灶白质脑病(PML);SV40则为猿类动物病毒。
在肾移植患者,由多瘤病毒感染的临床表现既可以是病毒尿症,也可以是明显的肾脏、泌尿系异常。如输尿管狭窄、一过性移植肾功能异常、间质性肾炎、出血性膀胱炎等,统称为多瘤病毒相关性肾病 (Polyomavirus-associatednephropathy,PVAN)。10%~60%的肾移植患者在接受抗排斥治疗程中有BKV感染 ,多见于术后3个月内。国外资料显示,肾移植术后44周可有约5%的病例发生PVAN。如无恰当的处理,高达45%的病例在组织学确诊后平均6个月转变为移植肾失功。PVAN的发生可能与免疫抑制维持治疗 (FK506,MMF及雷帕霉素)、肾小管上皮细胞损伤及再生、抗排斥治疗等多因素密切相关。
BK病毒(BKV)属多瘤病毒家族成员,感染后多以潜伏状态存在,当宿主免疫功能低下时可重新激活。BK病毒原发感染发生在儿童时期,一般存在于人体泌尿道及外周血白细胞中,约0.5%~20%感染者会出现BKV激活,导致病毒复制,一般不会引起肾功能损害。但在接受免疫抑制治疗的人群中,特别是肾移植术后患者,BKV再激活率会明显增高,并可能导致BKV相关性肾病(BKV associated nephropathy,BKVAN)。 肾脏是健康人 BKV潜伏感染的主要部位,肾移植术后患者可在尿液中检测到BKV,其中多数患者表现为无症状病毒血症或暂时的移植肾功能异常,偶可在切除的移植肾标本中发现病毒引起的组织损伤。
近年研究发现,初次感染BKV后,BKV常潜伏于肾小管上皮细胞及尿路移行上皮细胞内,当宿主免疫力下降时,BKV可再次激活并开始迅速大量复制。肾移植术后患者BKV再次激活的发生率为10%-68%,约1%-7%的肾移植患者会出现BKVAN,其中50%会导致移植肾失功。
BKV是导致PVAN的主要原因[5],与JCV具有75%的序列同源性。JCV可引起进行性多灶白质脑病(PML),还能在肾脏组织中复制,并通过尿液排出病毒。器官移植后,免疫抑制剂的使用是诱导多瘤病毒激活复制的重要原因,其中,40%以上的肾移植患者可检测到JCV的复制。据报道[6],大约3%的JCV感染患者可导致PVAN的发生;但如果JCV与BKV同时发生感染的患者,PVAN发生的机率将上升到15%[7]。目前,尚无有效的抗病毒药物。普遍的处理方法是恰当地调整免疫抑制剂的类型和用量以减少病毒的复制,但又增加引发排斥反应的风险。因此,建立快速、有效的检测方法,对PVAN的早期预测和诊断对肾移植患者预后有着重要的临床意义。
近年来,相对于其他又创性的检测,人们更推崇无创性检测方法,如采用PCR检测血中病毒DNA。 Toyoda[10]和 Leung[11]等研究证明,BKV 定量PCR测定对于检测BKV感染的发病过程非常有效,并建议联系临床现象和活检所见判断结果。PCR法检测多瘤病毒的敏感性为100%,特异性为88%~95%[12,13],在组织学检查的阴性而PCR阳性的病人最终约有半数以上病人发展为PVAN,在这期间具有数周到数月的窗口期[14]。尿PCR检测的灵敏度和特异性更高,但由于诱耳细胞内病毒包涵体可以是BKV或JCV[15],因此尿脱落细胞检测不能作BKV或JCV的特异性分型。实时荧光定量PCR检测方法被认为是一种检测病毒载量敏感性较高的非侵入性检查。在临床上,对肾移植术后患者血液和尿液中多瘤病毒进行定性、定量实时监测,可作为肾移植术后BKV相关性肾病(BKVAN)和多瘤病毒相关性肾病(PVAN)的早期诊断和筛选的方法。
据报道,肾移植受者Decoy细胞阳性率为29.4%~40.0%,病毒尿症发生率为13.0%~34.7%,病毒血症为5.0%~21.0%。其中病毒尿症的发生率与本文检测结果基因一致,而病毒血症的发生率略高。BKV病毒血症出现的原因可能有以下几种:(1)肾小管上皮细胞的BKV激活后通过小管周的毛细管进入血循环中;(2)血症和尿症是BKV在尿上皮细胞和外周单核细胞各自激活的结果,两者相互伴随发生;(3)BKV病毒尿症至少在一定程度上是血症的一个反映,血症中的病毒经过肾代谢进入尿中BKVAN。血液中BKV的出现反映了BKVAN的发展过程。
目前,关于多瘤病毒的研究报道很多[16],但对肾移植患者的BKV和JCV相关的PVAN、以及移植肾的免疫排斥之间相互作用的研究尚不清楚,相信在不久将来,这方面的研究会成为焦点,为临床治疗不断提供新的理论依据。
[1]Crew RJ,Markowitz G,Radhakrishnan J.Therapeutic options in K virus-associated interstitial nephritis[J].Kidney Int,2006,70(2):399-402.
[2]Randhawa P,Vats A,Shapiro R.Monitoring for polyomavirus BKand JC in urine:comparison of quantitative polymerase chain reaction with urine cytology[J].Transplantation,2005,79(8):984-986.
[3]Kazory A,Ducloux D,Chalopin JM,et al.The first case of JC virus allograft nephropathy[J].Transplantation,2003,76(11):1653-1655.
[4]Randhawa P,Brennan DC.BK virus infection in transplant recipients:an overview and update[J].Am J Transplant,2006,6(9):2000-2005.
[5]Nickeleit V,Klimkait T,Binet IF,et al.Testing for polyomavirus type BK DNA in plasma to identify renal-allograft recipients with viral nephropathy[J].N Engl J Med,2000,342(18):1309-1315.
[6]Singh D,Kiberd B,Alkhudair W,et al.Polyomavirus-induced hemorrhagic cystitis in renal transplantation patient with polyomavirus nephropathy[J].Urology,2006,67(2):423.e11-423.e12.
[7]Nickeleit V,Hirsch HH,Binet IF,et al.Polyomavirus infection of renal allograft recipients:from latent infection to manifest disease[J].J Am Soc Nephrol,1999,10(5):1080-1089.
[8]Bohl DL,Brennan DC,Ryschkewitsch C,et al.BK virus antibody titers and intensity of infections after renal transplantation[J].J Clin Virol,2008,43(2):184-189.
[9]Nickeleit V,Klimkait T,Binet IF,et al.Testing for polyomavirus type BK DNA in plasma to identify renal-allograft recipients with viral nephropathy[J].N Engl J Med,2000,342(18):1309-1315.
[10]Toyoda M,Puliyanda DP,Amet N,et al.Co-infection of polyomavirus BK and cytomegalovirus in renal transplant recipients[J].Transplantation,2005,80(2):198-205.
[11]Leung AY,Chan M,Tang SC,et al.Real-time quantitative analysis of polyoma BK viremia and viruria in renal allograft recipients[J].J Virol Methods,2002,3(1):51-56.
[12]Absan N,Sbab KV,Polyomaviruses:An overview[J].Graft,2002,5(s):9-17.
[13]Isabelle B,Volker N,Hans HH,Polyomavirus infections in transplant recipients[J].Crrent Opinion in organ transplantation,2000,5(3):210-216.
[14]Nickeleit V,Steiger J,Micheal J,BK virus infection after kidney transplantation[J].Graft,2002,5(s):46-57.
[15]Thomas FH,Emest CB,Mcbain BS,et al.Polyoma virus infection after renal transplantation[J].Transplantation,2001,71(7):896-899.
[16]Hirsch HH,Brennan DC,Drachenberg CB,et al.Polyomavirusassociated nephropathy in renal transplantation:interdisci-plinary analyses and recommendations[J].Transplantation,2005,79(10):1277-1286.

