CD137L在食管癌的表达及其临床病理学意义
陈洁,王健
(江西中医药大学附属医院,1、病理科;2、检验科,江西 南昌330006)
CD137/CD137L是除CD28/B7之外的另一对重要的共刺激分子,在免疫细胞之间进行双向信号传导,在免疫应答、抗肿瘤免疫和自身免疫性疾病中起重要作用[1]。CD137L属于肿瘤坏死因子超家族9,是肿瘤坏死因子家族的一员,它主要表达在抗原呈递细胞(APC),成熟的树突状细胞,也可表达于活化的B细胞和巨噬细胞等[2]。CD137信号传导途径既能提供刺激信号激活T细胞,使T细胞活化增殖分泌细胞因子,在诱导这种刺激信号的同时它也介导反向刺激信号,诱导APC活化增殖和分泌细胞因子,这种双向信号传导更加迅速和精确地调节机体的生物反应[3]。研究发现CD137L除了高表达于淋巴或骨髓来源的肿瘤细胞表面,还表达于多种实体瘤细胞株表面,如Colo205、PC3、SKBR3等肿瘤细胞株[4]。本研究采用实时荧光定量PCR和免疫组织化学染色方法检测食管癌组织及癌旁组织中CD137L的表达,探讨CD137L在食管癌组织及癌旁组织中的表达差异及CD137L的表达水平与食管癌的临床病理特征、预后等临床参数之间的关系,揭示CD137L在食管癌发生进展中的作用,为寻找食管癌新的分子标志物及治疗靶点奠定基础。
1 材料与方法
1.1 标本来源 收集华中科技大学同济医院和江西中医药大学附属医院2010年1月至2013年12月期间经手术切除病理诊断为食管鳞状细胞癌的石蜡标本31例,购买食管鳞状细胞癌组织芯片30例,癌旁组织30例。其中男性36例,女性25例,年龄25~78岁,中位年龄59岁。这些标本用于免疫组化实验。收集华中科技大学同济医院2014年5月至12月手术切除的食管癌组织18例,正常食管组织3例,经福尔马林浸泡时间均小于5h,采集未直接接触福尔马林的黄豆大小的癌组织、癌旁组织及正常食管组织,置-80℃冰箱保存。这些标本用于RT-PCR实验。(癌旁组织是指距离癌组织边缘1㎝以上没有癌组织的正常食管组织)
1.2 试剂和方法 采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连结法(SP)检测CD137L在食管癌中的表达。61例食管癌组织标本均经10%甲醛固定,石蜡包埋,4μm连续切片。兔抗人CD137L单克隆抗体和SP试剂盒均购自武汉博士德公司,具体实验步骤按试剂盒操作说明书进行。每次染色均用PBS替代一抗作为阴性对照。组织芯片购自于上海芯超公司。
RT-PCR所用的试剂盒主要有固定组织RNA提取试剂盒、HiFiScript快速去基因组cDNA第一链合成试剂盒、UltraSYBR Mixture等均购自康为世纪生物技术有限公司,Real Time PCR扩增仪为美国ABI公司生产。引物由上海生工合成。
1.3 总RNA提取及cDNA合成 根据固定组织RNA提取试剂盒说明书提取总RNA,提取产物经凝胶电泳确定RNA质量,使用紫外分光光度计检测总RNA的纯度并计算浓度。根据HiFiScript快速去基因组cDNA第一链合成试剂盒说明书合成cDNA。先去除基因组DNA反应,然后逆转录合成cDNA,合成条件 37℃孵育 15min,85℃孵育 5s。合成产物进行下一步荧光定量PCR。
1.4 实时荧光定量PCR β-actin上游引物5′-TGGCACCCAGCACAATGAA-3′, 下 游 引 物 5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′,扩增产物186bp;CD137L 上 游 引 物 5′ -CATGTTTGCGCAGCTGGTG-3′, 下 游 引 物 5′-CGCCGCAGCTCTAGTTGAAAG-3′, 扩增产物 183bp。PCR反应体系总体积为25μl:2xUltraSYBR Mixture(with ROX)12.5μl,上、下游引物混合物 1.5μl,模板cDNA1μl,RNase-Free Water10μl。PCR 反应条件为95℃ 10min,95℃ 15s,60℃ 1min,40cycles。 融解曲线分析 95℃ 15s,60℃ 1min,95℃ 15s,60℃ 15s。 每个cDNA标本进行三次PCR反应,数据以x±s表示,最后结果按公式:2-△△Ct进行计算。
1.5 免疫组化结果判定CD137L蛋白表达定位于细胞质和细胞膜,呈棕黄色或棕褐色颗粒。结果判定:每例标本在高倍镜视野下随意观察5个视野。CD137L染色强度评分为:0 分(没着色),1 分(弱),2 分(中等),3分(强)。 阳性细胞的百分比评分为:0 分(≤1%),1 分(1%~10%),2 分(10%-50%),3 分(≥50)。 将两者分数叠加后分数>4分即为阳性,0-3分为阴性。
1.6 统计学方法 所有数据统计均用SPSS18.0软件完成。所有数据均以均数±标准差(x±s)表示,临床病理参数组间数据采用χ2检验,两组间均数比较采用t检验。P<0.05时各组之间的差异具有统计学意义。
2 结果
2.1 食管癌组织中CD137L的分布和表达CD137L阳性表达定位于细胞质和细胞膜,呈棕黄色或棕褐色颗粒(图1)。在61例食管癌组织中32例阳性,表达率为52.5%,而邻近的癌旁组织中呈阴性表达或者弱阳性的非特异性表达(图2)。
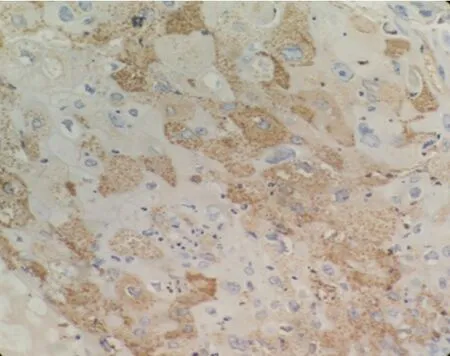
图1 CD137L在食管癌组织中表达阳性(×400)
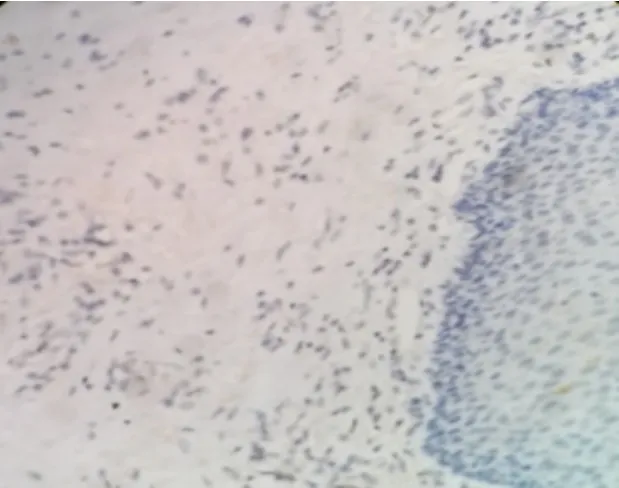
图2 CD137L在癌旁组织中表达阴性(×400)
2.2 与临床病理资料的联系 将61例食管癌患者按性别、年龄、肿瘤分化程度和分期等分组进行分析,结果显示,CD137L的表达在中-高分化的食管鳞状细胞癌中的阳性率高于低分化的鳞状细胞癌(P=0.001),在早期食管癌中的表达高于进展期食管癌(P=0.048),与其他因素无明显相关,P>0.05(表 1)。
2.3 总RNA电泳图 将提取的RNA产物进行1%琼脂糖凝胶电泳,可以清晰地看到28s、18s和5s三条带,说明提取的RNA质量可靠,可以进行下一步的RT-PCR实验。见图3。
2.4 食管癌组织中CD137LmRNA的表达 各实验组CD137L和内参β-actin扩增产物的Ct值见表2。食管癌组织中CD137L mRNA的相对表达量为0.075±0.355,高于癌旁组织的相对表达量0.031±0.383(P<0.05)。

表1 食管癌组织CD137L的表达与临床病理资料的联系

表2 实时荧光定量PCR检测食管癌组织CD137LmRNA的表达
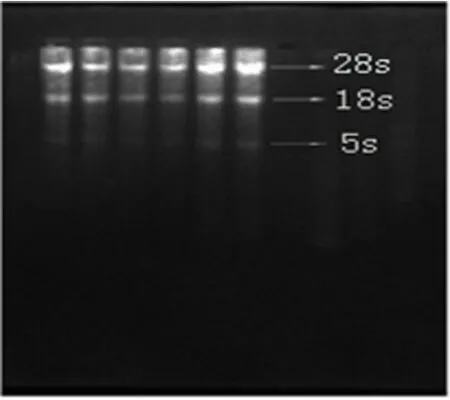
图3 RNA1%琼脂糖凝胶电泳
3 讨论
食管癌是世界上常见的八大恶性肿瘤之一,对人类的健康构成了严重的威胁。研究显示食管癌在国际上的发病率居恶性肿瘤发病率的第九位,死亡率居第八位。而我国是食管癌的高发地区,特别是北方地区河南省一带,以食管鳞状细胞癌最为常见,全国每年发病人数约25.9万人,占全世界每年发病人数的一半以上,发病率居全国恶性肿瘤第五位,死亡率居第四位[5,6]。到目前为止,食管癌的确切病因尚未完全明了,哪些因素与食管癌的生存和预后相关,以及寻找治疗食管癌的新的方法等等都是我们迫切需要解决的问题。
通过对CD137/CD137L信号传导途径研究发现,CD137L作用于CD137后可以通过 TRAF2、TRAF1和MAPK等途径传导细胞内信号,调节细胞因子的释放以及调控单核细胞的增殖和分化等,影响生物学行为。可以促进肿瘤特异性T细胞的活化、增殖,细胞因子分泌增加,保护T细胞免于活化诱导的细胞死亡 (activation-induced cell death,AICD)[7-9]。同时它也介导反向共刺激信号,因此能诱导APC活化增殖和分泌细胞因子。诱导单核细胞分泌细胞因子M-CSF,促进单核细胞的增殖,延长其生存;促进炎性因子 IL-6、IL-8、TNF-α的分泌,抑制抗炎性因子IL-10的分泌等[10]。其中IL-8是炎细胞趋化因子,参与白细胞聚集,也是许多恶性肿瘤的生长因子[11]。T细胞与巨噬细胞通过CD137/CD137L双向作用而相互活化,介导双向信号传导,促进免疫反应。
CD137/CD137L除了表达在免疫细胞也可以表达在其他非免疫细胞。Salih HR等研究发现人的不同癌细胞株和来源于这些细胞株的实体瘤及人体肿瘤细胞上均有CD137L的表达[4]。还有人研究了结肠癌、肺癌、淋巴瘤和肝癌等肿瘤细胞株,发现这些细胞不同程度地表达CD137L[12],这与Salih HR等研究结果一致,说明CD137L在肿瘤细胞上的表达是普遍现象。在人类恶性血液疾病中,CD137L能将生长和生存信号转换给肿瘤细胞而且还能引发抑制肿瘤生长的回应[13,14]。
一般认为在肿瘤的发生和进展过程中,肿瘤组织通常低表达或不表达共刺激分子从而逃避机体免疫系统的识别。多种恶性肿瘤细胞株均表达CD137L,并且该分子具有的生物学活性,能促使肿瘤细胞增殖、分泌IL-8,降低细胞凋亡,减弱抗癌药物的细胞毒效应。另一方面通过结合CD137,能促进T细胞分泌IFN-γ,抑制增殖促进凋亡。CD137L表达于多种人体恶性肿瘤组织细胞表面,CD137则表达于肿瘤组织血管内皮细胞及平滑肌细胞,这一对共刺激分子通过双向信号转导对肿瘤的发生进展及转移可能具有特殊的生物学意义。CD137L作为共刺激分子,因其逆向信号的存在,使它的作用不单是提供第二信号引起T细胞活化的功能[15]。研究表明 CD137L参与肿瘤的发展,通过与CD137交联向表达CD137L的肿瘤细胞传递逆向信号,产生的效应可以是增强免疫,最近关于CD137L在非小细胞肺癌中的作用的研究证明了这一点[16]。也可以使机体肿瘤细胞逃避免疫监视,影响机体免疫功能。有研究显示CD137L是诊断非霍奇金B细胞淋巴瘤的一个新的标记,它的表达可以作为免疫治疗淋巴瘤或其他恶性肿瘤的靶点[17]。因此,进一步研究CD137L参与肿瘤发展的机制使CD137L可能成为抗肿瘤免疫治疗的一个靶标。
本研究中,我们运用免疫组化的方法检测61例食管癌组织及30例癌旁组织CD137L蛋白的表达情况,结果显示食管癌组织中CD137L的表达为阳性,在癌旁组织中的表达为阴性。CD137L表达在食管癌细胞的细胞膜及细胞质,呈棕黄色或棕褐色颗粒。同时运用实时荧光定量RT-PCR方法检测18例食管癌组织及癌旁组织中CD137LmRNA的表达,结果显示癌组织中CD137LmRNA的表达水平高于癌旁组织。CD137L蛋白的表达在中-高分化的食管鳞状细胞癌中的阳性率高于低分化的鳞状细胞癌(P=0.001),在早期食管癌中的表达高于进展期食管癌(P=0.048)。中-高分化的鳞状细胞癌和早期的食管癌的预后均要好于低分化鳞状细胞癌和进展期食管癌。提示CD137L对预后有一定的影响,高表达CD137L的食管癌患者预后要相对较好。作用机制可能是CD137L和CD137相互作用向表达CD137L的肿瘤细胞传递逆向信号产生增强免疫的效应,而具体的作用途径有待进一步研究。由本文的结果推断CD137L可以作为食管癌一个新的诊断标记和治疗靶点。
[1]Taraban VY,Rowley TF,O'Brien L,et al.Expression and costimulatory effects of the TNF receptor superfamily members CD134(OX40)and CD137 (4-1BB),and their role in the generation of anti-tumor immune responses[J].Eur J Immunol,2002,32(12):3617-3627.
[2]Laderach D,Wesa A,Galy A.4-1BB-ligand is regulated on human dendritic cells and induces the production of IL-12[J].Cell Immunol,2003,226(1):37-44.
[3]Cheuk AT,Mufti GJ,Guinn BA.Role of 42 1BB:42 1BB ligand in cancer immunotherapy[J].Cancer Gene Ther,2004,11(3):215-226.
[4]Salih HR,Kosowski SG,Haluska VF,et al.Constitutive Expression of Functional 4-1BB(CD137)Ligand on Carcinoma Cells[J].J Immunol,2000,165(5):2903-2910.
[5]Ferlay J,Bray F,Pisani P,et al.Global cancer statistics[J].CA Cancer J Clin,2005,55(2):74-108.
[6]赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.
[7]Lee SW,Croft M.4-1BB as a therapeutic target for human disease[J].Adv Exp Med Biol,2009,647:120-129.
[8]Thum E,Shao Z,Schwarz H.CD137,implications in immunity and potential for therapy[J].Front Biosci(Landmark Ed),2009,14:4173-4188.
[9]Wang C,Lin GH,McPherson AJ,et al.Immune regulation by 4-1BB and 4-1BBL:complexities and challenges[J].Immunol Rev,2009,229(1):192-215.
[10]Drenkard D,Becke FM,Langstein J,et al.CD137 is expressed on blood vessel walls at sites of inflammation and enhances monocyte migratory activity[J].FASEB J,2007,21(2):456-463.
[11]Brat DJ,Bellail AC,Van Meir EG.The role of interleukin-8 and its receptors in gliomagenesis and tumoral angiogenesis[J].Neuro Oncol,2005,7(2):122-133.
[12]Wang Q,Zhang P,Zhang Q,et al.Analysis of CD137 and CD137L Expression in Human Primary Tumor Tissues[J].Croat Med J,2008,49(2):192-200.
[13]Gullo C,Koh LK,Pang WL,et al.Inhibition of proliferation and induction of apoptosis in multiple myeloma cell lines by CD137 ligand signaling[J].PLoS One,2010,5(5):e10845.
[14]Baessler T,Charton JE,Schmiedel BJ,et al.CD137 ligand mediates opposite effects in human and mouse NK cells and impairs NK-cell reactivity against human acute myeloid leukemia cells[J].Blood,2010,115(15):3058-3069.
[15]Shao Z,Schwarz H.CD137 ligand,a member of the tumor necrosis factor family,regulates immune responses via reverse signal transduction[J].J Leukoc Biol,2011,89(1):21-29.
[16]Qian Y,Pei D,Cheng T,et al.CD137 ligand-mediated reverse signaling inhibits proliferation and induces apoptosis in non-small cell lung cancer[J].Med Oncol,2015,32(3):44.
[17]Zhao S,Zhang H,Xing Y,et al.CD137 ligand is expressed in primary and secondary lymphoid follicles and in B-cell lymphomas:diagnostic and therapeutic implications[J].Am J Surg Pathol,2013,37(2):250-258.

