超声辅助双水相体系提取花椒果皮总生物碱研究
张丙云,魏俊青,郭 涛,黄 艳,王 雅,马建苹,王鸣刚,赵 萍,孙 莉,谢鹏燕,何 蕾
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
超声辅助双水相体系提取花椒果皮总生物碱研究
张丙云,魏俊青,郭 涛*,黄 艳,王 雅,马建苹,王鸣刚,赵 萍,孙 莉,谢鹏燕,何 蕾
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
目的:优化超声辅助双水相体系提取花椒果皮总生物碱工艺。方法:以酸性染料比色法分析,使用超声辅助正丙醇-磷酸氢二钾双水相体系提取花椒果皮总生物碱,以提取时间、超声功率和液固比为因素,以得率为响应值,以Box-Benhnken原理探索最佳工艺。结果:最佳提取工艺为:提取时间46min,超声功率250W,液固比22∶1,此条件下总生物碱得率为18.87mg/g,比回流提取法总生物碱得率高38.75%,纯度高39.64%。结论:优化出一条全新的花椒果皮总生物碱最佳提取工艺过程,为花椒果皮总生物碱的进一步开发奠定了良好的基础。
花椒,双水相体系,生物碱,酸性染料比色法,超声辅助提取
花椒(Zanthoxylumbungeanum)属于芸香科花椒属(Zanthoxylum)植物,是该属植物的代表植物,也是我国特有的食用香辛料之一[1-2]。花椒的果实、枝、叶等均可入药。药典记载,花椒有“温中止痛,杀虫止痒”的功效[3]。花椒在我国分布广泛,主要栽培品种有大红袍、大花椒、白沙椒等[4]。
生物碱是花椒属的主要活性成分之一。该属生物碱主要有四大类:喹啉衍生物类(Ⅰ)、异喹啉衍生物类(Ⅱ)、苯并菲啶衍生物类(Ⅲ)和喹诺酮衍生物类(Ⅳ)。已有研究证实花椒果皮中生物碱主要有白屈菜红碱、香草木宁碱、白鲜碱、茵芋碱等[5-6]。目前对该属植物生物碱类成分的研究报道很多,这些生物碱成分具有抑菌、抗癌、解痉等多种活性。
双水相萃取技术(aqueous two-phase extraction,ATPE)是将两种化学结构不同的亲水性聚合物或聚合物和无机盐在水中形成互不相溶的两相[7-8],具有分相时间短,萃取条件温和,有机溶剂残留少,对目标产物选择性强,易放大,可以实现分离和富集一步完成等特点[9-10],广泛用于蛋白质、氨基酸、酶、核酸等生物活性物质的分离纯化[11-13]。近年来,双水相萃取技术逐渐应用到天然产物的分离纯化中[14]。
为了提高花椒果皮中总生物碱的提取率和纯度,笔者以超声辅助双水相体系响应面分析法对总生物碱提取工艺进行优化研究,为其进一步开发提供实验依据。
1 材料与方法
1.1 材料与仪器
花椒(Zanthoxylumbungeanum)采集于陕西省凤翔县唐村乡,经郭涛副教授(兰州理工大学)鉴定为植物花椒(Zanthoxylumbungeanum)的果皮。
白鲜碱标准标准品 纯度>98%,上海盛中医药化工有限公司;溴百里香草酚蓝 天津市光复精细化工研究所;磷酸氢二钾,磷酸氢二钠,柠檬酸均为分析纯 天津市百世化工有限公司;正丙醇,甲醇,氯仿试剂均为分析纯 天津市富宇精细化工有限公司。
KH-600DE型数控超声波 昆山禾创超声仪器有限公司;SHB-IIIA型循环水式多用真空泵 郑州长城科工有限公司;RE52-86A旋转蒸发器 上海亚荣生化仪器厂;AB104-N电子分析天平 梅特勒-托利多仪器有限公司;Varian Cary 50紫外可见分光光度计 美国瓦里安技术中国有限公司。
1.2 实验方法
1.2.1 标准溶液的制备 精密称取白鲜碱标准品4.0mg,用甲醇溶解定容于100mL容量瓶,配制成0.04mg/mL的白鲜碱标准品溶液。精密吸取标准品溶液0.1、0.2、0.3、0.4、0.5mL分别置10mL容量瓶中,加甲醇定容,摇匀。配制成0.4、0.8、1.2、1.6、2.0μg/mL的标准系列溶液。
1.2.2 酸性染料比色法条件选择
1.2.2.1 检测波长的选择 精密吸取标准品溶液0.5mL于分液漏斗中,加入pH=6.0的磷酸氢二钠-柠檬酸缓冲溶液5mL,溴百里香草酚蓝溶液2mL及氯仿10mL,剧烈摇振后静置,以氯仿作空白,用紫外可见分光光度计在200~800nm处全波长扫描。
1.2.2.2 酸性染料用量的选择 精密吸取标准品溶液0.5mL于分液漏斗中,加入pH=6.0的磷酸氢二钠-柠檬酸缓冲溶液5mL,分别加入1.0、2.0、3.0、4.0、5.0、6.0mL的溴百里香草酚蓝溶液及氯仿10mL,剧烈摇振后静置,以氯仿作空白,在415nm波长检测。
1.2.2.3 缓冲液pH的选择 精密吸取标准品溶液0.5mL于分液漏斗中,分别加入pH为4.0、5.0、6.0、7.0、8.0的磷酸氢二钠-柠檬酸缓冲溶液5mL,溴百里香草酚蓝溶液5mL,氯仿10mL,剧烈摇振后静置,以氯仿作空白,在415nm波长检测。
1.2.2.4 缓冲液用量的选择 精密吸取标准品溶液0.5mL于分液漏斗中,分别加入体积为1、2、3、4、5mL的pH=5.0的磷酸氢二钠-柠檬酸缓冲溶液,溴百里香草酚蓝溶液5mL及氯仿10mL,剧烈摇振后静置,以氯仿作空白,在415nm波长检测。
1.3 标准曲线的绘制
分别吸取浓度为0.4、0.8、1.2、1.6、2.0μg/mL的白鲜碱标准系列溶液0.5mL,加入pH=5.0的磷酸氢二钠-柠檬酸缓冲溶液3mL,加入5.0mL的溴百里香草酚蓝溶液及氯仿10mL,剧烈摇振后静置,以氯仿作空白,分别在415nm处测定其吸光度。以白鲜碱标准溶液浓度(μg/mL不用标出)为横坐标(X),吸光度为纵坐标(Y)作图。
1.4 双水相体系优化
在前期预实验的基础上,选择正丙醇(NPA)/磷酸氢二钾(K2HPO4)双水相体系。通过单因素实验,考察不同比例的正丙醇(7%、10%、18%、21%、24%、27%)和磷酸氢二钾(12%、16%、19%、22%、25%、28%)对总生物碱得率的影响,确定最优(NPA)/(K2HPO4)体系。
1.5 单因素实验设计
1.5.1 提取时间对花椒果皮总生物碱得率的影响 准确称取1g花椒果皮粉末(液固比20∶1),加入双水相体系中于40℃恒温水浴下分别超声(200W)提取15、30、45、60、75min,过滤,滤液离心分相,测其吸光度值,计算得率。
1.5.2 提取功率对花椒果皮总生物碱得率的影响 准确称取1g花椒果皮粉末(液固比20∶1),加入双水相体系中于40℃恒温水浴下超声提取45min,提取功率分别为100、150、200、250、300W,过滤,滤液离心分相,测其吸光度值,计算得率。
1.5.3 液固比对花椒果皮总生物碱得率的影响 准确称取1g花椒果皮粉末,液固比分别为5∶1,10∶1,15∶1,20∶1,25∶1,加入双水相体系中于40℃恒温水浴下分别超声(200W)提取45min,过滤,滤液离心分相,测其吸光度值,计算得率。
1.6 生物碱的得率测定
按照响应面实验表配制双水相体系,称取花椒果皮粉末10.00g置于双水相体系中,于常温下进行超声提取。提取后将提取液置于分液漏斗中静置分层,将上层正丙醇层置于圆底烧瓶中,减压浓缩,得到粗提物浸膏。将所得粗提物浸膏用甲醇溶解,按照上述酸性染料比色法的方法,在415nm处测定各条件下样品的吸光度值,并计算提取出的生物碱得率。

1.7 响应面分析实验
根据Box-Benhnken中心组合设计的实验原理,选择提取功率、提取时间、液固比3个因素,进行3因素3水平共17个实验点的响应面分析实验,使用Design-expert software 8.05进行数据分析,求出数学模型,进而得到最佳的提取工艺条件,响应面实验因素与水平编码如表1。
1.8 比较研究
称取花椒果皮粉末10.00g置于500mL圆底烧瓶中,按照1.7所得的最优工艺进行双水相提取,获得双水相萃取物浸膏。

表1 响应面因素水平表Table 1 Independent variables and their actual values
称取花椒果皮粉末10.00g置于250mL圆底烧瓶中,加100mL 95%乙醇回流提取2h,提取两次,合并提取液,过滤,减压浓缩,得到乙醇粗提物浸膏。
测定并比较双水相萃取物浸膏和乙醇粗提物浸膏总生物碱的提取率和纯度。

2 结果与分析
结果如图1,显示白鲜碱标准品在415nm处有最大吸收,故选定415nm为检测波长。而在此波长下,用最大吸收光度值来确定酸性燃料用量、缓冲液pH、缓冲液用量,实验结果分别是5mL、5、3mL。酸性染料比色法在测定总生物碱的过程中,随着时间的延长,吸光度值不稳定,实验发现在2h内,吸光度值是稳定的[15]。因此,在整个测定吸光度值的实验过程中,需要控制其反应时间保持一致,且尽量控制在2h内测定吸光度。
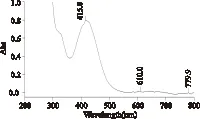
图1 白鲜碱全波长扫描图谱Fig.1 The maximum absorption wavelength of dictamnine(200~800nm)
2.1 标准曲线的绘制
在415nm处测定不同浓度白鲜碱的吸光度,以白鲜碱标准溶液浓度(μg/mL不用标出)为横坐标(X),吸光度为纵坐标(Y)作图,计算得出回归方程:Y=0.2375X+0.4312,相关系数R2=0.9936。本方程在0.4~2.0μg/mL线性关系良好,可用于花椒果皮中生物碱含量的测定。
2.2 NPA/K2HPO4的质量分数的选择
K2HPO4和NPA在一定的范围内可组成双水相,据此分别考察K2HPO4和NPA含量对总生物碱得率的影响。结果图2所示,在考察NPA质量分数对总生物碱得率影响的单因素中,随着NPA质量分数的增大,花椒总生物碱得率越高,在27%时达到最大值。当NPA质量分数超过27%时,体系中K2HPO4出现析出现象。所以NPA质量分数选择为27%。

图2 正丙醇浓度对总生物碱得率的影响Fig.2 Effects of the butanol concentration on the extraction rate of total alkaloid
在NPA质量分数固定为27%的条件下,选择不同质量分数的K2HPO4组成的双水相体系,考察K2HPO4质量分数对花椒果皮总生物碱得率的影响。结果如图3,随着K2HPO4质量分数的增大,花椒果皮总生物碱得率呈现先增大后减小的趋势,19%时达到最大值。所以K2HPO4质量分数选择为19%。

图3 磷酸氢二钾浓度对总生物碱得率的影响Fig.3 Effects of the K2HPO4 concentration on the extraction rate of total alkaloid
2.3 响应面分析实验结果
根据单因素实验结果,最佳的提取功率200W,提取时间45min,液固比20∶1。在响应面实验中选取这3个因素作为自变量,以花椒果皮总生物碱得率为响应值。Box-Benhnken实验设计与结果如表2所示。

表3 回归模型方差分析Table 3 Test results of significance for regression coefficient
注:*.p<0.05,差异显著;**.p<0.01,差异极显著。
2.4 显著性检验
用软件Design-Expert 8.05对所得数据进行回归分析,分析结果如表3所示。对各因素进行多元回归拟合和二项式拟合,得到花椒果皮总生物碱得率(Y)对三个因素(X)回归方程:
Y=-29.83175+0.065665X1+0.83193X2+0.85172X3-2.00000×10-4X1X2+6.25000×10-4X1X3- 1.73333×10-3X2X3+6.39000×10-5X12- 8.16778×10-3X22- 0.021503 X32(R2=0.9889)
为检验方程的显著性,对该模型回归方程进行方差分析,结果如表3,模型p<0.0001,该模型极显著,方程失拟误差p>0.05,不显著,说明该回归模型与实际实验拟合良好,证明应用响应面法优化的超声辅助双水相体系提取花椒果皮总生物碱是可行的。回归方程各项的方差分析结果表明,X1,X22,X32,达到极显著水平(p<0.01)。各因素对花椒果皮总生物碱得率的影响是:X1对花椒果皮总生物碱得率具有显著影响,X2,X3对花椒果皮总生物碱得率有影响,但不显著。

表2 响应面实验设计表Table 2 Experimental design of response surface methodology
2.5 响应面及等高线分析
X1,X2,X3各因素对花椒果皮总生物碱纯度影响的响应面和等高线图,反映了两两因素之间的交互作用及对总生物碱得率的影响。等高线的形状可反映交互作用的强弱,越趋于椭圆形表示两因素交互作用越强,越趋于圆形则与之相反。用Design-Expert 8.05分析得到,提取功率(X1)和液固比(X3),提取时间(X2)和液固比(X3),提取功率(X1)和提取时间(X2)两两交互作用较弱。而响应面的极值点对应等高线椭圆中心点,结合响应面图与等高线图发现,提取功率(X1)对花椒果皮生物碱的纯度有显著影响。本文中各因素对花椒果皮总生物碱影响的响应面图如图4。
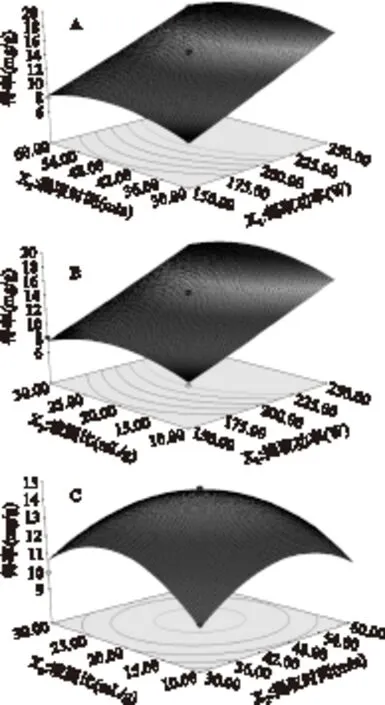
图4 提取功率、提取时间和液固比 对花椒果皮总生物碱得率的影响Fig.4 The extraction power,extraction time and ratio of solvent the effect on the extraction rate of total alkaloid from the peel of Z. bungeanum
2.6 工艺条件验证及提取法比较
通过软件分析,求得预测的生物碱纯度的最优工艺条件为:提取功率250W,提取时间45.59min,液固比21.6∶1,此时生物碱的得率最高,为19.28mg/g。
为检验其结果的可靠性,并考虑到实验室仪器及条件的限制,将条件修正为提取功率250W,提取时间46min,液固比22∶1,按照此条件,在常温下重复提取三次取平均值,结果如表4,生物碱得率平均值18.87mg/g,接近预测值,与预测值误差为2.2%(<3%),表明该数学模型预测性较好。由此可见,双水相法对生物碱的提取优于常规的乙醇回流法。
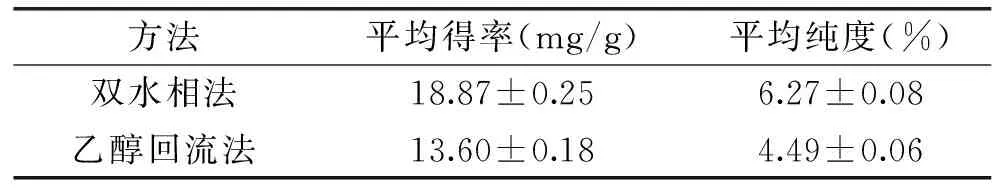
表4 两种提取方法的比较研究Table 4 A comparative study between two extractions method
由结果可知,确定的最优提取工艺与响应面实验中的最高值接近,且重复性较好,说明确定的工艺比较合理。
3 讨论
双水相萃取体系与传统的有机溶剂萃取体系相比,它对于生物大分子物质具有活性损失小、操作条件温和及有机溶剂残留少等优点。而选取磷酸氢二钾体系主要在于分相迅速,回收率高;过程集成,双水相萃取既达到了纯化的目的,又浓缩了料液。实验结果表明正丙醇(27%),磷酸氢二钾(19%)时,可获得稳定的双水相体系和较高的花椒果皮总生物碱得率。
确定了超声波辅助双水相提取花椒果皮总生物碱的最佳条件为:提取时间46min,超声功率250W,液固比22∶1,此条件下总生物碱得率为18.87mg/g。
选择了超声波辅助双水相体系提取花椒果皮总生物碱比传统的回流提取方法得率提高了38.75%,纯度提高了39.64%,既节约了提取时间,又减少了损失,比传统的回流提取法有着更好的优势和前景,对其开发利用具有一定指导意义。
[1]中科院中国植物志编辑委员会,中国植物志[M].第43卷,二分册. 北京:科学出版社,1997:34-35.
[2]高逢敏,蒲彪.青花椒果皮香气成分的抑菌性研究[J].四川食品与发酵,2007,43(3):28-30.
[3]杜丽君,郑国华,牛先前. 花椒果皮属植物的药理研究进展与展望[J].热带作物学报,2013,34(5):995-999.
[4]徐昭玺.百种调料香料类药用植物栽培[M]. 北京:中国农业出版社,2003:354-357.
[5]石雪萍,李小华,杨爱萍.花椒果皮有效成分以及开发利用研究进展[J].中国调味品,2012,37(7):6-9.
[6]赵秀玲. 花椒果皮的化学成分、药理作用及其资源开发的研究进展[J].中国调味品,2012,37(3):1-5.
[7]Shi J J,Liu Y Z,Yu H B. Technology and application of new type solvent extraction[J]. Journal of Chemical Industry & Engineering,2005,26(5):15-18.
[8]郭辉,张中玉,罗宇倩,等.双水相萃取法分离竹叶黄酮的工艺研究[J].氨基酸和生物资源,2012,34(2):24-28.
[9]Rose P A J,Azevedo A M,Sommerfeld S,etal. Aqueous Two-phase Extraction as a Platform in the Biomanufacturing Industry:Economical and Environmental Sustainability[J]. Biotechnol Adv,2011,29(6):559-567.
[10]刘小琴,张薇,范华均,等.双水相萃取分离苦参生物碱[J].过程工程学报,2012,12(4):641-647.
[11]Asenjo J A,Andrews B A. Aqueous Two-phase Systems for Protein Separation:A Perspective[J]. J Chromatogr A,2011,1218(49):8826-8835.
[12]Gisela Tubio,Guillermo A Picó,Bibiana B Nerli. Extraction of trypsin from bovine pancreas by applying polyethyleneglycol/sodium citrate aqueous two-phase systems[J]. Journal of Chromatography B,2009,877(3):115-120.
[13]Babak Mokhtarani,Ramin Karimzadeh,Mohammad Hassan Amini,etal. Partitioning of Ciprofloxacin in aqueous two-phase system of poly(ethylene glycol)and sodium sulphate[J]. Biochemical Engineering Journal,2008,38:241-247.
[14]谭志坚,李芬芳,邢健敏.双水相萃取技术在分离、纯化中的应用[J].化工技术与开发,2010,39(8):29-35.
[15]高晓娟,马志刚,董琳,等.响应面法优化毛铁棒锤根部生物碱提取工艺[J].中药材,2010,33(10):1628-1632.
Aqueous two phase system coupled with ultrasound for the extraction of total alkaloid from the peel ofZanthoxylumbungeanum
ZHANG Bing-yun,WEI Jun-qing,GUO Tao*,HUANG Yan,WANG Ya,MA Jian-ping,WANG Ming-gang,ZHAO Ping,SUN Li,XIE Peng-yan,HE Lei
(School of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
Objective:In this study the use of an aqueous two phase system coupled with ultrasound for the extraction of total alkaloid from the peel ofZanthoxylumbungeanumwas evaluated and optimized using response surface methodology. Method:Using acidic dye colorimetry analysis methods and the ultrasonic coupling with propanol-potassium hydrogen phosphate aqueous two-phase system for extracting total alkaloid from the peel ofZ.bungeanumwas studied. The extraction of extraction time,extraction power and ratio of solvent to material were selected as response factors,the extraction rate of total alkaloid was selected as response value. According to Box-Benhnken design,three factors and three levels to optimize conditions on extraction ratio of total alkaloid were obtained. Result:The optimum extraction process of total alkaloid was:time of 46min,extraction power of 250W,solvent-material ratio of 22∶1 at which the highest extraction rate of total alkaloid was 18.87mg/g. The comparative study showed that average extraction rate and the average purity were 38.75% and 39.64% higher than the ethanol extraction method. Conclusion:Ultrasonic coupled with aqueous two-phase system extraction technology of total alkaloid from the peel ofZ.bungeanumhas the advantage of high extraction rate,high purity,and the method was reliable,and provided the basis for its further development.
Zanthoxylumbungeanum;aqueous two-phase system;alkaloid;acidic dye colorimetry analysis methods;ultrasound-assisted extraction
2014-03-27
张丙云(1968-),女,硕士,副教授,主要从事食品保鲜研究。
*通讯作者:郭涛(1976-),男,博士,研究方向:天然食药资源的开发研究。
TS284.2
B
1002-0306(2015)01-0202-05
10.13386/j.issn1002-0306.2015.01.033

