枇杷叶黄酮提取物的抗氧化作用研究
付晓丹,汤春丰,刘壤莲,彭凯莉,蒋和体
(西南大学食品科学学院,重庆 400715)
枇杷叶黄酮提取物的抗氧化作用研究
付晓丹,汤春丰,刘壤莲,彭凯莉,蒋和体*
(西南大学食品科学学院,重庆 400715)
分别研究枇杷叶不同部位提取物中黄酮含量及黄酮提取物的抗氧化活性。采用超声法分别提取枇杷叶不同部位的黄酮类物质,用比色法测定含量。采用Schaal烘箱法,以过氧化值为指标研究了黄酮提取物对猪油的抗氧化效应,并采用DPPH自由基和ABTS自由基清除体系评价总黄酮的抗氧化能力。结果表明:枇杷叶尖部位的黄酮含量最高为(5.79±0.03)mg/g。在所研究的浓度范围内,枇杷叶黄酮对猪油具有一定的抗氧化作用,且随着其剂量的增加而增强;枇杷叶黄酮对DPPH自由基和ABTS自由基都具有较强的清除能力,在一定浓度范围内,清除自由基能力与浓度存在量效关系。
枇杷叶,黄酮,抗氧化,自由基,脂肪氧化
枇杷叶为蔷薇科常绿小乔木植物枇杷EriobotryaJaponica(Thunb.)Lindl.的叶,枇杷在我国种植广泛,主要分布于广东、江苏、浙江、福建、湖北等地[1]。目前,枇杷种植主要是采摘果实,而大多数的枇杷叶一般不加以利用,造成资源浪费。 国内外对枇杷叶的化学成分和药理作用进行了较多研究,已成功分离了挥发油、三萜类、倍半萜类、黄酮类和多酚等活性成分[2-4]。黄酮类化合物苷元主要是山奈酚、槲皮素,糖苷由1~3个单糖组成,此外还发现乙酰化黄酮苷存在[5]。近年来在枇杷叶总黄酮的提取工艺[6-8],黄酮苷元的含量测定[9-10]等方面做了大量研究。黄酮类物质具有抗肿瘤、抗病毒、降血糖、保肝利胆、清除氧自由基、增强机体免疫功能等作用[11-13]。其中最重要的生物活性是黄酮类化合物的抗氧化作用即减少自由基的产生和清除自由基[14]。因此,对枇杷叶黄酮提取物抗氧化作用的开发利用,具有重要的经济价值和社会效益。枇杷叶黄酮抗氧化性虽有报道,但都是单方面研究其抗油脂氧化活性[15-17]或体外清除自由基能力[7,10,18-21]。本实验用超声乙醇法从枇杷叶原料中提取黄酮化合物(loquat leaf flavonoids,以下用“LF”表示),并研究了枇杷叶不同部位提取物中黄酮含量及枇杷叶黄酮提取物的抗氧化能力,旨在为系统开发枇杷叶黄酮成分的应用提供基础。
1 材料与方法
1.1 材料与设备
枇杷叶 7、8月份采集于西南大学校内;猪油 市售(所购新鲜猪板油湿法熬制)。
芦丁标准品 中国药品生物制品检定;1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;二丁基羟基甲苯(BHT) 食品级;2,2-联氮基双(3-乙基苯并噻唑林-6-磺酸)二铵盐(ABTS)、硫酸亚铁、水杨酸、硫代硫酸钠、冰醋酸、氯仿、抗坏血酸(VC)、95%乙醇等试剂 均为国产分析纯。
电子天平 奥豪斯公司;超声波细胞粉碎机 宁波新芝科器研究所;WFJ 7200型可见光光度计 尤尼柯(上海)仪器有限公司;DHG-9240A电热恒温鼓风干燥箱、HWS-26电热恒温水浴锅 上海齐欣科学仪器有限公司;HU-6150D超声波清洗器 包头科发公司;SHB-Ⅲ循环水式多用真空泵 巩义市英峪华科仪器厂;RE-52A旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 枇杷叶不同部位LF提取
1.2.1.1 枇杷叶干燥 将采集的新鲜枇杷叶片,用自来水将其表面皱褶及背面绒毛等杂物冲洗干净后,晾至表面无水分,置于恒温热风干燥箱中,在65℃下干燥6h。将干燥后的一部分枇杷叶按照叶尖、叶中和叶柄大致均匀分成三部分。分别把剩余全叶以及不同部位的枇杷叶粉碎成40目干粉贮于磨口瓶中置干燥器内备用。
1.2.1.2 LF超声提取 分别精密称取枇杷叶全叶、叶尖、叶中、叶柄的干粉5g,置于250mL具塞锥形瓶中,加入50mL 95%乙醇,超声波提取温度70℃,提取时间2.5h,抽滤。滤渣再加40mL 95%乙醇,超声波温度70℃,提取1h,抽滤,合并两次滤液。滤液用旋转蒸发器浓缩至约10mL为止,转移至100mL容量瓶中,用60%乙醇稀释至刻度,得样品液,待测[22]。
1.2.2 枇杷叶不同部位LF含量测定
1.2.2.1 标准曲线的绘制 准确称取120℃干燥恒重的芦丁5.0mg,用60%微热乙醇定容至50mL,摇匀得浓度为0.1mg/mL的标准样液。准确吸取标准应用液0.0、1.2、2.4、3.6、4.8、6.0、7.2mL于6只具塞试管中,加30%乙醇使成5mL,加5%的NaNO2溶液0.3mL,摇匀,放置6min[23]。加10% Al(NO)3溶液0.3mL,摇匀,放置6min,加4%的NaOH溶液4mL,加水0.4mL,摇匀,放置10~15min。于510nm波长处测定吸光度,绘制浓度C(μg/mL)与吸光度A的标准曲线。
1.2.2.2 不同部位LF含量测定 精密吸取枇杷叶不同部位的LF提取液1.0mL按照1.2.2.1方法,在510nm波长处测定样品吸光度A,代入1.2.2.1回归方程,计算得到LF含量。
1.2.3 不同部位LF对猪油的抗氧化性实验
1.2.3.1 油脂试样的处理 称取50g油脂置于烧杯中,分别将按照1.2.1方法制得的枇杷叶叶尖、叶中、叶柄的LF粗提物按照油重的0.05%、0.10%、0.50%进行添加。以油重的0.02%添加BHT为阳性对照组,同时选用抗坏血酸(VC)作为增效剂,与枇杷叶不同部位的0.10%LF粗提物按一定比例混合均匀一起加入基质油中,以测定其协同抗氧化作用。另以只加50g油脂的处理作为空白对照,每组实验均设3次重复组[15]。
具体添加量如表1所示。参照Schaal箱贮存实验法[22],将已加入抗氧化物质的油脂试样在50℃下加热搅拌使油脂与添加物充分融化均匀,于(60±0.5)℃的恒温烘箱中,每隔12h搅拌1次,并交换其在烘箱中的位置。
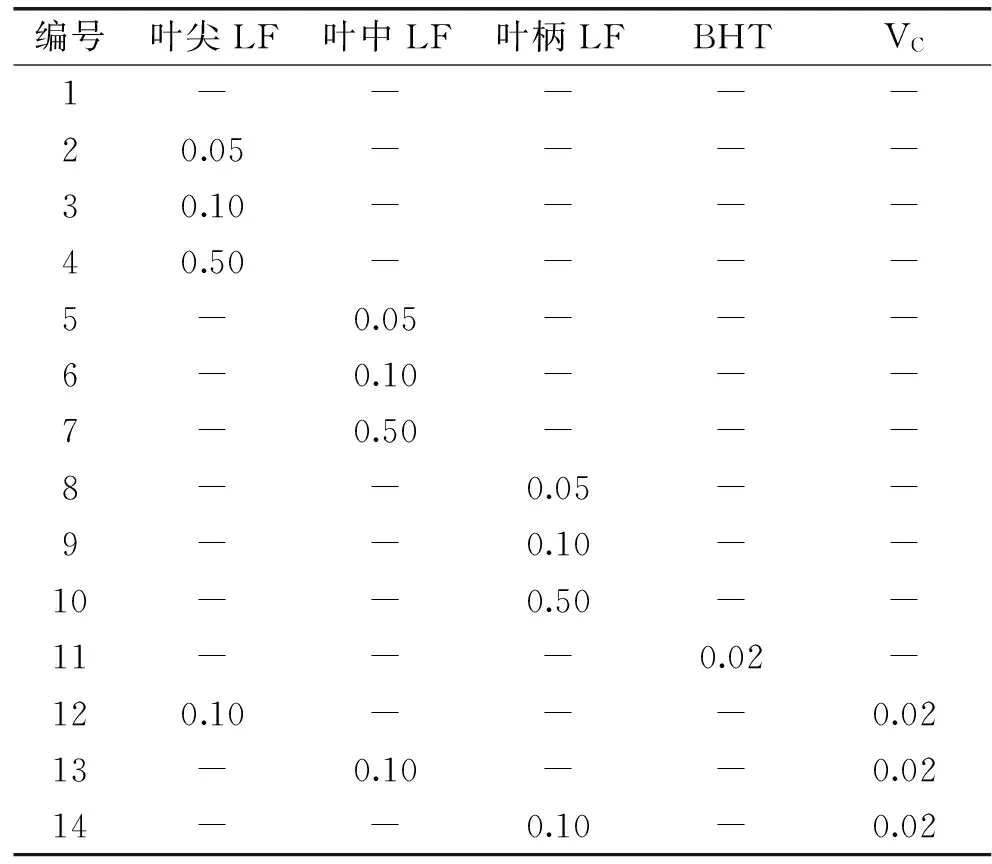
表1 枇杷叶不同部位LF粗提物添加质量分数(%)Table 1 The dosage of flavonoids extracts from the diffrent parts of leaves of Eriobotrya Japonica(Thunb.)Lindl.
1.2.3.2 油脂过氧化值的测定 按照GB/T5009.37-2003[23],用碘量法每隔48h取样检测猪油的过氧化值(Peroxide Value,POV),每个数值测定3次取平均值。过氧化值以每千克中活性氧的毫克当量表示:POV(mep/kg)=(V1-V2)×c×0.1269×100×78.8/m,式中,V1为试样消耗硫代硫酸钠标准滴定溶液体积(mL),V2为试剂空白消耗硫代硫酸钠标准滴定溶液体积(mL),m为试样质量(g),c为硫代硫酸钠标准滴定溶液的浓度(mol/L)。
1.2.4 清除DPPH自由基能力的测定 按照参考文献[24]中的方法。将0.1mL不同质量浓度的枇杷叶黄酮样品溶液和1.9mL 0.09mmol/L DPPH乙醇溶液混合,剧烈震荡后置在黑暗条件下反应30min,在517nm波长下测定吸光度。同时以BHT作为阳性对照。每份样品平行操作三次。DPPH自由基清除率计算公式为:
DPPH自由基清除率(%)=[(AControl-ASample)/AControl]×100
式中,AControl为空白样品的吸光度,ASample为待测样品的吸光度。
通过获得的抑制DPPH自由基回归方程,以待测样品浓度为横坐标(X),抑制率为纵坐标(Y)得到待测样品清除DPPH自由基的关系曲线,并计算得到枇杷叶黄酮的半数抑制浓度(IC50)。
1.2.5 清除ABTS自由基能力的测定 按照参考文献[24]中的方法。在浓度为7mmol/L ABTS溶液中加入过硫酸钾至浓度为2.45mmol/L,充分混合均匀,将反应液在室温避光条件下放置12~16h。在EP管中加入200μL不同质量浓度枇杷叶黄酮溶液、300μL ABTS反应液,然后加入0.5ml 50%甲醇溶液,充分震荡均匀,反应2min后,在745nm处测定吸光度。以不加样品为空白对照,用BHT作阳性对照。每份样品平行操作三次。ABTS自由基清除率计算公式按照1.2.4中公式计算。
获得的抑制ABTS自由基回归方程及关系曲线,并计算得到枇杷叶黄酮的半数抑制浓度(IC50)。

2 结果与分析
2.1 标准曲线
按照1.2.2.1方法得到芦丁标准曲线,如图1所示。得到浓度C(μg/mL)与吸光度A的线性回归方程A=0.0122C+0.0376,相关系数R2=0.9830,在12~72μg/mL浓度范围内具有良好的线性关系,适用于枇杷叶总黄酮含量的测定。

图1 芦丁标准曲线Fig.1 Standard curve of rutin
2.2 LF含量
按照上述1.2.2方法测得枇杷叶全叶、叶尖、叶中、叶柄提取物中黄酮含量测定结果见表2。结果显示,叶尖LF含量为(5.79±0.03)mg/g,叶中LF含量为(5.08±0.08)mg/g,叶柄LF含量为(4.97±0.35)mg/g,全叶LF含量为(5.04±0.12)mg/g。其中叶尖黄酮含量最高,而且与全叶及叶中、叶柄部位含量具有显著性差异。
纵伟[20]等报道枇杷叶经过不同方法干燥后,其样品中黄酮含量发生变化,其中冷冻干燥为7.352mg/g,真空干燥为7.342mg/g,自然干燥为6.234mg/g,热风干燥为5.053mg/g。本文枇杷叶黄酮含量范围与其热风干燥条件下的黄酮含量基本一致。枇杷叶样品中黄酮含量可能和枇杷叶干燥条件不同有关,热风干燥温度较高,会造成黄酮化合物的破坏[20]。同时枇杷品种、采收季节及叶片的成熟度也会影响叶片黄酮含量[25]。

表2 枇杷叶不同部位黄酮提取物黄酮含量(n=3)Table 2 The flavonoids contents of extracts from the diffrent parts of Eriobotrya Japonica(Thunb.)Lindl. leaves(n=3)
注:同一列标记字母不同,表示显著差异,p<0.05。
2.3 不同添加物对猪油的抗氧化作用比较
油脂氧化是指食品中的油脂在光、射线、空气和酶的作用下,食品表面和内部所发生的氧化反应,是油脂败坏的主要原因之一。氧化产物不仅影响油脂食品的风味、色泽、降低食品品质,而且产生许多有毒物质危害食用者健康。油脂的氧化主要包括油脂的自动氧化、光氧化和酶氧化,其中脂类的自动氧化是造成绝大部分油脂变质的主要原因。自动氧化过程包括诱导期、传播期、终止期及二次产物形成阶段。诱导期是油脂质量最为重要的指标之一,这一阶段结束就代表油脂开始酸败变质,因此,延长油脂的诱导期在实际生产中具有重要的意义[26]。
根据食用油脂卫生标准规定,当POV值达到19.7mep/kg时,动物油脂达到其酸败点,即样品的POV值超过19.7mep/kg所用的时间即为诱导期[27]。按照参考文献[22,28],猪油常温下诱导期约为8d,在(60±0.5)℃温度环境下,诱导期约为4d左右。为了加快猪油氧化速度,将加入了不同添加物的油脂试样置于(60±0.5)℃的恒温烘箱中,每24h测定一次猪油的POV值,连续测定18d。添加了抗氧化物质的油脂的POV值应比未处理的空白样品有所下降,同时其诱导期应有所延长。猪油POV值越低,诱导期延长时间越久,表明物质的抗氧化性能越强。
2.3.1 不同部位LF对猪油的抗氧化作用的比较 枇杷叶叶尖、叶中、叶柄三个部位的LF提取液在添加质量分数为0.05%,0.10%,0.50%水平下对猪油的抗氧化作用实验结果见图2。
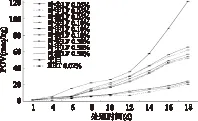
图2 不同部位的LF对猪油的抗氧化作用(n=3)Fig.2 Antioxidant effects of LF from different parts of the leaves on lard(n=3)
由图2可见,与空白样作比较可看出,LF可以一定程度上延长猪油的诱导期。各组在前3d区分度不大,LF的抗氧化效果也不明显。在该实验条件下,空白猪油的诱导期为6~7d左右,添加了0.05%和0.10% LF实验组的猪油诱导期分别延长至9d和11d左右,添加了0.50% LF的实验组诱导期由原来的6d延长到15d左右,0.02% BHT组处理样品的诱导期延长到了17d左右。说明LF可以延长猪油氧化的诱导期,其中0.50%LF组诱导期延长时间最久,接近BHT的效果。

表3 枇杷叶黄酮的DPPH自由基清除能力(n=3)Table 3 The DPPH radical scavenging activity of falvones from Eriobotrya Japonica(Thunb.)Lindl. leaves(n=3)
随着时间的推移,猪油的氧化程度逐渐加深,尤其是空白样品因为没有抗氧化成分的存在而很容易被氧化。到第18d内空白组猪油POV值高达121.29meq/kg,LF0.50%、BHT0.02%组样品的POV值分别为22.89、20.67meq/kg。说明LF可以有效降低猪油的POV值,当枇杷叶尖LF提取液添加量为0.50%时,其对猪油的抗氧化效果可与质量分数为0.02% BHT相媲美。
添加相同质量分数的叶尖、叶中、叶柄的LF提取液,叶尖LF降低猪油的POV值效果最好,其次是叶中和叶柄,这可能与叶尖黄酮含量最高有关。
通过比较相同部位不同浓度LF提取液对猪油的抗氧化作用可知,猪油中添加的LF浓度的增大,可有助于延长诱导期,降低POV值。
2.3.2 LF与VC混合后对猪油的抗氧化作用 选用抗氧化增效剂VC与LF提取物复配,考察其协同效应,与空白组、0.02% BHT组进行比较,结果见图3。

图3 0.10% LF与0.02% VC混合后 对猪油的抗氧化作用(n=3)Fig.3 Effect of antioxidant ability on lard by the mixture of 0.10% LF and 0.02% VC(n=3)
第18d,0.10%的叶尖LF与0.02% VC复配处理的猪油样品POV值降至21.32meq/kg,略高于BHT组的POV值,同时样品的诱导期也延长至15d左右。表明VC与LF提取液对减缓猪油的氧化过程有一定的协同作用。从提高食物安全性及资源利用率的角度看,可以用LF与VC的混合物来替代BHT。
2.4 枇杷叶黄酮对DPPH自由基清除作用
DPPH自由基清除法已被广泛应用于水果、中药材等提取物中,筛选抗氧化活性物质[29]。其利用DPPH单电子在517nm处的强吸,自由基清除剂(A-H)与其点那电子配对使其单电子消失,故而褪色[19]。通过分光光度法对不同质量浓度的枇杷叶总黄酮进行定量分析,同时以BHT作为阳性对照组,实验结果见图4。

图4 枇杷叶黄酮浓度对DPPH自由基清除作用(n=3)Fig.4 The DPPH radical scavenging activity of falvones from Eriobotrya Japonica(Thunb.)Lindl. leaves(n=3)
图4显示,在实验有效浓度范围内,枇杷叶LF表现出较好的清除DPPH自由基的能力,而且清除率均随着黄酮质量浓度的升高而增大,二者呈现一定的线性关系即黄酮浓度与对DPPH自由基清除率呈正量效关系(R2=0.9633),线性范围见表3。BHT作为对照品,其IC50为(0.02±0.09)mg/mL,相同质量浓度条件下其清除能力大于枇杷叶黄酮IC50(0.46±0.03)mg/mL。但是当黄酮浓度达到1.0g/L时,DPPH自由基清除率达到了85.00%。许丽璇[18]在研究枇杷叶抗氧化性实验中报道当枇杷叶黄酮质量浓度为0.50g/L时,其DPPH自由基清除率达到81.67%,其实验提取的枇杷叶黄酮的抗氧化性强于玉米须、金银花及黄豆等其他植物的黄酮。所以在于应用中可适当提高黄酮浓度,达到较高的清除率。
2.5 枇杷叶黄酮对ABTS自由基清除作用
ABTS自由基清除法可用于亲脂性和亲水性物质总抗氧化能力的测定[30]。通过分光光度法对不同质量浓度的总黄酮提取液进行定量分析,同时以BHT作为阳性对照组,实验结果见图5。

图5 枇杷叶黄酮浓度对ABTS自由基清除作用(n=3)Fig.5 The ABTS radical scavenging activity of falvones from Eriobotrya Japonica(Thunb.)Lindl. leaves(n=3)
图5显示,BHT对ABTS自由基有较强的清除作用,浓度为25mg/L时,对ABTS自由基的清除率达到96.12%。低浓度黄酮清除ABTS自由基效果较差,当黄酮浓度达到600mg/L时,清除率为83.58%左右。

表4 枇杷叶黄酮的ABTS自由基清除能力(n=3)Table 4 The ABTS radical scavenging activity of falvones from Eriobotrya Japonica(Thunb.)Lindl. leaves(n=3)
枇杷叶黄酮含量高于100mg/L时,对ABTS自由基表现出较好的的清除能力,而且清除率随着黄酮质量浓度的升高而增大。二者呈现一定的线性关系,即黄酮浓度与对ABTS自由基清除率呈正量效关系(R2=0.9516),线性范围见表4。
3 结论
本研究表明枇杷叶叶尖总黄酮含量相对较高,与全叶及叶中、叶柄总黄酮含量存在显著性差异。
抗油脂氧化能力的实验表明,枇杷总黄酮对猪油有一定的抗氧化效果,能够有效延长猪油氧化的诱导期,降低油脂POV值。本实验剂量范围内枇杷叶黄酮对猪油的抗氧化效果随着浓度的增加而增大,即存在量效关系。枇杷叶黄酮与抗坏血酸(VC)有一定协同抗氧化作用。
枇杷叶黄酮表现出较好的清除DPPH自由基、ABTS自由基的能力,IC50值分别为(0.46±0.03)mg/mL、(187.44±0.11)mg/L。在实验浓度范围内,随着黄酮浓度的增加,其清除自由基的活性增大。
[1]江苏新医学院.中药大词典[M].上海:上海科学技术出版社,2005:1248-1249.
[2]杨庆新,黄建安,刘仲华,等.枇杷叶中三萜酸的研究进展[J].食品工业科技,2008,29(3):282-285.
[3]Nobuo K,Motoyoshi S,Yukihiro G. A new acylated flavonolglycoside from the leaves of Eriobotrya japonica[J].Chem Pharm.Bull,2002,50(12):1619-1620.
[4]Huang Y,Li J,Cao Q,etal. Antioxidative effect of triterpene acidsofEriobotryajaponica(Thunb.)Lindl. leaf in chronic bronchitis rats[J].Life Sciences,2006,78(23):2749-2757.
[5]游见明,兰江涛.枇杷叶总黄酮提取工艺研究[J].食品研究与开发,2006,27(3):37-38,41.
[6]吕寒,滕杰晖,陈剑,等.枇杷叶总黄酮的纯化工艺及抗氧化活性研究[J].中国现代应用药学,2014,31(1):40-44.
[7]钱剑林.白沙枇杷叶黄酮类物质提取工艺的研究[J].食品科学,2007,28(7):252-254.
[8]董海丽,王谦.枇杷叶总黄酮超高压提取及抗氧化活性[J].中国农学通报,2011,27(5):489-492.
[9]韩秀奇,曾颂,李书渊.不同采收季节枇杷叶中黄酮类成分的含量考察[J].广东药学院学报,2010,26(6):576-578.
[10]罗美红,吕寒,李维林.枇杷叶中总黄酮含量的高效液相色谱测定[J].时珍国医国药,2011,22(3):582-583.
[11]Wang C Y,Chen C T,Wang S Y.Changes of flavonoid content andantioxidant capacity in blueberries after illumination with UV-C[J].Food Chemistry,2009,117(3):426-431.
[12]宋慧,李勇.黄酮类化合物的保健作用[J].中国食物与营养,2004(11):45-47.
[13]王丽玲,焦必林,曾凡坤.保健功能因子:生物类黄酮[J].粮食与油脂,2004(9):18-20.
[14]鲁晓翔.黄酮类化合物抗氧化作用机制研究进展[J].食品研究与开发,2012,33(3):220-224.
[15]杨桂福.枇杷叶黄酮对油脂的抗氧化性能研究[J].黑龙江中医,2009,22(2):150-152.
[16]蒋企洲,欧瑜,何执中.枇杷叶黄酮对油脂的抗氧化性能研究[J].医学综述,2008,14(10):1583-1585.
[17]谢红英,刘艺,王洪新,等.枇杷叶提取物抗氧化和抑菌作用的研究[J].食品工业,2007,28(2):1-4.
[18]许丽璇.枇杷叶黄酮的提取及对小鼠的抗氧化作用[J].西北农业学报,2013,22(3):23-28.
[19]严鹤峰.枇杷叶总黄酮的超声波提取及体外抗氧化性研究[J].山西农业科学,2013,41(5):449-452.
[20]纵伟,彭雪萍,赵光远.干燥方法对枇杷叶化学成分和抗氧化活性的影响[J].食品科技,2006,31(7):128-130.
[21]吕寒,李维林,裴咏萍,等.枇杷叶中黄酮类化学成分的HPLC-MS~n分析[J].现代中药研究与实践,2009(6):56-58.
[22]葛梅林,郜海燕,陈杭君,等.加工工艺对香榧油脂氧化和抗氧化活性的影响[J].中国粮油报,2011,26(5):42-46.
[23]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T5009.37-2003.食用油脂卫生标准的分析方法[S].北京:中国标准出版社,2004:303-308.
[24]Duan X W,Jiang Y M,Su X G,etal. Antioxidant properties of anthocyanins extracted from litchi(Litchi chinenesis Sonn.)friut pericarp tissues in relation to their role in the pericap browning[J]. Food Chemistry,2007(101):1365-1371.
[25]蔡建芬.枇杷叶、枝条及果实总黄酮含量比较及抗氧化分析[J].泉州师范学院学报,2010,28(4):55-59.
[26]穆同娜,张惠,景全荣.油脂的氧化机理及天然抗氧化物的简介[J].食品科学,2004,25(z1):243-246.
[27]徐雅琴,李淑芹,付红.黄树莓叶片中黄酮类物质的提取及抗氧化性[J].化学研究与应用,2002,14(6):739-741.
[28]丁晓雯.柑桔皮提取液抗氧化及其它保健功能研究[D].重庆:西南农业大学,2004.
[29]Sanchez M C. Review:methods used to evaluate the free radical scavenging activity infoods and biological systems[J].Food Science and Technology International,2002,8(3):121-137.
[30]Naczk M,Amarowicz R,Zadernowski R,etal. Antioxidant Acticity of Crude Phenolic Extracts from Wild Blueberry leaves[J]. Polish journal of food and nutrition science,2003,15(9):91-104.
Antioxidant effect of flavonoids in extracts from theEriobotryaJaponica(Thunb.)Lindl. leaves
FU Xiao-dan,TANG Chun-feng,LIU Rang-lian,PENG Kai-li,JIANG He-ti*
(College of Food Science,Southwest University,Chongqing 400715,China)
The objective of this study was to compare the total flavonoids contents in extracts from the different parts ofEriobotryaJaponica(Thunb.)Lindlleaves and to explore the antioxidant activities of the total flavonoids. The leaves were extracted with the ultrasonic method,and the contents of total flavonoids in different extracts were detected by Colorimetry. The lipid oxidation of fat was evaluated by the peroxide value under Schaal oven test conditions. Meanwhile,the antioxidant activities of total flavonoids were investigated by DPPH and ABTS free radical savenging assays. The results indicated the extracts from leaf tip had the highest flavonoids content(5.79±0.03)mg/g. The antioxidant effect of flavonoids on lard was existed and was enhanced with the increasing amount. Besides,within the scope of the study,the results showed that the flavonoids had remarkable activity for DPPH and ABTS radical scavenging,and the reduction ability increased with the concentration in experimental selecting concentration range.
EriobotryaJaponica(Thunb.)Lindlleaves;flavonoids;antioxidation;free radicals;lipid oxidation
2014-03-31
付晓丹(1993-),女,本科,研究方向:食品科学与工程。
*通讯作者:蒋和体(1963-),男,博士,教授,研究方向:果蔬及传统发酵食品加工。
TS201.2
A
1002-0306(2015)01-0135-05
10.13386/j.issn1002-0306.2015.01.020

