不同机械力作用下兔前颌缝和颧颌缝改建的组织形态学研究*
邓 婕, 张晓蓉
昆明医科大学附属口腔医院正畸科,昆明650031
不同机械力作用下兔前颌缝和颧颌缝改建的组织形态学研究*
邓 婕, 张晓蓉△
昆明医科大学附属口腔医院正畸科,昆明650031
目的 探讨不同大小交互偶联的机械力作用兔前颌缝和颧颌缝改建的组织形态学变化。方法 2.5月龄体重2.0~2.5kg雄性日本大白兔,通过在双侧前颌缝近远中两侧的上颌骨与前颌骨中分别植入微种植钉,镍钛拉簧双侧对称性即刻加载不同力值(50、100、150、200、250、300g/侧)7d,使左右的前颌缝受到来自拉簧的压缩应力;相对处于上颌骨远中的颧颌缝受到牵张应力,来观察在这种交互偶联力作用下,兔前颌缝和颧颌缝改建的形态学和组织学改变。结果 实验期间,随着力值增加实验兔覆盖减小,覆改变不显著。苏木精-伊红染色组织学观察可见,各实验小组从50 g/侧到250g/侧,随着力值增加前颌缝和颧颌缝分别发生破骨和成骨的改建,改建基本都处于生理范围,到250g/侧时两条骨缝的改建最活跃。当加力为300g/侧时,骨缝结构基本消失,该力值已超出兔骨缝改建所能承受的生理范围。结论 在生理范围内,不同机械力值作用兔骨缝引起的骨改建,在250g/侧时处于最活跃状态。
机械力; 上颌骨缝; 微种植体支抗; 兔; 组织形态学; 骨改建
正畸治疗中,颌骨改建的过程是通过相应受力的骨、软骨、骨缝组织发生改建来完成的。受力骨缝作为继发性改建部位,在缝两端吸收陈骨或形成新骨,通过抑制或促进作用达到骨改建的目的,是骨吸收和骨形成动态平衡的结果。骨缝受力之后由骨细胞将各种机械信号转化为生化信号,传导给成骨细胞和破骨细胞,由后两者之间相互作用发挥效应引起骨的改建。在这一过程中,破骨细胞和成骨细胞会释放多种关键酶、细胞因子、激素来参与、调节和控制整个成骨与破骨的变化过程。
本研究通过上颌骨种植体支抗后牵引前颌骨的动物实验模型,从组织学和形态学水平探讨体内环境下机械力对骨缝改建的影响,为颌骨矫形作用的机制研究提供进一步的科研参考。从而为正畸临床中矫形力治疗部分Ⅱ类骨性畸形选择骨改建效应最活跃时机,以及何时加力提供一定指导依据。
1 材料与方法
1.1 材料
2.5 月龄体重2.0~2.5kg雄性日本大白兔40只,SPF级(清洁级,即无特定病原体动物);韩国Abso Anchor系统种植体的微种植钉(直径1.2 mm,长7mm和10mm)及专用植入手柄;直径0.25mm不锈钢结扎丝,镍钛螺旋拉簧(北京有色金属研究院,丝直径0.012″,长1cm,使用时由中间剪断呈长5mm的镍钛拉簧),游标卡尺及改良毫米刻度尺(精确度1mm),生物显微镜(NIKON 50i,尼康公司,美国),Motic Med 6.0数码医学图像采集系统(MOTIC公司,日本),Image Pro Plus 6.0图像分析系统(Media Cybernetics公司,美国),梯度乙醇,进口脱钙液(福州迈新生物技术开发有限公司),4%多聚甲醛,二甲苯,苏木精和伊红(HE)。
1.2 方法1.2.1 动物模型的建立 本实验中设立实验组、植入种植钉未加力组(以下简称未加力组)和空白对照组3个大组。其中,实验组根据作用力值不同,分为6个不同力值的实验小组,分别加力50、100、150、200、250、300g/侧,每小组5只兔,均为双侧植入种植钉并且即刻加力,加力时间为7d。未加力组共5只兔,也为双侧植入种植钉,但不施加力;空白组共5只兔,不做任何手术处理。
术前称量并记录每只兔的体重,采用3%戊巴比妥钠,按照1mL/kg耳缘静脉注射麻醉。当出现肌肉紧张度下降,角膜反射迟钝,对疼痛刺激反应降低时,即可开始进行下一步手术操作。测定并记录每只兔中切牙的覆覆盖。然后牵开口角,5%碘酊棉球擦拭消毒全口3次,再用75%乙醇棉球脱碘3次,常规消毒术区。在拟植入种植钉的双侧中切牙根后方颊侧,距离切牙根尖远中约1.5mm处,先用手术刀做2mm左右的切口,深度直达骨皮质,并钝性分离周围的软组织,防止在植入过程中,软组织随种植钉的旋入而带进骨组织中,影响钉的稳定性和创口的愈合。前颌骨处的种植钉直径1.2mm,长7 mm,进钉方向均应尽量垂直于骨面,种植钉完全旋入之后只留下颈部暴露在口腔黏膜之上(图1A),碘酊棉球清洁植入区。上颌骨处的种植钉直径1.2 mm,长10mm,在双侧第一磨牙近中根尖上方约1 mm处同前先做一深达骨皮质的2mm切口,再垂直于骨面植入种植钉。双侧前颌骨和上颌骨的种植钉植入完成后,即刻双侧加载力值,以0.25mm不锈钢结扎丝将NiTi螺旋拉簧的两端连接于钉头部的结扎孔处(图1B、C)。
用测力计测定好不同机械力值,使前颌缝受到的压缩力值分别为每侧50、100、150、200、250、300 g,而对应的位于上颌骨远中的颧颌缝则受到牵张力,持续牵引7d。未加力组的兔均采用上述的种植钉植入操作,只是未进行NiTi螺旋拉簧加力。而空白组不进行任何手术处理。术后注意控制室温保暖,待兔清醒后予以软食喂养。术后第2天常规标准饲料喂养,兔能正常摄食饮水,未见明显不适。
1.2.2 组织切片制作 实验组、未加力组、空白组的兔均于加力后7d处死(图1D、E)。处死前分别称量兔的体重并记录。毫米刻度尺测定并记录每只兔中切牙的覆覆盖(图1F)。取下双侧前颌缝所在的前颌骨和部分上颌骨的骨组织块;剪下双侧包含颧颌缝区的骨组织块,生理盐水冲洗后立即放入4%多聚甲醛固定液中固定至少48h。骨组织块固定好后,进口脱钙液脱钙7d,梯度乙醇脱水、二甲苯透明、石蜡包埋制作成组织蜡块。最后制作成厚度3μm的石蜡切片。
1.2.3 HE染色、图像的采集和分析 分别取实验组、未加力组和空白组的兔双侧前颌缝和颧颌缝组织切片,HE染色,中性树胶封片,光学显微镜下观察并照相。采用HPIAS-1000高清晰度彩色图文分析系统,矢状切片(×100)上观察相同时间不同应力值的各实验小组、未加力组和空白组的前颌缝和颧颌缝骨缝改建前后的组织学以及细胞学变化。
1.3 统计学处理
应用SPSS 17.0统计软件包对数据进行统计学分析,根据不同实验分组,分别采用区组方差分析、配对t检验和随机区组实验设计方差分析进行统计学分析,结果分别以均数±标准差()表示,以P<0.05为差异有统计学意义。
2 结果
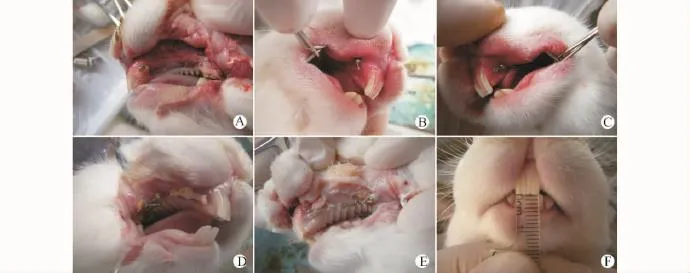
图1 种植体植入过程及测量指标Fig.1 Implantation procedures of micro-implants and indexes of measurement
表1 各实验小组、未加力组和空白组之间在实验前后的覆覆盖差值比较(x¯±s,mm)Table 1 Comparison of the difference value of overbite and overjet before and after experiment among experimental groups,non-force group and blank control group(x¯±s,mm)
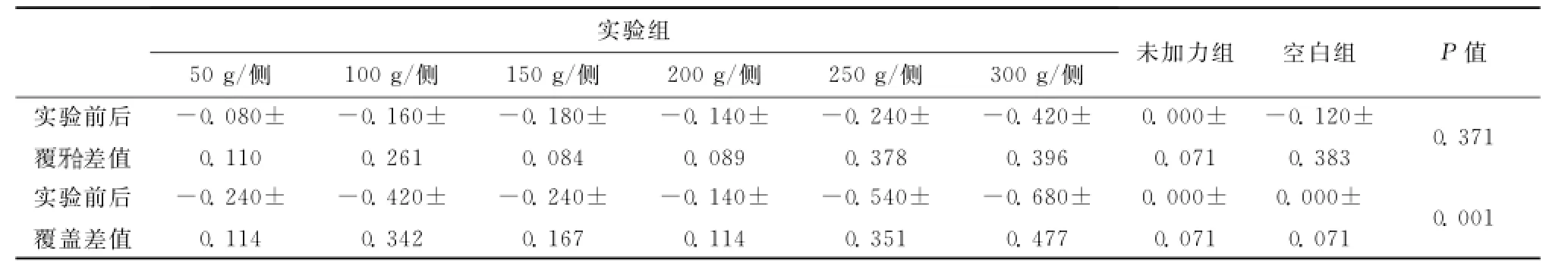
表1 各实验小组、未加力组和空白组之间在实验前后的覆覆盖差值比较(x¯±s,mm)Table 1 Comparison of the difference value of overbite and overjet before and after experiment among experimental groups,non-force group and blank control group(x¯±s,mm)
采用区组方差分析,结果显示各实验小组、未加力组和空白组之间在实验前后的覆差值差异均无统计学意义(均P>0.05);实验前后的覆盖差值差异有统计学意义(P<0.05)
实验组50g/侧100g/侧150g/侧200g/侧250g/侧300g/侧未加力组空白组P值实验前后覆0.371实验前后覆盖差值差值-0.080± 0.110-0.160± 0.261-0.180± 0.084-0.140± 0.089-0.240± 0.378-0.420± 0.396 0.000± 0.071-0.120± 0.383-0.240± 0.114-0.420± 0.342-0.240± 0.167-0.140± 0.114-0.540± 0.351-0.680± 0.477 0.000± 0.071 0.000± 0.0710.001
表2 各实验小组、未加力组和空白组各组内在实验前后的覆值比较(x¯±s,mm)Table 2 Intragroup comparison of the value of overbite before and after experiment in experimental groups,non-force group and blank control group(x¯±s,mm)
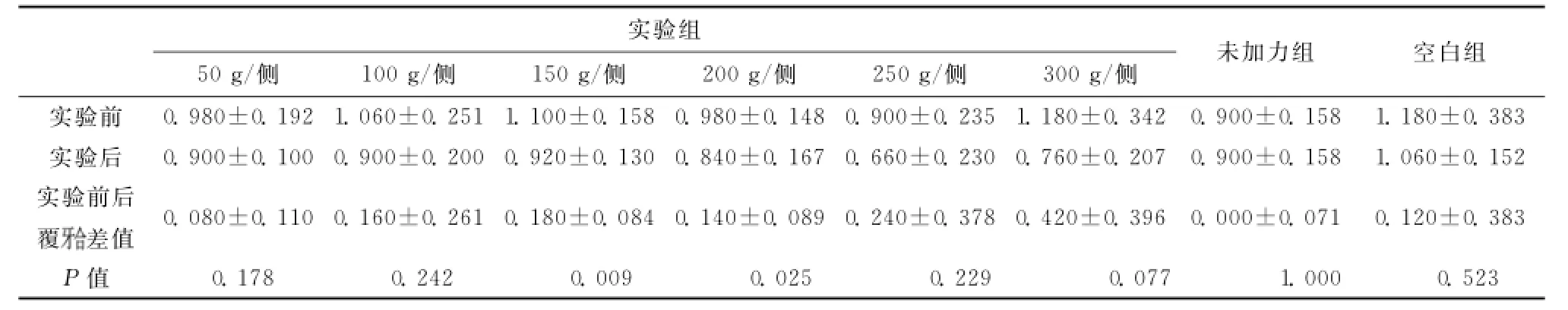
表2 各实验小组、未加力组和空白组各组内在实验前后的覆值比较(x¯±s,mm)Table 2 Intragroup comparison of the value of overbite before and after experiment in experimental groups,non-force group and blank control group(x¯±s,mm)
采用配对t检验,结果显示50g/侧组、100g/侧组、250g/侧组、300g/侧组、未加力组和空白组各组内在实验前后的覆值差异均无统计学意义(均P>0.05);150g/侧组和200g/侧组各组内在实验前后的覆值差异有统计学意义(均P<0.05)
实验组50g/侧100g/侧150g/侧200g/侧250g/侧300g/侧未加力组空白组.180±0.383实验后0.900±0.100 0.900±0.200 0.920±0.130 0.840±0.167 0.660±0.230 0.760±0.207 0.900±0.158 1.060±0.152实验前后覆实验前0.980±0.192 1.060±0.251 1.100±0.158 0.980±0.148 0.900±0.235 1.180±0.342 0.900±0.158 1差值0.080±0.110 0.160±0.261 0.180±0.084 0.140±0.089 0.240±0.378 0.420±0.396 0.000±0.071 0.120±0.383 P值0.178 0.242 0.009 0.025 0.229 0.077 1.000 0.523
2.1.2 覆盖的变化 各实验小组、未加力组和空白组之间在实验前后的覆盖差值比较差异有统计学意义(P<0.05)(表1)。各实验小组、未加力组和空白组各组内在实验前后的覆盖差值比较,结果显示100g/侧组、200g/侧组、未加力组和空白组各组内在实验前后的覆盖值差异均无统计学意义(均P>0.05);50g/侧组、150g/侧组、250g/侧组和300g/侧组各组内在实验前后的覆盖值差异有统计意义(均P<0.05)(图2,表3)。

图2 前牙覆盖测量正面观Fig.2 Anterior view of the measurement of the overjet of incisors
表3 各实验小组、未加力组和空白组各组内在实验前后的覆盖值比较(,mm)Table 3 Intragroup comparison of the value of overjet before and after experiment in experimental groups,non-force group and blank control group(,mm)

表3 各实验小组、未加力组和空白组各组内在实验前后的覆盖值比较(,mm)Table 3 Intragroup comparison of the value of overjet before and after experiment in experimental groups,non-force group and blank control group(,mm)
采用配对t检验,结果显示100g/侧组、200g/侧组、未加力组和空白组各组内在实验前后的覆盖值差异均无统计学意义(均P>0.05);50 g/侧组、150g/侧组、250g/侧组和300g/侧组各组内在实验前后的覆盖值差异有统计学意义(均P<0.05)
实验组50g/侧100g/侧150g/侧200g/侧250g/侧300g/侧未加力组空白组.500±0.158实验后2.000±0.292 1.740±0.134 2.020±0.164 2.000±0.100 1.960±0.114 2.160±0.498 2.500±0.158 2.500±0.158实验前后覆盖差值0.240±0.114 0.420±0.342 0.240±0.167 0.140±0.114 0.540±0.351 0.680±0.477 0.000±0.071 0.000±0.071实验前2.240±0.230 2.160±0.270 2.260±0.207 2.140±0.134 2.500±0.274 2.840±0.207 2.500±0.158 2 P值0.009 0.052 0.033 0.052 0.026 0.033 1.000 1.000
2.2 组织形态学观察
见图3。骨缝从开始发育到成熟骨缝,是由从骨端过渡的成骨层、与联合带骨膜相连的纤维包囊层、疏松结缔组织的中间层、纤维包囊层、以及另一侧成骨层[1-2]结构,加内外两层联合带骨膜构成,形态和结构与关节相近。
各实验小组加力7d之后,与未加力组和空白组比较,可见50g/侧组兔前颌缝和颧颌缝的结构清晰,骨细胞排列有序,成骨层可见少量成骨细胞,未见明显破骨细胞。100g/侧组前颌缝和颧颌缝可见骨缝的结构尚清晰,骨细胞排列基本有序,骨小梁与骨缝平行。150g/侧组前颌缝的编织骨骨小梁排列出现不规律,骨细胞密集程度增加,并且可见到个别的单核或多核破骨细胞在缝边缘;颧颌缝骨缘增厚,可见中间层有新生血管出现。200g/侧组前颌缝中某些部位骨缝纤维及中间层结构有轻微紊乱,骨细胞密集度增大,横穿纤维可见,中间层有血管成分出现,缝边缘出现多核破骨细胞;颧颌缝骨小梁排列不规律,成骨层有成骨细胞,中间层有新生血管。250 g/侧组前颌缝边缘增厚,骨细胞数量密集,骨小梁结构改变,横穿纤维明显,大量多核破骨细胞聚集在骨缝的边缘;颧颌缝成骨层中可见成骨细胞数量较多,骨细胞发生分化、增殖,中间层有大量成纤维细胞、间充质细胞、以及新生血管。300g/侧组前颌缝板层骨结构被大量含破骨细胞虫蚀状间隙代替,中间层成纤维细胞排列紊乱,横行纤维断裂,细胞数量减少,仍可见多核破骨细胞在骨缝处,中间层有红细胞;颧颌缝两端骨组织成骨细胞成分明显减少,骨小梁形态不规则。未加力组和空白组骨缝结构清晰,骨小梁与骨缝边缘平行,骨细胞、成纤维细胞排列规律,也可偶见单个破骨细胞和成骨细胞在缝边缘(图3)。
3 讨论
颌面部骨缝是整个颌面生长改建的活跃区,骨缝的生长改建主要依赖于成骨细胞和破骨细胞两者的增殖和分化,并发挥骨形成和骨吸收效应达到改建的目的。骨缝组织的改建离不开机械力刺激,应力不仅调控成骨细胞的增殖和分化,也影响破骨细胞的形成和作用。在生理性的承受范围内,对骨缝施加一定程度的机械力,可以通过骨细胞将力传递至相应骨缝的受体细胞,通过一系列的信号转化成生物刺激,促进破骨或成骨细胞的生成[2-4]。
有关骨缝受力后改建的研究,由于矫形作用的动物模型较难建立,大部分研究集中在体外培养细胞并施予人工受力装置,模拟体内加力环境,观察细胞受力前后,微观形态发生的改变[5-9],而体内动物实验研究方面,Ichiro等[10]自制扩弓簧放置于大鼠上腭扩张腭中缝研究β1整合素及黏着斑激酶在成软骨方面的表达。Hou和Fukai等[11]学者则利用机械力诱导小鼠上颚骨缝改建。段银钟[12]、Yok-oya[13]和张红梅[14]等学者的研究认为,加力时间7d能够达到骨改建的峰值。近年随着矫治技术和材料学飞速发展,微种植体支抗的问世,以其“绝对”支抗、基本无创并且疗效明显,显示出显著优势。口内支抗不仅简化操作,而且配合依赖性降低,舒适度提高。
徐芸、张晓蓉等学者[15-16]的前期研究中,利用微钛板植入青春期恒河猴上颌骨,成功建立起微种植体支抗后牵引猴上颌骨的动物模型。采用加载到猴骨缝改建的力值为150g/侧,双侧共计300g。鉴于文献中对兔骨密度与人骨密度换算的资料较为罕见,因此本实验采用不同的力值直接加载骨缝处,从而为寻找到适合于兔骨缝改建的机械力值提供一定的参考。由于猴属于高等动物,较为昂贵,实验数量有限,因此实验的重复性受到了一定的限制。本实验考虑到伦理学实验动物优化原则,以低等动物代替高等动物。根据Hassett等[17]的研究表明,兔和人的互补脱氧核糖核酸(cDNA)克隆显示,核苷酸及其推导出的氨基酸具有高度的相似性(相似度超过85%)。本实验选用日本大白兔来代替恒河猴,一定程度上扩大样本数量,增加实验重复性也易于操作。将兔的上颌骨与前颌骨之间的前颌缝,和上颌骨与颧骨之间的颧颌缝作为实验骨缝,选择体积较小、植入简便的微种植钉代替微钛板作为支抗装置,提高实验可操作性。通过在兔双侧前颌缝近远中两侧的上颌骨与前颌骨中分别植入种植钉,镍钛(NiTi)拉簧双侧对称性即刻加载力值,使左右的前颌缝受到来自拉簧的压缩应力;相对的,处于上颌骨远中的颧颌缝受到牵张应力,从而更为科学、简便、有效地建立了交互偶联的机械力作用下兔前颌缝和颧颌缝改建的动物实验模型。
不同力值(50、100、150、200、250、300g/侧)施加于前颌缝,测量中切牙的覆覆盖,HE染色观察不同机械力值作用下,兔前颌缝和颧颌缝改建情况。随着力值的增加,兔水平方向位变化表现为覆盖减小,垂直方向覆改变不明显,这可能是由于兔前颌缝直接受力,对前颌骨形成后牵引作用,一定程度上抑制了前颌骨的向前生长,也反映出该模型具有一定的有效性。
通过组织学观察,光镜下可见从50g/侧到250 g/侧,随着力值增加,骨缝结构的改建基本处于生理性范围内,并未见到骨细胞及其他细胞肿胀、破裂、变性或坏死等病理性改变。前颌缝受到压缩力后破骨效应占主导,发生骨改建而出现骨小梁排列不规律,破骨细胞逐渐增加,缝边缘有骨吸收,到250g/侧时,多核破骨细胞数量达到峰值,骨改建活跃。颧颌缝受到牵张力后成骨效应占主导,成骨层中的成骨细胞随力值增加逐渐增多,中间层可见横行纤维和新生的血管。当加力到300g/侧时,镜下表现骨缝结构基本消失,中间层成纤维细胞排列紊乱,有红细胞出现,横行纤维断裂,说明该力值已经超出兔骨缝改建所能承受的生理范围,不适宜采用。因此,在生理范围内,不同机械力值作用骨缝引起的骨改建,在250g/侧时处于最活跃状态。
兔上颌骨种植体支抗后牵引前颌骨的动物实验模型中,压缩力和牵张力交互偶联产生,在观察受力骨缝改建的对比观察方面更有优势,为进一步颌骨矫形作用机制的探索打下基础。从临床指导方面来看,本实验为选择骨改建效应最活跃时的机械力值提供一定依据,以期为利用种植体支抗解决部分轻中度Ⅱ类骨性畸形的正畸治疗中加力时间和力值的选择上提供实验参考,探索更有效的治疗途径。
[1] Pritchard J J,Scott J H,Girgis F G.The structure and development of cranial and facial sutures[J].J Anat,1956,90(1): 73-86.
[2] 王涛,徐慧芬,王大章.受压前颌上颌骨缝组织微观结构变化的观察[J].实用口腔医学杂志,2004,20(30):259-262.
[3] 吴拓江,李松,徐芸.应力作用下骨缝中成骨细胞的细胞因子改变[J].现代口腔医学杂志,2004,18(1):81-82.
[4] 马李晅,唐国华.成骨细胞凋亡与颅颌骨缝的生长改建[J].中国口腔颌面外科杂志,2006,4(3):233-236.
[5] 许海燕,周洪,饶国洲.持续压力对体外培养的人破骨细胞形态和基质金属蛋白酶9,抗酒石酸酸性磷酸酶表达的影响[J].上海口腔医学,2008,17(3):285-288.
[6] 刘文佳,王晓庚,周洪,等.高纯度破骨样细胞体外培养及功能表达的研究[J].华西口腔医学杂志,2008,26(6):599-603.
[7] 傅德皓,杨述华,肖宝钧,等.骨形态发生蛋白-2对原代鼠胚成骨细胞血管内皮生长因子表达的影响[J].中华创伤骨科杂志,2006,8(8):751-754.
[8] 张勇.模拟失重环境下BMP-2对成骨细胞诱导作用变化的研究[D].西安:第四军医大学,2002.
[9] 朱慧勇.成骨细胞、生长因子复合生物活性支架的骨再造研究[D].浙江:浙江大学,2003.
[10] Ichiro T,Kazuyuki O,Yasuyuki S,et al.Effect of stretching on gene expression ofβ1integrin and focal adhesion kinase and on chondrogenesis through cell-extracellular matrix interactions[J].Eur J Cell Biol,2003,82(04):182-192.
[11] Hou B,Fukai N,Olsen B R.Mechanical force-induced midpalatal suture remodeling in mice[J].Bone,2007,40(6):1483-1493.
[12] 金钫,段银钟,李潇.MMP-9在大鼠牙齿移动后牙周组织中的表达和分布[J].临床口腔医学杂志,2004,20(4):205-207.
[13] Yokoya K,Sasaki T,Shibasaki Y,et al.Distributional changes of osteoclasts and pre-osteoclastic cells in periodontal tissues during experimental tooth movement as revealed by quantitative immunohistochemistry of H(+)-ATPase[J].J Dent Res,1997,76(1):580-587.
[14] 张红梅.咬合升高对青春期大鼠髁突软骨组织学形态及PCNA、BMP-2表达影响的实验研究[D].西安:第四军医大学,2007.
[15] 徐芸,小山勋男,傅民魁,等.种植体支抗向后牵引上颌骨动物模型的建立[J].口腔正畸学,2005,12(2):77-80.
[16] 张晓蓉,曾祥龙,徐芸.种植体支抗后牵引上颌骨颅颌面结构变化的动物实验研究[J].中华口腔正畸学杂志,2009,16(1): 9-12.
[17] Hassett C,Richter R J,Humbert R,et al.Characterization of cDNA clones encoding rabbit and human serum paraoxonase: the mature protein retains its signal sequence[J].Biochemistry,1991,30(42):10141-10149.
(2014-04-16 收稿)
Histomorphological Changes during Remodeling of Premaxillary Suture and Zygomaticomaxillary Suture under Different Mechanical Forces in Rabbits
Deng Jie,Zhang Xiaorong△
Department of Orthodontics,Affiliated Stomatological Hospital of Kunming Medical University,Kunming 650031,China
ObjectiveTo examine the histomorphological changes during the remodeling of premaxillary suture and zygomaticomaxillary suture of rabbits by using different mechanical forces.Methods Micro-implants were placed in premaxillary and maxillary suture,respectively,as the anchorage in the male Japanese rabbits at the age of 2.5month with the weight from 2.0to 2.5kg.Mechanical force was produced by nickel titanium spring between these anchorages on both sides immediately.Different forces(50,100,150,200,250,300g/side)were exerted directly on the premaxillary suture for 7days,which also caused a tensile force to zygomaticomaxillary suture at the same time.The overbite and overjet of the incisors of rabbits were measured.Histomorphological changes were observed by hematoxylin-eosin(HE)staining.Results The overjet was decreased significantly under different forces and the overbite had no significant changes at 7days.HE staining showed that bone resorption and formation occurred to some extent in premaxillary suture and zygomaticomaxillary suture when the force was between 50g/side to 250g/side.Remodeling of sutures happened most obviously in 250g/side group.In 300g/side group,the normal construction of sutures disappeared,suggesting that 300g/side was beyond the physiological ranges of the remodeling of suture in rabbits.Conclusion Physiological remodeling of sutures was most active when 250g/side force was exerted on sutures.
mechanical force; maxillary suture; micro-implant anchorage; rabbit; histomorphology; bone remodeling
R783.5
10.3870/j.issn.1672-0741.2015.02.009
*国家自然科学基金资助项目(No.81060089)
邓 婕,女,1985年生,住院医师,医学硕士,E-mail:baihupodeng@sina.com
△通讯作者,Corresponding author,E-mail:xiaorongzhang36@hotmail.com

