有机物消耗无机试剂最大量问题例析
柴勇
有机物与无机试剂反应,是高考命题中考查有机判断和计算的切入点,特别是有机物消耗无机试剂的最大量问题,更是历年高考命题的热点.解答此类问题要明确反应方式和用量关系,特别是各种官能团与无机试剂反应的比例关系.为了更好的应对这一问题,下面总结如下,希望对学生的备考有所帮助.
一、明确反应关系储备必要知识
1.与H2反应的有:C=C(碳碳双键)、C≡C(碳碳叁键)、 (苯环)、C=O(酮羰基)、H-C=O(醛基).
2.与溴水反应的有:
(1)加成反应:C=C(碳碳双键)、C≡C(碳碳叁键);
(2)取代反应:OH (苯酚:取代苯环中酚羟基邻位与对位上的氢原子).
3.与Na反应的官能团有:-OH(羟基)、-COOH(羧基).
4.与NaOH反应的官能团有:R-X(卤素原子)、 OH(酚羟基)、-COOH(羧基)、RCOOR(酯基)、RCONHR(肽键)、RCOONa(羧酸钠:CH3COONa+NaOHCH4↑+Na2CO3).
5.与Na2CO3反应的官能团有:-COOH(羧基)、OH(酚羟基:OH+Na2CO3ONa+NaHCO3).
6.与NaHCO3反应的官能团有:-COOH(羧基).应, 再恢复到原状态时, 测得气体的总体积为12 L, 试确定烯烃的分子式及其所占的体积百分含量?
解法讨论法
此题如按一般设未知数列方程法求解显然是不可取的解题方法(因为已知条件不充足), 所以应对题目做认真剖析找到解题突破口.
依据题意, 反应前气体总体积V前=1 L+11 L=12 L, 反应后气体总体积V后=12 L, 因此反应前后气体体积不变
2CO+O2点燃2CO2V减少
CnH2n+3n2O2点燃nCO2+nH2O(气)ΔV增加
利用差量法解题, 设烯烃气体体积为x
CnH2n+3n2O2点燃nCO2+nH2O(气)ΔV增加
1 L 3n2L nL nLn+n-3n2-1(L)=0.5n-1(L)
x x(0.5n-1)
2CO+O2点燃2CO2ΔV减少
2 L1 L2 L 2+1-2(L)=1 L
1-x 1-x2
∵反应前后体积不变
∴ΔV减少=ΔV增加
∴1-x2=x(0.5n-1) x=1n-1(L) (有两个未知数无确定的解)
讨论: 烯烃为气态:2≤n≤4
∴n=2x=1 (不合理, 烯烃气体体积为1 L, CO气体体积为0, 此种情况不会形成反应前后体积不变)
n=3x=12烯烃C3H6
n=4x=13烯烃C4H8均合理
∴若烯烃为C3H6时, 所占体积50%
烯烃为C4H8时, 所占体积为13×100%=33.33%
评注某些有机计算题根据题设条件最终只能得到不定方程,必须利用化学原理找出解题范围加以讨论才可以得出合理的有限组解,使问题得到圆满解决.
总之,有机化学计算题主要考查学生思维的敏捷性,解题时主要靠平时积累的解题方法加上灵活运用来解题.(收稿日期:2014-10-17)7.与新制Cu(OH)2反应的有:H-C=O(醛基)、-COOH(羧基)、HCOO-R(甲酸某酯).
二、例析考题类型把握命题趋向
类型1单一无机试剂最大用量问题
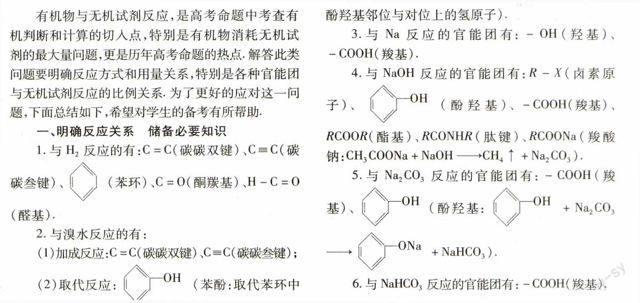
例1已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如图1所示.
ClO2NCOOHOCOCH2BrNO2Br
图1
1 mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( ).
A.5 mol10 molB.6 mol2 mol
C.8 mol2 mol D.8 mol4 mol
解析根据有机物的结构,对它在碱溶液中的反应进行分步分析.第一步,结构中-Br、-Cl、-COO-在碱性条件下发生水解反应,其反应方程式为:
ClO2NCOOHOCOCH2BrNO2Br+4H2O
OHO2NCOOHOH+COHOCH2OHNO2OH
+2HBr+HCl
第二步,水解产物与NaOH反应.综观上述水解产物,能与NaOH反应的有3 mol酚羟基,2 mol羧基,2 mol HBr,1 mol HCl,则消耗NaOH共8 mol.当所得溶液蒸干后,因产物中有2 mol-COONa,加热时可与2 mol NaOH发生脱羧反应(即:CH3COONa+NaOHCH4↑+Na2CO3).
综上分析,得a=8 mol,b=2 mol.答案:C.
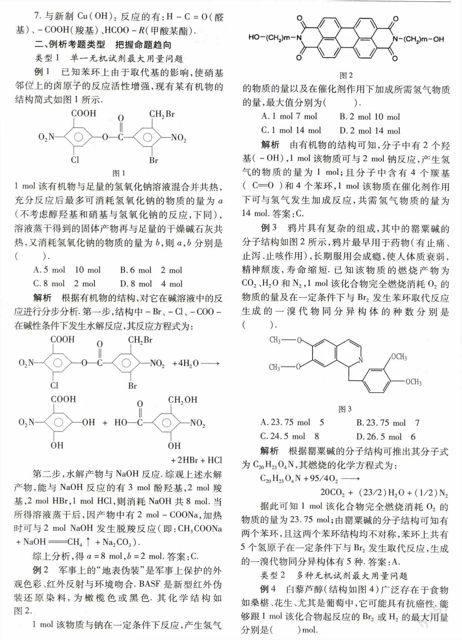
例2军事上的“地表伪装”是军事上保护的外观色彩、红外反射与环境吻合.BASF是新型红外伪装还原染料,为橄榄色或黑色.其化学结构如图2.
图21 mol该物质与钠在一定条件下反应,产生氢气的物质的量以及在催化剂作用下加成所需氢气物质的量,最大值分别为( ).
A.1 mol 7 mol B.2 mol 10 mol
C.1 mol 14 mol D.2 mol 14 mol
解析由有机物的结构可知,分子中有2个羟基(-OH),1 mol该物质可与2 mol钠反应,产生氢气的物质的量为1 mol;且分子中含有4个羰基(CO)和4个苯环,1 mol该物质在催化剂作用下可与氢气发生加成反应,共需氢气物质的量为14 mol.答案:C.
例3鸦片具有复杂的组成,其中的罂粟碱的分子结构如图2所示,鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短.已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是( ).
图3A.23.75 mol5 B.23.75 mol7
C.24.5 mol8 D.26.5 mol6
解析根据罂粟碱的分子结构可推出其分子式为C20H23O4N,其燃烧的化学方程式为:
C20H23O4N+95/4O2
20CO2 + (23/2)H2O+(1/2)N2
据此可知1 mol该化合物完全燃烧消耗O2的物质的量为23.75 mol;由罂粟碱的分子结构可知有两个苯环,且这两个苯环结构均不对称,苯环上共有5个氢原子在一定条件下与Br2发生取代反应,生成的一溴代物同分异构体有5种.答案:A.
类型2多种无机试剂最大用量问题
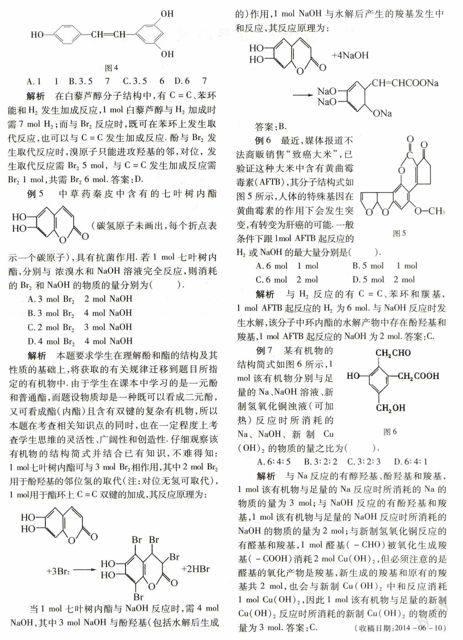
例4白藜芦醇(结构如图4)广泛存在于食物如桑椹、花生、尤其是葡萄中,它可能具有抗癌性.能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是( )mol.
HOCHCHOHOH
图4
A.1 1B.3.5 7 C.3.5 6D.6 7
解析在白藜芦醇分子结构中,有C=C、苯环能和H2发生加成反应,1 mol白藜芦醇与H2加成时需7 mol H2;而与Br2反应时,既可在苯环上发生取代反应,也可以与C=C发生加成反应.酚与Br2发生取代反应时,溴原子只能进攻羟基的邻,对位, 发生取代反应需Br2 5 mol, 与C=C发生加成反应需Br2 1 mol,共需Br2 6 mol.答案:D.
例5中草药秦皮中含有的七叶树内酯(碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1 mol七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( ).
A.3 mol Br22 mol NaOH
B.3 mol Br24 mol NaOH
C.2 mol Br23 mol NaOH
D.4 mol Br24 mol NaOH
解析本题要求学生在理解酚和酯的结构及其性质的基础上,将获取的有关规律迁移到题目所指定的有机物中.由于学生在课本中学习的是一元酚和普通酯,而题设物质却是一种既可以看成二元酚,又可看成酯(内酯)且含有双键的复杂有机物,所以本题在考查相关知识点的同时,也在一定程度上考查学生思维的灵活性、广阔性和创造性.仔细观察该有机物的结构简式并结合已有知识,不难得知:1 mol七叶树内酯可与3 mol Br2 相作用,其中2 mol Br2 用于酚羟基的邻位氢的取代(注:对位无氢可取代),1 mol用于酯环上C=C双键的加成,其反应原理为:
当1 mol七叶树内酯与NaOH反应时,需4 mol NaOH,其中3 mol NaOH与酚羟基(包括水解后生成 的)作用,1 mol NaOH与水解后产生的羧基发生中和反应,其反应原理为:
答案:B.
图5例6最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式如图5所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能.一般条件下跟1mol AFTB起反应的H2或NaOH的最大量分别是( ).
A.6 mol1 mol B.5 mol 1 mol
C.6 mol2 mol D.5 mol2 mol
解析与H2反应的有C=C、苯环和羰基,1 mol AFTB起反应的H2为6 mol.与NaOH反应时发生水解,该分子中环内酯的水解产物中存在酚羟基和羧基,1 mol AFTB起反应的NaOH为2 mol.答案:C.
图6例7某有机物的结构简式如图6所示,1 mol该有机物分别与足量的Na、NaOH溶液、新制氢氧化铜浊液(可加热)反应时所消耗的Na、NaOH、新制Cu(OH)2的物质的量之比为( ).
A.6∶4∶5 B.3∶2∶2C.3∶2∶3 D.6∶4∶1
解析与Na反应的有醇羟基、酚羟基和羧基,1 mol该有机物与足量的Na反应时所消耗的Na的物质的量为3 mol;与NaOH反应的有酚羟基和羧基,1 mol该有机物与足量的NaOH反应时所消耗的NaOH的物质的量为2 mol;与新制氢氧化铜反应的有醛基和羧基,1 mol醛基(-CHO)被氧化生成羧基(-COOH)消耗2 mol Cu(OH)2,但必须注意的是醛基的氧化产物是羧基,新生成的羧基和原有的羧基共2 mol,也会与新制Cu(OH)2中和反应消耗1 mol Cu(OH)2,因此1 mol该有机物与足量的新制Cu(OH)2反应时所消耗的新制Cu(OH)2的物质的量为3 mol.答案:C.(收稿日期:2014-06-10)