悬浮固化液相微萃取-高效液相色谱法分析生长素
卢巧梅, 张文敏, 黄川辉, 卢明华, 励建荣, 张 兰
(1. 福州大学测试中心, 福建 福州 350002; 2. 福州大学食品安全与检测重点实验室, 福建 福州 350116; 3. 浙江工商大学食品与生物工程学院, 浙江省食品安全重点实验室, 浙江 杭州 310035; 4. 渤海大学辽宁省食品安全重点实验室, 辽宁 锦州 121013)
悬浮固化液相微萃取-高效液相色谱法分析生长素
卢巧梅1, 2, 张文敏2, 黄川辉2, 卢明华2, 励建荣3, 4, 张 兰1, 2
(1. 福州大学测试中心, 福建 福州 350002; 2. 福州大学食品安全与检测重点实验室, 福建 福州 350116; 3. 浙江工商大学食品与生物工程学院, 浙江省食品安全重点实验室, 浙江 杭州 310035; 4. 渤海大学辽宁省食品安全重点实验室, 辽宁 锦州 121013)
建立基于悬浮固化液相微萃取预处理的高效液相色谱-荧光检测法(SFODME-HPLC-FLD)用于两种植物生长素(吲哚丙酸和吲哚丁酸)的分析. 实验考察各因素对萃取过程的影响, 确定最佳条件: 50 μL十二醇(纯)为萃取剂, 20.0 mL样品溶液(pH 3.0)、 0.25 g·mL-1NaCl、 26 ℃、 1 800 r·min-1条件下萃取10 min. 结果表明, SFODME技术重现性好、 灵敏度高, 相对标准偏差小于8.66%, 检测限为0.01 ng·mL-1, 线性范围为0.02~60 ng·mL-1, 加标回收率大于84.3%. 方法快速、 稳定、 环境友好, 适用于实际样品的检测.
悬浮固化液相微萃取; 高效液相色谱; 液相微萃取; 生长素
0 引言
样品前处理一直是分析检测的难点. 自1996年Jeannot和Cantwell提出液相微萃取(LPME)方法[1]后, 为了拓展LPME实用性, 学术界提出了多种模式, 包括单滴液相微萃取(SDME)[2]、 中空纤维-液相微萃取(HF-LPME)[3]、 分散液液微萃取(DLLME)[4]、 悬浮固化液相微萃取(SFODME)[5]等. 上述方法中, SDME将有机液滴悬挂在微量进样器针头上, 液滴表面积小、 易脱落而影响萃取效果和稳定性; HF-LPME以中空纤维为载体, 增大了萃取表面积, 富集效果有所提高; DLLME技术将分散剂和萃取剂混合, 萃取在数分钟内完成, 极大缩短了前处理时间, 但此方法中萃取剂和基质共沉淀于试管底部, 基质干扰很难避免; SFODME技术相对于以上预处理方法, 采用密度小于水的低毒萃取剂, 萃取完成后使上浮的萃取剂固化取出, 室温融化后进样测定[6], 所以能简单地实现目标物与基质分离, 特别适合于复杂样品的处理. 当前, 已开展了该方法在环境污染物[7-9]、 离子检测[10-11]等方面的应用研究.
吲哚丙酸(indole propionic acid, IPA)和吲哚丁酸(indole butyric acid, IBA)是常见的外源性植物生长素, 广泛应用于植物组织培养、 扦插技术中. 这类物质的广泛使用将导致在水源、 果蔬表面甚至食品中残留激素[12-14], 对环境和食品安全存在隐患和危害. 研究应用SFODME技术结合高效液相色谱-荧光检测法(HPLC-FLD)测定上述2种生长素, 既获得高效前处理的结果, 还提高了方法的选择性及灵敏度.
1 实验部分
1.1 仪器和试剂
Agilent 1100系列液相色谱仪, 配有荧光检测器(Agilent公司, 美国); Milli Q超纯水器(Millipore公司, 美国); DF-101S恒温加热磁力搅拌器(予华仪器有限责任公司).
标准品IPA和IBA(纯度均> 98%)购自百灵威化学试剂公司; 十一醇和十二醇分别购于上海晶纯试剂有限公司和Alfa Aesar公司; 甲醇为色谱纯, 其余试剂均为分析纯. 所有溶液使用前均用0.45 μm滤膜过滤.
1.2 液相色谱
甲醇 ∶水(65 ∶35, 体积比)为流动相, Zorbax 300 SB C8(5 μm × 4.6 mm × 150 mm, Agilent)色谱柱, 流速0.8 mL·min-1, 柱温30 ℃, FLD检测波长230 nm/360 nm(激发波长/发射波长), 进样量10 μL.
1.3 溶液配制和样品处理
标准溶液配制: 称取IPA和IBA标准品用甲醇配制成2.000 mg·mL-1储备液, 4 ℃贮存, 临用前逐级用甲醇稀释.
实际样品: 植物培养基干粉购自杭州临安木木生物技术有限公司. 称取3 g干粉用100 mL二次水加热搅拌溶解、 稀释, 备用.
1.4 SFODME法
准确吸取20.0 mL样品溶液(pH=3.0, 0.25 g·mL-1NaCl)于25 mL萃取瓶中, 以50.0 μL十二醇为萃取剂, 1 800 r·min-1、 26 ℃搅拌10 min. 取出样品瓶, 冰浴5 min后用药匙取出上浮的十二醇固体, 室温融化后分析.
2 结果与讨论
2.1 SFODME影响因素2.1.1 萃取剂种类
萃取剂的选择能够显著影响萃取效果. SFODME技术要求萃取剂的密度小于水、 熔点接近室温、 挥发性弱. 选择了符合上述条件的两种溶剂: 纯十一醇(熔点: 13~15 ℃), 纯十二醇(熔点: 22~24 ℃), 结果表明, 纯十二醇萃取效果更为理想.
2.1.2 萃取温度、 萃取剂体积、 离子强度、 pH值、 搅拌速度
在SFODME中, 萃取温度升高, 有利于缩短平衡时间. 萃取剂体积增大, 直接增大目标物的萃取量, 但由此引起的稀释效应将影响方法的灵敏度. 样品溶液中离子强度增加, 使得分析物和萃取剂在水中的溶解度减小, 有利于萃取和富集. 通过调节溶液pH, 使2种生长素最大程度的以分子形式存在, 从而提高色谱的信号响应. 选择合适的搅拌速率, 能实现萃取剂和样品溶液中目标物的充分接触和快速传质, 可有效提高萃取效率. 综上述, 萃取温度(A)、 萃取剂体积(B)、 盐浓度(C)、 pH值(D)、 搅拌速度(E)等因素对体系的萃取效果都有相互的影响. 因此, 采用5因素4水平正交试验(见表1), 共设计16个实验组(见表2), 以考察各因素对萃取效果影响的主次顺序, 寻求最优萃取方案. 表3为SFODME法正交实验的极差分析.

表1 因素水平表
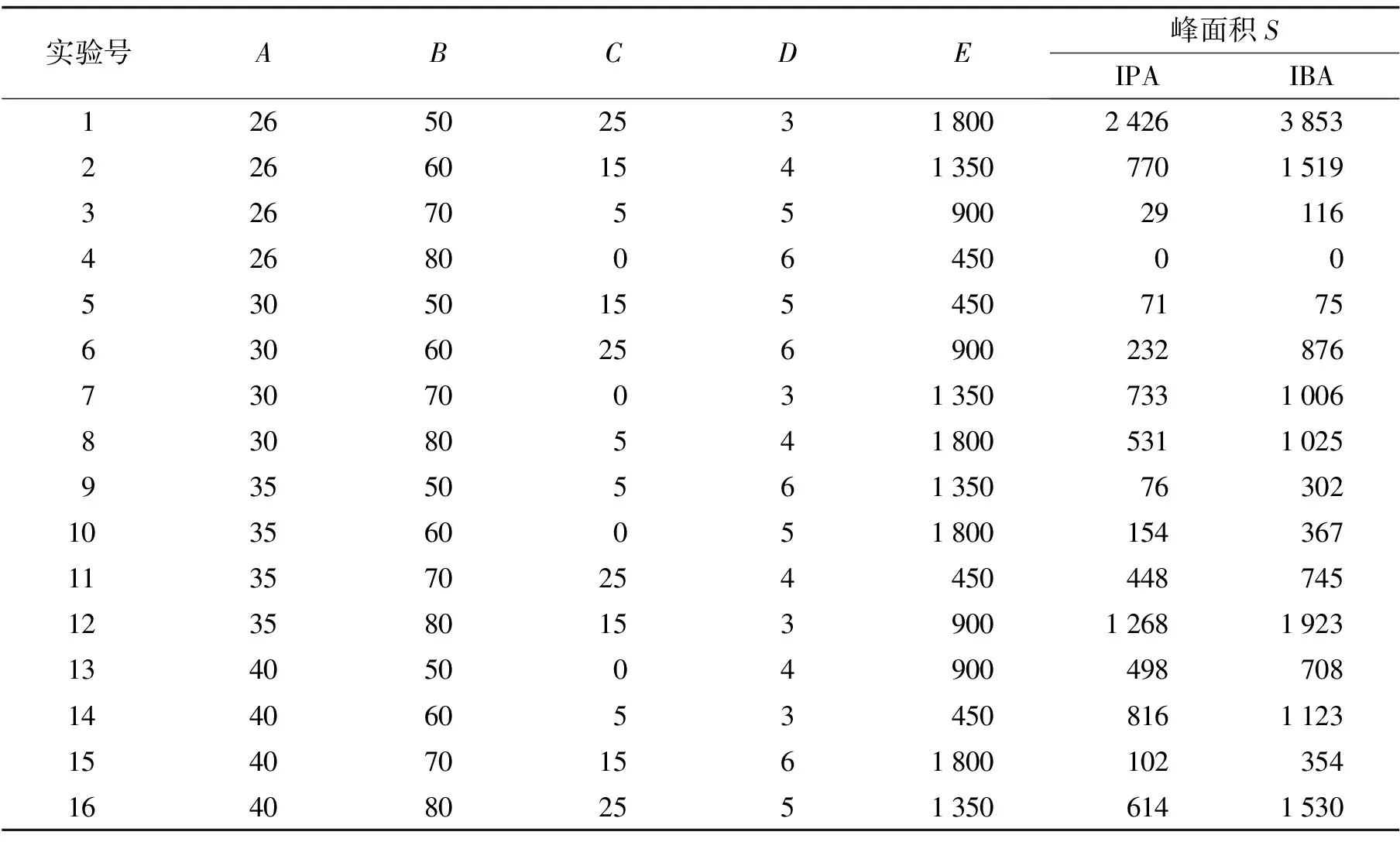
表2 SFODME法的正交实验方案表

表3 SFODME法正交实验极差分析
续表

分析物试验指标因素ABCDEIBAK154884938700479055599K229823885387139974357K333372221256620883623K437154478208115321943k113721235175119761400k27469719689991089k3834555642522906k49291120520383486R62668012311593914
注:K值表示每个因素下对应水平的实验结果之和;k是K的均值;R表示极差, 就是每个因素下K的最大值与最小值之差.
表3的极差分析中, 极差越大表明该因素对结果的影响越显著. 试验表明, 溶液的pH值对2种生长素的萃取效果影响最大, 其次是盐浓度, 而温度对萃取效果的影响最弱. 这是因为IPA和IBA结构上带有一个羧基, 其pKa值分别为6.15和4.80. 在pH 3.0溶液中, 2种待测物大部分以非离子形式存在, 易于被十二醇萃取和富集. 萃取过程的其他条件为: 50 μL十二醇为萃取剂, 盐浓度为0.25 g·mL-1NaCl, 萃取温度和搅拌速率分别为26 ℃和1 800 r·min-1.
2.1.3 萃取时间

图1 萃取时间对峰面积的影响Fig.1 Effects of extraction time on peak areas
恰当的萃取时间能保证待测物在有机溶剂和样品溶液中达到动态平衡. 将上述样品溶液分别搅拌萃取5、 10、 20、 30、 50 min后进样分析(其他实验条件: 50 μL十二醇, 20.0 mL溶液, 萃取温度26 ℃, 搅拌速度1 800 r·min-1, 0.25 g·mL-1NaCl, pH 3.0, 样品浓度为10 ng·mL-1), 比较不同萃取时间对峰面积的影响, 见图1. 结果表明, 萃取效率在10 min已达到最大, 表明该SFODME能实现较快速地萃取. 当萃取50 min后, 2种生长素的峰面积仍基本恒定, 萃取体系稳定性好.
2.2 SFODME的方法评价2.2.1 重现性
方法重现性以日内精密度来评价, 计算保留时间和峰面积的相对标准偏差(RSD). 实验先以0.5 μg·mL-1标样在同一天内连续5次进样测定, 再取5份10 ng·mL-1样品溶液经SFODME法萃取后当天内分析. 上述结果比较可得, 标样直接分析法重现性很理想, SFODME预处理法的保留时间RSDs在2.33%~2.56%范围内, 峰面积RSDs介于7.92%~8.66%, 表明该前处理技术稳定、 重现, 符合分析方法的要求(见表4).

表4 SFODME方法的重现性(n=5)
2.2.2 富集效果
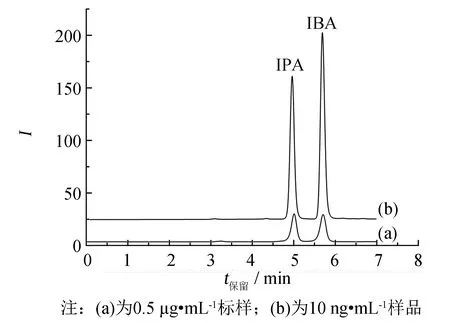
图2 SFODME萃取前和萃取后响应对比图 Fig.2 The effect of corresponding method before SFODME and after SFODME extraction
富集能力是衡量前处理方法优劣的一项重要指标. 在SFODME方法中, 磁力搅拌使萃取剂迅速分散成无数小液滴, 与样品溶液和目标物大面积混合. 剧烈的扰动效应增强了各溶剂间的穿透力和传质过程, 促使待测物进入萃取剂, 因此SFODME能实现高效萃取和富集. 对比0.5 μg·mL-1标样直接进样和10 ng·mL-1样品溶液经SFODME法萃取后进样测定的结果. 实验发现, 尽管初始浓度相差50倍, 经富集后2种待测物的响应远高于萃取前的响应(见图2). SFODME的富集倍数(EF)公式为: EF=Cf/C0, 其中Cf为富集后萃取剂中待测物浓度;C0为样品溶液中待测物初始浓度. 经计算, 实验中IPA和IBA的富集倍数分别为300和310, 显示SFODME技术具有强富集能力.
2.3 SFODME-HPLC检测2种生长素2.3.1 分析方法参数
在最优条件下, 建立SFODME-HPLC分析法用于2种生长素的检测. 配制各浓度的加标水溶液, 以峰面积为纵坐标、 浓度为横坐标, 拟合工作曲线. 方法的分析参数见表5, 检测限低达0.01 ng·mL-1. 日内精密度以同一天内连续5次进样(0.2 ng·mL-1加标水样进行萃取)来计算峰面积RSD, 日间精密度以连续5 d进样分析来评价. 2种物质峰面积RSDs小于7.35%, 表明该方法重现性良好.

表5 SFODME-HPLC方法的线性范围、 检测限及精密度
2.3.2 样品分析及回收率实验

图3 培养基实际样品和加标样品(2 ng·mL-1)的色谱图Fig.3 Chromatograms of culture media sample and spiked sample (2 ng·mL-1)
植物培养基干粉为实际样品. 称取3 g干粉用100 mL二次水加热搅拌溶解、 稀释. 该培养基稀释液经过SFODME萃取后进样, 测得富集后IBA含量为 0.17 mg·L-1. 经计算, 该培养基空白溶液中初始IBA浓度为0.55 ng·mL-1, 原干粉中IBA含量约为18 ng·g-1. 添加不同浓度的IBA、 IPA标准混合溶液, 进行SFODME-HPLC分析(见图3). 结果表明, 2种生长素的回收率在84.3%~125.9%之间, RSDs<5.1%(见表6). 因此, 方法准确、 可靠, 可应用于实际样品中生长素的测定.
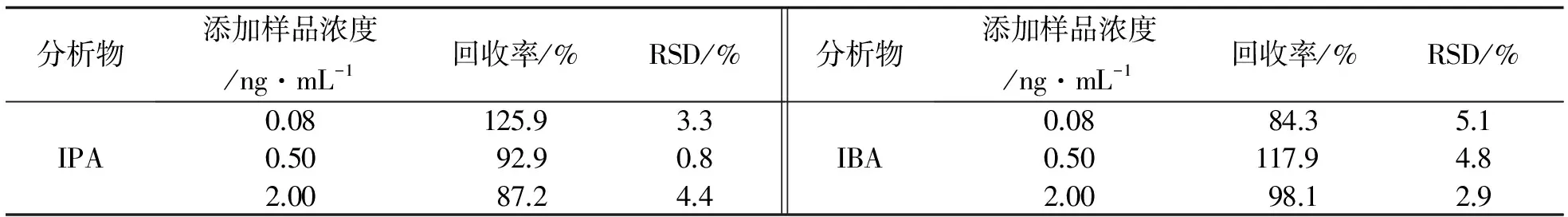
表6 2种生长素培养基加标回收率(n=3)
3 结论
研究采用正交实验优化萃取条件, 建立了SFODME-HPLC-FLD 新方法检测两种常见的植物生长素. 方法灵敏度高(检测限为0.01 ng·mL-1)、 消耗有机溶剂少(仅微升级)、 操作简单快速(10 min完成萃取), 能用于实际样品测定. 将此新技术与更多仪器联用, 用于各种复杂体系中痕量成分的分析应具有良好的应用前景.
[1] Jeannot M A, Cantwell F F. Solvent microextraction into a single drop[J]. Analytical Chemistry, 1996, 68(13): 2 236-2 240.
[2] He Y, Lee H K. Liquid-phase microextraction in a single drop of organic solvent by using a conventional microsyringe[J]. Analytical Chemistry, 1997, 69(22): 4 634-4 640.
[3] Stig P B, Knut E R. Liquid-liquid-liquid microextraction for sample preparation of biological fluids prior to capillary electrophoresis[J]. Analytical Chemistry, 1999, 71(14): 2 650-2 656.
[4] Rezaee M, Assadi Y, Hosseini M M,etal. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006, 1 116(1/2): 1-9.
[5] Zanjani M R K, Yamini Y, Shariati S,etal. A new liquid-phase microextraction method based on solidification of floating organic drop[J]. Analytica Chimica Acta, 2007, 585(2): 286-293.
[6] 王莹莹, 赵广莹, 常青云, 等. 悬浮固化液相微萃取技术研究进展[J]. 分析化学, 2010, 38(10): 1 517-1 522.
[7] Kamarei F, Ebrahimzadeh H, Yamini Y. Optimization of ultrasound-assisted emulsification microextraction with solidification of floating organic droplet followed by high performance liquid chromatography for the analysis of phthalate esters in cosmetic and environmental water samples[J]. Microchemical Journal, 2011, 99(1): 26-33.
[8]常青云, 周欣, 高书涛, 等. 悬浮固化液相微萃取-气相色谱联用测定水样中酰胺类除草剂残留[J]. 分析化学, 2012, 40(4): 523-528.
[9] Farahani H, Yamini Y, Shariati S,etal. Development of liquid phase microextraction method based on solidification of floated organic drop for extraction and preconcentration of organochlorine pesticides in water samples[J]. Analytica Chimica Acta, 2008, 626(2): 166-173.
[10] Ghambarian M, Khalili-Zanjani M R, Yamini Y,etal. Preconcentration and speciation of arsenic in water specimens by the combination of solidification of floating drop microextraction and electrothermal atomic absorption spectrometry[J]. Talanta, 2010, 81(1/2): 197-201.
[11] Dadfarnia S, Shabani A M H, Kamranzadeh E. Separation/preconcentration and determination of cadmium ions by solidification of floating organic drop microextraction and FI-AAS[J]. Talanta, 2009, 79(4): 1 061-1 065.
[12] 赵敏, 邵凤赟, 周淑新, 等. 植物生长调节剂对农作物和环境的安全性[J]. 环境与健康杂志, 2007, 24(5): 370-372.
[13] 颜金良, 俞明飞. 离子色谱法测定饮水中吲哚乙酸、 吲哚丙酸和吲哚丁酸含量[J]. 中国卫生检验杂志, 2013, 23(7): 1 723-1 724; 1 728.
[14] 王佳祥, 王珊珊, 赵平. 高效液相色谱法同时测定蔬菜及水果中的吲哚丁酸和萘乙酸[J]. 化学工程师, 2013, 212(5): 23-25.
(责任编辑: 洪江星)
Analysis of auxins by solidification of floating organic drop combined with high-performance liquid chromatography
LU Qiaomei1, 2, ZHANG Wenmin2, HUANG Chuanhui2, LU Minghua2, LI Jianrong3, 4, ZHANG Lan1, 2
(1. Analytical and Testing Center, Fuzhou University, Fuzhou, Fujian 350002, China; 2. Ministry of Education Key Laboratory of Analysis and Detection for Food Safety, Fuzhou University, Fuzhou, Fujian 350116, China;3. College of Food Science and Biotechnology, Zhejiang Gongshang University, Food Safety Key Laboratory of Zhejiang Province, Hangzhou, Zhejiang 310035, China; 4. Food Safety Key Laboratory of Liaoning Province,Bohai University, Jinzhou, Liaoning 121013, China)
Determination of two anxins (indole propionic acid and indole butyric acid) by solidification of floated organic drop microextraction with high-performance liquid chromatography-fluorescence detection (SFODME-HPLC-FLD) was established. The experimental conditions affecting the extraction process were optimized. The optimal conditions of SFODME were as follows: 50 μL dodecanol as extraction solvent, 20.0 mL sample solution with pH 3.0 and 0.25 g·mL-1NaCl. The above solution was extracted for 10 min at temperature of 26 ℃ and centrifugation speed of 1 800 r·min-1. Results showed that this SFODME approach had high sensitivity and good reproducibility, with relative standard deviations lower than 8.66%. Its linear range was 0.02~60 ng·mL-1, with the limit of detection of 0.01 ng·mL-1and the recoveries larger than 84.3%. This method was rapid, stable and environmentally benign, and it can be applied to real sample analysis.
solidified floating organic drop microextraction; high-performance liquid chromatography; liquid phase microextraction; auxin
10.7631/issn.1000-2243.2015.04.0554
1000-2243(2015)04-0554-06
2014-11-24
卢明华(1983-), 助理研究员, 主要从事色谱质谱分析、 药物分析研究, 349762886@qq.com
“十二五”国家科技支撑计划项目(2012BAD29B06); 福建省自然科学基金资助项目( 2010J05021); 福州大学科技启动专项(600852)
O657.7
A

