罗非鱼无乳链球菌LAMP快速检测方法的建立
郑磊,樊海平,吴斌,曾占壮,钟全福,张新艳
(福建省淡水水产研究所,福建福州 350002)
0 引言
随着罗非鱼养殖业的发展,罗非鱼链球菌病日趋严重,其发病面积之广、危害程度之重已成为罗非鱼养殖业发展的主要障碍,并造成重大的经济损失[1].农业部2008年新修订的《一、二、三类动物疫病病种名录》,鱼类链球菌病被列为三类动物疫病,其主要的病原菌是无乳链球菌(Streptococcus agalactiae)和海豚链球菌(Streptococcus iniae).罗非鱼链球菌病的病鱼主要症状为:体色发黑,临死前于水面打转或间隙性窜游,部分病鱼眼球突出或混浊发白,腹部体表具点状或斑块出血或溃疡,鳃盖内侧出血,肝脏、胆囊、脾脏肿大,严重时糜烂,肠道和胃积水或积黄色粘液.此病危害各种大小的鱼,100 g以上规格容易感染,传染性强,发病率达10%~30%,死亡率达25% ~80%,造成了严重的经济损失.目前,国内罗非鱼链球菌病害防控没有特效的药物,因此,建立罗非鱼无乳链球菌快速检测体系对罗非鱼养殖的健康发展能够起到积极作用.无乳链球菌链球的多重PCR及real-time PCR鉴定已有报道[2-4],但其检测方法耗时、设备要求高.环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是一种新颖的核酸扩增方法,具有特异性高、操作简单、肉眼判断结果的特点,已被广泛应用于病原微生物及寄生虫的检测[5-8].其中,王永等[9]和Kimura等[10]分别针对牛源的无乳链球菌FBS基因及人源的无乳链球菌CFB基因设计LAMP检测引物组,建立了LAMP检测方法.
无乳链球菌的血清学分类是依据其菌株的荚膜多糖的特异性,目前已经鉴定出10种不同的荚膜类型(Ia、Ib、II、III、IV、V、VI、VII、VII和 IX).其中 Ia、Ib和 III型为目前确定的水生动物源血清型[11-12].Brodeur等[13]的动物实验表明无乳链球菌表面免疫相关蛋白(surface immunogenic protein,SIP)广泛存在于多种血清型(Ia、Ib、II、III、V和VI)中,表明SIP基因存在于水生动物源的三种血清型.此外,SIP基因序列(登录号:FJ752159.1)Blast结果显示其与数据库中其它登陆SIP基因序列相似性为97%~100%,表明SIP具有高度的序列保守性,可成为罗非鱼无乳链球菌检测的重要候选基因.
本研究首次针对罗非鱼无乳链球菌SIP基因设计了LAMP检测引物组,对无乳链球菌病进行检测,优化反应条件,验证了方法的特异性和灵敏度,并应用该方法检测人工攻毒样品.
1 材料与方法
1.1 菌株
包括2株罗非鱼无乳链球菌株,8株其它链球菌属菌株及6株水体常见菌株,详见表1.
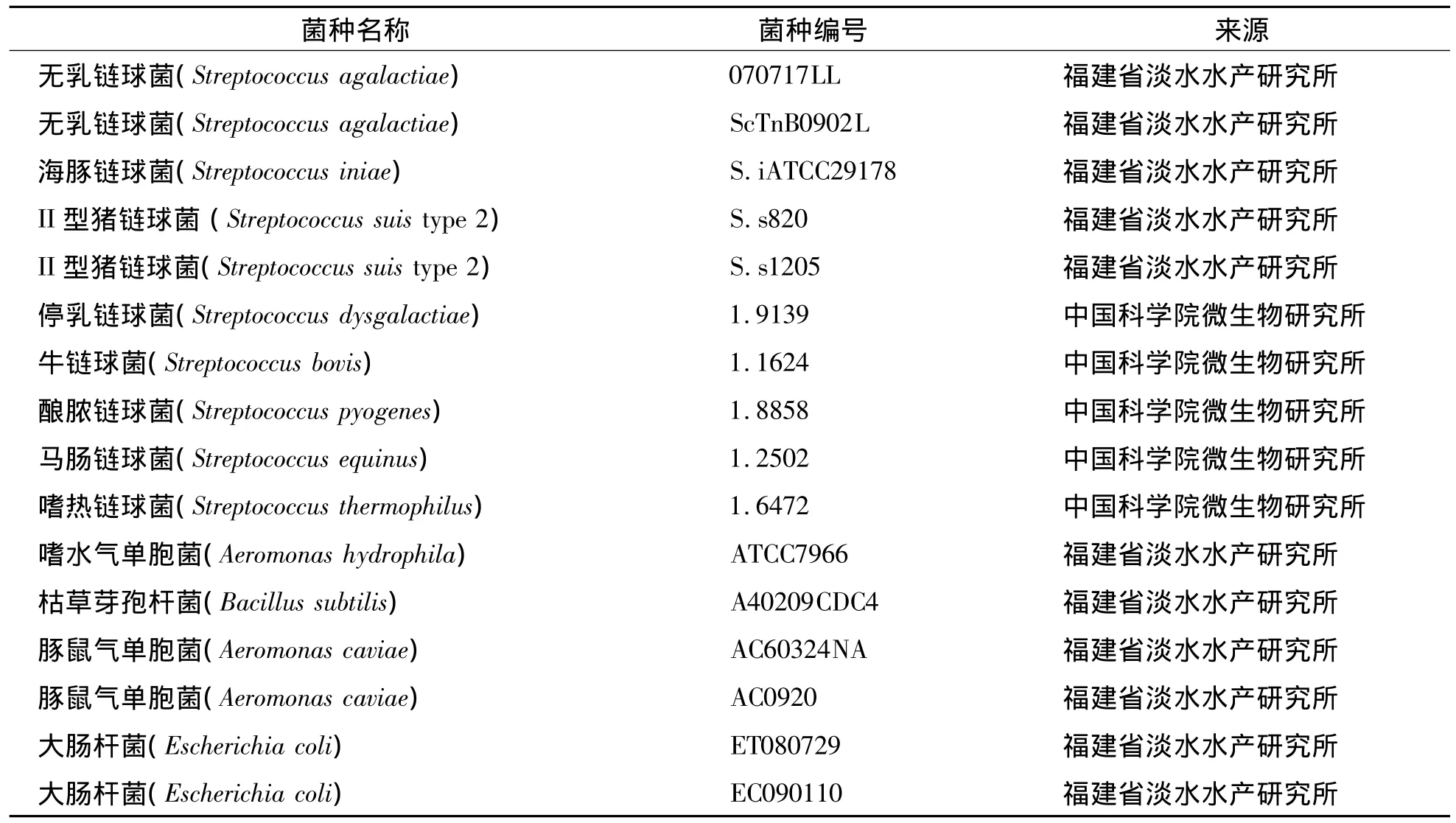
表1 实验菌株Tab.1 Bacterial strains
1.2 试剂
细菌DNA提取试剂盒及SYBR Green I购自厦门泰京生物技术公司;BstDNA聚合酶购自New England Biolabs公司;甜菜碱(Betain)购自Sigma公司;dNTPs、MgCl2、DL2000 DNA Marker和Premix Ex Taq购自TaKaRa公司;细菌培养基购自北京陆桥公司.
1.3 试验方法
1.3.1 细菌DNA提取
无乳链球菌(ScTnB0902L)接种脑心浸液培养基(BHI),28℃过夜培养,采用细菌DNA提取试剂盒提取DNA,-20℃保存备用.
1.3.2 引物设计
根据GenBank公布的无乳链球菌SIP基因序列(登录号:FJ752159.1),用Primer Explorer IV软件分析设计一套引物(F3、B3、FIP、BIP),分别是前外引物F3,后外引物B3,前内引物FIP,后内引物BIP,见表2.
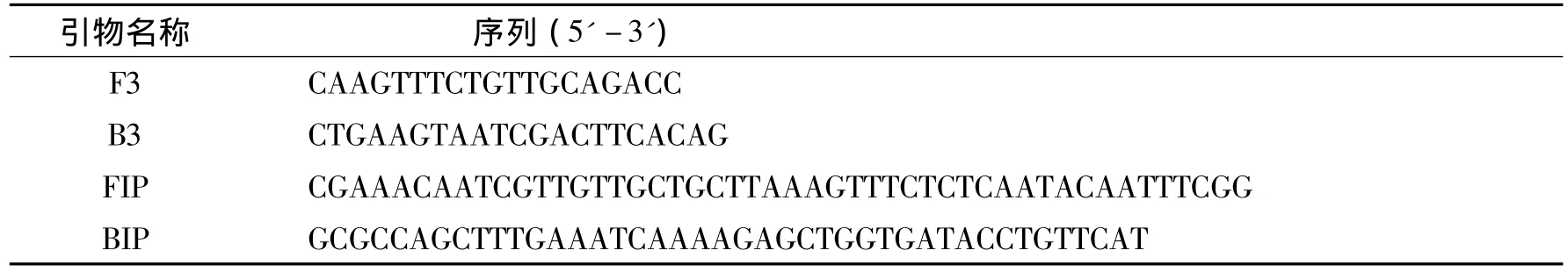
表2 LAMP引物Tab.2 Specific primer sequences for LAMP
1.3.3 LAMP 方法的建立
LAMP反应体系为25 μL.优化后的反应组分见表3.反应条件:混匀后将反应液放入恒温水浴锅,61℃反应60 min.反应产物采用琼脂糖凝胶电泳检测或直接加入2 μL荧光显色剂SYBR Green I(稀释100倍),观察颜色变化.
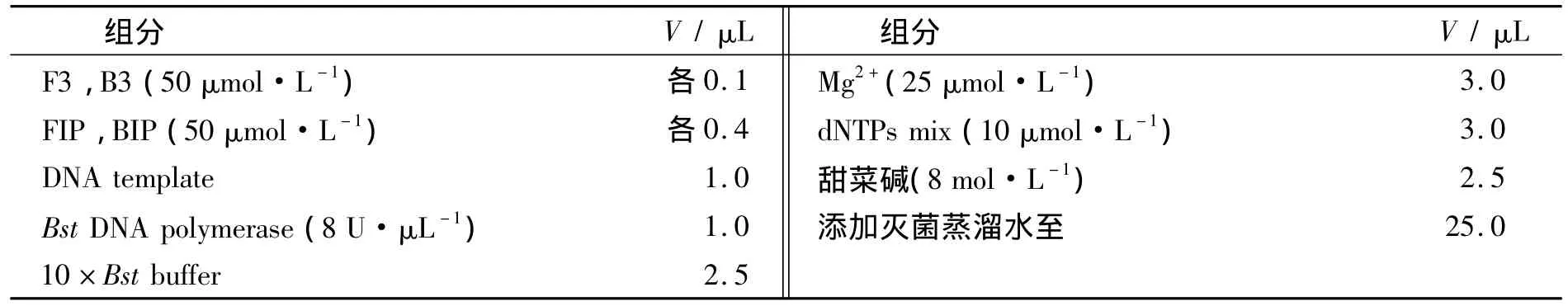
表3 LAMP反应体系组成Tab.3 Reaction composition of LAMP
1.3.4 LAMP 特异性
提取8株链球菌属和6株水体常见病原菌的DNA,采用1.3.3建立的LAMP反应体系检测,反应产物采用琼脂糖凝胶电泳检测.
1.3.5 LAMP方法检测无乳链球菌的灵敏度
无乳链球菌(ScTnB0902L)接种脑心浸液固体培养基(BHI)纯培养后,用灭菌的生理盐水洗脱,洗脱液进行10倍比稀释,各取每个稀释度的菌液1 mL,用试剂盒提取DNA后进行LAMP扩增.
1.3.6 LAMP 检测方法的应用
无乳链球菌(ScTnB0902L)接种脑心浸液固体培养基(BHI)纯培养后,用灭菌的生理盐水洗脱.罗非鱼每尾腹腔注射0.2 mL菌液,菌浓度为2.6×106CFU·mL-1,共注射11尾.24 h后,取其肝、肾和脾,用试剂盒提取DNA后进行LAMP扩增,同时采用福建省地方标准DB35/T 1354-2013《罗非鱼无乳链球菌病双重PCR诊断规程》鉴定.
2 结果与讨论
2.1 LAMP 扩增结果
采用1.3.3所述方法,无乳链球菌LAMP扩增产物电泳检测结果见图1,可以观察到LAMP反应的特异性梯状条带.图2为对应的LAMP扩增产物荧光显色结果,阴性组保持橙色不变,而加入无乳链球菌DNA的反应组颜色变为绿色,表明优化的LAMP反应体系可以有效地扩增无乳链球菌DNA.
2.2 LAMP方法检测无乳链球菌的特异性
采用1.3.4所述方法,特异性试验结果显示,以两株无乳链球菌DNA为模板扩增出特异性梯状条带,而8株链球菌属菌株及6株水体常见菌株均未扩增出相应产物(见图3(a)).图3(b)分别为对应的LAMP扩增产物荧光显色结果,2株无乳链球菌的反应组颜色变为绿色,其它14株非无乳链球菌保持橙色未变.测试结果表明针对无乳链球菌SIP基因为模板的LAMP检测方法具有良好的特异性.
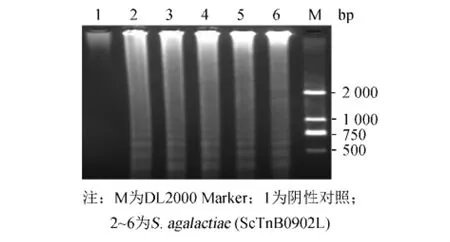
图1 无乳链球菌LAMP产物电泳检测结果Fig.1 Electrophoresis of LAMP products of Streptococcus agalactiae

图2 无乳链球菌LAMP产物荧光染色结果Fig.2 The LAMP products of Streptococcus agalactiae after adding fluorescent dye

图3 LAMP检测无乳链球菌特异性结果Fig.3 Specificity of LAMP primers detection Streptococcus agalactiae
2.3 LAMP方法检测无乳链球菌的灵敏度
经平板计数,原始无乳链球菌菌液浓度为3.0×108CFU·mL-1.10 倍倍比稀释菌液并提取DNA进行LAMP检测.电泳检测结果显示,当菌液稀释到3.0×101CFU·mL-1时仍可见梯状扩增产物(见图4),表明LAMP法检测灵敏度达30 CFU·mL-1.
2.4 LAMP检测方法的应用
应用LAMP方法,对人工感染的11尾罗非鱼的肝、肾和脾进行检测.结果表明,LAMP方法检测11尾鱼全部呈阳性,检测结果与福建省地方标准DB35/T 1354—2013《罗非鱼无乳链球菌病双重PCR诊断规程》一致.

图4 无乳链球菌LAMP检测灵敏度的电泳图Fig.4 Sensitivity of LAMP products for Streptococcus agalactiae
3 结论
相比于PCR检测方法,LAMP反应过程无需高精密度的温度循环装置,对设备要求低,操作简单,检测成本低,产物可通过离心观察是否有沉淀,或加入荧光显色剂观察是否变色来判断检测结果,适用于基层水产科研机构、各类水产养殖场的使用,具有实践应用价值.
研究结果显示,建立的LAMP检测方法特异性好,检测灵敏度高达30 CFU·mL-1,1 h即可完成扩增,为罗非鱼无乳链球菌病的快速诊断提供一种重要的技术手段,对于罗非鱼无乳链球菌病的早期诊断具有重要意义.
[1]周清,沈锦玉,徐洋,等.海南罗非鱼无乳链球菌分离鉴定及其特性研究[J].生物学杂志,2012,29(2):27-30.
[2]汤炜,周雪,于立权,等.无乳链球菌及其血清型的 PCR方法鉴定[J].中国预防兽医学报,2013,35(7):595-598.
[3]Bergseng H,Bevanger L,Rygg M,et al.Real-time PCR targeting theSIPgene for detection of group BStreptococcuscolnization in pregnant women at delivery[J].Journal of Medical Microbiology,2007,56(2):223 -228.
[4]黎炯,叶星,卢迈新,等.双重PCR快速鉴别无乳链球菌和海豚链球菌[J].湖南农业大学学报:自然科学版,2010,36(4):449-452.
[5]张金凤,曾令兵,张辉,等.草鱼呼肠孤病毒逆转录环介导等温扩增(RT-LAMP)检测方法的建立[J].中国水产科学,2013,20(7):129-136.
[6]Dugan L,Bearinger J,Hinckley A,et al.Detection ofBacillus anthracisfrom spores and cells by loop-mediated isothermal amplification without sample preparation[J].Journal of Microbiological Methods,2012,90(3):280 -284.
[7]Sappata A,Jaroenramb W,Puthawibool T,et al.Detection of shrimpTaura syndromevirus by loop-mediated isothermal amplification using a designed portable multi- channel turbidimeter[J].Journal of Virological Methods,2011,175(2):141 -148.
[8]王国良,周旻曦,徐益军.刺激隐核虫 LAMP检测方法的建立[J].中国预防兽医学报,2013,35(7):574-577.
[9]王永,赵新,景海春,等.LAMP检测无乳链球菌方法的建立及应用[J].华北农学报,2009,24(5):234-238.
[10]Kimura K,Yanagisawa H,Wachino J,et al.Rapid and reliable loop-mediated isothermal amplification method for detectingStreptococcus agalactiae[J].Japanese Journal of Infectious Diseases,2013,66(6):546 -548.
[11]Vandamme P,Devriese L A,Pot B,et al.Streptococcusdifficile is a nonhemolytic group B,type IbStreptococcus[J].International Journal of Systematic Bacteriology,1997,47(3):81-85.
[12]Suanyuka N,Kongb F,Kob D,et al.Occurrence of rare genotypes ofStreptococcus agalactiaein cultured red tilapiaOreochromissp.and Nile tilapiaO.niloticusin Thailand-relationship to human isolates[J].Aquaculture,2008,284(1):35-40.
[13]Brodeur B R,Boyer M,Charlebois I,et al.Identification of group BstreptococcalSIP protein,which elicits cross-protective immunity[J].Infect Immun,2000,68(10):5 610 -5 618.

