立枯丝核菌对马铃薯侵染过程的显微结构观察与胞壁降解酶活性的测定
拓宁,张君,邱慧珍*,张文明,张春红,刘星,朱静
(1.甘肃农业大学资源与环境学院,甘肃 兰州 730070; 2.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070)
立枯丝核菌对马铃薯侵染过程的显微结构观察与胞壁降解酶活性的测定
拓宁1,2,张君1,2,邱慧珍1,2*,张文明1,2,张春红1,2,刘星1,2,朱静1,2
(1.甘肃农业大学资源与环境学院,甘肃 兰州 730070; 2.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070)
由立枯丝核菌引起的马铃薯茎溃疡病(黑痣病)已成为限制甘肃省马铃薯产业健康发展的主要土传病害之一。本研究在盆栽试验条件下将病原菌接种于马铃薯植株的茎基部,显微观察侵染过程,并测定了胞壁降解酶活性的变化。结果表明,土壤中接种病原菌后,马铃薯侵染顺序依次为:芽-茎-根-匍匐茎-块茎;接菌12 h后菌丝开始附着寄主表面,36 h后形成附着胞,48 h后形成侵染垫;电镜下可见,细胞壁变形、断裂,细胞膜破损,质体结构变形,细胞质溶解和质壁分离等;纤维素酶(Cx)、多聚半乳糖醛酸酶(PG)和果胶甲基半乳糖醛酸酶(PMG)的活性高达1.7,2.9和3.1 μg/(h·g),显著高于对照,尤其是PG和PMG的活性,为对照的两倍。这些酶活性的提高可能与组织坏死有关。
立枯丝核菌;侵染过程;超微结构;透射电镜;胞壁降解酶
马铃薯(Solanumtuberosum)是位居小麦(Triticumaestivum)、水稻(Oryzasativa)和玉米(Zeamays)之后的第四大粮食作物[1],近年种植面积和产量持续增长,已成为调整中国种植业结构和农民增收的主要粮食作物之一[2]。甘肃省以其独特的土壤和气候特点成为我国重要的马铃薯种薯和商品薯基地以及淀粉加工基地,马铃薯生产已成为带动全省农业和农村经济发展,促进农业增效,农民增收的战略性主导产业,在保障我省粮食安全和主产区农民收入方面发挥着十分重要的作用[3-6]。而近年来马铃薯真菌病害的普遍发生,已成为马铃薯产业健康发展的主要限制因子[4-5,7-8],尤其是由立枯丝核菌(Rhizoctoniasolani)侵染引起的马铃薯茎溃疡病,发病日趋严重,对马铃薯块茎产量、商品价值和马铃薯产业的可持续发展产生了极大影响[9-11]。因此,探明马铃薯立枯丝核菌的致病机理对病害的有效防控具有十分重要的意义。
由立枯丝核菌引起的马铃薯茎溃疡病(又称茎基腐病、黑痣病、丝核菌溃疡病和黑色粗皮病)是一种真菌性病害,以带病种薯和土壤为主要传播途径[12-13]。主要危害幼芽、茎基部、匍匐茎和薯块[14-17]。田间发病的马铃薯植株最直观的症状表现为茎溃疡和茎基部隘缩,感病植株的块茎表现黑痣。由于立枯丝核菌可侵染马铃薯不同部位引起多种症状,病理和生理机制可能非常复杂,所以已有的研究主要集中在立枯丝核菌融合群鉴定[7]、生物学特性[18]以及病害的防治技术等方面[19-20],而对病原菌致病机理的研究鲜有报道。
水稻立枯丝核菌的研究指出,胞壁降解酶的产生是水稻立枯丝核病菌重要的致病因子之一,人工培养产生的胞壁降解酶能引起水稻叶鞘细胞膜透性改变和组织浸解,可损伤组织结构,使细胞壁断裂,细胞器变形等,在病斑形成和扩展中起重要作用[21-22]。另有研究指出,果胶酶是水稻立枯丝核菌的致病因子,病菌产生果胶酶和纤维素酶的量与致病性密切相关[23]。
为此,我们通过接种病原菌,利用透射电镜技术,结合植株形态组织学研究的方法,观察立枯丝核菌侵染马铃薯芽和茎等器官的发病进程和侵染结构的形成过程以及立枯丝核菌对马铃薯茎基部组织和细胞的破坏作用,同时测定茎基部组织胞壁降解酶的活性,旨在探明马铃薯立枯丝核菌可能的致病机理,以及病原菌胞壁降解酶的产生与寄主植物的组织和细胞遭受破坏作用之间的关系,为马铃薯茎溃疡病的防控提供基础。
1 材料与方法
1.1试验设计
盆栽试验于2014年4-9月在甘肃农业大学网室进行,设2个处理:对照,空白不接菌的PDB培养基;处理,接入病原菌的PDB培养基,将病原菌按0.5 g/kg的量均匀拌入灭菌土壤中。采用20 cm×25 cm陶土盆,每盆装土9 kg,每盆种植4株,每处理种20盆,共80次重复。
供试品种:马铃薯“大西洋”,由甘肃省景泰县条山农场提供;供试菌株:马铃薯立枯丝核菌(R.solani)-JT18,由本课题组提供。供试土壤:采自景泰条山农场。
1.2病原菌和供试土壤的准备
将立枯丝核菌菌饼(直径9 mm)接种于PDB培养基中,于25℃ 黑暗培养3 d,用无菌纱布过滤菌丝,自然晒干称重后豆浆机打碎备用。
土壤进行高压灭菌,121℃灭菌30 min,取出后晾2 h,进行第2次灭菌,方法同上,之后自然晾干备用。
1.3样品采集与处理
分别在苗期取样5次(播种后23,26,29,32,35 d),现蕾期取样1次(50 d),盛花期1次(65 d),每处理随机取样6株,带回实验室后取处理茎基部发病组织1 g用于测定胞壁降解酶,设3次重复。
于播种30 d后取对照健康幼苗茎基部,用无菌水冲洗3遍后,剪成3 cm的小段,放在盛有0.8%的500 mL水琼脂的盘中,将在PDA培养基上培养3 d的病原菌菌饼(0.9 mm)接种于茎段上,每茎段接种一个菌饼,设6次重复。25℃黑暗离体培养,用于观察立枯丝核菌侵染结构。
于播种后35,50和65 d取对照茎基部健康组织与处理茎基部发病组织,无菌水洗涤3遍后切成1 mm3大小的组织块,3%的戊二醛4℃下固定备用,用于观察立枯丝核菌对马铃薯组织和细胞破坏作用的超微结构变化。试验设3次重复。
每次取样后观察马铃薯形态特征,记录病情指数与发病进程。
1.4立枯丝核菌对马铃薯侵染过程的观察
将播种30 d后离体接种培养的马铃薯地下茎分别于接种后4,8,12,24,36,48 h取样,从菌片边缘横切制片。以不接菌的健康马铃薯苗为对照。将切片用95%酒精和冰醋酸等量混合固定5 min,然后用0.05%的棉兰染液染色20 min,在光学显微镜下观察并拍照[24]。
1.5立枯丝核菌对马铃薯组织和细胞的破坏作用
分别取已处理好对照茎基部健康组织与处理发病组织,经3%的戊二醛4℃下固定后,系列丙酮脱水,Epoin812树胶包埋,切片染色后用JEM-1230型透射电镜观察[25-26]。
1.6立枯丝核菌对马铃薯茎基部胞壁降解酶活性的影响
1.6.1胞壁降解酶的提取 参照陈夕军等[21]的方法,在样品中加入5 mL 0.25 mol/L 氯化钠提取液,适量石英砂冰浴研磨。过滤后4℃下15000 r/min离心20 min,取上清液(粗酶液)备用。
1.6.2胞壁降解酶的纯化 取上述提取的粗酶液,加入硫酸铵至60%饱和度,4℃下静置5 h后, 1500 r/min离心20 min,弃上清液。用50 mmol/L醋酸-醋酸钠缓冲液(pH 5.0)溶解沉淀,并在该缓冲液中于4℃ 下透析2 d,每12 h换1次透析液,纯化的酶保存在-18℃下备用。
1.6.3胞壁降解酶的测定 采用紫外—可见光分光光度法测定胞壁降解酶的活性。取上述粗酶液,分别加入纤维素酶Cx(B-1, 4-内切葡聚糖酶),果胶酶PG(多聚半乳糖醛酸酶)和PMG(果胶甲基半乳糖醛酸酶)的反应底物,利用 DNS法在540 nm处测定OD值,分别计算活性。酶活单位用每h每g样品在50℃催化底物生成半乳糖醛酸的质量表示(即μg/h·g)[27]。
1.7数据处理
用SPSS 21.0软件对试验数据进行统计分析,同一时间不同处理的数据采用Duncan法完成;图表绘制在Microsoft Excel 2007软件上进行。
2 结果与分析
2.1马铃薯立枯丝核菌的侵染过程
2.1.1马铃薯茎溃疡病发病进程 于播种10 d后开始取样,观察到马铃薯茎溃疡病的整个发病进程:马铃薯播种后10 d开始发育芽,20 d后芽上出现褐色病斑,该部位生长点坏死,不再继续生长。感病重者幼芽腐烂死亡,形成芽腐,(图1-1,1-2)。播种30 d后马铃薯全部出苗,茎开始发育,35 d后在茎基部观察到褐色病斑(茎溃疡),感病重者可造成立枯(图1-3,1-4)。40 d后根系黑褐色菌核或褐色溃疡,重者腐烂死亡(图1-5),此时匍匐茎开始发育。50 d后在匍匐茎上可观察到黑褐色病斑,病斑处不再发育,顶端不能膨大,不再形成薯块(图1-6)。60 d后开始形成薯块,处理较对照薯块体积小,数量少。75 d后在薯块上可观察到少量黑痣,为黑褐色菌核(图1-7)。90 d后收获时,在处理盆栽中发现,成熟块茎的感病程度不同,轻者表面形成的黑痣量较少,重者形成大量菌核,其大小形状不规则,呈土壤颗粒状,且不易被冲洗掉,而菌核下边的组织完好(图1-8,1-9)。观察中统计接种病原菌后植株发病率为72.5%,有黑痣的块茎占总块茎数的69.2%。结果表明,立枯丝核菌对马铃薯的侵染随着各器官的发育而发展,侵染顺序依次为:芽-茎-根-匍匐茎-块茎。
2.1.2马铃薯立枯丝核菌侵染结构的形成 取播种30 d后的对照健康马铃薯茎基部离体培养,观察其显微结构,发现接菌4 h后,在培养基表面即可看到菌丝开始沿着茎段表面生长,但显微结构显示尚未看到菌丝(图2-1)。12 h后,在寄主表面可看到菌丝开始附着生长(图2-2),24 h后附着菌丝少量结合在一起,开始轻度缠绕,36 h后菌丝顶端开始膨大变粗,分枝增多,分枝再分裂出许多粗短的侧枝,开始形成附着胞的雏形。至48 h后,形成侵染结构,菌丝继续分枝,顶端膨大,分枝再不断分出许多短粗的侧枝,侧枝顶端膨大形成附着胞。菌丝分枝间相互交错,缠绕,逐渐形成网状结构(图2-3),随后,网状结构生出的侧枝紧密结合在一起,聚集成团,形成侵染垫(图2-4)。侵染垫紧贴在寄主表面,呈椭圆形。

图1 马铃薯茎溃疡病发病进程
1:播种20 d后对照马铃薯芽;2:播种20 d后处理马铃薯芽,出现病斑;3:播种35 d后对照马铃薯茎;4:播种35 d后处理马铃薯茎,出现病斑;5:播种40 d后处理马铃薯根出现褐色溃疡斑;6:播种50 d后处理马铃薯匍匐茎出现病斑;7:播种75 d后处理马铃薯形成少量黑痣;8:播种90 d后形成的少量黑痣;9:播种90 d后形成的大量黑痣。
1:Control potato buds after seeding 20 d; 2:Treatment potato buds show scab after seeding 20 d; 3:Control potato stems after seeding 35 d; 4:Treatment potato stems show scab after seeding 35 d; 5:Treatment potato roots show brown ulceration after seeding 40 d; 6:Treatment potato stolons show scab after seeding 50 d; 7:Treatment potato tubers show little black scurf after seeding 75 d; 8:Treatment potato tubers show little black scurf after seeding 90 d; 9:Treatment potato tubers show more black scurf after seeding 90 d.
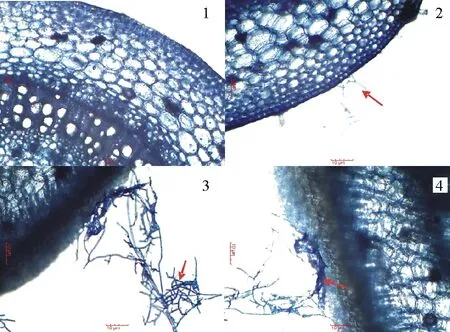
图2 马铃薯立枯丝核菌侵染结构的形成
1:接菌4 h后组织结构清晰可见(×100);2:接菌12 h后可见少量菌丝附着(×100);3:接菌48 h后形成附着胞,菌丝形成网状结构(×100);4:网状结构形成侵染垫(×100)。
1:Organizational structure is clearly visible after inoculation 4 h(×100); 2:Few hyphae were attached after inoculation 12 h (×100); 3:Appressoria formation and hyphae a mesh structure 48 h after inoculation(×100); 4:Infection cushions formed (×100).
2.2立枯丝核菌对马铃薯组织和细胞的破坏作用
透射电镜的结果显示在菌丝侵入前,细胞结构清晰可见,细胞壁,质膜完整光滑,核质丰富。质体(主要为造粉体)与线粒体等细胞器紧靠细胞壁排列,形态规则正常。菌丝侵入后马铃薯茎基部细胞发生了明显的变化。播种后35 d电镜结果显示细胞壁缝隙增大,细胞壁变形,粗细不均(图3-1,3-2),菌丝可穿透淀粉粒,淀粉粒体积变大,数量增多(图3-3,3-4),并挤压细胞核,使核缢缩(图3-5);播种后50 d结果显示对细胞器造成了影响,质体结构变形,片层结构消失(图3-6,3-7),同时细胞壁断裂,细胞膜破损(图3-8);播种后65 d结果显示,细胞质溶解,质壁分离,细胞器离壁,结构松散(图3-9)。
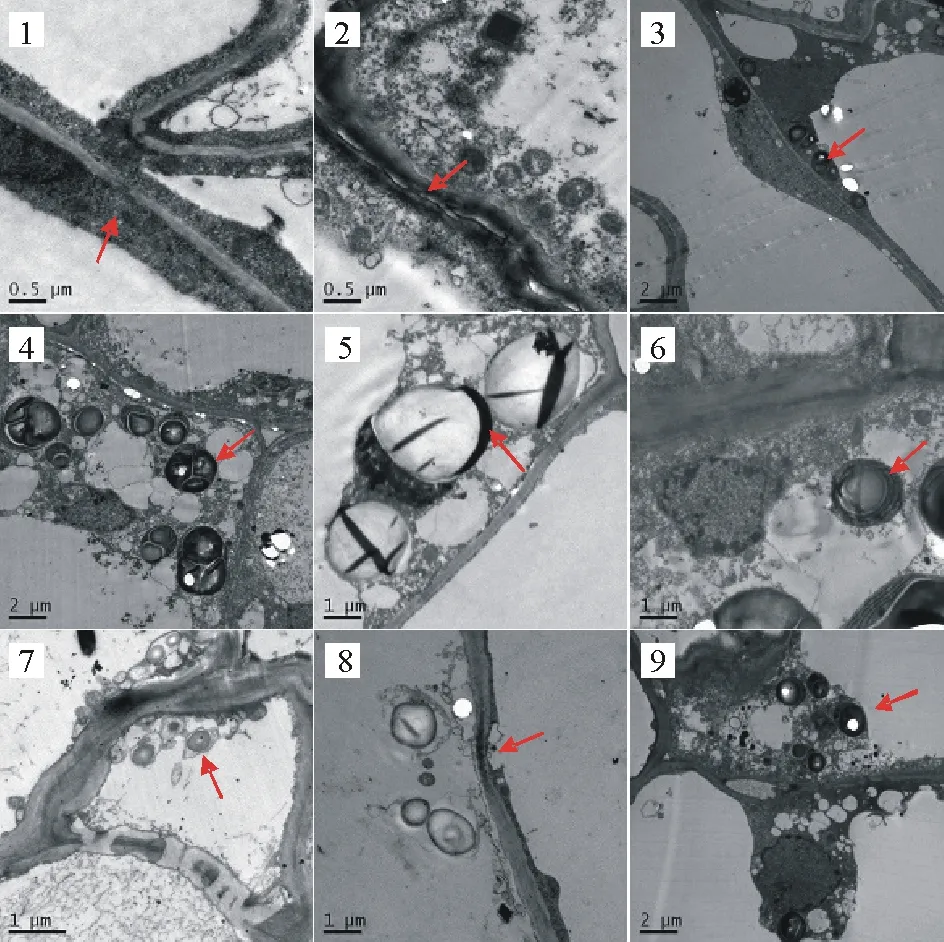
图3 立枯丝核菌对马铃薯组织和细胞的破坏作用
1:对照马铃薯细胞壁膜完整(×20000);2:处理马铃薯细胞壁变形(×20000);3:对照马铃薯淀粉粒(×5000);4:处理马铃薯淀粉粒,数量增多,体积变大(×5000);5:菌丝穿透淀粉粒,并挤压细胞核(×10000);6:对照马铃薯质体片层结构清晰(×10000);7:处理马铃薯质体变形,片层结构消失(×15000);8:对照马铃薯细胞膜破损(×10000);9:处理马铃薯细胞质溶解,质壁分离(×5000)。
1:The normal structure of cell membrane in control potato (×20000); 2:Deformation of potato cell wall in treatment potato (×20000); 3:Starch grains in control potato (×5000); 4:More and bigger starch grains in treatment potato (×5000); 5:Hyphae penetrate starch grains and squash nuclear (×10000); 6:Plastid lamellar structure is distinct in control potato (×10000); 7:Plastid structural deformation, lamellar structure disappearance in treatment potato (×15000); 8:Cell membranes damage in treatment potato (×10000); 9:Cytoplasm dissolution and plasmolysis (×5000).
2.3立枯丝核菌对马铃薯茎基部胞壁降解酶活性的影响
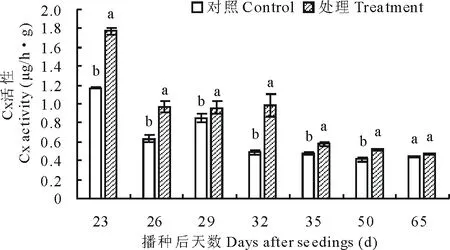
图4 不同时期纤维素酶(Cx)活性变化
试验结果表明,处理马铃薯茎基部组织的两种果胶酶,多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)和纤维素酶(Cx)的活性均高于对照。
2.3.1立枯丝核菌对纤维素酶活性的影响 如图4所示,处理马铃薯在播种后23 d酶活性达到最高峰,达到1.7 μg/(h·g),显著高于对照,至播种后50 d,酶活性略有下降,但始终与对照差异显著。
2.3.2立枯丝核菌对果胶酶活性的影响 PG活性测定结果如图5所示,测定时期内处理活性始终显著高于对照。播种23 d后酶活性最高,达到2.9 μg/(h·g),高于对照141.67%。略下降后又呈上升趋势,在32 d时上升到第2个活性高峰,达到2.6 μg/(h·g),之后呈下降趋势。
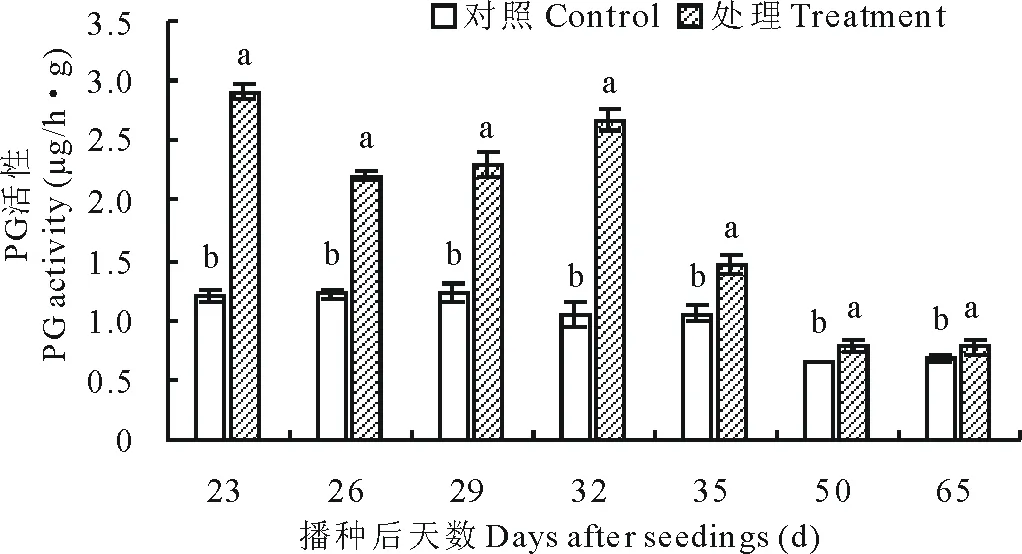
图5 不同时期多聚半乳糖醛酸酶(PG)活性变化
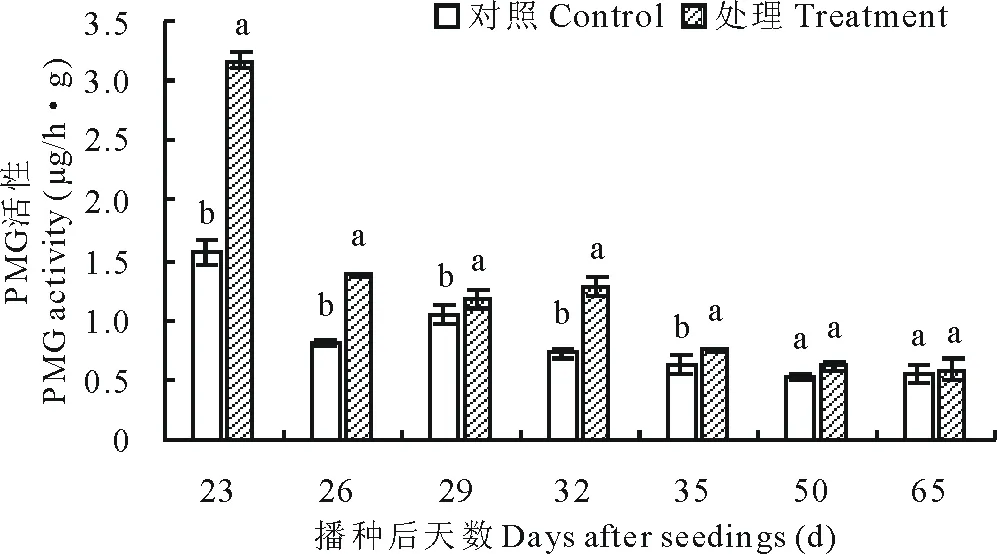
图6 不同时期果胶甲基半乳糖醛酸酶(PMG)活性变化
如图6所示,病原菌对马铃薯茎基部PMG活性造成了显著影响,在播种后23 d处理马铃薯茎基部酶活性显著高于对照,达到3.1 μg/(h·g),为对照的2倍。在26 d时开始呈下降趋势,50 d后处理与对照酶活性基本相同,无显著差异。
根据已有的研究表明,立枯丝核菌侵染马铃薯主要是在出苗之前,对芽的侵染带来出苗率低等问题[15],因此本实验在苗期连续取样,结果显示,在播种23 d后,处理马铃薯茎基部胞壁降解酶活性含量均为最高,分别达到1.7,2.9和3.1 μg/(h·g),其中PG与 PMG活性为对照的两倍。说明它们在病斑形成或扩展过程中可能交替或协同发挥作用。
3 讨论
本研究通过盆栽试验,首次观察到立枯丝核菌对马铃薯芽、茎、根等器官的侵染过程,研究表明,病原菌对马铃薯各器官的侵染都随着器官发育而发展,侵染顺序依次为:芽-茎-根-匍匐茎-块茎。病原菌侵染寄主植物后依次形成:芽上的褐色病斑、芽腐,茎基部形成褐色病斑,植株立枯,根系黑褐色菌核或褐色溃疡,根系腐烂死亡,匍匐茎黑褐色病斑,顶端不再膨大,薯块上形成黑痣。并发现一般在器官形成10 d左右可观察到病斑出现。对马铃薯茎溃疡病已有的研究表明,随着生育期的延长,感病程度增加,器官表面形成菌核后,变为黑褐色病斑,继而茎基部溃疡斑造成立枯,最后出现腐烂现象,使芽、茎、根等都不能继续生长,器官死亡[13,28]。
本研究发现,在立枯丝核菌的侵染过程中,会形成附着胞与侵染垫的侵染结构,但与在小麦,水稻及玉米上已有的研究结果相比有差异。本研究中尚未发现刘雪梅和肖建国[29]研究发现的菌丝圈结构,与陶家凤[30]的研究结果类似。在形成侵染结构的时间上不同作物也存在差异,本研究表明,在接种24 h后出现侵染结构雏形,36 h后形成附着胞,48 h后形成侵染垫,继而再通过表皮或直接进入组织。可能在接种36~48 h侵入寄主。陈捷等[31]在玉米上的研究结果显示,侵染时间在12~24 h之间,也晚于陶家凤[30]对水稻的研究,该研究表明在接种10~12 h后侵入寄主,16 h即可在寄主细胞中发现立枯丝核菌菌丝。
立枯丝核菌在不同作物上形成侵染结构的种类和入侵时间之间存在差异,可能原因一是立枯丝核菌对不同寄主侵染过程不同,二是立枯丝核菌种类较多,根据陶家凤[30]的研究表示不同融合群之间入侵时间不同,因此菌株的差异也可能带来入侵时间与侵染结构的不同。具体原因有待进一步研究。
病原菌接种后马铃薯茎基部出现黑褐色溃疡病斑,电镜结果显示,立枯丝核菌侵染马铃薯茎基部后,可使茎基部组织结构发生变化,细胞遭受破坏。
胞壁降解酶测定结果表示,在对照健康茎基部组织中均可测到Cx、PG和PMG,但活性较低,可能是正常的马铃薯茎基部细胞会产生少量的胞壁降解酶,当接种病原菌后,病原菌产生酶或刺激寄主本身酶活性提高[32],导致处理后马铃薯茎基部胞壁降解酶活性上升,显著高于对照。35 d后开始呈下降趋势,至65 d基本与健康组织活性相同,说明此时酶活性相应恢复到正常水平,不再发挥作用,这与玉米茎腐病[32],黄瓜棒孢叶斑病[33],水稻纹枯病[21],马铃薯干腐病[2]的研究结果一致。表明病原菌接种后对马铃薯植株茎基部细胞胞壁降解酶活性的提高,可能是马铃薯茎基部器官和细胞受到破坏的重要原因之一。
这一结论已在其他作物上得到研究证实。陈夕军等[21]的研究结果表明,水稻纹枯病菌产生的胞壁降解酶能引起水稻叶鞘的细胞膜损伤,并且病斑部胞壁降解酶活性显著高于健康组织。张红等[22]的研究结果表明,果胶酶和纤维素酶可使水稻叶鞘细胞超微结构受到严重破坏,如细胞壁部分裂解、叶绿体和线粒体损伤等。陈捷等[34]发现玉米胚根经胞壁降解酶处理后,细胞壁变薄、粗细不均,局部变形、断裂,相邻细胞壁消失,分离严重,细胞器分辨不清,结构松散。这些结果提示病原菌侵染后,胞壁降解酶具有显著的致病作用。Pierson和Walker[35]的研究推测纤维素酶在分解细胞壁中可能起到重要作用。李宝聚等[36]的研究结果表明在胞壁降解酶对黄瓜叶片细胞的作用过程中,首先是果胶酶降解果胶层,然后是纤维素酶、果胶酶对栅栏组织的分解,最后是纤维素酶作用于薄壁细胞壁,二者协同作用于细胞内部组织。
4 结论
本实验认为立枯丝核菌侵染马铃薯的过程首先是菌丝在土壤中生长,扩展遇到寄主后开始附着在其表面。附着生长48 h后,菌丝形成侵染结构,胞壁降解酶活性上升,导致细胞壁受损,使细胞壁变形、断裂,从而使菌丝直接进入细胞,侵入后,缠绕并穿透淀粉粒,推测可能利用其中的营养物质不断繁殖,之后破坏其他细胞器,直至细胞质溶解,细胞器结构松散,细胞凋亡。从器官发育、菌丝附着、侵入细胞到植株感病,这一过程可能会历时10 d左右完成,因此芽、茎、根等器官发育10 d后表现出病症。关于立枯丝核菌的致病机理,国内外都有研究,可尚无定论,认为立枯丝核菌的致病机理是复杂的,在病菌侵染的过程中,胞壁降解酶是如何作用的,还需进一步研究。
[1] Xie C H.Potato industry:status and development.Journal of Huazhong Agricultural University(Social Sciences Edition), 2012, 97(1):1-4.
[2] Yang Z M, Bi Y, Li Y C,etal.Changes of cell wall degrading enzymes in potato tuber tissue slices infected byFusariumsulphureum.Scientia Agricultura Sinica, 2012, 45(1):127-134.
[3] Wang B, Ma Y L, Zhang Z B,etal.Potato viruses in China.Crop Protection, 2011, 30:1117-1123.
[4] Lu J W, Qiu H Z, Zhang W M,etal.Characteristics of dry matter and potassium accumulation and distribution in potato plant in semi-arid rainfed areas.Chinese Journal of Applied Ecology, 2013, 24(2):423-430.
[5] Meng P P, Liu X, Qiu H Z,etal.Fungal population structure and its biological effect in rhizosphere soil of continuously cropped potato.Chinese Journal of Applied Ecology, 2012, 23(11):3079-3086.
[6] Li F, Yue Y.Development strategy of potato industrial cluster in Gansu Province.Crops, 2011, (4):11-15.
[7] Wang Y, Yang Z H, Qin Y X,etal.Analysis on anastomosis groups ofRhizoctoniasolaniAG2.1 and AG3 from potato (Solanumtuberosum).Journal of Agricultural Biotechnology, 2013, 21(2):230-237.
[8] Chen S Q, Wang S R.Antagonistic effect of actinomycetes D01 against four strains potato pathogens.Acta Prataculturae Sinica, 2014, 23(5):365-369.
[9] Yu B, Shen B Y, Wang W,etal.Effects of different potato varieties on preventing continuous cropping obstacle in the arid regions.Journal of Gansu Agricultural University, 2012, 47(4):43-47.
[10] Niu X Q, Li J H, Zhang J L,etal.Changes ofFusariumin rhizosphere soil under potato continuous cropping systems in arid-irrigated area of Gansu Province.Acta Prataculturae Sinica, 2011, 20(4):236-243.
[11] Wang F S, Duan X Q, Du Y C.The causes and comprehensive control measures of potato disease in Tongwei county.Gansu Agricultural Science and Technology, 2007, 3:54-55.
[12] Hadi M R, Balali G R.The effect of salicylic acid on the reduction ofRizoctoniasolanidamage in the tubers of marfona potato cultivar.American Eurasian Journal of Agriculture & Environment Science, 2010, 7(4):492-496.
[13] Chen W L.Research progress of black scurf in potatoes.Chinese Potato Journal, 2012, 26(1):49-51.
[14] Zhang X Y, Yu X X, Gao X,etal.The changes on MDA content, cell membrane permeability and PAL activity after inoculating with toxin ofRizoctoniasolaniin potato.Journal of Inner Mongolia Agricultural University, 2012, 33(2):16-20.
[15] Cao C M, Li W G, Zhang J P,etal.The current research status of potato black scurf.Chinese Potato Journal, 2009, 23(3):171-173.
[16] Atkinson D, Thornton M K, Miller J S.Development ofRhizoctoniasolanion stems, stolons and tubers of potatoesⅠ.effect of inoculum source.American Journal of Potato Research, 2010, 87:374-381.
[17] Woodhall J W, Lees A K, Edwards S G,etal.Infection of potato byRhizoctoniasolani:effect of anastomosis group.Plant Pathology, 2008, 57:897-905.
[18] Liu B Y, Hu J, Meng M L,etal.Molecular identification and biological characters of the pathogen causing black scurf disease in potato.Acta Phytophylacica Sinica, 2011, 38(4):379-380.
[19] Qiu G W.The occurrence and prevention of potato black scurf disease.Grain Crop, 2009, (6):133-134.
[20] Zhang R, Li J H, Chai Z X,etal.Screening of biocontrolTrichodermafrom potato rhizosphere of Western Gansu againstFusariumsambucinumand their identification .Acta Prataculturae Sinica, 2009, 18(2):138-145.
[21] Chen X J, Zhang H, Xu J Y,etal.Cell wall degrading enzymes produced byRhizoctoniasolaniand their pathogenicity to rice plants.Jiangsu Journal of Agricultural Science, 2006, 22(1):24-28.
[22] Zhang H, Chen X J, Tong Y H,etal.Damage of cell wall degrading enzymes produced byRhizoctoniasolanito rice tissue and cells.Journal of Yangzhou University (Agricultural and Life Science), 2005, 26(4):84-86.
[23] Chen B, Wang K Y, Dong G Q,etal.The correlations in the pathogenicity to the enzymes activities ofThanatephoruscucumeriscausing rice sheath blight disease.Acta Agriculturae Zhejiang Gensis, 1992, 23(1):19-22.
[24] Zhang X Y.Study on Identification Technology and Resistance Mechanism of Stem Canker and Black Scurf in Potato byRhizotoniasolani[D].Hohhot:Inner Mongolia Agricultural University, 2012.
[25] Chen J H, Li R H, Guo P G,etal.Impact of drought stress on the ultrastructure of leaf cells in three barley genotypes differing in level of drought tolerance.Chinese Bulletin of Botany, 2011, 46(1):28-36.
[26] Zhou E X, Cao J X, Yang M.Research advances in the histopathology of rice sheath blight.Journal of Zhongkai Agrotechnical College, 2002, 15(2):61-65.
[27] Wu J Y.The Species of Cutinase and Cell-wall Degrading Enzymes Produced byBotrytiscinereaand their Pathogenicity to Tomato Plants[D].Yangzhou:Yangzhou University, 2007.
[28] Li Q K, Sun S D, Li M Q.Studies onRhizoctoniadisease in potato.Chinese Potato Journal, 1988, 2(2):79-85.
[29] Liu X M, Xiao J G.Histopathological studies on infection process of wheat sheath blightRhizoctoniacerealis.Mycosystema, 1999, 18(3):288-293.
[30] Tao J F.Studies on the infection process ofRhizoctoniasolaniin rice.Sichuan Agricultural University, 1992, 10(3):471-477.
[31] Chen J, Tang C R, Gao Z G,etal.On penetration process of sheath blight pathogen in maize.Journal of Shenyang Agricultural University, 2000, 31(5):503-506.
[32] Gao Z G, Chen J, Gao H M,etal.The kinds and activity of cell wall degrading enzymes produced from corn stalk rot pathogens.Acta Phytopathologica Sinica, 2000, 30(2):148-152.
[33] Liu Z H, Qi Y, Huang X Y,etal.Conditions and activity analysis of cell wall degrading enzymes produced fromCorynesporacassiicolaof brown spot of cucumber.China Vegetables, 2011, (8):76-80.
[34] Chen J, Gao H M, Ji M S,etal.On the pathogenicity of CWDEs produced from stalk rot pathogens in maize.Acta Phytopathologica Sinica, 1998, 28(3):221-226.
[35] Pierson C F, Walker J C.Relation ofCladosporumcucumerinurto susceptible and resistant cucumber tissue.Phytopathology, 1954, (44):459-465.
[36] Li B J, Zhou C L, Zhao K H,etal.Pathogenic mechanism of scab of cucumber caused byCladosporiumcucumerinumⅢ effects and synergism of cell wall-degrading enzymes and toxin produced byC.cucumerinumon ultrastructure of cucumber.Acta Phytopathologica Sinica, 2001, 31(1):63-69.
参考文献:
[1] 谢从华.马铃薯产业的现状与发展.华中农业大学学报(社会科学版), 2012, 97(1):1-4.
[2] 杨志敏, 毕阳, 李永才, 等.马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化.中国农业科学, 2012, 45(1):127-134.
[4] 卢建武, 邱慧珍, 张文明, 等.半干旱雨养农业区马铃薯干物质和钾素积累与分配特性.应用生态学报, 2013, 24(2):423-430.
[5] 孟品品, 刘星, 邱慧珍, 等.连作马铃薯根际土壤真菌种群结构及其生物效应.应用生态学报, 2012, 23(11):3079-3086.
[6] 李福, 岳云.甘肃省马铃薯产业集群发展思路.作物杂志, 2011, (4):11-15.
[7] 王宇, 杨志辉, 秦宇轩, 等.马铃薯黑痣病菌AG2.1和AG3融合群分析.农业生物技术学报, 2013, 21(2):230-237.
[8] 陈淑琴, 王生荣.放线菌D01对马铃薯4种病原真菌的抑菌作用.草业学报, 2014, 23(5):365-369.
[9] 余斌, 沈宝云, 王文, 等.连作障碍对干旱地区不同马铃薯品种的影响.甘肃农业大学学报, 2012, 47(4):43-47.
[10] 牛秀群, 李金花, 张俊莲, 等.甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化.草业学报, 2011, 20(4):236-243.
[11] 王凤山, 段禳全, 杜银川.通渭县马铃薯病害发生原因及综合防治措施.甘肃农业科技, 2007, (3):54-55.
[13] 陈万利.马铃薯黑痣病的研究进展.中国马铃薯, 2012, 26(1):49-51.
[14] 张笑宇, 于肖夏, 高翔, 等.马铃薯黑痣病菌毒素诱导马铃薯幼苗丙二醛含量、细胞膜透性及 PAL 活性的变化.内蒙古农业大学学报, 2012, 33(2):16-20.
[15] 曹春梅, 李文刚, 张建平, 等.马铃薯黑痣病的研究现状.中国马铃薯, 2009, 23(3):171-173.
[18] 刘宝玉, 胡俊, 蒙美莲, 等.马铃薯黑痣病病原菌分子鉴定及其生物学特性.植物保护学报, 2011, 38(4):379-380.
[19] 邱广伟.马铃薯黑痣病的发生与防治.粮食作物, 2009, (6):133-134.
[20] 张茹, 李金花, 柴兆祥, 等.甘肃河西马铃薯根际生防木霉菌对接骨木镰刀菌的拮抗筛选及鉴定.草业学报, 2009, 18(2):138-145.
[21] 陈夕军, 张红, 徐敬友, 等.水稻纹枯病菌胞壁降解酶的产生及致病作用.江苏农业学报, 2006, 22(1):24-28.
[22] 张红, 陈夕军, 童蕴慧, 等.纹枯病菌胞壁降解酶对水稻组织和细胞的破坏作用.扬州大学学报(农业与生命科学版), 2005, 26(4):84-86.
[23] 陈兵, 王坤元, 董国强, 等.水稻纹枯病菌的致病性与酶活力的关系.浙江农业学报, 1992, 23(1):19-22.
[24] 张笑宇.马铃薯抗黑痣病鉴定技术及其抗病机制研究[D].呼和浩特:内蒙古农业大学, 2012.
[25] 陈健辉, 李荣华, 郭培国, 等.干旱胁迫对不同耐旱性大麦品种叶片超微结构的影响.植物学报, 2011, 46(1):28-36.
[26] 周而勋, 曹菊香, 杨媚.水稻纹枯病组织病理学的研究进展.仲恺农业技术学院学报, 2002, 15(2):61-65.
[27] 吴洁云.灰葡萄孢角质酶、胞壁降解酶种类及其对番茄植株的致病作用[D].扬州:扬州大学, 2007.
[28] 李乾坤, 孙顺娣, 李敏权.马铃薯立枯丝核菌病的研究.马铃薯杂志, 1988, 2(2):79-85.
[29] 刘雪梅, 肖建国.小麦纹枯病菌侵染过程的组织学研究.菌物系统, 1999, 18(3):288-293.
[30] 陶家凤.立枯丝核菌对水稻侵染过程的研究.四川农业大学学报, 1992, 10(3):471-477.
[31] 陈捷, 唐朝荣, 高增贵, 等.玉米纹枯病病菌侵染过程研究.沈阳农业大学学报, 2000, 31(5):503-506.
[32] 高增贵, 陈捷, 高洪敏, 等.玉米茎腐病菌产生的细胞壁降解酶种类及其活性分析.植物病理学报, 2000, 30(2):148-152.
[33] 刘志恒, 亓烨, 黄欣阳, 等.黄瓜棒孢叶斑病(褐斑病)病菌细胞壁降解酶的产生条件及活性分析.中国蔬菜, 2011, (8):76-80.
[34] 陈捷, 高洪敏, 纪明山, 等.玉米茎腐病菌产生的细胞壁降解酶的致病作用.植物病理学报, 1998, 28(3):221-226.
[36] 李宝聚, 周长力, 赵奎华, 等.黄瓜黑星病菌致病机理的研究Ⅲ细胞壁降解酶和毒素对寄主超微结构的影响及其协同作用.植物病理学报, 2001, 31(1):63-69.
Pathogenic mechanism ofRhizoctoniasolanipotato blight Ⅰ Micro-structure observation of the infection process and measurement of cell wall degradation enzyme activity
TUO Ning1,2, ZHANG Jun1,2, QIU Hui-Zhen1,2*, ZHANG Wen-Ming1,2, ZHANG Chun-Hong1,2,LIU Xing1,2,ZHU Jing1,2
1.CollegeofResourcesandEnvironmentalSciences,GansuAgriculturalUniversity,Lanzhou730070,China; 2.GansuProvincialKeyLabofAridlandCropScience,Lanzhou730070,China
Stem canker (black scurf disease) caused byRhizoctoniasolanihas become one of the main soil-borne diseases which limit the development of the potato industry in Gansu province.In this study,R.solanispores were inoculated onto the stem base of potato plants grown in pots.The infection process and activity of potato cell wall degradation enzymes was observed and measured.Results showed that the infection sequence was bud, stem, root, stolon and lastly tuber.Hyphae attached to the surface of the host within 12 h, appressoria formed in 36 h, infection cushions formed in 48 h.Deformation and fracture of the cell wall, damage to the cell membrane, and the effects of plasmolysis such as deformation and fracture of the cell wall, damage to the cell and plastid membranes and the dissolution of cytoplasm were then observed under the electron microscope.The activities of cellulase (Cx), polygalacturonase (PG) and polymethyl-galacturonase (PMG) were 1.7, 2.9 and 3.1 μg/(h·g), respectively, and these values were significantly higher than those of the control group.The activities of PG and PMG were as twice those of the control group.The increased enzyme activity may be related to tissue necrosis.
Rhizoctoniasolani; infection process; ultrastructure; transmission electron microscope; cell-wall-degrading enzymes
10.11686/cyxb2015051
http://cyxb.lzu.edu.cn
2015-01-27;改回日期:2015-03-18
国家自然科学基金(31360500),国家公益性行业(农业)科研专项(201103004)和国家科技支撑计划项目(2012BAD06B03)资助。
拓宁(1989-),女,甘肃兰州人,在读硕士。 E-mail:tuoning1989@126.com
*通信作者Corresponding author.E-mail:hzqiu@gsau.edu.cn
拓宁, 张君, 邱慧珍, 张文明, 张春红, 刘星, 朱静.立枯丝核菌对马铃薯侵染过程的显微结构观察与胞壁降解酶活性的测定.草业学报, 2015, 24(12):74-82.
TUO Ning, ZHANG Jun, QIU Hui-Zhen, ZHANG Wen-Ming, ZHANG Chun-Hong, LIU Xing, ZHU Jing.Pathogenic mechanism ofRhizoctoniasolanipotato blightⅠ Micro-structure observation of the infection process and measurement of cell wall degradation enzyme activity.Acta Prataculturae Sinica, 2015, 24(12):74-82.

