施氮磷肥对青藏高原高寒草甸土壤线虫群落组成的影响
王静,胡靖,杜国祯*
(1.草地农业生态系统国家重点实验室,甘肃 兰州 730020;2.兰州大学生命科学学院,甘肃 兰州 730000)
施氮磷肥对青藏高原高寒草甸土壤线虫群落组成的影响
王静1,胡靖2,杜国祯2*
(1.草地农业生态系统国家重点实验室,甘肃 兰州 730020;2.兰州大学生命科学学院,甘肃 兰州 730000)
对典型高寒草甸放牧不施肥(G),放牧施氮肥(GN)(5,10,15 g/m2)和放牧施磷肥(GP)(2,4,8 g/m2)条件下的土壤线虫群落组成进行研究,结果表明,放牧草甸施肥条件下,土壤线虫多样性升高、成熟度指数随施肥梯度升高而降低,但各处理间土壤线虫多样性指数、成熟度指数和数量没有显著差异。放牧施氮肥、放牧施磷肥处理中食真菌和捕食性土壤线虫数量降低,食细菌土壤线虫数量增加,且食细菌土壤线虫在施磷肥处理中增加显著。在少量施氮肥和磷肥时,植食性土壤线虫数量较低,但杂食性土壤线虫数量较高。土壤线虫cp-1和cp-3类群的数量随施肥梯度的升高而增多,其他类群的数量降低。除食细菌土壤线虫外,其他类群土壤线虫与土壤理化性质之间没有显著相关关系。
高寒草甸;氮磷肥;放牧;土壤线虫;生物多样性;成熟度;土壤理化性质
土壤线虫在土壤中广泛存在,且数量众多,多样性高,具有多种食性类群[1],包括取食植物根系的植食性土壤线虫,食细菌、食真菌、捕食性和杂食性土壤线虫[2]。根据土壤线虫的食性类群和生活史策略,将土壤线虫划分为cp-1、cp-2、cp-3、cp-4和cp-5五个类群[3]。放牧导致食细菌线虫中低cp值类群的数量减少,而高cp值类群的数量增加;捕食性和杂食性土壤线虫的数量也增加;植食性土壤线虫数量减少;杂食性、捕食性和食真菌线虫的数量与土壤有机碳的含量间显著相关[4],同时放牧也会影响土壤的养分[5]。
土壤线虫群落组成的变化对土壤养分状况的指示作用已得到广泛的证实,是评估土壤质量的一个有效工具[6]。土壤线虫通过取食微生物可以增加40%的矿质营养[7]。添加氮肥对土壤线虫的群落组成会有抑制[8]。一般说来,氮添加减少了土壤线虫的数量和生物多样性,但只是在不同的结构类群之间发生变化[9]。在草地生态系统中,植食性、食真菌、杂食性和捕食性的土壤线虫数量随施氮肥梯度的升高而减少,食细菌土壤线虫数量随施氮肥梯度的升高而增多[10]。然而,对于长期施肥处理的草地生态系统,氮添加减少了植食性土壤线虫的数量,但仅在研究开始的第一年,之后就开始出现增加的现象[8]。
随着氮添加,会出现不同程度的土壤酸化,这可能是导致土壤线虫数量减少的一个重要因素[9]。在另一些研究中,硝态氮和铵态氮的含量与植食性和食真菌土壤线虫间呈负相关关系[8,10],说明施氮肥对土壤线虫造成了直接的影响。更重要的是,土壤线虫群落组成不仅受到土壤理化性质的影响,而且植物群落的组成也间接影响了土壤线虫的群落结构[11],对于解释土壤线虫群落组成的变化具有一定的作用。与施氮肥相比,土壤线虫的数量、多样性以及成熟度在施用磷肥的处理中均要高,且施用氮肥显著提高食细菌和食真菌土壤线虫的数量[12]。施氮肥显著降低了土壤线虫的数量和各类群的数量,施磷肥对线虫数量的影响不显著,但提高了食细菌土壤线虫的数量[13]。
目前关于施肥对草地生态系统中土壤线虫群落的影响,主要集中在半干旱区草地生态系统中,对于高寒草甸生态系统的研究较少,特别是在放牧和施肥双重干扰下的土壤线虫群落结构方面的研究更是少见。研究区域属于青藏高原东部典型高寒草甸区,实验样地为夏季牧场,平均每hm2草地放牛0.18头,放羊3.68只,属中度放牧。因此,通过研究放牧条件下添加氮肥和磷肥后土壤线虫的群落组成变化,对高寒草甸生态系统的草地管理提供借鉴。
1 材料与方法
1.1研究区域概况
研究区域在甘肃省甘南藏族自治州玛曲县,位于青藏高原东北缘(101°-103° E,34°-35° N),海拔2900~4000 m;地势开阔、多风,气候寒冷。年均降水量450~780 mm,主要分布在7-9月;年平均温度为1.2℃,最冷月1月均温为-10℃,最热月7月均温为11℃;年平均霜期不少于270 d。植被属典型的高寒草甸。草地资源丰富,是黄河重要的水源补给区,也是藏族人民赖以生存的重要牧场。
1.2实验样地处理与样品采集
实验样品采自兰州大学高寒草甸与湿地生态系统定位研究站(瓦拉卡观测点)。在一块大样地内按6 m×6 m的小区大小,共划分出42块小区,每两块相邻的小区之间间隔为1 m。分放牧不施肥(G);放牧施氮肥5,10,15 g/m2,分别用GN5,GN10,GN15表示;放牧施磷肥2,4,8 g/m2,分别用GP2,GP4,GP8表示。每个处理6个重复。样品采集时间选在2013年9月。采集样品时,用土钻在每块小区内随机取3钻15 cm深的土样,混合成1个样品,装入聚乙烯袋中贴上标签带回实验室。
土壤理化性质的测定:依据《土壤农业化学分析方法》[14],测定pH,全氮(total N, TN),全磷(total P, TP),速效磷(available P, S),有机碳(organic carbon, C)。
1.3土壤线虫的分离和鉴定
每个土壤样品称取50 g,用改进的贝曼漏斗(湿漏斗)法分离48 h[15];按无水甘油酒精快速处理法[16]进行固定,制片。依据《中国土壤动物检索图鉴》[17]、《中国淡水和土壤线虫研究》[18]、《Dorylaimida-Free-living, Predaceous and Plant-parasitic Nematodes》[19]和《Soil And Freshwater Nematodes》[20],在显微镜下按科、属对线虫进行分类并计数,线虫个体数量转换成条/100 g干土。各属数量优势度的划分:个体数量占总捕获量10%以上为优势类群(+++),个体数量占总捕获量1%~10%为常见类群(++),个体数量占总捕获量1%以下为稀有类群(+)[9-10,21]。土壤线虫群落结构分析中采用以下指标:
1)香农威那指数(H′)[22]:H′=-∑PilnPi
2)成熟度指数(MI,不包括植物寄生类土壤线虫)[23]:MI=∑c(i)×Pi
式中,c(i)为土壤线虫第i类群Colonizer-persister值,Pi为该类群的个体数量占总量的比例。
1.4统计分析
用SPSS 17.0软件进行ANOVA分析和相关分析,用Excel进行绘图。
2 结果与分析
2.1土壤线虫群落组成
实验中分离得到的土壤线虫分属于2纲5目30科39属,见表1及图1。
放牧不施肥处理的样地,经分离得到土壤线虫平均密度为1033条/100 g干土。其中,食真菌土壤线虫数量最多,占总数的39.76%;食细菌和植食性土壤线虫的数量占总体的比例分别为30.64%和20.77%,捕食性土壤线虫所占比例最少,仅为1.01%。丝垫刃属(Filenchus)、拟丽突属(Acrobeloides)、垫刃属(Tylenchus)、类滑刃属(Aphelenchoides)为优势属,螺旋属(Helicotylenchus)等6个属为常见属,轮属(Criconemoides)等23个属为稀有属。
在放牧施氮肥处理的样地,经分离得到的土壤线虫平均密度为961条/100 g干土。其中,食细菌土壤线虫数量最多,占总数的36.59%;植食性土壤线虫的比例为19.52%;食真菌土壤线虫的比例为34.18%;而捕食性土壤线虫数量最少,仅为2.52%。丝垫刃属、拟丽突属、垫刃属为优势属,螺旋属等12个属为常见属,潜根属(Hirschmanniella)等22 个属为稀有属。随着施肥梯度的升高,食细菌土壤线虫的比例逐渐增加,而食真菌比例逐渐降低。
在放牧施磷肥处理的样地,经分离得到的土壤线虫平均密度为1021条/100 g干土。其中,食细菌土壤线虫数量最多,占总数的38.79%;植食性土壤线虫比例为19.16%;食真菌土壤线虫的比例为33.77%;捕食性土壤线虫仅占1.17%。丝垫刃属、拟丽突属、垫刃属为优势属,矮化属(Tylenchorhynchus)等11个属为常见属,潜根属等15个属为稀有属。随着施肥梯度的升高,食细菌土壤线虫的比例逐渐升高,植食性土壤线虫所占比例逐渐降低。
2.1.1土壤线虫数量 与放牧不施肥处理相比,施肥处理后,土壤线虫数量在中度施肥水平时较高,GN5和GP2线虫数量最低(图2)。但各处理间土壤线虫数量没有显著差异。说明放牧条件下,施氮肥和磷肥不会对土壤线虫的数量造成显著影响,低施肥水平减少了土壤线虫的数量。
2.1.2土壤线虫成熟度 放牧不施肥处理下的成熟度均高于施肥处理(图3)。在施肥处理中,成熟度随施肥梯度的升高逐渐降低,GN10和GP8成熟度最低。并且在各处理间土壤线虫成熟度没有显著差异。说明高施肥水平能减小土壤线虫的成熟度。
2.1.3土壤线虫生物多样性 施肥处理以后,土壤线虫的生物多样性呈增加的趋势(图4)。GN5和GP4多样性最高,即此时有最多的土壤线虫种类。且各处理间土壤线虫多样性没有显著差异。但在低施肥水平条件下,土壤线虫的多样性较高,说明低干扰情况下土壤线虫的种类较多。
2.2土壤线虫群落的cp类群
不同处理的土壤线虫cp类群存在差异,其中cp-2类群占据主要地位(图5)。各cp类群随施肥梯度的不同而各有变化。
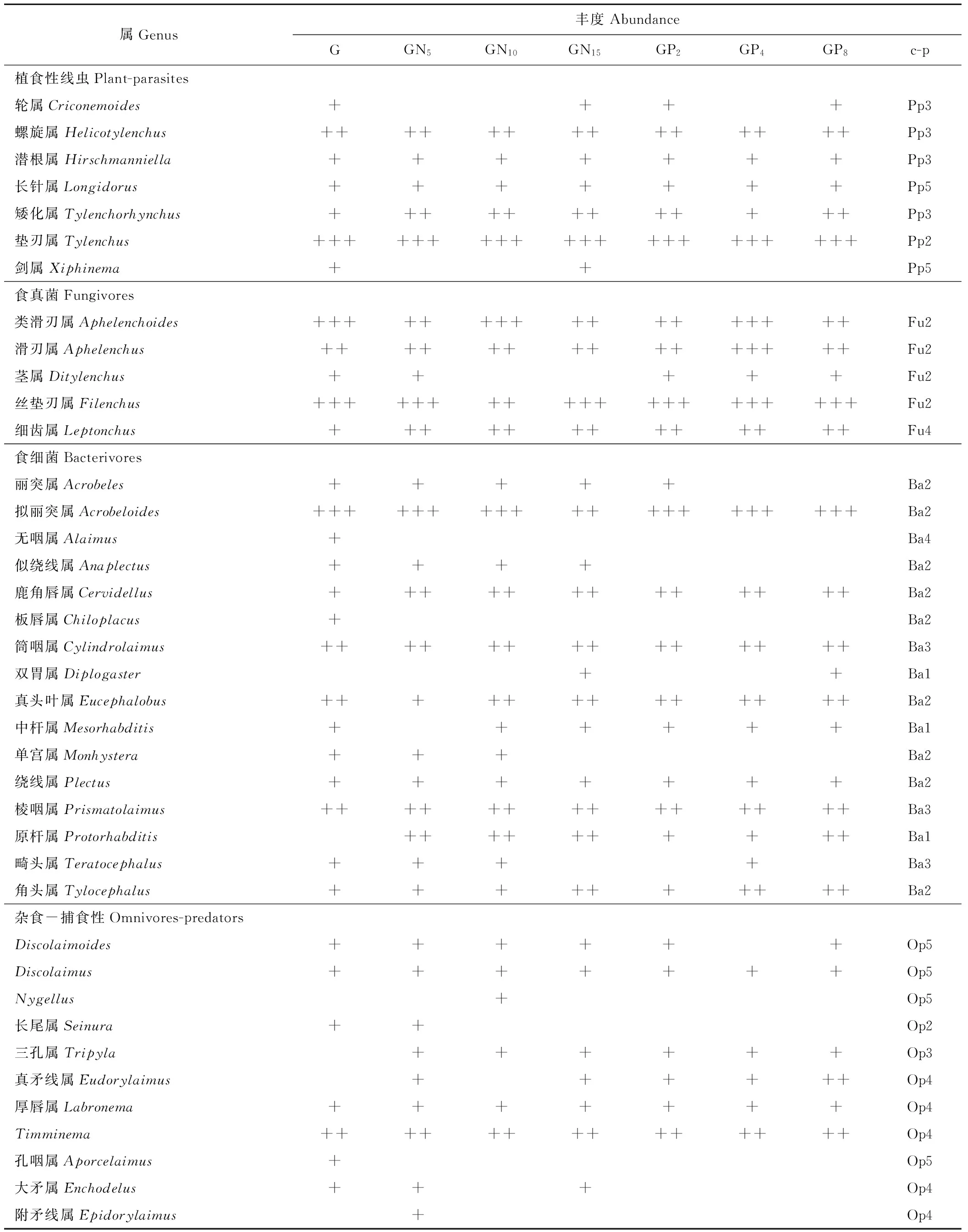
表1 放牧条件下不同施肥处理水平中土壤线虫群落组成及各类群cp值Table 1 Compositions of nematode communities and cp value of trophic groups on different fertilizer were applied under grazing condition
Pp:植物寄生类线虫Plant-parasites;Fu:食真菌类线虫Fungivores;Ba:食细菌类线虫Bacterivores;Op:杂食-捕食类线虫Omnivores-predators.
cp-1类群所占比例在各处理中均较少,在放牧不施肥样地中仅占0.2%,在放牧施氮肥和放牧施磷肥样地中,随施肥梯度的升高而增加。其中,施氮肥为GN10时达到最大值,比例为5.9%;施磷肥为GP8时达到最大值,比例为7.3%。放牧不施肥和其他施肥处理与施磷肥为GP8间存在显著差异(P<0.05),放牧不施肥和施磷肥为GP2分别与施氮肥为GN10之间存在显著差异(P<0.05)。由此可见,施肥处理增加了cp-1类群的数量,并且在施氮肥水平最高时cp-1类群土壤线虫的数量显著增加。
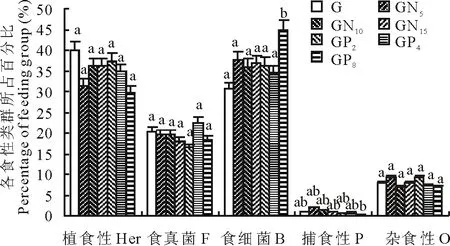
图1 高寒草甸不同施肥处理水平下土壤线虫食性类群多度的变化
不同处理中cp-2类群所占比例均最高,随施肥梯度的升高而降低。其中,放牧不施肥样地该类群所占比例高达76.1%,是所有处理中的最大值;放牧施磷肥样地施磷肥为GP2时所占比例最低,为67.7%。该类群土壤线虫均为各处理中的优势属和常见属,大多为植食性和食真菌的土壤线虫。但各处理间没有显著差异。
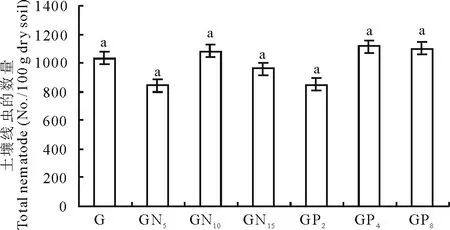
图2 不同施肥水平处理下的土壤线虫数量变化
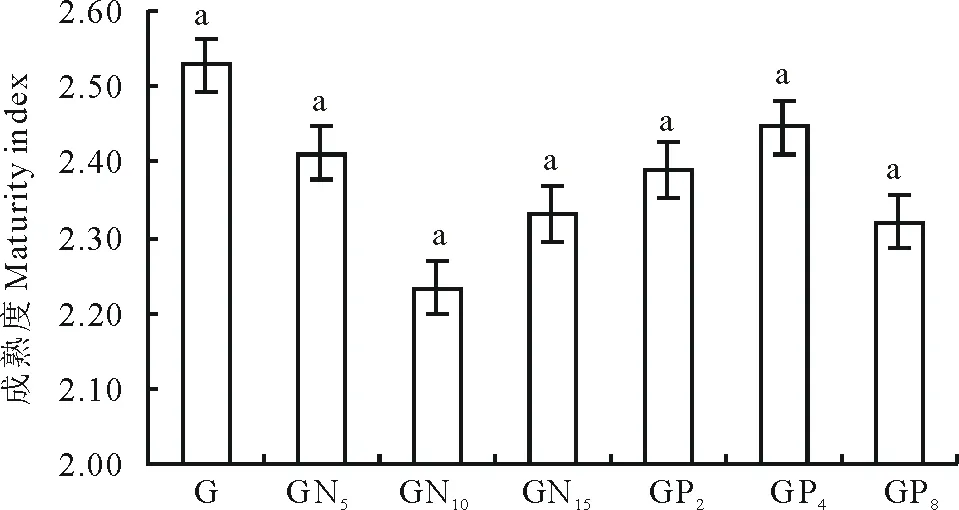
图3 不同施肥处理的土壤线虫成熟度变化
cp-3类群在各处理间的分布不同于cp-1和cp-2类群,在放牧不施肥样地中所占比例最低,仅为8.9%。在放牧施氮肥处理样地中,随施肥梯度的升高,该类群所占比例增加;在放牧施磷肥样地中,该类群所占比例随施肥梯度的升高而降低。施磷肥为GP2时所占比例最高,达16.6%。
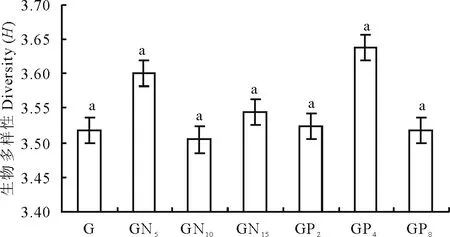
图4 不同施肥处理土壤线虫生物多样性变化
实验中所鉴定得到的cp-4土壤线虫类群,全部属于杂食性土壤线虫,且所占比例随施肥梯度的升高而降低,各处理间没有显著差异。该类群在放牧不施肥样地中所占比例最高,在施磷肥为GP8时所占比例最低。说明施肥减少了cp-4类群土壤线虫的数量,但是这种影响并不显著。
cp-5类群在放牧施氮肥和放牧施磷肥处理中均逐渐降低,并在施氮肥为GN15和施磷肥为GP8时最低。但是各处理间没有显著差异。说明高施肥梯度,即强干扰条件下,该类群土壤线虫对干扰较为敏感,其数量因强干扰而减少。
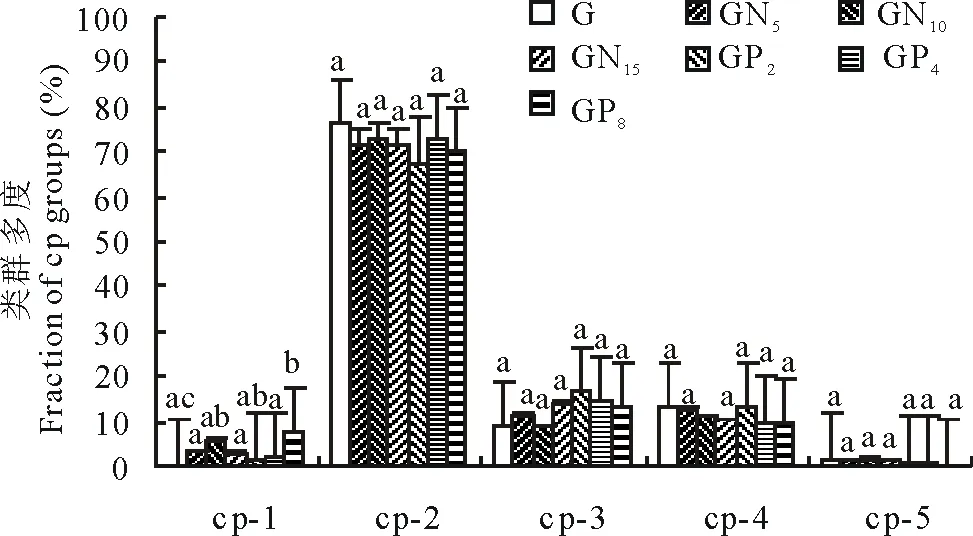
图5 不同施肥处理条件下土壤线虫的类群多度变化
2.3不同施肥处理条件下土壤线虫群落的差异
施用氮肥和磷肥对土壤线虫群落没有显著影响,见表2。土壤线虫数量、多样性指数和土壤线虫的成熟度在各处理间并无显著差异。
各处理间植食性、食真菌、杂食性土壤线虫的多度没有显著差异。GP8处理与其他施肥处理间,食细菌土壤线虫多度有显著差异(P<0.05);GN5和GP8处理之间,捕食性土壤线虫多度有显著差异(P<0.05)。说明施磷肥水平较高时,食细菌和捕食性土壤线虫数量所受干扰较为显著,表现为食细菌土壤线虫显著增加而捕食性土壤线虫显著减少。
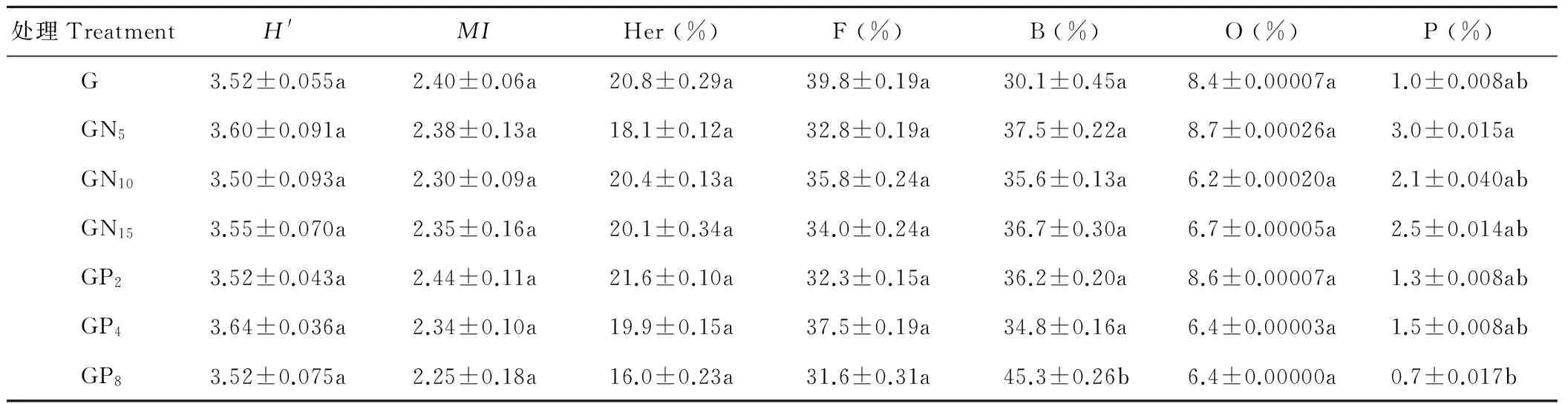
表2 不同施肥处理条件下土壤线虫群落组成的差异Table 2 Difference of nematode community composition on different fertilizer were applied under grazing condition
不同小写字母表示同列不同处理间差异显著(P<0.05) Values with different lower case letters show significant differences among the treatments in the same column at 0.05 level.Her:植食性线虫Plant-parasites;F:食真菌线虫Fungivores;B:食细菌线虫Bacterivores;P:捕食性线虫Predators;O:杂食性线虫Omnivores.
2.4土壤线虫与土壤理化性质的关系
土壤线虫的多样性与全氮、全磷、速效磷及土壤有机碳之间均存在负相关关系,即土壤磷、氮含量升高时,土壤线虫的生物多样性降低(表3)。
土壤线虫成熟度与土壤有机碳之间存在负相关关系,而与土壤全氮、全磷等呈正相关关系;土壤线虫的数量与土壤pH、全磷、全氮等理化性质间均呈正相关关系,说明土壤养分的升高将增加土壤线虫的数量。
植食性、食真菌和捕食性土壤线虫与土壤pH值呈负相关关系,而食细菌和杂食性土壤线虫与土壤pH之间呈正相关关系,且均没有显著性。除植食性土壤线虫与土壤全磷之间呈负相关关系外,其他食性类群的土壤线虫与土壤全磷之间均呈正相关关系。植食性、食细菌和杂食性的土壤线虫与土壤全氮之间呈负相关关系,食真菌和捕食性的土壤线虫与土壤全氮呈正相关关系。土壤速效磷与植食性、食真菌和杂食性土壤线虫间呈负相关关系,食细菌和捕食性土壤线虫与速效磷之间呈正相关关系,且食细菌土壤线虫与速效磷之间的关系显著(P<0.05)。土壤有机碳与食细菌土壤线虫间呈负相关关系,与植食性、食真菌、杂食性和捕食性土壤线虫均呈正相关关系。
土壤线虫类群中,除cp-1与速效磷之间显著正相关(P<0.05)外,其他类群与土壤理化性质之间均没有显著的相关关系。
土壤线虫与土壤理化性质之间的关系显示:食细菌土壤线虫和cp-1类群与土壤速效磷之间存在显著的正相关关系。
3 讨论
研究鉴定得到的高寒草甸土壤线虫属的数量低于藏北高寒草甸草原93个属,但土壤线虫数量997条/100 g干土,高于藏北高寒草甸草原847条/100 g干土的数量[24]。植食性的Tylenchus,食真菌的Filenchus,食细菌的Acrobeloides属,是放牧施肥处理草地的优势属,杂食-捕食性的土壤线虫在各处理中仅有少量存在。
放牧不施肥处理的样地,土壤线虫多样性、数量相比施肥处理样地低,但土壤线虫成熟度高。生物多样性减少,说明放牧对生态系统各组分造成了负面影响。因为生物多样性是保持生态系统稳定性、抗压力性和弹性的先决条件[25-26]。土壤肥力增加,成熟度指数变小[6],该结果在不同耕作类型的土壤中已经得到证实[27]。从食性类群来看,放牧处理样地中食真菌土壤线虫数量最多,食细菌土壤线虫数量最低。在土壤食物网中,有机质通过不同的方式被分解。纤维素和木质素含量高的物质主要通过真菌降解;水分和氮含量丰富的物质主要通过细菌进行降解[28]。说明施肥有助于细菌的生长,从而增加土壤中氮素的含量,食细菌土壤线虫数量的增多,正好反映了土壤中细菌的丰富度。从cp类群来看,与放牧施肥处理相比,放牧处理样地中cp-1、cp-3类群土壤线虫所占比例最低,而cp-4、cp-5类群土壤线虫所占比例较高。cp-1类群生活在细菌和营养丰富的土壤中;cp-3、cp-4和cp-5类群土壤线虫对干扰较为敏感[6]。说明施肥增加了土壤养分,对土壤营养需求较高的cp类群的数量增加,在竞争中占据优势。而在放牧和施肥双重干扰下,对干扰较为敏感的cp类群的数量减少,土壤食物网的营养结构因施肥而发生了改变。
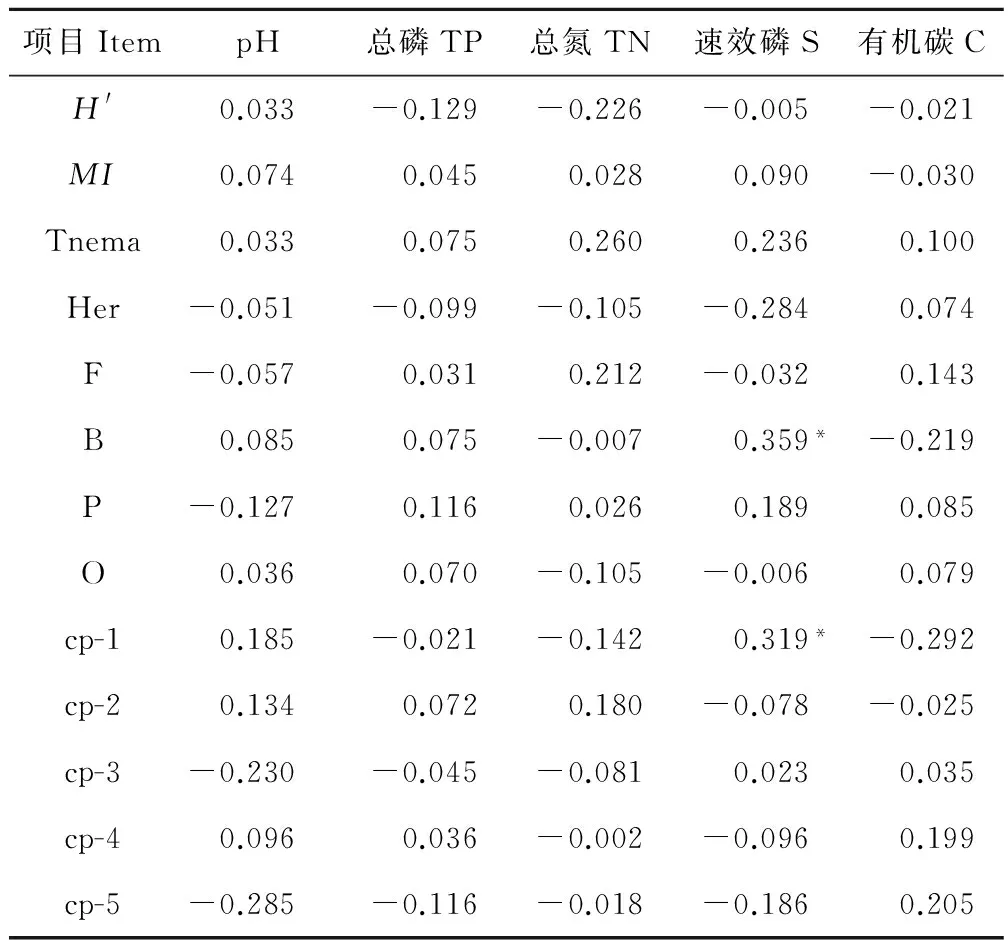
表3 土壤理化性质与土壤线虫群落营养结构特征指数、食性类群及cp类群间的关系Table 3 Correlation coefficients between nematode community nutrition structure, feeding groups and cp groups and major soil properties
*表示显著相关(P<0.05);Tnema:土壤线虫的数量。* Significant correlation(P<0.05); Tnema:The total number of nematodes.
施肥处理以后,土壤线虫生物多样性和数量增加,但是成熟度降低,食细菌土壤线虫数量增多,食真菌土壤线虫数量减少[28-29]。放牧条件下,土壤微生物群落主要通过细菌进行物质的分解,食细菌土壤线虫与氮的转化关系紧密[30],并且放牧增强了草地生态系统中的氮限制[31]。在放牧施氮肥处理中,表面看来,由放牧造成的氮限制将减小。然而,食细菌土壤线虫数量随施肥梯度升高而增多,但与放牧不施肥处理间食细菌土壤线虫所占比例没有显著差异(表2)。因此,放牧虽然对土壤食物网造成了影响,但是添加氮肥以后,生态系统中的氮限制并没有得到有效的抑制,放牧对该地区的草地生态系统造成了一定的压力。在放牧施磷肥处理中,食细菌土壤线虫的数量随施肥梯度升高而增加,且存在显著差异。同样说明放牧带来的负效应,并且这种效应无法通过施肥得到有效抑制。杂食性和捕食性的土壤线虫属于高cp值类群,它们决定了土壤食物网的复杂性[26],它们对干扰最敏感[3]。放牧施肥处理条件下,捕食性的土壤线虫增多,杂食性土壤线虫减少,且放牧不施肥处理时,捕食性土壤线虫数量最少,杂食性土壤线虫数量较高施肥水平下的多。说明捕食性土壤线虫数量主要受放牧干扰的影响而减少,而施肥可以帮助捕食性土壤线虫在竞争中占据优势,但是抑制了杂食性土壤线虫的数量。
[1] Wu T, Ayres E, Bardgett R D,etal.Molecular study of worldwide distribution and diversity of soil animals.Proceedings of the National Academy of Sciences, 2011, 108:17720-17725.
[2] Yeates G W, Bongers T, De Goede R,etal.Feeding habits in soil nematode families and genera:an outline for soil ecologists.Nematology, 1993, 25:315-331.
[3] Bongers T, Bongers M.Functional diversity of nematodes.Applied Soil Ecology, 1998, 10:239-251.
[4] Pan F J, Xu Y L, McLaughlin N B,etal.Response of soil nematode community structure and diversity to long-term land use in the black soil region in China.Ecological Research, 2012, 27(4):701-714.
[5] Bardgett R D, Wardle D A, Yeates G W.Linking above-ground and below-ground interactions:how plant responses to foliar herbivory influence soil organisms.Soil Biology and Biochemistry, 1998, 30:1867-1878.
[6] Bongers T, Ferris H.Nematode community structure as a bioindicator in environmental monitoring.Trends in Ecology and Evolution, 1999, 14:224-228.
[7] Verhoef H, Brussaard L.Decomposition and nitrogen mineralization in natural and agroecosystems:the contribution of soil animals.Biogeochemistry, 1990, 11:175-211.
[8] Liang W, Lou Y, Li Q,etal.Nematode faunal response to long-term application of nitrogen fertilizer and organic manure in Northeast China.Soil Biology and Biochemistry, 2009, 41:883-890.
[9] Wei C, Zheng H, Li Q,etal.Nitrogen addition regulates soil nematode community composition through ammonium suppression.PLoS One, 2012, 7(8):e43384.
[10] Murray P J, Cook R, Currie A F,etal.Interactions between fertilizer addition, plants and the soil environment:Implications for soil faunal structure and diversity.Applied Soil Ecology, 2006, 33:199-207.
[11] De Deyn G B, Raaijmakers C E, Van Ruijven J,etal.Plant species identity and diversity effects on different trophic levels of nematodes in the soil food web.Oikos, 2004, 106:576-586.
[12] Sarathchandra S U, Ghani A, Yeates G W,etal.Effect of nitrogen and phosphate fertilisers on microbial and nematode diversity in pasture soils.Soil Biology and Biochemistry, 2001, 33:953-964.
[13] Qi S, Zhao X R, Zheng H X,etal.Changes of soil biodiversity in Inner Mongolia steppe after 5 years of N and P fertilizer application.Acta Ecological Sinica, 2010, 30(20):5518-5526.
[14] Lu R K.Soil and Agricultural Chemical Analysis[M].Beijing:China Agricultural Sci-Tech Press, 2000.
[15] Oostenbrink M.Estimating nematode populations by some selected methods.Nematologica, 1960, 6:85-102.
[16] Seinhorst J W.On the killing, fixing and transferring to glycerin of nematodes.Nematologica, 1962, 8:29-32.
[17] Yin W Y.Pictorial Keys to Soil Animals of China[M].Beijing:Science Press, 1998.
[18] Wu J H.Studies of Freshwater and Soil Nematodes of China[D].Wuhan:Institute of Hydrobiology, Chinese Academy Sciences, 1999.
[19] Jairajpuri M S, Ahmad W.Dorylaimida-Freeliving, Predaceous and Plant-parasitic Nematodes[M].New Delhi:Printed in India at Pauls Press, 1992.
[20] Goodey T.Soil and Freshwater Nematodes[M].London:Printed and Bound in Great Britain by Butler and Tanner, 1951.
[21] Liang W J, Zhang W M, Li W G,etal.Effect of chemical fertilizer on nematode community composition and diversity in the black soil region.Biodiversity Science, 2001, 9(3):237-240.
[22] Shannon C E, Weaver W.The Mathematical Theory of Communication[M].Urbana:University of Illinois, 1949.
[23] Bongers T.The maturity index:An ecological measure of environmental disturbance based on nematode species composition.Oecologia, 1990, 83:14-19.
[24] Xue H Y, Hu F, Luo D Q.Effects of alpine meadow plant communities on soil nematode functional structure in Northern Tibet, China.Acta Ecological Sinica, 2013, 33(5):1482-1494.
[25] Wardle D A, Bardgett R D, Klironomos J N,etal.Ecological linkages between aboveground and belowground biota.Science, 2004, 304:1629-1633.
[26] Polis G A, Strong D R.Food web complexity and community dynamics.American Naturalist, 1996, 147:813-846.
[27] Freckman D W, Ettema C H.Assessing nematode communities in agroecosystems of varying human intervention.Agriculture, Ecosystems and Envionment, 1993, 45:239-261.
[28] Wardle D A, Yeates G W.The dual importance of competition and predation as regulatory forces in terrestrial ecosystems, evidence from decomposer food webs.Oecologia, 1993, 93:303-306.
[29] Bardgett R D, Jones A C, Jones D L,etal.Soil microbial community patterns related to the history and intensity of grazing in sub-montane ecosystems.Soil Biology and Biochemistry, 2001, 33:1653-1664.
[30] Ferris H, Venette R C, van der Meulen H R,etal.Nitrogen mineralization by bacterial-feeding nematodes:verification and measurement.Plant and Soil, 1998, 203:159-171.
[31] Pineiro G, Paruelo J M, Oesterheld M,etal.Pathways of grazing effects on soil organic carbon and nitrogen.Rangeland Ecology and Management, 2010, 63:109-119.
参考文献:
[13] 齐莎, 赵小蓉, 郑海霞, 等.内蒙古典型草原连续5年施用氮磷肥土壤生物多样性的变化.生态学报, 2010, 30(20):5518-5526.
[14] 鲁如坤.土壤农业化学分析方法[M].北京: 中国农业科技出版社, 2000.
[17] 尹文英.中国土壤动物检索图鉴[M].北京: 科学出版社, 1998.
[18] 吴纪华.中国淡水和土壤线虫的研究[D].武汉: 中国科学院水生生物研究所, 1999.
[24] 薛会英, 胡锋, 罗大庆.藏北高寒草甸植物群落对土壤线虫群落功能结构的影响.生态学报, 2013, 33(5):1482-1494.
Effects of nitrogen and phosphorus on the soil nematode community in Tibetan Plateau alpine meadows
WANG Jing1, HU Jing2, DU Guo-Zhen2*
1.StateKeyLaboratoryofGrasslandAgro-ecosystems,Lanzhou730020,China; 2.SchoolofLifeSciences,LanzhouUniversity,Lanzhou730000,China
Soil nematodes are sensitive to environmental changes and are widely used as indicators of soil conditions.Here we monitored temporal dynamics of the soil nematode community using a multi-level N and P addition experiment in the eastern Tibetan Plateau alpine meadow under grazing conditions.The results showed N and P fertilizer applications slightly improved the diversity (H′) and the total number of soil nematodes, but that the maturity index (MI) declined with increases in the fertilizer gradient.The abundance of fungivores and predators decreased whereas bacterivorous nematodes significantly increased after P input.With lower-level applications of N and P fertilizer, the abundance of herbivorous nematodes was low but that of omnivores was high.The abundance of cp-1 (colonizer-persister) and cp-3 group nematodes increased with increases in the fertilizer gradient.The largest abundance of cp-1 and cp-3 appeared in treatments with moderate N and P fertilizer applications.We found a significantly positive relationship between bacterivorous nematodes, cp-1 and available phosphorus.The response of soil nematodes to different kinds of fertilizer is probably caused by grazing.
alpine meadow; nitrogen and phosphorus; grazing; soil nematode; biodiversity; maturity index; physicochemical properties of soil
10.11686/cyxb2015035
http://cyxb.lzu.edu.cn
2015-01-20;改回日期:2015-04-20
国家自然科学基金(41171214,41201285)资助。
王静(1989-),男,云南楚雄人,硕士。E-mail:jingwang2012@lzu.edu.cn
*通信作者Corresponding author.E-mail:guozdu@lzu.edu.cn
王静, 胡靖, 杜国祯.施氮磷肥对青藏高原高寒草甸土壤线虫群落组成的影响.草业学报, 2015, 24(12):20-28.
WANG Jing, HU Jing, DU Guo-Zhen.Effects of nitrogen and phosphorus on the soil nematode community in Tibetan Plateau alpine meadows.Acta Prataculturae Sinica, 2015, 24(12):20-28.

