肝源性糖尿病患者的临床特点和生存状况研究
崔路佳,韦 红,黄咏东,苗新普
(海南省人民医院消化内科,海口 570311)
·论著·
肝源性糖尿病患者的临床特点和生存状况研究
崔路佳,韦 红,黄咏东,苗新普
(海南省人民医院消化内科,海口 570311)
目的 探讨肝源性糖尿病(HD)患者的临床特点及生存状况,并对影响HD患者预后的危险因素进行分析。方法 收集2011年1月至2012年12月该院消化内科收治的168例肝硬化患者的临床资料,根据患者是否合并糖尿病将患者分为单纯肝硬化组74例,合并HD组 48例以及合并2型糖尿病(T2MD)组46例,所有病例以死亡为随访终点。对比分析各组患者临床特点及预后情况。肝硬化患者预后危险因素采用单因素及Logistic多因素分析。结果 T2MD组患者糖尿病史高于HD组及肝硬化组(P<0.05),HD组及T2MD组酒精性肝硬化比例高于肝硬化组(P<0.05),HD组及T2MD组患者肝性脑病、上消化道出血、电解质紊乱等并发症发生率、病死率、Child-Pugh评分及住院时间显著高于肝硬化组,差异有统计学意义(P<0.05),而HD组与T2MD组差异无统计学意义(P>0.05)。HD组患者总胆红素(TBil)水平高于T2MD组及肝硬化组(P<0.05),肝硬化组空腹血糖水平(FPG)、胰岛抵抗指数(HOMA-IR)、总胆固醇(TG)、C肽水平低于HD组及T2MD组(P<0.05),而HD组FPG、C肽均高于T2MD组(P<0.05),T2MD组TG水平高于HD组(P<0.05)。经Logistic多因素分析显示,年龄、饮酒、腹水、合并HD、合并T2DM、Child-Pugh评分是肝硬化患者死亡的独立危险因素。结论 HD患者与肝硬化患者相比并发症发生率及病死率更高,HD可增加肝硬化患者死亡风险。
肝硬化;糖尿病;血糖;生存状况;临床特点
2型糖尿病(T2MD)是肝硬化较为常见的并发症,临床上发病率约为30%[1]。T2MD会增加肝硬化患者并发症发生率及病死率,不利于患者预后[2]。肝源性糖尿病(HD)是由慢性肝实质损伤引起的糖代谢异常而继发糖尿病[3]。目前HD患者的临床意义及特点尚不明确,国内外对HD与肝硬化合并T2MD的临床差异研究也较少。本文将探讨HD患者临床特点及预后情况,分析肝硬化合并HD与合并T2MD的临床特点及预后差异,并采用Logistics多因素分析HD对肝硬化患者死亡风险的影响。
1 资料及方法
1.1 一般资料 选取2011年1月至2012年12月本院消化内科收治的肝硬化患者168例。纳入标准:(1)符合2000年中华医学会修订的病毒性肝炎临床防治方案中对肝硬化的诊断标准;(2)签署知情同意书;(3)获取本院医学伦理委员会批准。排除标准:有原发性肝癌、甲状腺功能疾病、肾功能障碍;合并严重心肺疾病;妊娠期及哺乳期者。分组标准:参考1999年世界卫生组织对糖尿病的诊断标准:即空腹血糖水平(FPG)≥7.0 mmol/L,2 h FPG≥11.1 mmol/L。参照Nishida等对HD的定义:即糖尿病作为肝病并发症继发于肝病,无糖尿病家族病史或既往病史,患者临床表现为组织学或生化指标变化,且血糖、尿糖好转或恶化与肝功能变化一致。肝硬化患者中,男95例,女73例,年龄21~78岁,平均(53.6±5.4)岁,住院时间10~18 d,平均住院时间(12.6±4.3)d。Child-Pugh评分6~10分,平均(7.12±1.85)分。肝硬化原发疾病:乙型肝炎 78例,丙型肝炎 34例,酒精性肝硬化28例,混合性肝病 18例,其他 10例。根据患者是否合并糖尿病分为单纯肝硬化组74例,合并HD组 48例以及合并T2MD组46例。3组性别比、年龄、肝硬化病程、吸烟史差异无统计学意义(P>0.05)。
1.2 方法 收集所有患者人口学资料、临床表现、基础疾病史、Child-Pugh评分、辅助检查及实验室生化指标结果,包括总胆红素(total bilirubin,TBil)、FPG、TG、LDH-C、HDL-C、总胆固醇(total cholesterol,TC)、C肽,患者入院当天抽取静脉血3 mL,离心处理后留取上清液,采用全自动化生化分析仪测定TBil、FPG、TG、LDH-C、TC水平。患者均行口服葡萄糖耐量试验(OGTT)及胰岛素C肽释放试验,记录患者FPG、C肽水平。稳态胰岛素抵抗指数(HOMA-IR)=空腹胰岛素水平×空腹血糖水平/22.5。
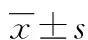
2 结果
2.1 临床资料分析 T2MD组患者糖尿病史高于HD组及肝硬化组(P<0.05),HD组及T2MD组酒精性肝硬化比例高于肝硬化组(P<0.05),HD组及T2MD组患者肝性脑病、上消化道出血、电解质紊乱等并发症发生率、病死率、Child-Pugh评分及住院时间显著高于肝硬化组,差异有统计学意义(P<0.05),而HD组与T2MD组差异无统计学意义(P>0.05),见表1。
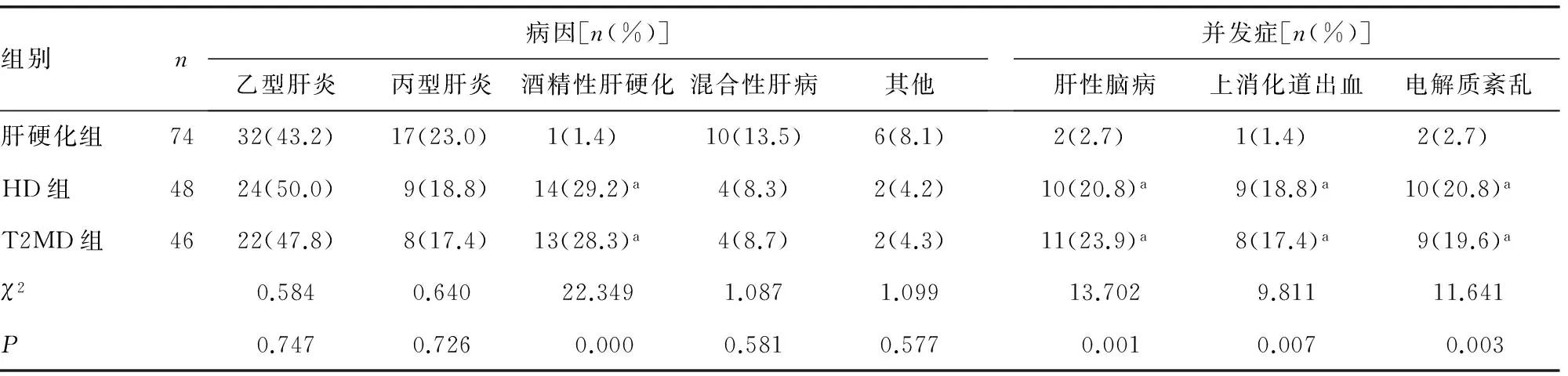
表1 各组临床资料分析
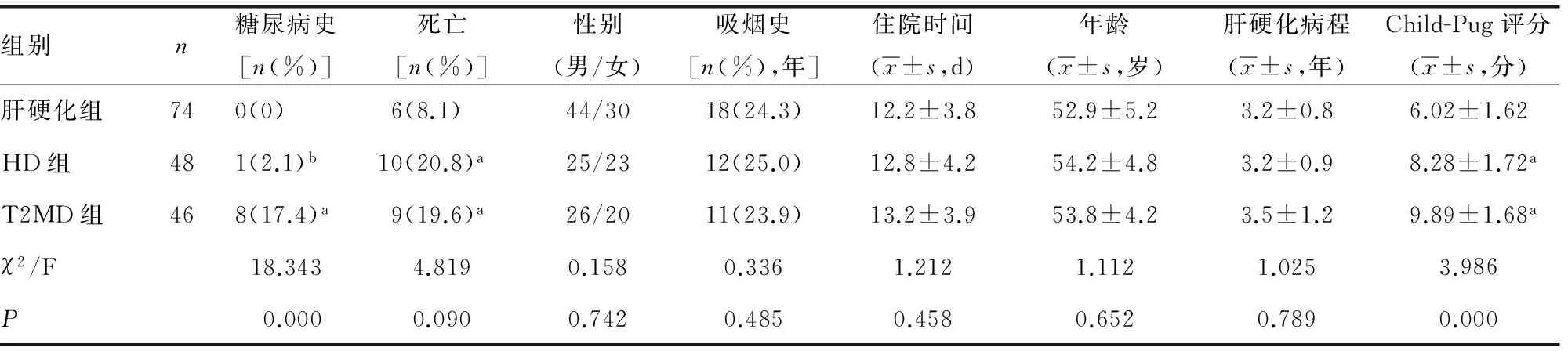
续表1各组临床资料分析
a:P<0.05,与肝硬化组比较;b:P<0.05,与T2MD组比较。

表2 各组血糖、血脂及肝功能指标分析
a:P<0.05,与肝硬化组比较;b:P<0.05,与T2MD组比较;c:P<0.05,与HD组比较。
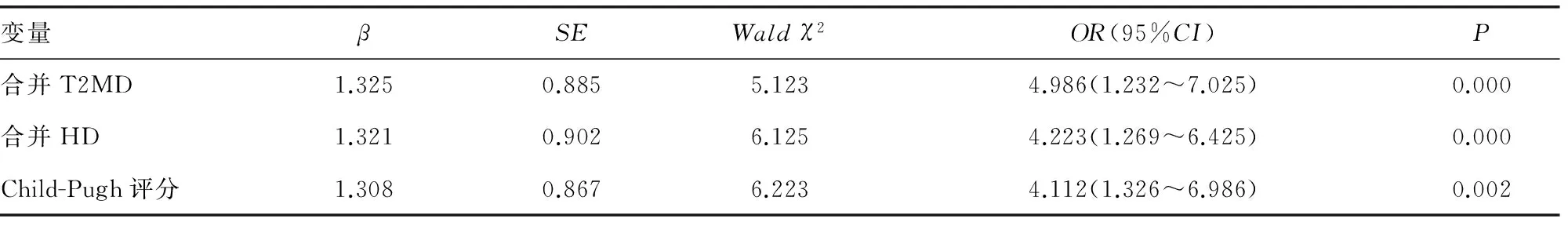
表3 影响肝硬化患者死亡的Logistic多因素分析
2.2 各组血糖、血脂及肝功能指标分析 HD组患者TBil水平高于T2MD组及肝硬化组(P<0.05),肝硬化组FPG、HOMA-IR、TG、C肽水平低于HD组及T2MD组(P<0.05),而HD组FPG、C肽均高于T2MD组(P<0.05),T2MD组TG水平高于HD组,而各组TC、LDH-C、HDL-C差异无统计学意义(P>0.05),见表2。
2.3 影响肝硬化患者死亡的危险因素分析 168例肝硬化患者中,死亡25例,经单因素分析显示,年龄、饮酒、腹水、并发症、合并HD、合并T2DM、Child-Pugh评分与肝硬化患者死亡有关。经Logistic多因素进一步分析显示,合并T2MD、合并HD、Child-Pugh评分是肝硬化患者死亡的独立危险因素,见表3、4。
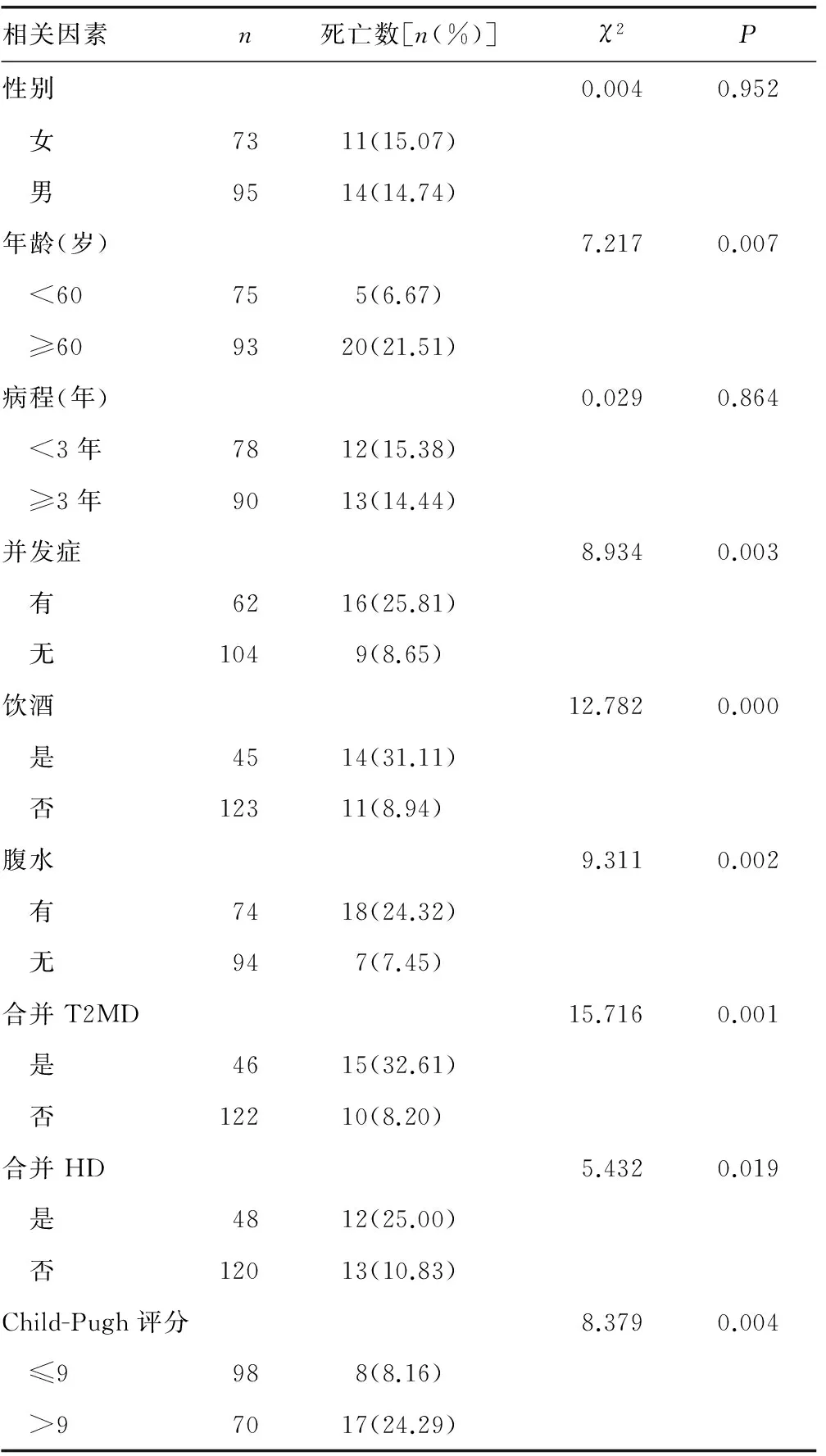
表4 影响肝硬化患者死亡的单因素分析
3 讨论
既往研究指出,糖尿病是肝硬化患者预后不良的独立危险因素,可增加患者病死率[4-5]。本研究中经单因素及Logistic多因素分析显示,糖尿病是肝硬化死亡的独立危险因素,与国外Hu等[6]报道一致,进一步表明糖尿病是肝硬化患者死亡的独立危险因素,肝硬化合并糖尿病患者预后差,病死率高。
目前国际上尚未对HD建立统一的诊断标准及定义,Holstein等[7]在2002年时将其定义为继发于肝硬化的并发症,将发生在肝硬化之后或同时被诊断出的糖尿病定义为HD。随后国内外关于HD的诊断也参照该定义进行。目前无法确定HD的诊断标准主要是由于该病的发病机制尚不明确。相关研究认为,HD的发生机制可能是由于肝硬化时肝代谢功能异常,导致胰岛素水平分泌功能亢进,使得血液中胰岛素水平升高,引起高胰岛血症[8]。血液中胰岛素水平升高会引起胰岛素抵抗,从而抑制胰岛β细胞生成,导致胰岛素分泌功能不足,引起糖尿病。病毒性肝炎患者除了肝脏组织受损外,病毒还可侵犯胰腺组织,从而破坏胰腺胰岛β细胞,导致胰岛β细胞分泌能力减弱,导致血糖水平升高[9]。本研究中肝硬化组FPG、C肽水平低于HD组及T2MD组(P<0.05),而HD组FPG、C肽均高于T2MD组(P<0.05),从而表明HD患者体内存在明显的胰岛素抵抗作用,导致胰岛β细胞功能受损,使得胰岛素调控能力下降,从而导致胰岛素水平升高[10]。这与Winhofer等[11]报道的慢性肝炎患者体内存在明显的胰岛素抵抗及高胰岛素血症的结论一致。
本研究结果显示,肝硬化合并HD患者糖尿病家族史显著低于肝硬化合并T2MD患者,且HD患者FPG、C肽、胆固醇水平均高于合并T2MD患者。HD患者尽管体内存在明显的高胰岛血症,但其C肽分泌水平基本正常,而T2MD患者C肽水平较低,这可能对肝硬化合并HD具有一定的提示意义。国内外也有关于肝硬化合并HD及单纯T2MD间胰岛素与C肽水平的研究[12-13],结果与本研究结果一致。此外,本研究结果显示,肝硬化合并HD与合并T2MD均为肝硬化死亡的独立危险因素,两者均可增加肝硬化患者死亡风险。本研究经Logistic多因素分析显示,除了合并T2MD、合并HD外,Child-Pugh评分也是肝硬化患者死亡的独立危险因素,Child-Pugh评分是临床用于评价肝硬化患者肝脏储备功能的指标,其评分越高,患者肝脏存备功能越差[14]。
综上所述,HD患者与肝硬化患者相比并发症发生率及病死率更高,HD可增加肝硬化患者死亡风险。由于本研究病例数不多,随访时间较短,加之目前尚没有建立HD统一诊断标准,还需要加大样本量进一步行前瞻性研究。
[1]陈杰,惠威,徐斌,等.肝硬化合并肝源性糖尿病患者血清细胞因子水平分析[J/CD].中华临床医师杂志:电子版,2013,(8):3270-3272.
[2]刘大凤,冉兴无,王林,等.病毒性肝炎合并糖尿病的流行病学特征分析[J/CD].中华实验和临床感染病杂志:电子版,2012,6(2):121-124.
[3]Qiu NC,Zhang Q,Song X,et al.Impact of the hepatic branch of the vagus and Roux-en-Y gastric bypass on the hypoglycemic effect and glucagon-like peptide-1 in rats with type 2 diabetes mellitus[J].J Surg Res,2014,191(1):123-129.
[4]Kalra S,Vithalani M,Gulati G,et al.Study of prevalence of nonalcoholic fatty liver disease (NAFLD) in type 2 diabetes patients in india (SPRINT)[J].J Assoc Physicians India,2013,61(7):448-453.
[5]吴娟,胡乃中.肝硬化合并糖尿病临床、预后和糖代谢指标的观察研究[J].中华消化杂志,2013,33(9):601-605.
[6]Hu N,Hu M,Duan R,et al.Increased levels of fatty acids contributed to induction of hepatic CYP3A4 activity induced by diabetes-in vitro evidence from HepG2 cell and Fa2N-4 cell lines[J].J Pharmacologic Sci,2014,124(4):433-444.
[7]Holstein A,Hinze S,Thiessen E,et al.Clinical implications of hepatogenous diabetes in liver cirrhosis[J].J Gastroenterol Hepatol,2002,17(6):677-681.
[8]Bhattacharya S,Bank S,Maiti S,et al.The control of Hyperglycemia by estriol and progesterone in alloxan induced type I diabetes mellitus mice model through hepatic insulin synthesis[J].Int J Biomed Sci,2014,10(1):8-15.
[9]李冰昱,周少雄,谢伟贤,等.慢性乙型肝炎与肝硬化所致肝源性糖尿病患者肝纤四项与胰岛素抵抗的相关性分析[J].实用医学杂志,2013,29(17):2803-2805.
[10]Jenks SJ,Conway BR,Hor TJ,et al.Hepatic steatosis and non-alcoholic fatty liver disease are not associated with decline in renal function in people with type 2 diabetes[J].Diabet Med,2014,31(9):1039-1046.
[11]Winhofer Y,Krššák M,Wolf P,et al.Hepatic rather than cardiac steatosis relates to glucose intolerance in women with prior gestational diabetes[J].PLoS One,2014,9(3):e91607.
[12]涂盛,邵安文,叶真,等.肝源性糖尿病发病机制研究进展[J].中华肝脏病杂志,2014,22(1):78-80.
[13]Liang J,Wang Y,Li H,et al.Combination of diabetes risk factors and hepatic steatosis in Chinese:the Cardiometabolic Risk in Chinese (CRC) Study[J].PLoS One,2014,9(3):e90101.
[14]Sheldon RD,Laughlin MH,Rector RS.Reduced hepatic eNOS phosphorylation is associated with NAFLD and type 2 diabetes progression and is prevented by daily exercise in hyperphagic OLETF rats[J].J Appl Physiol,2014,16(9):1156-1164.
The clinical characteristics and survival study of patients with hepatogenic diabetes
CuiLujia,WeiHong,HuangYongdong,MiaoXinpu
(DepartmentofGastroenterology,thePeople′sHospitalofHainanProvincial,Haikou,Hainan570311,China)
Objective To investigate the clinical characteristics and living conditions of hepatic diabetes (HD) patients and to analyze the risk factors of the prognosis of HD patient.Methods One hundred and sixty-eight cases of cirrhosis cases were divided into liver cirrhosis group(n=74),the combined group cases(n=48)and combined HD type 2 diabetes (T2MD) group(n=46)selected from January 2011 to December 2012.Death was end point.The clinical features and prognosis of patients were compared.The risk factors for liver cirrhosis were analyzed by the simple factor analysis and Logistic regression analysis.Results The patients with history of diabetes in T2MD group were more than those in the HD group and the cirrhosis group (P<0.05).The proportion of alcoholic cirrhosis cirrhosis of HD group and T2MD group were higher than those in liver cirrhosis group (P<0.05).The hepatic encephalopathy,upper gastrointestinal bleeding,electrolyte disorders and other complications,mortality,Child-Pugh score and length of hospital stay of HD group and T2MD groups were significantly higher than those in liver cirrhosis group(P<0.05),but there was no significant difference between HD and T2MD group(P>0.05).The total bilirubin (TBil) of HD group was higher than those of the T2MD group and liver cirrhosis group(P<0.05).The levels of fasting glucose levels(FPG),insulin resistance index (HOMA-IR),total cholesterol (TG),C-peptide of liver cirrhosis group were lower than HD group and T2MD group (P<0.05).The levels of FPG,C peptide of HD group were higher than that of T2MD group (P<0.05).The levels of TG of T2MD group were higher than that of HD group (P<0.05).Logistic multivariate analysis showed that age,alcohol consumption,diabetes,Child-Pugh score were independent risk factors for death in patients with liver cirrhosis.Conclusion The morbidity and mortality of HD patients may be higher than patients with liver cirrhosis,and HD could increase the risk of death in patients with liver cirrhosis.
liver cirrhosis;diabetes mellitus;blood glucose;survival;clinical features
崔路佳(1981-),主治医师,硕士,主要从事胃肠病、肝硬化方向研究。
10.3969/j.issn.1671-8348.2015.03.003
R587.1
A
1671-8348(2015)03-0295-04
2014-09-25
2014-11-01)

