二甲双胍对LKB1基因过表达的子宫内膜癌HEC-1A细胞的影响
宋玥宋红林唐乔乔潘月琼何君葵赵瑞奇
作者单位:530021 南宁1广西医科大学附属肿瘤医院妇瘤二科;2广西医科大学研究生学院
基础研究
二甲双胍对LKB1基因过表达的子宫内膜癌HEC-1A细胞的影响
宋玥1,2宋红林1唐乔乔2潘月琼2何君葵2赵瑞奇2
作者单位:530021 南宁1广西医科大学附属肿瘤医院妇瘤二科;2广西医科大学研究生学院
目的 研究二甲双胍对LKB1基因过表达的子宫内膜癌HEC-1A细胞的增殖与细胞周期的影响。方法 以不同浓度的二甲双胍作用于LKB1基因过表达的子宫内膜癌HEC-1A细胞(LKB组)与缺失LKB1基因表达的HEC-1A细胞(CON组)。用流式细胞术仪检测各组HEC-1A细胞的细胞周期;RT-PCR法和Western blot技术检测各组HEC-1A细胞的LKB1、mTOR基因与蛋白的表达;以平板克隆法与细胞迁移实验检测各组细胞的细胞增殖水平。结果 与缺失LKB1基因表达的HEC-1A细胞比较,LKB1基因过表达的HEC-1A细胞随着二甲双胍浓度的升高明显降低细胞克隆形成率、细胞迁移率、S期细胞比例及mTOR基因与蛋白的表达,而增加G0/G1期细胞比例及LKB1基因与蛋白的表达,差异均有统计学意义(P均<0.05)。结论 二甲双胍抑制LKB1基因过表达的子宫内膜癌HEC-1A细胞的生长和侵袭,其机制可能为介导LKB1/mTOR信号传导通路而抑制子宫内膜癌细胞的增殖。
子宫肿瘤;肝激酶基因;HEC-1A细胞;二甲双胍;胰岛素抵抗
子宫内膜癌是女性最常见的恶性肿瘤之一,肥胖、高血压病和糖尿病是其致病的高危因素。二甲双胍是用于治疗糖尿病的双胍类降糖药,近年研究发现二甲双胍有潜在的抗癌特性,临床上有用于子宫内膜样腺癌治疗取得成功的案例[1,2]。LKB1基因,即肝激酶基因(liver kinase B1),又称丝氨酸苏氨酸激酶Ⅱ(serine threonine kinaseⅡ,STKⅡ),是一种肿瘤生长抑制基因[3],在子宫内膜癌的发生、发展中存在着LKB1基因的表达缺失[4]。同时,相关研究发现二甲双胍可以调节LKB1相关信号传导通路[5,6]。但目前对二甲双胍如何抑制子宫内膜癌的发生、发展尚未完全清楚。本研究拟通过应用不同浓度的二甲双胍处理缺失LKB1基因表达的子宫内膜癌HEC-1A细胞与LKB1基因过表达的HEC-1A细胞,以探讨二甲双胍对子宫内膜癌生长的影响及可能机制。
1 材料与方法
1.1 细胞株
人子宫内膜癌HEC-1A细胞、慢病毒转染LKB1基因过表达的人子宫内膜癌HEC-1A细胞均为广西医科大学附属肿瘤医院实验室传代培养、保存。
1.2 主要试剂及仪器
二甲双胍及胰岛素购自美国Sigma公司。胎牛血清购自美国Hyclone公司。所有引物均由美国Invitrogen(英杰上海生物工程有限公司)公司合成。细胞周期实验盒购自上海凯基公司。BCA蛋白浓度试剂盒购自上海碧云天生物技术有限公司。一步法总RNA提取试剂TRIzol购自美国Invitrogen公司。逆转录试剂盒为美国Fermentas公司产品。兔抗人LKB1 mAb、兔抗人mTOR mAb购自美国Abcam公司。生物素化山羊抗兔IgG购自武汉三鹰生物技术有限公司。安捷伦MX3000P荧光定量PCR仪购自美国Agilent Technologies公司,Multiskan MK3酶标仪购自美国Thermo Scientific公司。
1.3 实验方法
1.3.1 细胞模型的建立 以缺失LKB1基因表达的子宫内膜癌细胞株HEC-1A细胞(CON组)及经慢病毒转染LKB1基因过表达的人子宫内膜癌HEC-1A细胞(LKB组),常规培养于含10%胎牛血清的DMEM培养基中,在5%CO2、37℃培养箱中培养,每天更换培养液,待细胞生长至铺满率达到80%~90%时用胰酶消化传代。各实验组用细胞行血清饥饿24 h后,以二甲双胍0 mmol/L、1 mmol/L、5 mmol/L、10 mmol/L分别处理两组HEC-1A细胞并进行培养36 h。
1.3.2 流式细胞术仪检测各组HEC-1A细胞细胞周期的变化 收集成功建立细胞模型的细胞,用70%乙醇固定过夜,按细胞周期检测试剂盒说明书在流式细胞术检测前加入PI染色,4℃避光30 min后,以流式细胞术仪检测各组细胞的细胞周期。
1.3.3 RT-PCR技术检测各组HEC-1A细胞LKB1 mRNA、mTOR mRNA的表达 各组细胞经不同浓度的二甲双胍处理后,收集细胞并用TRIzol法提取细胞总RNA,按逆转录试剂盒说明书进行逆转录获取cDNA,然后在安捷伦MX3000P荧光定量PCR仪上进行基因扩增。引物由美国Invitrogen公司合成。LKB1上游引物为5′-TGTGGCTATGAGGATGTTTGG-3′,下游引物为5′-TTGGTCGTGTTGTCTGGTTGAT-3′,长度为118 bp。β-actin上游引物为5′-AAAAGC-C ACCCCACTTCTCT-3′,下游引物为3′-GACCAAAAGCCTTCATACATCTCA-5′,长度为221 bp。PCR扩增条件为95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸1min,共40个循环。采用2-△△Ct法分析基因的相对表达量。
1.3.4 Western blot法检测各组HEC-1A细胞LKB1、mTOR蛋白的表达 各组细胞经不同浓度的二甲双胍处理后,收集细胞并使用RIPA和PMSF提取蛋白,按BCA试剂盒说明书进行蛋白定量并稀释,加入1×上样缓冲液混匀,100℃沸水中煮5min。取各组待测蛋白100μg进行SDS-PAGE(凝胶浓度为100 g/L),经分离的蛋白采用湿电转移法转移至PVDF膜上,室温用50 g/L的脱脂奶粉-TBST溶液封闭1 h;加入1∶500稀释的兔抗人LKB1 mAb、兔抗人mTOR mAb,兔抗人β-actinmAb,4℃孵育过夜;TBST洗涤3次×5min,加入辣根过氧化物酶标记的山羊抗兔二抗(1∶3 000)室温孵育1 h;TBST洗涤3次×5 min,ECL显色,用ChemiDocTM MP系统进行扫描,以目的蛋白吸光度值/内参蛋白吸光度值表示LKB1、mTOR蛋白的相对表达量。
1.3.5 细胞克隆实验 将各组HEC-1A细胞按5 000个/L细胞接种到10 cm细胞培养皿中,置于37℃、5%CO2培养箱连续培养18 d后中止培养。细胞经甲醇固定15 min,以0.1%结晶紫染色30 min,显微镜下计数细胞克隆数。实验设3个平行样品,重复实验3次,取平均值表示实验结果。
1.3.6 细胞迁移实验 消化各组HEC-1A细胞,用PBS和无血清培养基先后洗涤1次,用无血清培养基悬浮细胞并计数,调整细胞浓度为1×108个/L;使用Transwell小室,在下室加入600μl细胞悬浮液,继续在细胞培养箱培养24 h;取出Transwell用PBS洗涤2次,甲醇固定,置室温20min;加入0.1%结晶紫于室温下染色30min,PBS洗涤2次,用棉球擦去表面细胞,显微镜下随机取10个视野计数穿过膜的细胞,取其平均值。每个标本重复实验3次。
1.4 统计学方法
采用SPSS 13.0统计学软件进行统计学分析。计量资料数据用±s表示,组间比较采用方差分析或t检验、SNK(Student-Newman-Keuls)法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍对HEC-1A细胞周期的影响
CON组HEC-1A细胞经不同浓度二甲双胍处理后各细胞周期无明显变化,差异均无统计学意义(P均>0.05);LKB组HEC-1A细胞随二甲双胍浓度上升,细胞周期阻滞在G0/G1期,G0/G1期比例增大,而S期比例减小,差异均有统计学意义(P均<0.05),但G2/M期细胞比例则无明显变化,差异无统计学意义(P>0.05)。见表1。
2.2 二甲双胍对HEC-1A细胞LKB1 mRNA、mTOR mRNA与蛋白表达的影响
CON组HEC-1A细胞经不同浓度二甲双胍处理后LKB1 mRNA、mTOR mRNA与蛋白的表达水平无明显变化,差异均无统计学意义(P均>0.05);LKB组HEC-1A细胞随二甲双胍浓度上升,LKB1mRNA与蛋白的表达明显上调,而mTORmRNA与蛋白的表达明显下调,差异均有统计学意义(P均<0.05)。见表2、表3。不同浓度二甲双胍处理后,CON组LKB1 mRNA、mTOR mRNA、LKB1蛋白表达水平、mTOR蛋白表达水平分别与LKB组比较,差异均有统计学意义(P均<0.05)。
表1 不同浓度的二甲双胍作用两组HEC-1A细胞后细胞周期的变化[(±s)%]

表1 不同浓度的二甲双胍作用两组HEC-1A细胞后细胞周期的变化[(±s)%]
二甲双胍(mmol/L)组别 细胞周期0 1 F P 5 10 CON组G0/G1期 41.51±4.01 44.57±1.19 44.51±1.22 43.18±1.24 0.591 >0.05 S期 37.24±3.65 31.67±1.27 32.17±1.25 32.06±1.61 0.923 >0.05 G2/M期 21.25±1.87 23.76±1.62 23.32±2.08 26.76±1.86 0.785 >0.05 LKB组G0/G1期 50.9±2.65 64.77±0.96 69.8±0.95 76.2±3.32 101.218 <0.05 S期 27.6±1.17 22.33±0.45 18.17±1.1 13.67±2.14 57.552 <0.05 G2/M期 11.5±0.89 10.33±2.49 10.97±2.54 9.43±0.55 0.690 >0.05
表2 不同浓度的二甲双胍作用两组HEC-1A细胞后LKB1m RNA、m TOR m RNA表达的变化(±s)
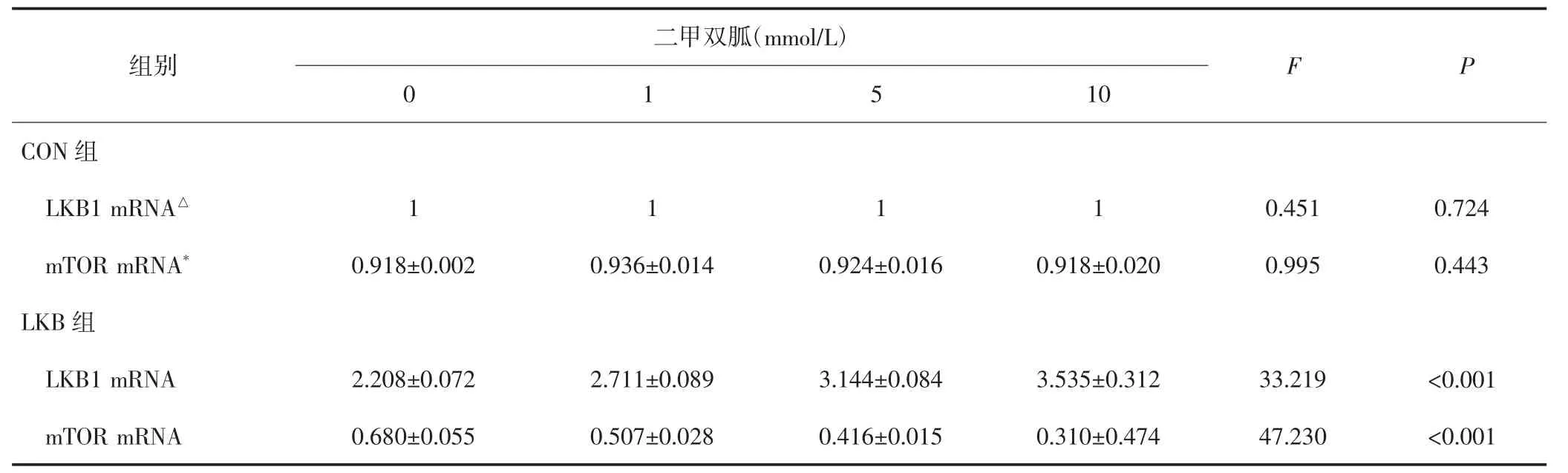
表2 不同浓度的二甲双胍作用两组HEC-1A细胞后LKB1m RNA、m TOR m RNA表达的变化(±s)
CON组LKB1mRNA、mTORmRNA与LKB组比较,△、*P均<0.05。
二甲双胍(mmol/L)组别0 1 F P 5 10 CON组LKB1mRNA△mTORmRNA*LKB组LKB1mRNA 1 1 1 1 0.451 0.724 0.918±0.002 0.936±0.014 0.924±0.016 0.918±0.020 0.995 0.443 2.208±0.072 2.711±0.089 3.144±0.084 3.535±0.312 33.219 <0.001 mTORmRNA 0.680±0.055 0.507±0.028 0.416±0.015 0.310±0.474 47.230 <0.001
表3 不同浓度的二甲双胍作用两组HEC-1A细胞后LKB1、m TOR蛋白表达的变化(±s)

表3 不同浓度的二甲双胍作用两组HEC-1A细胞后LKB1、m TOR蛋白表达的变化(±s)
CON组LKB1、mTOR蛋白与LKB组比较,△、*P均<0.05。
二甲双胍(mmol/L)组别0 1 F P 5 10 CON组LKB1△mTOR*LKB组LKB1 0 0 0 0--0.473±0.117 0.596±0.082 0.533±0.087 0.440±0.030 1.957 0.199 0.260±0.039 0.414±0.039 0.640±0.040 0.875±0.095 63.141 <0.001 mTOR 0.449±0.028 0.352±0.064 0.254±0.029 0.172±0.022 27.880 <0.001
2.3 二甲双胍对HEC-1A细胞的克隆形成能力与细胞迁移能力的影响
各组细胞经不同浓度的二甲双胍处理后进行平板克隆实验检测细胞克隆形成能力。结果显示CON组HEC-1A细胞的细胞克隆形成率无明显变化,差异无统计学意义(P>0.05);LKB组HEC-1A细胞随着二甲双胍浓度上升,细胞克隆形成率越小,差异有统计学意义(P<0.05)。见表4。迁移实验结果显示,CON组HEC-1A细胞迁移率无明显变化,差异无统计学意义(P>0.05);LKB组HEC-1A细胞随二甲双胍浓度上升,细胞迁移率明显降低,差异有统计学意义(P<0.05)。见表5。不同浓度二甲双胍处理后,CON组和LKB组的细胞克隆形成能力及迁移能力比较,差异均有统计学意义(P均<0.05)。
表4 不同浓度的二甲双胍作用两组HEC-1A细胞后细胞克隆能力的变化(±s)
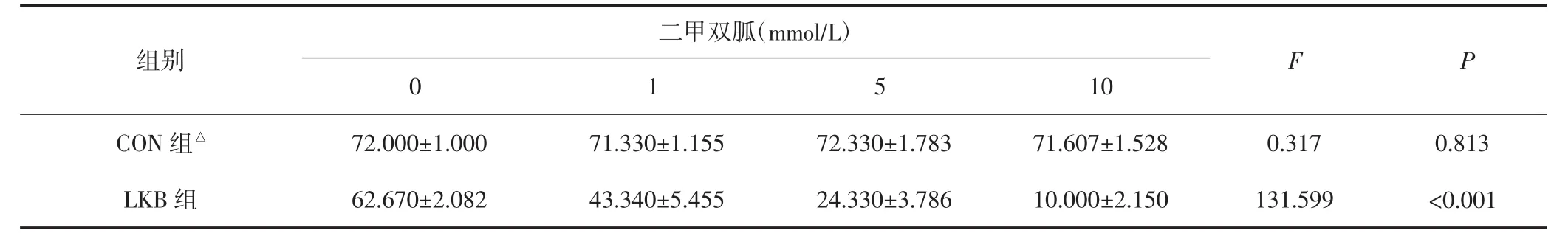
表4 不同浓度的二甲双胍作用两组HEC-1A细胞后细胞克隆能力的变化(±s)
C ON组与LKB组比较,△P均<0.05。
二甲双胍(mmol/L)组别F P 10 CON组△72.000±1.000 71.330±1.155 72.330±1.783 71.607±1.528 0.317 0.813 LKB组0 1 5 62.670±2.082 43.340±5.455 24.330±3.786 10.000±2.150 131.599 <0.001
表5 不同浓度的二甲双胍作用两组HEC-1A细胞后细胞迁移能力的变化(±s)

表5 不同浓度的二甲双胍作用两组HEC-1A细胞后细胞迁移能力的变化(±s)
C ON组与LKB组比较,△P均<0.05。
二甲双胍(mmol/L)组别F P 10 CON组△173.670±1.155 167.670±10.408 157.870±1.098 158.330±2.323 6.651 0.014 LKB组0 1 5 142.260±4.583 63.670±3.512 45.330±2.082 25.670±1.781 779.522 <0.001
3 讨论
美国癌症协会调查发现,子宫内膜癌的发病率占女性生殖道恶性肿瘤的首位[7]。随着分子生物学的发展,目前认为子宫内膜癌的高危因素具有肥胖、高血压病和糖尿病共同的病理生理基础是胰岛素抵抗(insulin resistance,IR)和继发高胰岛素血症。二甲双胍可通过降低体内高胰岛素血症及改善胰岛素抵抗状态而发挥其抗癌特性[8,9]。但国内外尚无有关二甲双胍治疗子宫内膜癌的分子生物学机制的研究报道。
LKB1是Hemminki等[10]从peutz-Jeghers syndrome(PJS)患者血液细胞中克隆出来的基因。Hwang等[11]在研究肌肉高血糖与胰岛素抵抗的关系时,发现红松内酯是通过介导LKB1相关信号通路来增强肌肉的葡萄糖摄取能力。Grahame[12]的研究证实了LKB1是胰岛素抵抗相关信号通路的重要因子。同时,大量研究也表明在缺失LKB1基因表达的动物模型中子宫内膜癌的高发和高侵袭性[13,14]。这与本研究结果相符,经慢病毒转染LKB1基因过表达的子宫内膜癌HEC-1A细胞相对缺失LKB1基因表达的子宫内膜癌HEC-1A细胞的生长、细胞克隆形成能力与迁移率均明显活跃[15]。LKB1是AMP依赖的蛋白激酶(adenosine 5′-monophosphate(AMP)-activated protein kinase,AMPK)的一个上游激酶[16,17],可以通过激活AMPK,从而抑制mTOR复合体,最终抑制肿瘤细胞的生长与侵袭。在本研究中,我们用不同浓度的二甲双胍与缺失LKB1基因表达和LKB1基因过表达的HEC-1A细胞共同培养,发现随着二甲双胍浓度的增加,LKB1基因过表达的HEC-1A子宫内膜癌细胞的细胞周期、细胞克隆形成能力及迁移能力都受到明显抑制,同时,RT-PCR技术与 Western blot法检测结果也显示LKB1相关信号传导通路受到抑制,表现为LKB1 mRNA的表达上调和mTOR mRNA的表达下调,但缺失LKB1基因表达的HEC-1A细胞的生长及LKB1/ AMPK/mTOR通路活性无明显改变。Laskov等[18]应用糖尿病治疗剂量的二甲双胍治疗子宫内膜癌患者,发现患者相关的肿瘤标志物的水平降低,且发现该试验显示的二甲双胍对女性抗增殖作用与临床上生物学证据一致。大量的临床与基础相关研究也表明二甲双胍对子宫内膜癌在术前或保守治疗中均有积极的作用[18~22]。因此,我们认为二甲双胍通过介导LKB1的活化而激活AMPK-mTOR信号传导通路,从而抑制子宫内膜癌细胞的生长与迁移。
本实验表明在缺失LKB1基因的子宫内膜癌细胞其生长更为活跃,细胞克隆形成能力及迁移能力明显增强。而经慢病毒转染致LKB1基因过表达的子宫内膜癌细胞其生长能力减弱,经不同浓度的二甲双胍处理后细胞生长明显受抑制和LKB1/mTOR通路的活化。提示二甲双胍可能通过介导LKB1信号传导通路抑制子宫内膜癌细胞的生长。
[1] S hen Z Q,Z hu H T,L in J F.R e v e rs e of p ro ge st in-r e s i st an t a t ypica l endo me tr ia l hype r p l a s ia b y me tfor min an d or a l c o n tr acep t i v e s[J].O bst e t Gynec ol,2008,112(2 Pt 2):465-467.
[2] St an osz S.A n a tt emp t a t c o n s e rv a t i v e tr ea t men t in s e l ec t e d ca s e s of t ype I en do me tr ia l ca r cin o ma(st age I a/G1)in y o ung wo men[J].E u r J Gynaec ol O nc ol,2009,30(4):365-369.
[3] Z ha o RX,X u Z X.T a r ge t ing t he LKB1 t um or s upp r e ssor[J].C u rr D r ug T a r ge ts,2014,15(1):32-52.
[4] B or un P,B a rtkow ia k A,B ana s ie w ic z T,e t a l.H igh r e sol u t i o n me lt ing ana l y s i s a s a r api d an d e ff icien t me t h od of s c r eening for s ma ll mu t at i o n s in t he S T K11 gene in pa t ien tsw i t h P eu tz-J eghe rs s yn dro me[J]. BMCM e d Gene t,2013,14:58.
[5] B ang S,C hen Y,A hima R S,e t a l.C o n v e r gence of I P MK an d LKB1-AM P K s igna l ing pa t h w ay s o n me tfor min ac t i o n[J].M ol E n do c r in ol,2014,28(7):1186-1193.
[6] S nima K S,P i ll ai P,C he r ian AM,e t a l.A n t i-d ia b e t ic dr ugme t-for min:cha ll enge s an d pe rs pec t i v e s for cance r t he r apy[J].C u rr C ance r D r ug T a r ge ts,2014,14(8):727-736.
[7] S iege l R,M a J,Z o u Z,e t a l.C ance r st a t i st ic s,2014[J].CA C ance r J C l in,2014,64(1):9-29.
[8] S i v a l ingam V N,M ye rs J,N ich ol a s S,e t a l.M e tfor min in r ep rod uc t i v e hea lt h,p r egnancy an d gynaec olo gica l cance r:e st a bl i s he d an d eme r ging in d ica t i o n s[J].H um R ep rod Up d a t e,2014,20(6):853-868.
[9] D owl ing R J,N i r au l a S,St am bol ic V,e t a l.M e tfor min in cance r:tr an sl a t i o na l cha ll enge s[J].J M ol E n do c r in ol,2012,48(3):31-43.
[10]H emmin k i A,M a rk ie D,T o m l in so n I,e t a l.A s e r ine/t h r e o nine k ina s e gene d e f ec t i v e in P eu tz-J eghe rs s yn dro me[J].N a t u r e,1998,391(6663):184-187.
[11] H w ang S L,J e o ng Y T,H ye Yang J,e t a l.P inu sol i d e imp rov e s high g l uc os e-in d uce d in s u l in r e s i st ance v ia ac t i v a t i o n of AM P-ac t i v a t e d p rot ein k ina s e[J].B i o chem B i o phy s R e s C o mmun,2013,437(3):374-379.
[12]G r ahame H a rd ie D.AM P-ac t i v a t e d p rot ein k ina s e:a k ey r egu l a tor of ene r gy b a l ance w i t h many rol e s in human d i s ea s e[J].J I n t e r n M e d,2014,276(6):543-559.
[13]C heng H,L iu P,Z hang F,e t a l.A gene t ic m o u s e m od e l of in v a s i v e en do me tr ia l cance r dr i v en b y c o ncu rr en t loss of p t en an d L kb1 I s high l y r e s p o n s i v e to m T OR inhi b i t i o n[J].C ance r R e s,2014,74(1):15-23.
[14]T an w a r PS,K ane ko-T a r ui T,Z hang L,e t a l.Stro ma l l i v e r k ina s e B1[S T K11]s igna l ing loss in d uce s ov i d uc t a l a d en o ma s an d en do me tr ia l cance r b y ac t i v a t ingmamma l ian T a r ge t of R apamycin C o mp l e x 1.[J]P L oS Gene t,2012,8(8):e1002906.
[15]唐乔乔,宋玥,龙颖,等.慢病毒介导的LKB1基因在子宫内膜癌HEC-1A细胞中的表达[J].中国癌症防治杂志,2014,6(2):133-137,138.
[16] G oodw in J M,Sv en sso n R U,L o u H J,e t a l.A n AM P K-in d epen d en t s igna l ing pa t h w ay dow n str eam of t he LKB1 t um or s upp r e ssor c o ntrols S nai l1 an d me t a st a t ic p ot en t ia l[J].M ol C e ll,2014,55(3):436-450.
[17]Z hang W,W ang Q,W u Y,e t a l.E n dot he l ia l ce ll-s peci f ic l i v e r k ina s e B1 d e l e t i o n cau s e s en dot he l ia l d y sf unc t i o n an d hype rt en s i o n in mice in v i vo[J].C i r cu l a t i o n,2014,129(13):1428-1439.
[18]L a skov I,D r u d i L,B eauchamp MC,e t a l.A n t i-d ia b e t ic dos e s of me tfor min d ec r ea s e p rol i f e r a t i o n ma rk e rs in t um ors of pa t ien ts w i t h endo me tr ia l cance r[J].Gynec ol O nc ol,2014,134(3):607-614.
[19] M i ts uha s hi A,K iy ok a w a T,S a to Y,e t a l.E ff ec ts of me tfor min o n en do me tr ia l cance r ce ll g rowt h in v i vo:a p r e o pe r a t i v e p ros pec t i v e tr ia l[J].C ance r,2014,120(19):2986-2995.
[20]K o EM,W a lt e r P,J ac kso n A,e t a l.M e tfor min i s a sso cia t e d w i t h imp rov e d s u rv i v a l in en do me tr ia l cance r[J].Gynec ol O nc ol,2014,132(2):438-442.
[21] I g l e s ia s D A,Ya t e s M S,v an d e r H o e v en D,e t a l.A n ot he r s u r p r i s e fro m me tfor min:n ov e l mechani s m of ac t i o n v ia K-R a s in fl uence s en do me tr ia l cance r r e s p o n s e to t he r apy[J].M ol C ance r T he r,2013,12(12):2847-2856.
[22]M ac k ay H J,E i s enhaue r EA,K ame l-R ei d S,e t a l.M ol ecu l a r d e t e r minan ts of o u t c o me w i t h mamma l ian t a r ge t of r apamycin inhi b i t i o n in en do me tr ia l cance r[J].C ance r,2014,120(4):603-610.
[2014-11-05收稿][2014-12-29修回][编辑 阮萃才]
Effect ofmetform in on HEC-1A endometrial cancer cells in the presence of LKB1 overexpression
SONG Yue1,2,SONG Honglin1,TANG Qiaoqiao2,PAN Yueqiong2,HE Junkui2,ZHAO Ruiqi2(1Department of Gynecology Oncology,Affiliated Tumor Hospital of Guangxi Medical University;2Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
SONG Honglin.E-mail:381783170@qq.com
Objective To investigate the effect ofmetformin on proliferation and cell cycle of HEC-1A endometrial cancer cells in the presence of LKB1 overexpression.Methods HEC-1A cells overexpressing LKB1 and control HEC-1A cellswere treated with different concentrations ofmetformin.The two groups were compared in terms of proliferation rate,cellmigration ability and cell cycle using a colony formation assay,transwell experiments and flow cytometry.Expression of LKB1 and mTOR mRNA was measured using RTPCR,and levels of the corresponding proteinsweremeasured using Western blotting.Results Treating LKB1-overexpressing HEC-1Acellswithmetformin inhibited colony formation,cellmotility,and expression ofmTORmRNA and protein in a dose-dependentmanner relative to control HEC-1A cells(P<0.05).It also reduced the proportion of LKB1-overexpressing HEC-1A cells in S phase relative to controls(P<0.05).Conversely,treating LKB1overexpressing HEC-1A cells with metformin increased the proportion of cells in G0/G1phase and upregulated expression of LKB1mRNA and protein in a dose-dependentmanner(P<0.05).Conclusion Metformin inhibits proliferation and cellmigration of HEC-1A endometrial cancer cells overexpressing LKB1,potentially by acting on the LKB1/mTOR signaling pathway.
Endometrial neoplasm;Liver kinase B1;HEC-1A cell;Metformin;Insulin resistance
R737.33
A
1674-5671(2015)01-06
10.3969/j.issn.1674-5671.2015.01.03
广西自然科学基金资助项目(2011GXNSFA018253)
宋红林。E-mail:381783170@qq.com

