巨大淋巴结增生症的CT及MRI表现
金佳熙,李华灿,刘 耀
福建中医药大学附属第二人民医院影像科,福建 福州 350003
(收稿日期:2015-03-03 修回日期:2015-03-24)
巨大淋巴结增生症的CT及MRI表现
金佳熙,李华灿,刘 耀
福建中医药大学附属第二人民医院影像科,福建 福州 350003
目的:探讨巨大淋巴结增生症的影像学特征。方法:回顾性分析经手术病理证实15例患者的CT或MRI表现。结果:病理类型为局限型透明血管型13例;混合型和浆细胞型各1例,均为弥漫型。CT或MRI平扫,3例透明血管型中间可见斑点状或分支状钙化;2例弥漫型内见点状钙化;3例伴有子灶。8例透明血管型增强后动脉期明显强化,门静脉期及延迟后持续强化,强化方式与大血管相似。4例透明血管型中间和(或)周围见迂曲扩张血管影;4例透明血管型(>4 cm)动脉期病灶内见条片状、裂隙状低密度区或低信号区,延迟后2例由周围逐渐向中心强化,2例未见强化;5例透明血管型中度强化,2例弥漫型呈轻-中度强化。结论:CT及MRI能清晰显示该病的特征,熟悉这些特征对于提高诊断准确率、避免误诊具有重要意义。
巨大淋巴结增生症;计算机断层成像;磁共振成像
Castleman病(Castleman disease,CD)又称巨大淋巴结增生症,是一种少见的良性淋巴结增生性疾病。该病发病率低,发病隐匿,病史较长,早期易误诊为神经源性肿瘤、淋巴瘤、胸腺瘤及间质瘤等,诊断存在一定的困难。本研究回顾性分析经手术及病理检查证实的包括颈胸腹15例CD患者资料,病理结果包括透明血管型、混合型及浆细胞型,分析其CT及MRI征象,探讨并总结归纳其影像学表现,以提高对该病的诊断准确率。
1 资料和方法
1.1 临床资料
收集2010年4月—2014年12月经手术病理证实的15例CD患者,女性10例、男性5例;年龄20~56岁,中位年龄36岁,平均年龄35.8岁。病灶发生于胸部及腹部各6例,颈部3例。其中13例经常规体检或意外发现,无明显临床症状;1例背部阵发性刺痛;1例有反复皮疹伴瘙痒、乏力,合并肝、脾大。10例行CT检查,4例行MRI检查,1例同时行CT及MRI检查,均行平扫+增强。
1.2 检查方法
CT扫描采用TOSHIBA公司Aquilion 64层CT检查。扫描参数:管电压120 kV,管电流90~160 mA,层厚0.5 mm,重建层厚3~5 mm,间隔3~5 mm。增强扫描采用高压注射器经肘静脉团注对比剂碘海醇(300 mg I/mL)。腹部CD患者采用3期增强扫描,动脉期25~30 s,门静脉期60~70 s,延迟期300 s,扫描范围为膈顶至耻骨联合。颈、胸部采用双期增强扫描,动脉期25~30 s,静脉期60~70 s;颈部扫描范围为颅底至胸廓入口,胸部扫描范围为胸廓入口至肺底。MRI扫描采用GE公司Signa HDxt 1.5T MRI,胸、腹部视野(field of view,FOV)为420 mm×420 mm,层厚6.0 mm,层间距1.0 mm;颈部FOV为260 mm×260 mm,层厚4.0 mm,层间距1.0 mm。行T1WI及脂肪抑制T2WI,脂肪抑制T1WI动态增强,对比剂采用钆喷酸葡胺注射液(马根维显),注射剂量0.1 mmol/kg,流率2.0 mL/s。
1.3 观察内容
观察病灶的部位、数量、大小、形态、边缘、密度及强化方式,有无钙化及钙化的形态、分布及周围有无增粗迂曲的血管及子灶。
2 结 果
2.1 肿瘤位置、大小、形态及边界
本组15例,其中胸部6例:前上纵隔2例、后纵隔2例、左及右肺门各1例;腹部6例:腹膜后3例、肝门区1例、胰腺下缘1例、盆腔内乙状结肠旁1例;颈部3例:左侧颈根部及左侧颈动脉鞘区各1例、右侧腮腺区1例。均为单发,呈类圆形或椭圆形,大小不等。肿瘤最大径线2~6.8 cm,边界光整,未见分叶,病灶对周围组织无明显侵袭性改变,仅表现为不同程度受推压改变,未见明显胸、腹腔积液。3例病灶伴周围多发子灶(图1),4例病灶周围和(或)中间可见增粗迂曲血管影(图2、3),5例病灶内可见钙化灶。
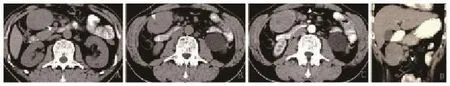
图1 胰腺下缘肠系膜上静脉根部弥漫型混合型Castleman病的CT表现A:平扫,内见点状钙化灶(箭头所示);B:平扫,内见小低密度灶(箭头所示);C、D:分别为动脉期及静脉期,病灶呈轻度强化,中间小低密度灶未见明显强化(箭头所示),病灶周围见多发子灶,呈均匀强化,与主病灶强化类似

图2 左侧颈部局限型透明血管型Castleman病的MRI表现A:T2WI压脂像,呈高信号,病灶中间及周围分别见迂曲扩张流空血管影(箭头所示);B:动脉期,病灶呈明显均匀强化,病灶中间及周围可见强化血管影(箭头所示)
2.2 肿瘤平扫密度或信号
CT平扫病灶与相邻正常肌肉相比呈等或稍低密度,6例密度较均匀,3例密度不均伴中间斑点及分支状钙化(图3、4),2例密度不均(最大径均>4 cm)伴中间灶性低密度灶及点状钙化。5例MRI平扫T1WI呈等或稍低信号,T2WI呈高信号,2例信号尚均匀,2例病灶内及周围见流空血管影(图2),1例(同时行CT检查)中央见条片状T2WI低信号灶。
2.3 肿瘤强化表现
本组病灶强化程度分3度,动脉期CT值上升10 HU左右为轻度强化,上升30 HU左右为中度强化,上升60~90 HU以上为明显强化。8例高度强化,强化方式与同层大血管相似,即动脉期显著强化,CT值105~163 HU。此时胸腹主动脉CT值172~330 HU,门静脉期及延迟后持续强化。5例动脉期均匀强化;3例早期不均匀明显强化,中间见裂隙样或条片状低密度区,其中2例延迟后低密度区逐渐缩小(图4),另1例(同时行MRI检查)延迟后低密度区(T2WI呈低信号)轻度强化,CT值较动脉期增加15 HU左右。7例轻、中度强化,其中4例均匀中度强化,2例不均匀中度强化,1例轻度不均匀强化,不均匀强化肿块中间见小斑片状低密度灶,未见明显强化。周围子灶与主病灶强化程度一致(图1)。
2.4 手术病理
本组15例均行手术完整切除。13例为局限型,病理类型均为透明细胞型;另外2例腹部病例为弥漫型,病理分型分别为混合型和浆细胞型。3例病灶周围多发子灶病理证实均为淋巴结反应性增生。
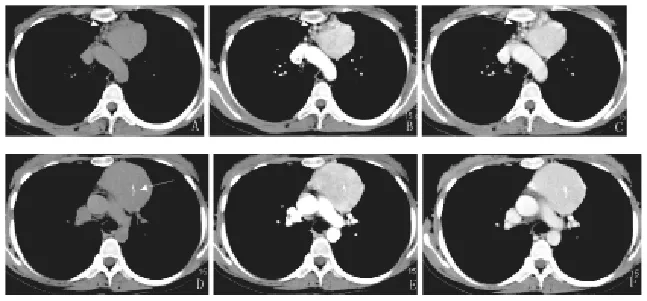
图3 左前纵隔局限型透明血管型Castleman病的CT表现A、D:平扫,病灶中间分支状钙化灶(D,箭头所示);B、E:动脉期,病灶呈明显欠均匀强化;C、F:静脉期,病灶呈持续均匀强化。病灶边缘可见丰富增粗血管影(B、C,箭头所示)
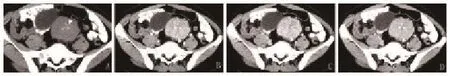
图4 乙状结肠旁局限型透明血管型Castleman病的CT表现A:平扫,中间见斑点状及分支状钙化灶(箭头所示);B、C、D:分别为动脉期、门静脉期及延迟期图像,增强后病灶呈明显不均匀强化,中间见裂隙样低密度区,随时间延长由周围向中央渐进性强化(箭头所示)
3 讨 论
CD病因不明,可能与慢性抗原刺激、病毒感染、药物或免疫功能异常等引起淋巴组织反应性异常增生有关。多数学者认为系淋巴引流区的慢性非特异性炎症所致,由Castleman于1956年首先报道[1]。CD可发生于淋巴结存在的任何部位,最常发生于胸部(70%),其次是颈部(14%)、腹部(12%)、腋部(4%)[2]。本组病灶位于颈部3例、胸部6例、腹部6例,所占比例与文献不符,可能与病例数较少有关系。
3.1 CD的临床及病理
CD临床上按病变累及范围分为局限型和弥漫型;病理学上按形态不同分为透明血管型、浆细胞型及混合型。局限型透明血管型最多见,以淋巴滤泡间大量玻璃样变的小血管和散在的淋巴滤泡增生为主[3]。临床无症状,多为体检或无意间发现,手术多可切除,预后良好。浆细胞型少见,以增生的滤泡间大量浆细胞浸润为主,多为弥漫型,临床上通常有症状及体征,包括发热、乏力、消瘦、肝及脾大等,预后差。混合型兼具两者特点。本组透明血管型13例,均为局限型,手术后效果良好,未见明显复发;浆细胞型及混合型各1例,均为弥漫型。其中浆细胞型合并颌下、双颈部、腋窝、纵隔内及腹腔内淋巴结肿大,术后加以美罗华免疫抑制治疗后随访4年未见明显复发;混合型患者术后随访至今2年未见复发。
3.2 CD的CT及MRI表现
CD的影像学显示形态、边界及与周围组织分界等均具备良性病变的特征,其影像学表现特点与病理类型密切相关。局限型透明血管型CD的特征之一为病灶中央可见斑点状及分支状钙化灶。王仁贵等[4]报道CD合并钙化相对少见,发生率为5%~20.8%,均见于透明血管型,浆细胞型病灶合并钙化未见报道。其病理学基础是病灶内增生的毛细血管主干及分支管壁增厚、管腔狭窄,并呈明显玻璃样变性、硬化和纤维化变性等退变,钙化沿着小血管走行沉积分布,部分钙化灶融合成钙斑[5]。本组3例局限型均呈典型中央斑点及分支状钙化灶。本组另外2例弥漫型(1例混合型、1例浆细胞型)病灶内均可见小点状钙化,与文献报道不同。
透明血管型CD平扫多边界清楚,密度均匀,增强扫描呈显著强化,与同层大血管相似,延迟后持续强化是其另一重要特点[6],且少有坏死、出血,这与其淋巴组织特性及血供丰富有关。透明血管型CD高强化与其周围有较多迂曲扩张供养血管,且增生的微小动脉多为增厚、玻璃样变的血管,致血液在微循环中停留时间延长有关,对比剂廓清缓慢,故强化呈“快进慢出”型[7]。本组4例局限型中间和(或)周围见迂曲扩张血管影。当病灶较大时可出现不均匀强化,病灶内可见低密度灶,其中裂隙样低密度影是局限型CD的另一特点[8]。王仁贵等[9]报道病灶内裂隙状、条片状低密度可有延迟强化的特征。本组病例中4例(>4 cm)增强扫描呈不均匀强化,病灶中间出现裂隙状或条片状、斑片状低密度灶或低信号灶。延迟扫描2例逐渐由周围向中心强化;1例 (同时行MRI检查)中间低密度区(T2WI呈低信号) CT值延迟后测量值与平扫对比升高15 HU左右,呈轻度强化;1例低密度区仍较明显,未见明显强化。有研究认为,增强病灶中间低密度是由于毛细血管玻璃样变、纤维化或其内皮细胞过度增生致血管狭窄、闭塞,使对比剂进入延迟或不能进入[5,10]。范舒璇等[11]研究病理证实病灶中间的低密度或低信号区为纤维组织及玻璃样变性的血管结构所致,并不是缺血坏死。本组1例腹部病灶中间T2WI低信号灶,CT轻度强化,最后病理证实为纤维组织成分。部分病灶增强呈中度强化,其强化程度不及同层大血管,可能与对比剂的注射方式、流率和剂量有关。弥漫型CD多属于浆细胞型,由于其病理上血管增生较少,血供不如透明血管型丰富,增强后强化程度低于透明血管型,呈轻、中度强化。本组病例中2例弥漫型均呈轻、中度不均匀强化,中间可见灶性低密度灶,延迟后未见明显强化。张敏等[6]认为局限型CD病灶周围伴子灶为其另一征象,肿块周围子灶的病理改变与主灶的性质一致为慢性淋巴结炎症。本组3例病灶(1例局灶型透明血管型及2例弥漫型)周围可见子灶,术后病理证实3例均为淋巴结反应性增生。我们认为CD伴有子灶在与其他病变的鉴别存在一定的价值。
MRI软组织分辨率较CT有明显优势,能多方位成像,无论平扫或增强均能清晰显示病灶中间及周围迂曲扩张的血管影。MRI平扫就能区分病变中央瘢痕与液化坏死[12]。但CT对钙化的显示优于MRI。
3.3 鉴别诊断
CD主要与下面几种疾病鉴别。① 淋巴瘤:一般累及多个淋巴结,部分融合成团,包绕血管呈血管漂浮征,呈轻、中度强化[7]。② 神经源性肿瘤:多沿神经或血管走行分布,常伴有坏死、囊 变[6,13]。③ 胸腺瘤:发生于前纵隔胸腺区,常伴重症肌无力,侵袭性胸腺瘤常侵犯周围组织。④ 异位嗜铬细胞瘤:其内可有出血、坏死及囊变,增强后明显不均匀强化,临床上常伴有高血压病史[14]。⑤ 间质瘤:多为富血供肿瘤,但其强化程度较透明血管型CD轻,且多为分叶状,>5 cm 时多为恶性,囊变坏死多见[14]。
综上所述,局限型透明血管型CD具有相对特征性影像学表现,包括:① 中间斑点状及分支状钙化;② 中间和(或)周围迂曲扩张血管影;③ 增强表现多呈持续高强化,较大肿块内增强后可出现裂隙样、条片状低密度区或低信号区;④ 病灶周围可伴子灶,故表现典型的CD在术前多数能明确诊断。弥漫型浆细胞型及混合型CD的病变范围广,多呈轻、中度强化,缺乏特征性影像学特征,确诊仍需结合病理检查。
[1]CASTLEMAN B, IVERSON L, MENENDEZ V P. Localized mediastinal lymph-node hyperplasia resembling thymoma [J]. Cancer, 1956, 9(4): 822-830.
[2]郑穗生, 刘斌. 医学影像疑难病例解读[M]. 合肥: 安徽科学技术出版社, 2013: 264-265.
[3]那加, 柳萍, 王仁贵, 等. Castleman病的临床病理观察[J]. 中华病理学杂志, 2003, 32(6): 521-524.
[4]王仁贵, 那佳, 宾怀有, 等. 局限性Castleman病特征性钙化的CT表 现 和病理学对照 [J]. 中华放射学杂志 , 2002, 36(4): 354-356.
[5]马强, 贺文. Castleman病的临床和影像学研究进展 [J].山西医药杂志, 2013, 42(2): 149-150.
[6]张敏, 周良平, 刘庆喜, 等. 腹盆部局限性巨大淋巴结增生的CT及MRI表现 [J]. 中国医学影像技术, 2009, 25(9): 1631-1634.
[7]王昌盛, 宋立强. 腹、盆部Castleman 病的CT表现及病理对照 [J]. 中国CT和MRI杂志, 2015, 13(1): 75-77.
[8]李丹燕, 朱斌, 祝因苏, 等. 胸腹部局灶型巨大淋巴结增生症影像学表现 [J]. 放射学实践, 2013, 28(9): 955-959.
[9]王仁贵, 霍萌, 王丹丹, 等. 胸腹部局限型Castleman病的CT特征分析 [J]. 中华放射学杂志, 2010, 44(11): 1161-1166.
[10]邹玉坚, 郑晓林, 陈瞾, 等. 局限型巨大淋巴结增生症的影像学表现 [J]. 中国CT和MRI杂志, 2011, 9(6): 69-72.
[11]范舒璇, 叶兆祥, 孟晓燕, 等. Castleman病的CT表现及临床病理特点 [J]. 放射学实践, 2014, 29(6): 647-650.
[12]周良平, 张 蓓, 王佩华, 等. 腹、盆部巨大淋巴结增生的影像学表现 [J]. 中华放射学杂志, 2006, 40(5): 522-526.
[13]靳仓正, 叶宇俊, 严福华. 腹部局灶型透明血管型Castleman病的MSCT表现 [J]. 临床放射学杂志, 2014, 33(6): 886-889.
[14]李刚, 姚秀忠, 张化一, 等. 腹膜后局限型Castleman病的CT及MRI表现 [J]. 医学影像学杂志, 2014, 24(10): 1786-1789.
CT and MRI findings of Castleman disease
LI Huacan E-mail: 13067260922@sohu.com
Objective:To analyze the imaging features of Castleman disease (CD).Methods:A total of 15 patients with Castleman disease were performed CT or MRI scan and proved by pathology.Results:Among the patients, 13 localized cases were hyaline vascular type (HVT), 1 diffuse case was mixed type, and 1 diffuse case was plasma cell type (PCT). On CT or MRI scan, 3 cases of HVT showed punctate or bifurcate calcifications. 1 case of PCT and 1 case of mixed type showed punctate calcifications. 3 cases had small satellite nodules. A significant enhancement was shown in 8 cases of HVT in arterial phase, with nearly the same enhancement level compared with vessels. In portal venous phase and delayed phase the enhancement continued. Enlarged blood vessels within or around the mass were displayed in 4 cases of HVT. In 4 cases of HVT, the intratumoral radial or fissured nonenhanced areas in early stage of enhancement were gradually filled up (2 cases) or still obviously existed (other 2 cases) as the scan time was delayed. 5 cases of HVT displayed moderate enhancement. 2 diffuse cases showed mild-moderate enhancement.Conclusion:The characteristics of CD can be showed clearly by CT and MRI. It is important to be familiar with these characteristics to improve the diagnostic accuracy and to avoid misdiagnosis.
Castleman disease; Computed tomography; Magnetic resonance imaging
(收稿日期:2015-03-03 修回日期:2015-03-24)
R445.2; R445.3
A
1008-617X(2015)01-0303-05
李华灿 E-mail:13067260922@sohu.com
JIN Jiaxi, LI Huacan, LIU Yao (Department of Radiology, The SecondPeople’s Hospital, Fujian University of Traditional Chinese Medicine, Fuzhou Fujian 350003, China)

