广西北部湾管角螺性腺发育与繁殖规律研究❋
区小玲, 苏翔驹, 何俊锋, 王文杰, 2,潘奕达, 2,吴雪萍, 2, 陈德金, 唐甜甜, 潘 英, 2❋❋
(1. 广西大学动物科学技术学院,广西 南宁530004;2. 广西高校水生生物健康养殖与营养调控重点实验室,广西 南宁 530005)
广西北部湾管角螺性腺发育与繁殖规律研究❋
区小玲1, 苏翔驹1, 何俊锋1, 王文杰1, 2,潘奕达1, 2,吴雪萍1, 2, 陈德金1, 唐甜甜1, 潘 英1, 2❋❋
(1. 广西大学动物科学技术学院,广西 南宁530004;2. 广西高校水生生物健康养殖与营养调控重点实验室,广西 南宁 530005)
本文对广西北部湾海域管角螺(Hemifusustuba)的生殖系统进行了解剖和观察,采用组织切片技术对其生殖腺发育和生殖细胞的发生过程进行研究。结果表明:广西北部湾管角螺为雌雄异体,雌雄比例接近1∶1。雄性生殖系统主要由精巢、贮精囊、前列腺、输精管和阴茎(阴茎囊和交接器)构成,精巢发育分为增殖期、生长期、成熟与排放期、退化期4个时期。雌性生殖系统由卵巢、输卵管、囊腺体(蛋白腺和缠卵腺)、生殖孔和腹足口组成,卵巢的发育分为增殖期、生长期、成熟与排放期、休止期4个时期。精细胞发生经过精原细胞、初级精母细胞、次级精母细胞、精细胞期和成熟精子期5个阶段。卵细胞发生经过卵原细胞、初级卵母细胞、次级卵母细胞、成熟卵子4个阶段。管角螺生殖腺在1周年内具有2个繁殖周期,且卵巢与精巢的周年变化规律相吻合。此外,观测的全部雌性个体除了雌性生殖系统外,还具有雄性生殖器官输精管和阴茎。广西北部湾管角螺雌性个体均存在性畸变现象,性畸变率为100%。
管角螺;性腺发育;精子发生;卵子发生;繁殖规律
管角螺(HemifusustubaGmelin)俗称响螺、角螺,隶属软体动物门(Mollusca)腹足纲(Gastropoda)新腹足目(Neogastropoda)盔螺科(Melongenidae)角螺属(Hemifusus),是一种大型的浅海经济腹足类[1](最大壳高达300 mm以上)。管角螺是西北太平洋的地方性物种,广泛地分布在中国东南沿海,北起浙江南至广西、海南,栖息在近海深为11~42 m的泥沙或软泥底质的海底[2],其软体部肥大,味美且营养丰富。由于近年来过度采捕加上环境污染日益恶化等原因,造成渔区自然资源遭受严重破坏,亟待发展管角螺的人工增养殖。
目前,国内外对管角螺的研究已涉及摄食、繁殖、摄食及饥饿对其幼体的影响、幼螺生长及种内残杀[3-5]、呼吸和循环方面的动力学[6]以及人工育苗及养殖[7-8]、生态习性[9-10]、营养成分分析[11-13]和生化代谢[14-17]、染色体核型[18]、群体遗传学研究[19-21]等方面。对管角螺的繁殖生物学研究主要集中在繁殖习性[22]、胚胎发育[23]及环境因子对胚胎发育的影响[24],而对生殖系统发育方面的研究极少[25]。本研究利用组织切片技术对广西北部湾自然海区管角螺的生殖系统组织学及性腺发育规律进行研究,旨在为管角螺的人工育苗、增养殖、资源保护和开发利用提供科学依据。
1 材料与方法
1.1 材料
管角螺样品取自广西北部湾涠洲岛附近海区(见图1),自2011年1—12月,每月采集5~15个个体作为实验材料,其中1、6月采样2次,其余每月采样1次。共解剖103个个体,雌雄比例接近1∶1。其中雄性个体平均壳高(114.66±9.28)mm,平均壳宽(51.67±8.78)mm,平均体重(79.01±15.83)g,平均软体重(22.64±5.46)g;雌性个体平均壳高(121.26±17.26)mm,平均壳宽(53.49±10.47)mm,平均体重(91.71±29.84)g,平均软体重(29.22±14.91)g。

图1 样品采集地点示意图 (比例尺1∶2100000)Fig.1 The sketch map of the experimental samples collected (bar 1∶2100000)
1.2 方法
管角螺样品低温保鲜运回实验室后,室温恢复其活性并检查个体活力,暂养1 d至其消化道食物排空。用软毛刷除去贝壳表面附着物,用干净滤纸吸干多余水分,对管角螺称重并测量贝壳形态指标,活体解剖,去壳后取出软体部,观察其构造和区分雌雄个体,称重并记录。快速剪下生殖系统及肝脏、囊腺体,将精巢或卵巢与肝脏剥离并分别称重。生殖腺经Bouin氏液固定后,采用常规石蜡切片法与H·E染色制片[26],中性树脂封片,Nikon Eclipse E100 显微镜观察,Axioskop 40显微摄影仪拍照。
在确定雌、雄性和性畸变个体后,根据Gibbs[27]的方法计算其性畸变率(IOI:性畸变雌性个体占雌性个体总数的百分数,IOI=性畸变个体数/雌性个体总数×100%)、相对阴茎大小指数(RPSI=(雌体阴茎平均长度/雄体阴茎平均长度)3×100%)、输精管发育程度指数(VDSI:所有雌性个体VDS的平均数)和性比指数(SRI= 雌性个体数/雄性个体数),用这4项指标对该种群的性畸变程度进行综合评价。
2 结果
2.1 管角螺生殖系统形态结构观察
2 1.1 雄性生殖系统 管角螺雄性生殖系统主要由精巢、输精管、贮精囊、前列腺和阴茎(阴茎囊和交接器)构成,活体解剖观察如图2a所示。
精巢 精巢紧贴肝脏表面,位于内脏团顶部,靠近螺壳一侧,一层薄膜包裹着表面,并随肝脏旋转成螺旋状。在非繁殖季节,精巢只有薄薄的一层,为黄色和橙黄色;繁殖季节精巢变得肥大,大小可增至与肝脏相同,颜色逐渐变浅,一般为黄色和浅黄色。若将繁殖期的精巢与肝脏剥离放平,精巢呈月牙状。
贮精囊 贮精囊是一膨大的囊状结构,紧贴于精巢后部内侧,附着在外套膜上。在非繁殖季节呈土白色,在繁殖季节成熟个体的贮精囊内因充满精液而呈乳白色。
前列腺 前列腺与输精管相连,是一球状突出结构,体积较贮精囊小,呈黄白色。
输精管 输精管是贯穿外套腔壁的一段细长的管道。上连前列腺,末端与阴茎相连。连接前列腺的一端的输精管附着在外套膜上,与肠平行,并沿着外套膜向前伸;输精管中段及连接阴茎的一端则附着在肌肉表层,中间高度弯曲,后端又呈直线状,皆为乳白色。
阴茎 阴茎由阴茎囊和交接器构成。阴茎囊是一扁平弯角状突起,呈黑色,位于足部右侧。连接输精管的一端较宽,末端窄。交接器是阴茎囊末端伸出的白色突出,呈弯钩状。
2.1.2 雌性生殖系统 雌性生殖系统主要由卵巢、输卵管、囊腺体(蛋白腺和缠卵腺)、生殖孔和腹足口组成(见图2b、图3)。

(a.雄性生殖系统:L: 肝脏, S: 精巢, Sv: 贮精囊, Pr: 前列腺, D: 输精管, Ps: 阴茎囊, P: 阴茎;b. 雌性生殖系统:L: 肝脏, O: 卵巢, Oi: 输卵管, Ag: 蛋白腺, Ng: 缠卵腺, Ra: 生殖孔, Dd: 性畸变输精管, Dp: 性畸变阴茎。a. The male reproductive system: L: Liver, S: Spermary, Sv: Seminal vesicle, Pr: Prostate, D: Ductus deferens, Ps: Penial sheath, P: Penis. b. The female reproductive system: L: Liver, O: Ovary, Oi: Oviduct, Ag: Albumen gland, Ng: Nidamental gland, Ra: Reproductive aperture, Dd: Distortion of ductus deferens, Dp: Distortion of penis.)
图2 管角螺的生殖系统
Fig.2 Reproductive system ofH.tuba
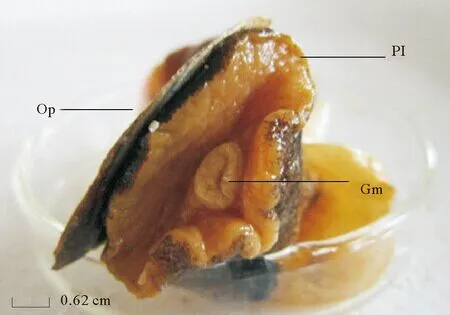
(Op: 厣 Operculum; PI: 腹足 Pleopod; Gm: 腹足口 Gastropod mouth)
卵巢 卵巢的颜色与精巢有较大差别,在位置、形状、结构则与精巢相同。在非繁殖季节,卵巢只有薄薄的一层,呈土白色;繁殖季节卵巢体积迅速增大,并占据肝脏螺旋层的一半,颜色逐渐变深,一般呈褐色和灰褐色。
输卵管 输卵管为土灰色透明状,短小。输卵管一端始于卵巢螺旋底部,并与直肠平行,一端连接囊腺体。
囊腺体 囊腺体在繁殖季节为乳白色长圆筒状结构,附着在外套膜上,由蛋白腺和缠卵腺组成。靠近卵巢较小的一端是蛋白腺,在非繁殖季节为半透明状,繁殖季节变得肥大而明显,颜色加深呈乳白色。缠卵腺在非繁殖季节为一特粗的管状结构,呈黄白色;繁殖季节继而变得肥大,里面充满着白色膏状物质,呈乳白色。
生殖孔 生殖孔是囊腺体的末端的一短管状结构,开口于外套膜右方最前端。
腹足口(产卵孔) 腹足口位于足部前端,由足部表面上皮组织反复凹陷所形成,外表为一突出开口。腹足口与卵囊的形成有关[28-29],管角螺交配时,雄性管角螺将阴茎伸入雌性个体的生殖孔进行交配,受精卵在卵囊腺内形成卵囊雏形,然后从生殖孔产出,到达足面的腹足口(即产卵孔),再经腹足口的成形作用形成特定形状的卵囊附着于基质上[22-23, 30]。
此外,本研究还发现,每个雌性个体除了具有正常雌性生殖器官外,还具有一套输精管和阴茎,但仍表现为雌性。雌性个体的输精管与阴茎相对于正常雄性个体中的输精管与阴茎要细小。管角螺雌性个体所具有的这套雄性生殖器官,其输精管从生殖孔与囊腺体交接点开始向前端延伸,在足部右侧与正常雄性个体阴茎相同的位置形成阴茎,输精管与阴茎大小比正常的雄性个体要小得多,已经接近Gibbs[27]提出VDS(Vas deferens sequences)指数中第4阶段,即小阴茎形成,同时从其基部开始形成输精管前段。
2.2 管角螺生殖系统的组织学
2.2.1 雄性生殖系统
精巢的发育分期 管角螺的精巢由外膜及内部的生精小管和输精小管构成。研究表明,随着季节和个体成熟程度,精巢的丰满度、颜色和生精小管形态结构、生殖细胞形态和数量等会发生周期性变化。根据精巢生精小管的形态、不同发育阶段的各种生殖细胞的数量比例以及间质细胞的多少,将精巢发育划分为增殖期、生长期、成熟与排放期、退化期4个时期。
精细胞的发生 根据生殖细胞的形态结构、大小、发育程度及分布特点,将管角螺精细胞的发生划分为精原细胞期、初级精母细胞期、次级精母细胞期、精子细胞期和成熟精子期等5个时期。各时期的雄性生殖细胞特征如表1及图4所示。

表1 管角螺各期雄性生殖细胞特征Table 1 The male reproductive cell of H. tuba
2.2.2 雌性生殖系统
卵巢的发育分期 卵巢滤泡型(滤泡壁和滤泡腔组成),内含嗜酸性颗粒。研究表明,随着季节和个体成熟程度,卵巢的丰满度、颜色和滤泡形态结构、生殖细胞形态和数量等会发生周期性变化。依据卵巢内滤泡的大小、不同发育阶段的各种雌性生殖细胞的数量比例及嗜酸性颗粒的大小与数量,以及雌性生殖细胞的边成熟边排放的特点,将卵巢的发育划分为增殖期、生长期、成熟与排放期、休止期等4个时期。
卵细胞的发生 依据生殖细胞的形态结构、大小、发育程度以及卵黄颗粒的含量,将管角螺卵细胞的发生划分为卵原细胞期、初级卵母细胞期、次级卵母细胞和成熟卵母细胞期4个时期。各时期的雌性生殖细胞特征见表2及图5。

(1.精原细胞期: L: 肝脏, E: 外膜, Rt: 网状结缔组织, St: 生精小管, Sp: 精子细胞; 2.初级精母细胞期: Ps: 初级精母细胞, Ss: 次级精母细胞; 3.次级精母细胞期: Spe: 精细胞; 4.精子细胞期和精子期: Sip: 精细胞前期, Sim: 精细胞中期, Ms: 成熟精子。1.spermatogonium stage: L: Liver, E: Extima, Rt: Reticular connective tissue, St: Seminiferous tubule, Sd: Seminiferous duct, Sp: Sperm; 2. primary spermatocyte phase: Ps: Primary spermatocyte, Ss: Secondary spermatocyte; 3. secondary spermatocyte phase: Spe: Spermatid; 4. sperm cells period and Sperm phase: Sip: Spermatid in prophase, Sim: Spermatid in metaphase, Ms: Mature sperm.)
图4 管角螺各期雄性生殖细胞(比例尺1∶0.01 mm)
Fig.4 The male reproductive cell ofH.tuba(bar 1∶0.01 mm)

表2 管角螺各期雌性生殖细胞特征

(1.卵原细胞期: F: 滤泡, Og: 卵原细胞; 2.初级卵母细胞期: Po: 初级卵母细胞, So: 次级卵母细胞; 3.次级卵母细胞期: Vso: 卵黄合成前期次级卵母细胞, Vo: 卵黄合成期卵母细胞; 4.成熟卵母细胞期: Ov: 成熟卵细胞, Vi: 卵黄颗粒, A: 嗜酸性颗粒。1. oogonium period: F: Follicle, Og: Oogonium; 2. primary oocyte: Po: Primary oocyte, So: Secondary oocyte; 3. secondary oocytes: Vso: Vitellogenic stage of oocyte, Vo: Vitellogenic of oocyte; 4.mature oocyte: Ov: Ovum, Vi: Vitelline, A: Acidophilic granule.)
图5 管角螺各期雌性生殖细胞(比例尺1∶0.01mm)
Fig.5 The female reproductive cell ofH.tuba(bar 1∶0.01mm)
2.3 性畸变现象
本研究共解剖103个管角螺个体,雄性51个,雌性52个,雌雄比例(SRI)接近1∶1,其中在雌性52个个体中,性畸变现象个体为52个,性畸变率(IOI)为100%(见表3)。

表3 广西北部湾管角螺的性畸变程度Table 3 The degree of imposex of H. tuba from Beibu Gulf in Guangxi
Note:①The sampling sites;②Male penis length;③Female penis length;④Incidence of imposex;⑤Relative penis size index;⑥Vas deferens sequence index;⑦Sex ratio index
2.4 管角螺性腺的周年繁殖发育特征
2.4.1 精巢的周年发育规律 本研究发现,广西北部湾海区管角螺精巢在周年内具有2次生长发育繁殖周期,每次生长发育期间精细胞有多次成熟多次排放现象。其规律为:9月为增殖期,10月为生长期Ⅰ,11—12月为成熟与排放期Ⅰ,次年1—2月精巢发育停滞,在2—3月进入生长期Ⅱ,4—5月为成熟与排放期Ⅱ,6月精母细胞排空,精巢严重退缩,进入退化期。其中,精巢的繁殖高峰期为4、5月,表明精巢的周年繁殖发育以上半年为主。
2.4.2 卵巢的周年发育规律 卵巢和囊腺体的体积与形态随着月份的不同而发生显著的变化,统计雌性囊腺体与性腺的每月重量,求出各个月份的囊腺体重/软体重与性腺/软体重的比值(见图6)。结果显示,3—5月管角螺的性腺与囊腺体可达到最大值,而在7、8月则达到最小值。结合这2个比值在各月份的变化规律与各月份卵巢组织变化规律来推测管角螺的卵巢繁殖发育规律,发现广西北部湾海区管角螺卵巢繁殖规律与精巢相似,在周年内具有2个发育繁殖周期,且在每个发育周期内雌性生殖细胞具有一边成熟一边排放现象。其规律为:9月中下旬至10月上旬为增殖期,10月中旬至11月为生长期Ⅰ,12月到次年1月上旬为成熟与排放期Ⅰ, 1月中旬卵巢发育停滞进入休止期Ⅰ,在2月中下旬进入生长期Ⅱ,3月中下旬直到5月为成熟与排放期Ⅱ,6月卵母细胞排空卵巢严重萎缩,进入休止期Ⅱ。其中,卵巢的繁殖高峰期为4、5月,表明卵巢的周年繁殖发育以上半年为主。因此,卵巢的周年发育规律与精巢的周年变化规律情况相吻合。

图6 北部湾管角螺雌性囊腺体与性腺的周年变化规律Fig.6 Changes of cystadenoma and ovary of H. tuba in Beibu Gulf within an annual cycle
3 讨论
3.1 管角螺雌雄个体的辨别和性比
管角螺为雌雄异体,雌雄个体在贝壳和厣上不易区别,但在繁殖季节雄性个体在外套腔右侧具发达的交接突起,而雌性个体具有交接囊和腹足口[22-23]。研究表明,广西北部湾海域管角螺雌雄个体在软体部存在以下差异:(1)雄性在足部右侧有一肥大的扁平弯角状的阴茎,雌性在足部前端有一个突出的腹足口;(2)雄性有一细长的输精管,在相同部位上雌性则是长筒状的囊腺体;(3)精巢为黄色或橙黄色且组织均匀,而卵巢为褐色、土灰色或土白色,外表呈细微颗粒状;(4)雄性个体的阴茎、前列腺和输精管发达,雌性个体的囊腺体肥大丰满。
此外,本研究首次报道了广西北部湾海域管角螺每个雌性个体都含有一套雄性生殖系统,但仍表现为雌性。有关角螺属生殖系统组织学的研究中,广东湛江细角螺(H.ternatanus)群体[29]发现部分雌性个体具有雄性生殖器官,而广东湛江管角螺群体[25]中却未见报道。针对管角螺雌性个体中含有一套雄性生殖系统的现象,作者推测有以下2种可能性:一种是性逆转(Sex change)现象。性逆转的前提是动物体内既有雌性生殖器官又有雄性生殖器官,一般情况下只会表现出其中一种性别,当某些时候被抑制的另一套生殖系统被激发从而表现出另一种性别。性逆转现象在鱼类中多有发生,其中以黄鳝(MonopterusalbusZuiew)[31]最为常见。近20年来,海洋双壳类中性逆转现象的报道越来越多,在牡蛎科、珍珠贝科和贻贝科[32]中特别明显,主要表现为生活周期某阶段出现性逆转,并在短时间内存在雌雄同体现象[33]。性逆转现象在腹足类中少有报道,曹伏君等[29]认为细角螺的特殊个体为雌性个体向雄性个体的性转变现象。
另一种则是性畸变现象。贝类有很多存在性畸变现象,主要是腹足类,如狗岩螺(Nucellalapillus)[34]、滨螺(Littorinalittorea)[35]、泥螺(Hydrobiaulvae)[36]、方斑东风螺(Babyloniaareolata)和波部东风螺(B.formosaehabei)[37]、疣荔枝螺(Thaisclavigera)[38]等皆有报道。Blaber[34]1970年首次在狗岩螺发现海产腹足类的性畸变现象。1980年代初陆续证实了英国西南海岸狗岩螺和其它一些海产腹足类普遍存在性畸变现象。随后,大量实验证明海产腹足类性畸变与有机锡污染有关,尤以三丁基锡(tributyltin, TBT)的影响最为显著[39-41]。自1960年代开始使用含有机锡化合物的船舶防污漆,对海洋生态系统造成严重的影响,甚至造成不可逆转的破坏。有关研究表明[42],有机锡可导致海产腹足类雌性个体产生雄性的特征,也就是所谓的性畸变(Imposex),严重时导致雌性个体生殖失败,其中三丁基锡能直接导致腹足类雌性个体产生雄性生殖器官,严重时会导致输卵管堵塞,使雌性成体不育而导致种群生存能力下降,甚至区域性绝种。江桂斌等[43]在1999年对大连、天津、青岛和广西北海等地港口海区的调查结果表明,有机锡中的三丁基锡浓度范围平均达到151 ng/L,这一浓度远远高于目前各国制定的三丁基锡限制标准(20 ng/L)。由于底泥对有机锡化合物的高吸附性,而在浅海营底栖生活的管角螺长期生活在有机锡污染的海洋环境中,有机锡化合物通过食物链在其体内富积,从而受到污染。这也是肉食性的管角螺容易发生性畸变的原因之一。
本研究中,管角螺的性畸变发生在雌性个体,性畸变个体除了具有正常雌性生殖器官外,还具有输精管和阴茎,但略细小于正常雄性个体。因此,根据以上的特征初步推测,广西北部湾管角螺雌性个体具有雄性生殖器官为性畸变现象。广西北部湾管角螺的性畸变已达到几乎所有雌体都产生阴茎的严重程度,性畸变率为100%。在输精管发育指数(VDSI)上,当种群VDSI高于4时,就会影响性畸变雌性的正常繁殖功能。广西北部湾管角螺的VDSI达到3.64,接近4,说明该种群雌性个体生殖功能和种群延续能力开始受到影响。然而只根据阴茎的有无和发达程度却无法判断雌体是否有生殖能力,因为生殖能力的丧失是由输精管的形成,并最后导致输卵管阻塞所引起的,与阴茎有无没有直接关系。
本研究自2011年1—12月总共取材103个,其中雌性个体52个,雄性个体51个,雌雄比例接近1∶1。这与林志华等[22]1992年在浙江海区采集到的108个管角螺雌雄比 98∶10(约10∶1)及罗杰等[25]2007年在广东湛江取材179个,管角螺雌雄比 102∶56(约2∶1)的结果有较大差异。虽然根据阴茎的有无和发达程度并不能直接说明雌性管角螺不具生殖能力,但是从1992年、2007年与在2011年采样的管角螺雌雄性比例呈下降趋势来看,有机锡污染直接或间接地使雌性个体数量大大减少。Horiguchi[44]也发现日本东风螺(B.japonica)发生了性畸变,并认为性畸变可能是导致日本近年来东风螺产卵量和捕获量下降的主要原因。此外,不排除不同的地理种群之间个体年龄大小和种的地理分布差异等因素所造成的误差。广西北部湾海域管角螺雌体性畸变的诱变因子、机理及其对种群衰退的影响有待今后深入研究。
3.2 管角螺性腺成熟的影响因素及周年发育规律
影响腹足类生长的环境因素有很多,比如季节变化、海区的温度、海水的盐度、饵料的丰富程度等。大量研究表明[10,22-23],管角螺在水温23~28℃条件下生长速度快,当水温下降到20℃以下时,生长速度明显变慢,下降至13℃基本不摄食,下降至6℃少有爬行活动;当温度达到28℃以上时,生长速度明显变慢,高于34℃时则反应迟钝,极少爬行。管角螺为广盐性贝类,最适生长盐度范围是28.1~32.2。本实验材料取自广西北海涠洲岛附近海区,北部湾位于我国南海西北部,向西凸出的半封闭性浅海,涠洲岛位于北部湾北部浅水区并靠近东岸。该海区的水温年变化为Ⅰ型[45],水温年变幅达到12~15℃,最低水温出现在1—2月,约15.5~18.5℃,最高水温在8月,约30℃。全年出现两个时段最适合管角螺生长:一是4月上旬到5月下旬,温度为22~28℃,呈上升趋势;二是10月中旬到12月中旬,温度为28~22℃,呈下降趋势。该海区年盐度变化为Ⅱ型[45],盐度年变幅小,约2.5左右,最高盐度出现在6月,约33.4,最低盐度出现在11月,约31.0。
组织学观察表明,管角螺的精巢和卵巢在周年内具有2个发育繁殖期:第一次出现在10月—翌年1月上旬,第二次出现在2月中下旬至5月。这个繁殖规律与该海区的温度变化情况相吻合。因此,本文认为管角螺在周年内具有2个繁殖周期的现象主要是由该海区温度所决定的。在1—2月时管角螺性腺发育的停滞可能是由于温度过低,而导致生长速度变慢甚至停止摄食有关,并不是真正发育学意义上的退化期或休止期。周年内上半年管角螺肥满度达到高峰,这可能与北部湾的周年环流模式[45]有关。春夏季的复杂环流模式可能给贝类带来丰富的饵料,而导致贝类在上半年的生长发育比下半年更优,这与本文中的雌性囊腺体与性腺2种腺体指标趋势相吻合。根据周年内广西北部湾海区管角螺的2次生长繁殖发育情况,我们将上半年的繁殖期命名为大繁殖期,下半年的繁殖期命名为小繁殖期。周年内具有2个繁殖期现象在粤西海区管角螺也有类似报道[46]。
3.3 管角螺性腺发育分期
有关管角螺的生殖系统研究国内已有报道。罗杰等[25]的研究表明,管角螺精巢发育分为增殖期、生长期、成熟与排放期、退化期4个时期,精细胞发生经历精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子4个阶段;卵巢发育分为增殖期、生长期、成熟期、排放期和休止期,卵细胞发生过程分为增殖期、生长期和成熟期。本研究观察得到的管角螺精巢和卵巢发育分期与罗杰等[25]的研究结果基本一致。腹足类的性腺发育分期至今仍没有统一的依据或标准。本文依据性腺的形态学表现及生殖泡的发育程度,泡腔中的生殖细胞等变化规律将管角螺雌性的生殖腺发育分为增殖期、生长期、成熟与排放期和休止期4个时期,精巢的发育分为增殖期、生长期、成熟与排放期、退化期4个时期。由于管角螺卵子或精子的排出是以多次成熟、多次排放的生殖方式,导致了性腺的成熟期和排放期难以区分,故本文将成熟期与排放期合并在一起,其它分期则与大多数双壳类和腹足类生殖腺的发育过程基本相同。组织切片观察结果表明,精卵子成熟或排放的时间间隔不大,这2个时期没有明显界限。在繁殖期,管角螺卵巢中滤泡的数目会大量增加,可见管角螺卵巢的发育程度与卵巢内滤泡细胞的数量有关。
[1] 张玺, 齐钟彦. 中国经济动物志 [M]. 北京: 科学出版社, 1962: 60-61.
[2] 蔡英亚, 张英, 魏若飞. 贝类学概论 [M]. 上海: 上海科学技术出版社, 1995: 203-245.
[3] Morton B. Prey preference, capture and ration in Hemifusus tuba (Gmelin) (prosobranchia: Melongenidae) [J]. J Exp Mai Bio Ecol, 1985, 94: 191-210.
[4] Morton B. Reproduction, juvenile growth, consumption and the effects of starvation upon the South China Sea whelk Hemifusus tuba (Gmelin)(Prosobranchia: Melongenidae) [J]. J Exp Mar Biol Ecol, 1986, 102: 257-280.
[5] Morton B. Juvenile growth of the South China Sea whelk Hemifusus tuba (Gmelin) (Prosobranchia: Melongenidae) and the importance of sibling cannibalism in estimates of consumption [J]. J Exp Mar Biol Ecol, 1987, 109(1): 1-14.
[6] Phillips D J H, Depledge M H. Circulation, respiration and fluid dynamics in the gastropod mollusc, Hemifusus tuba(Gmelin) [J]. J Exp Mar Biol Ecol, 1986, 95(1): 1-13.
[7] 潘英, 陈锋华, 庞有萍, 等. 管角螺的生物学特性及养殖 [J]. 水产科学, 2008, 27(1): 24-26.
[8] 潘英, 吴雪萍, 陈德金, 等. 管角螺网笼养殖技术的研究 [J]. 海洋湖沼通报, 2012, 135(4): 84-88.
[9] 陆珠润, 蒋霞敏, 段雪梅, 等. 不同温度、底质和饵料对管角螺孵化和稚、幼螺生长的影响 [J]. 南方水产, 2009, 5(3): 10-14.
[10] 潘英, 陈锋华, 李斌, 等. 管角螺对几种环境因子的耐受性试验 [J]. 水产科学, 2008, 27(11): 566-569.
[11] 傅余强, 顾谦群, 刘睿, 等. 管角螺肌肉中性糖蛋白的化学组成及抗肿瘤活性研究 [J]. 中国海洋药物, 2002, 21(6): 20-24.
[12] 朱爱意, 赵向炯, 杨运琪. 东极海区管角螺软体部的营养成分分析 [J]. 南方水产, 2008, 4(2): 63-68.
[13] 迟淑艳, 周歧存, 周健斌, 等. 华南沿海5种养殖贝类营养成分的比较分析 [J]. 水产科学, 2007, 26(2): 79-83.
[14] 罗杰, 刘楚吾, 唐洪超, 等. 温度对管角螺Hemifusus tuba(Gmelin) 耗氧率和排氨率的影响 [J]. 广东海洋大学学报, 2008, 28(1): 85-88.
[15] 罗杰, 刘楚吾, 李锋, 等. 盐度及规格对管角螺耗氧率和排氨量的影响 [J]. 海洋科学, 2008, 32(5): 46-50.
[16] 罗杰, 刘楚吾, 李锋, 等. 管角螺窒息点及昼夜代谢规律 [J]. 应用生态学报, 2008, 19(9): 2092-2096.
[17] 梁海鹰, 曹伏君, 伍泽妹, 等. 管角螺不同组织同工酶的研究 [J]. 广东海洋大学学报, 2007, 27(6): 22-26.
[18] 曹伏君, 李长玲, 罗杰, 等. 管角螺、细角螺的核型研究 [J]. 广东海洋大学学报, 2008, 28(1): 15-18.
[19] 罗福广, 李斌, 罗平秀, 等. 中国沿海管角螺4个自然种群形态差异的比较 [J]. 中国海洋大学学报(自然科学版), 2010, 40(3): 65-70.
[20] 罗福广, 苏翔驹, 区小玲, 等. 中国沿海管角螺4个自然群体遗传多样性的RAPD分析 [J]. 上海海洋大学学报, 2011, 20(5): 655-660.
[21] 潘英, 慕翠敏, 李琪, 等. 管角螺遗传多样性的AFLP分析 [J]. 中国海洋大学学报(自然科学版), 2013, 43(4): 58-62.
[22] 林志华, 王铁杆, 夏彩国. 管角螺生态及繁殖习性观察 [J]. 海洋科学, 1998(5): 11-12.
[23] 潘英, 庞有萍, 罗福广, 等. 管角螺的繁殖生物学 [J]. 水产学报, 2008, 32(2): 217-222.
[24] 罗杰, 刘楚吾, 黄翔鹄. 盐度对管角螺胚胎发育的影响 [J]. 广东海洋大学学报, 2007, 27(3): 24-28.
[25] 罗杰, 曹伏君, 李长玲, 等. 管角螺生殖系统解剖学及组织学观察 [J]. 水产学报, 2011, 35(4): 569-578.
[26] 芮菊生, 杜懋琴, 陈海明, 等. 组织切片技术[M〗. 北京: 人民教育出版社, 1980.
[27] Gibbs P E, Bryan G W, Pascoe P L, et al. The use of dog-whelk, Nucella lapillus, as an indicator of tributyltin contamination [J]. J Mar Biol Assoc UK, 1987, 67: 507-523.
[28] 柯才焕, 李复雪. 台湾东风螺的生殖系统及其组织结构 [J]. 台湾海峡, 1990, 9(4): 359-365.
[29] 曹伏君, 罗杰, 李长玲, 等. 细角螺的生殖系统组织学研究 [J]. 热带海洋学报, 2010, 29(6): 57-64.
[30] 王慧珍. 浙江动物志(软体动物篇)[M]. 杭州: 浙江科学技术出版社, 1991: 103.
[31] 石琼, 孙儒泳. 黄鳝的性转变 [J]. 生物学通报, 1999, 34(5): 14-15.
[32] 于非非, 余祥勇, 王梅芳, 等. 双壳类的性转换现象及其机理探讨 [J]. 水生生物学报, 2007, 31(4): 576-580.
[33] 廖承义, 徐应馥, 王远隆. 栉孔扇贝的生殖周期 [J]. 水产学报, 1983, 7(1): 1-2.
[34] Blaber S J M. The occurrence of a penis-like outgrowth behind the right tentacle in spent females ofNucellalapillus(L.) [J]. Proc Malac Soc Lond, 1970, 39: 231-233.
[35] Bauer B, Fioroni P, Ide I, et al. TBT effects on the female genital system of Littorina littorea: a possible indication of tributyltin pollution [J]. Hydrobiologia, 1995, 309: 15-27.
[36] Schult e-Oehhm ann U , Oehlmann J P, Fioroni, et al . Imposex and reproductive failure in Hydrobia ulvae (Pennant) (Gastropoda, Prosobranchia) [J]. Mar Biol, 1997, 128: 257-266.
[37] 施华宏, 黄长江, 陈善文. 方斑东风螺和波部东风螺的性畸变及其对生殖的影响 [J]. 中国水产科学, 2003, 10(4): 293-296.
[38] 于秀娟, 黄长江, 朱四喜, 等. 疣荔枝螺(Thais clavigera)性畸变现象的解剖学和组织学研究 [J]. 海洋与湖沼, 2004, 35(2): 149-154.
[39] Cleary J J. Organotin and total tin in coastal waters of South-west England [J]. Mar Pollut Bull, 1985, 16: 350-355.
[40] Smith B S. Male characteristics on female mud snails caused by antifouling bottom paints [J]. J Appl Toxicol, 1981, 1: 22-25.
[41] Bryan G W, Gibbs P E. Comparison of the effectiveness of tributyltin chloride and five other or ganotin compounds in promoting the development of imposex in the dog-whelk Nucella lapillus [J]. J Mar Biol Assoc UK, 1988, 68: 733-744.
[42] 施华宏, 黄长江. 有机锡污染与海产腹足类性畸变 [J]. 生态学报, 2001, 21(10): 1711-1717.
[43] 江桂斌, 徐福正, 何滨, 等. 有机锡化合物测定方法研究进展 [J]. 海洋环境科学, 1999, 18(3): 61-68.
[44] Horiguchi T. Contamination by organotin (tributyltin and triphenyltin) compounds from antifouling paints and endocrine disruption in marine gastropods [J]. Riken Review, 2001, 35: 9-11.
[45] 苏纪兰, 袁业立. 中国近海水文 [M]. 北京: 海洋出版社, 2005.
[46] 王兵兵. 管角螺组织切片与繁育及养殖的初步研究 [D]. 湛江: 广东海洋大学, 2012.
责任编辑 朱宝象
Studies on the Gonadal Development and Reproductive Pattern ofHemifusustuba(Gmelin) Inhabiting Beibu Gulf, Guangxi, China
OU Xiao-Ling1, SU Xiang-Ju1, HE Jun-Feng1, WANG Wen-Jie1, 2, PAN Yi-Da1, 2,
WU Xue-Ping1, 2, CHEN De-Jin1, TANG Tian-Tian1, PAN Ying1, 2
(1.College of Animal Science and Technology, Guangxi University, Nanning 530004, China;2. Provincial Colleges and Universities Key Laboratory of Aquatic Healthy Breeding and Nutrition Regulation of Guangxi, Nanning 530005, China)
In this paper, the reproductive system ofHemifusustubainhabiting Beibu Gulf, Guangxi, China, was dissected and observed, and the process of the development of the genital gland and the germ cells was studied by tissue slicing technique. The results showed thatH.tubawas gonochorism, and the ratio of female and male was close to 1∶1. The male reproductive system was mainly composed of spermary, seminal vesicle, prostate, ductus deferens and the penis (penial sheath and copulatory organ). The spermary development was divided into 4 stages: multiplication, growth, maturity and emission, catagen. The female reproductive system was mainly composed of ovary, oviduct, capsule gland (albumen gland and nidamental gland), reproductive aperture and gastropod mouth. The ovary development was divided into 4 stages: multiplication, growth, maturity and emission, rest. The spermatogenesis could be divided into 5 stages: spermatogonium, primary spermatocyte, secondary spermatocyte, sperm cells and mature sperms. The oogenesis was divided into 4 stages: oogonium, primary oocyte, secondary oocyte and mature oocytes. The genital gland ofH.tubahad 2 reproductive cycles in the year, and the anniversary change of ovary coincided with spermary. In addition, according to the observation, all female individuals had the female reproductive system, also had the male reproductive organs of the ductus deferens and penis. All femalesH.tubafrom Beibu Gulf, Guangxi were found to be imposex, and incidence of imposex was 100%.
Hemifusustuba; gonadogenesis; spermatogenesis; oogenesis; reproductive pattern
国家自然科学基金项目(31060353 );广西科技攻关项目(11107012-9);南宁市科技开发计划项目(201102045B);广西海洋生物技术重点实验室开放基金项目(GLMBT-201201)资助
2013-09-22;
2014-07-19
区小玲(1988-),女,硕士生,主要从事海洋贝类遗传育种研究。E-mail: 417550015@qq.com
❋❋通讯作者: E-mail: yingpan@gxu.edu.cn
S968
A
1672-5174(2015)11-020-09
10.16441/j.cnki.hdxb.20130354

