白芍总苷对糖尿病大鼠肾组织Txnip、Trx与ASK1表达的调节作用
王 喆,吴永贵,章超群,武晓旭,徐兴欣,王 坤
白芍总苷对糖尿病大鼠肾组织Txnip、Trx与ASK1表达的调节作用
王 喆,吴永贵,章超群,武晓旭,徐兴欣,王 坤
目的了解白芍总苷(TGP)对糖尿病大鼠肾组织硫氧还蛋白相互作用蛋白(Txnip)、硫氧还蛋白(Trx)与凋亡信号激酶1(ASK1)表达的影响,探讨TGP对糖尿病肾组织Trx系统调节作用。方法将链脲佐菌素(STZ)诱导的糖尿病大鼠随机分为模型组、TGP[50、100、200 mg/(kg·d)]给药组,另取正常大鼠为对照组,8周后测定大鼠尿白蛋白排泄率(UAER)。应用免疫组化、Western blot法及实时定量PCR法检测大鼠肾组织Txnip、Trx与ASK1表达。结果实验8周后TGP[50、100、200 mg/(kg·d)]给药组及对照组大鼠UAER水平均低于模型组(P<0.01);免疫组化和(或)Western blot法显示TGP[50、100、200 mg/(kg·d)]给药组及对照组大鼠肾组织Txnip、ASK1表达低于模型组(P<0.05,P <0.01),而Trx高于模型组(P<0.05,P<0.01);实时定量PCR显示TGP[50、100、200 mg/(kg·d)]给药组及对照组Txnip mRNA低于模型组(P<0.01,P<0.05),Trx mRNA高于模型组(P<0.01,P<0.05)。结论糖尿病肾病大鼠肾组织存在Trx系统异常,TGP对糖尿病大鼠肾组织保护作用可能与抑制Txnip表达、提高Trx表达有关。
糖尿病肾病;硫氧还蛋白;ASK1;白芍总苷
研究[1]表明氧化应激参与糖尿病肾病的发生及发展。硫氧还蛋白(thioredoxin,Trx)系统是机体一种对抗氧化应激、维持氧化还原反应的平衡系统。Trx是细胞内主要的抗氧化剂,其作用在于减少活性氧生成,另外其还原形式可抑制凋亡信号激酶1 (apoptosis signal-regulating kinase 1,ASK1)的活性,从而抑制ASK1依赖性的凋亡。Trx相互作用蛋白(thioredoxin-interacting protein,Txnip)作为Trx功能和表达的负性调节因子,下调Trx表达,其平衡紊乱可导致氧化还原体系的失调,进而加剧氧化应激[2]。白芍总苷(total glucosides of paeony,TGP)是一种从白芍干燥根中提取的有效物质,主要作用有抗氧化、免疫调节与抗炎[3]。研究[4]表明TGP对糖尿病肾病有明显保护作用,其机制部分与抗氧化应激有关,但其对于Trx系统的作用尚不明确,该研究进一步观察TGP对糖尿病大鼠肾组织Trx、Txnip及ASK1表达的影响,旨在探讨TGP对糖尿病肾组织Trx系统的调节作用。
1 材料与方法
1.1 材料
1.1.1 动物 Munich-Wistar大鼠50只,由安徽医科大学实验动物中心提供,昆明种,体重180~200 g。
1.1.2 药品与试剂 TGP由安徽医科大学临床药理研究所魏教授赠予,使用前先将TGP溶于1%的羧甲基纤维素钠溶液中;链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);尿白蛋白测定试剂盒(法国SPI公司);Trx、Txnip、内参GAPDH引物及探针(上海生工公司);M-MLV反转录酶、RNA酶抑制剂(美国Promega公司);Tag酶及MgCl2(美国Roche公司);TRIzol试剂(美国Life Technologies公司);Txnip、Trx及ASK1多克隆抗体(美国Santa Cruz公司);辣根酶标记山羊抗兔/小鼠IgG(武汉博士德公司);免疫组化检测试剂盒(PV-9000)、DAB显色试剂盒(北京中杉金桥生物技术有限公司);SDSPAGE蛋白上样缓冲液(5×)、SDS-PAGE凝胶配制试剂盒及BCA蛋白定量试剂盒(上海碧云天生物技术研究所);ECL增强发光试剂盒(美国Thermo Scientific公司);硝酸纤维膜(美国Amersham公司)。
1.2 方法
1.2.1 动物饲养条件 实验前所有大鼠于12 h光照、12 h黑暗的光照周期、室温(22±2)℃、相对湿度(55±5)%环境中适应饲养1周。实验期间正常饮食,每日更换敷料,不应用胰岛素,观察8周。
1.2.2 动物分组及模型制备 将适应饲养1周的实验大鼠随机均等分成:对照组、模型组、TGP 50 mg/(kg·d)给药组、TGP 100 mg/(kg·d)给药组、TGP 200 mg/(kg·d)给药组。STZ用前先将其溶于0.01 mmol/L枸橼酸缓冲液中,使其pH达到4.5;模型组及TGP给药组大鼠腹腔一次性注射STZ 65 mg/kg,对照组则注射等量枸橼酸缓冲液。48~72 h后于尾静脉采血,应用血糖仪测定全血血糖,血糖在16.7 mmol/L以上者确定为糖尿病模型。
1.2.3 标本收集 大鼠处死前1 d用代谢笼准确收集24 h尿液,3 000 r/min离心10 min后分装,放置于-80℃冰箱中保存,待测尿白蛋白含量。使用戊巴比妥对大鼠进行腹腔注射麻醉,从右侧颈总动脉插管,向管中注入生理盐水反复灌洗肾脏,至整个肾脏颜色变苍白后去除包膜,并置于冰上,取8 mm3大小肾组织,置于4%多聚甲醛溶液中固定,进行免疫组化研究,剩余肾组织分割成均等大小后分装到冻存管中,迅速转移至液氮中以备Western blot及实时定量PCR检测。
1.2.4 尿白蛋白排泄率(urinary albumin excretion rate,UAER)测定 采用ELISA法测定尿白蛋白含量,UAER=尿白蛋白含量×24 h尿量。
1.2.5 实时定量PCR测定Txnip及Trx的表达使用TRIzol法提取肾组织总RNA,One-Drop核酸蛋白紫外分析仪检测RNA质量和浓度,并要求吸光度(absorbance,A)值A260/A280为1.8~2.0,并调整RNA浓度至1 mg/L。Txnip上游引物:5′-TCAGTCAGAGGCAATCACATTA-3′,下游引物:5′-GGAGCCAGGGACACTAACATAG-3′;Trx上游引物:5′-CCTTCTTTCATTCCCTCTGTGA-3′,下游引物:5′-CCCAACCTTTTGACCCTTTTTA-3′;GAPDH上游引物:5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物:5′-TTTGAGGGTGCAGCGAACTT-3′。使用Bio-Rad SYBR Green PCR试剂盒进行PCR检测,在Bio-Rad Real-Time PCR扩增仪中进行反转录及PCR反应,每个样本均设置3个复孔,计算平均Ct值,按照2-ΔΔCt计算目的基因表达值。
1.2.6 免疫组化测定Txnip、Trx及ASK1的表达大鼠肾组织经甲醛溶液固定及石蜡包埋后制成2 μm厚度的切片,并经多聚赖氨酸处理,将石蜡切片常规脱蜡,滴加3%过氧化氢溶液以抑制内源性过氧化物酶,放置于室温下孵育15 min。冲洗甩干后浸泡于柠檬酸盐缓冲液中,并使用微波炉高火加热10~15 min以修复表面抗原,PBS冲洗后加入山羊血清封闭,37℃孵育30 min,再分别滴加兔抗大鼠Trx多克隆抗体(1∶100)、山羊抗大鼠Txnip多克隆抗体(1∶200)、兔抗大鼠ASK1多克隆抗体(1∶100),使用PBS作为阴性对照组,后放置于4℃冰箱中过夜,第2天,将切片放入37℃温箱中孵育30 min复温,PBS冲洗甩干后滴加聚合物增强剂,37℃孵育20 min,PBS冲洗后加入辣根酶标记山羊抗兔/小鼠IgG多聚体,30℃孵育30 min,PBS冲洗甩干后应用DAB显色。肾小球免疫组化结果按半定量分析法评分,按染色面积计分:微弱或无染色为0分,染色面积<25%为1分,染色面积25%~50%为2分,染色面积51%~75%为3分,染色面积>75% 为4分。肾小管-间质区使用图像分析软件,进行阳性目标分割编辑后测算阳性面积占肾小管-间质百分比,取均值。
1.2.7 Western blot法检测ASK1及Txnip的蛋白表达 取100 mg肾组织及苯甲基磺酰氟(phenylmethanesulfonylfluorid,PMSF)放入匀浆器中,冰上充分研磨后4℃、12 000 r/min离心30 min,取上清液放入EP管中,并用BCA蛋白定量试剂盒测定总蛋白含量。取30 μg蛋白与SDS-PAGE蛋白上样缓冲液(5×)按4∶1比例混匀,置于100℃水浴5 min,使蛋白变性,10 000 r/min,离心1 min,取出上清液放入EP管中,按照SDS-PAGE凝胶配制试剂盒说明书配制6%~15%PAGE胶,上样后先用电压55 V,约45 min,待蛋白电泳至浓缩胶与分离胶交界处时改用电压110 V,约60~90 min。再将蛋白转移至NC膜上,提前将脱脂奶粉5 g、PBST 100 ml配制成封闭液,将NC膜放入封闭液中,放在摇床上室温封闭2 h。洗膜后加入免抗大鼠Txnip(1∶100);ASK1(1∶100)和β-actin(1∶500)4℃过夜,洗膜后放入辣根过氧化物酶偶联的羊抗兔/鼠二抗(1 ∶5 000)中孵育,37℃,1 h。洗膜后使用ECL发光试剂化学显色后曝光并显影,使用Image J图象分析系统测定条带灰度值。β-actin作为内参,取其余组与其比值,计算均值。
1.3 统计学处理采用SPSS 19.0软件进行分析,正态分布资料的实验数据用±s表示,肾小球免疫组化评分为非正态分布资料,用中位数表示。由于UAER为非正态分布资料,故先采用对数转换后,再用几何均数×(÷)耐受因子表示。参数资料采用单因素方差分析检验。非参数资料采用Krustal-Wallis秩和检验。
2 结果
2.1 各组大鼠UAER的变化实验8周后对照组、模型组、模型+TGP 50 mg/(kg·d)给药组、TGP 100 mg/(kg·d)给药组、TGP 200 mg/(kg·d)给药组的UAER水平分别为0.38×(÷)1.3、1.87× (÷)1.1、1.32×(÷)1.1、1.15×(÷)1.1、0.65× (÷)1.1,实验显示模型组大鼠UAER明显高于对照组(P<0.01),而TGP 50、100 mg/(kg·d)给药组及TGP 200 mg/(kg·d)给药组均低于模型组(F =5.41,P<0.05,P<0.01)。
2.2 各组大鼠肾组织Txnip表达的变化对照组、模型组、TGP 50 mg/(kg·d)给药组、TGP 100 mg/(kg·d)给药组、TGP 200 mg/(kg·d)给药组肾小球Txnip表达按染色面积计分,评分分别为0(0~1)、2(2~3)、1.5(1~2)、1(0~1)、0.5(0~1),结果显示模型组肾小球Txnip表达明显高于对照组(P <0.01),TGP 50 mg/(kg·d)及TGP 100、200 mg/(kg·d)给药8周大鼠肾小球Txnip表达低于模型组(H=35.231,P<0.05,P<0.01),见图1。Western blot法显示模型组肾组织Txnip蛋白表达明显高于对照组(P<0.01),与模型组比较,TGP 50、100、200 mg/(kg·d)给药8周肾组织Txnip蛋白表达明显降低(F=30.55,P<0.05),见图2。实时定量PCR显示模型组肾组织Txnip mRNA表达高于对照组(P<0.01)。TGP 50、100、200 mg/(kg·d)给药8周肾组织Txnip mRNA表达低于模型组(F=111.582,P<0.05),见图3。
2.3 各组大鼠肾组织Trx表达的变化免疫组化显示模型组Trx在肾小球及肾小管-间质的表达明显低于对照组(P<0.01),TGP 50、100、200 mg/(kg ·d)给药8周大鼠肾小球中Trx表达高于模型组(H=20.245,P<0.01),TGP 50、100、200 mg/(kg· d)给药组大鼠肾小管-间质中Trx表达也明显高于模型组(F=19.446,P<0.05,P<0.01)。见表1、图4。实时定量PCR显示模型组肾组织Trx mRNA表达明显低于对照组(P<0.01),TGP 50、100、200 mg/(kg·d)给药8周肾组织Trx mRNA表达高于模型组(F=14.377,P<0.05),见图5。
表1 各组大鼠肾组织免疫组化指标Trx变化(n=10,±s)
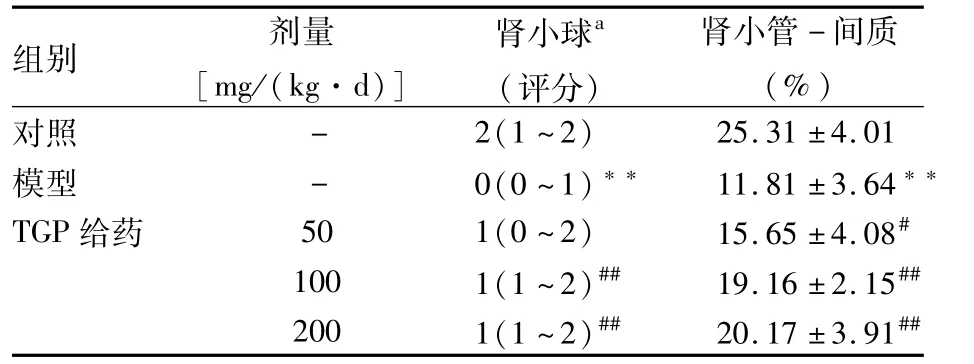
表1 各组大鼠肾组织免疫组化指标Trx变化(n=10,±s)
a肾小球评分为非参数资料,用中位数表示;与对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
组别剂量[mg/(kg·d)]肾小球a(评分)肾小管-间质(%)对照-2(1~2)25.31±4.01模型-0(0~1)**11.81±3.64**TGP给药501(0~2)15.65±4.08#1001(1~2)##19.16±2.15##2001(1~2)##20.17±3.91##
2.4 各组大鼠肾组织ASK1表达的变化免疫组化显示模型组ASK1在肾小球及肾小管-间质的表达明显高于对照组(P<0.01),TGP 50、100、200 mg/(kg·d)给药8周大鼠肾小球中ASK1表达低于模型组(H=26.034,P<0.05,P<0.01),肾小管-间质中ASK1表达也低于模型组(F=32.464,P <0.05,P<0.01)。见表2、图6。Western blot法显示模型组肾组织ASK1蛋白表达明显高于对照组(P <0.01),TGP 50、100、200 mg/(kg·d)给药8周肾组织ASK1蛋白表达明显低于模型组(F=2 214.085,P<0.05),见图7。
表2 各组大鼠肾组织ASK1免疫组化指标变化(n=10,±s)

表2 各组大鼠肾组织ASK1免疫组化指标变化(n=10,±s)
a肾小球评分为非参数资料,用中位数表示;与对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
组别剂量[mg/(kg·d)]肾小球a(评分)肾小管-间质(%)对照-0.5(0~1)2.54±0.63模型-2.5(1~3)**8.48±1.91**TGP给药502(0~2)#6.79±1.43#1001(1~2)##6.44±1.26##2001(0~2)##4.06±0.92##
3 讨论
在高血糖或糖尿病肾病时,体内产生的大量活性氧自由基明显超过机体正常的清除能力,未能清除的活性氧自由基则可激活体内的信号转导通路或细胞因子,引起肾组织的损伤。为了维持细胞内外氧化还原平衡状态,细胞本身存在一个调节系统Trx系统,Trx可清除氧自由基对抗氧化应激,Trx还可与细胞内的一种重要的促凋亡蛋白ASK1结合,从而抑制ASK1活性。Txnip也被称作Trx结合蛋白2(TBP-2)及维生素D3上调蛋白(VDVP-1),高糖是Txnip最主要的生理性刺激物,Txnip通过与ASK1竞争结合Trx,导致了ASK1从Trx-ASK1复合物中释放出来,游离的ASK1随后激活下游的c-Jun氨基端激酶(JNK)和丝裂原活化蛋白激酶p38 (p38 MAPK),诱导细胞凋亡,p38 MAPK反过来可促进Txnip表达,加重氧化应激反应,促进糖尿病肾病进展。
研究[5]显示在糖尿病肾病大鼠造模成功4周时,模型组中Txnip mRNA和蛋白水平均明显增高,说明在糖尿病肾病的早期已有Txnip的增高。实验[6]显示Trx在糖尿病大鼠肾脏组织的表达较正常组明显减少,而Txnip明显升高。研究[7]显示Trx在正常大鼠肾组织中表达较高,在模型组中表达降低。本研究显示,与对照组比较,模型组肾组织中Txnip表达明显升高、Trx表达降低,与上述文献报道一致。Saitoh et al[8]发现Trx可与ASK1的N-末端结合,形成蛋白-蛋白复合物,抑制ASK1活性。本研究提示糖尿病肾组织ASK1表达明显增加,提示Trx系统与凋亡在糖尿病肾病发病中起重要作用。
白芍系毛莨科植物,有多种生理与药理活性,研究[9-10]显示TGP可通过抑制糖尿病大鼠肾组织前炎症介质的过度表达及减少氧化应激,发挥其保护肾脏的作用并且TGP有不依赖降低血糖、血脂水平的DN保护作用,无明显毒副作用。但其对于肾组织Trx系统的影响尚不明确,研究[11]表明在高糖环境下抑制p38 MAPK通路能显著降低Txnip表达,研究[12]显示TGP可显著降低糖尿病肾病大鼠肾组织中p38 MAPK的表达,影响p38 MAPK信号通路的激活。本研究表明TGP可使糖尿病大鼠的UAER明显降低,与模型组比较,TGP给药组Txnip及ASK1明显降低,而Trx表达明显增加,因而,TGP的抗氧化应激作用可能与调节Trx系统有关,TGP可能通过抑制p38 MAPK通路,使Txnip水平降低、Trx水平增加进而降低ASK1水平,发挥其抗氧化应激效应,从而保护糖尿病肾病,并延缓糖尿病肾病进展,但TGP作用于Trx系统的具体机制尚不明确,待进一步研究。
[1] Forbes J M,Coughlan M T,Cooper M E.Oxidative stress as a major culprit in kidney disease in diabetes[J].Diabetes,2008,57(6):1446-54.
[2] Junn E,Han S H,Im J Y,et al.Vitamin D3 up-regulated protein 1 mediates oxidative stress via suppressing the thioredoxin function [J].J Immunol,2000,164(12):6287-95.
[3] 徐叔云,陈敏珠,魏 伟,等.免疫药理与临床[M].中药药理与临床研究进展(第1册).北京:中国科学技术出版社,1992:49-59.
[4] Su J,Zhang P,Zhang J J,et al.Effects of total glucosides of paeony on oxidative stress in the kidney from diabetic rats[J].Phytomedicine,2010,17(34):254-60.
[5] 靳玉宏,郑海霞,贾慧婕,等.糖尿病肾病早期大鼠肾脏中硫氧还蛋白相互作用蛋白的表达研究[J].中国糖尿病杂志,2011,19(3):183-6.
[6] 林海玲,刘东方,王南楠,等.普罗布考对2型糖尿病大鼠肾脏硫氧还蛋白系统表达的影响[J].中华内分泌代谢杂志,2011,27(3):199-203.
[7] 王晓慧,张 新,何 泳,等.曲尼司特对糖尿病肾病大鼠肾脏的保护作用[J].武汉大学学报(医学版),2013,34(1):42-5.
[8] Saitoh M,Nishitoh H,Fujii M,et al.Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase(ASK)1[J]. EMBO J,1998,17(9):2596-606.
[9] 袁 亮,吴永贵,郝 丽,等.白芍总苷对糖尿病大鼠肾脏保护作用及部分机制[J].中国药理学通报,2007,23(6):821-6.
[10]方 芳,吴永贵,董 婧,等.白芍总苷对糖尿病大鼠肾组织氧化应激的影响[J].中国药理学与毒理学杂志,2008,22(3):199-204.
[11]Fang S,Jin Y,Zheng H,et al.High glucose condition upregulated Txnip expression level in rat mesangial cells through ROS/MEK/MAPK pathway[J].Mol Cell Biochem,2011,347(1-2):175-82.
[12]张晶晶,吴永贵,张 培,等.白芍总苷对糖尿病大鼠肾组织p38 MAPK磷酸化与NF-κB表达的影响[J].安徽医科大学学报,2008,43(5):534-7.
Effect of total glucosides of paeony on the expression of Txnip,Trx and ASK1 in the kidney from diabetic rats
Wang Zhe,Wu Yonggui,Zhang Chaoqun,et al
(Dept of Nephropathy,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo research effect of total glucosides of paeony(TGP)on the expression of thioredoxin-interacting protein(Txnip),thioredoxin(Trx)and apoptosis signal-regulating kinase 1(ASK1)investigate role of TGP on thioredoxin system in the kidney from diabetic rats.MethodsDiabetes rats induced with streptozotocin were randomly divided into model group which was treated with TGP[50,100,200 mg/(kg·d),for 8 weeks];besides,use normal rats as control group.24 h urinary albumin excretion rate(UAER)was determined with ELISA. Txnip,Trx and ASK1 were measured with immunohischemistry,Western blot and real-time PCR.ResultsElevated 24 h UAER was obviously decreased by TGP treatment with 50,100,200 mg/(kg·d).Compared with diabetic rats,analysis of the immunohischemistry and/or Western blot showed the expression of Txnip and ASK1 was decreased in TGP treatment with 50,100,200 mg/(kg·d)(P<0.01),and the expression of Trx was increased(P <0.01).Real-time PCR analysis showed that Txnip mRNA expression in diabetic rats was also significantly inhibited by TGP(P<0.05),and that Trx mRNA was markedly increased by TGP(P<0.05).ConclusionThere is an abnormity occuring in the thioredoxin system in the renal tissue of diabetic rats.TGP obviously has the function of renal protection,and its mechanism may be related to the inhibition of Txnip expression and the enhancement of Trx expression.
diabetic nephropathy;thioredoxin;ASK1;total glucosides of paeony
R 587.24
A
1000-1492(2015)07-0916-06
2015-03-10接收
国家自然科学基金(编号:81270813、81374034);安徽省自然科学基金(编号:1208085MH149)
安徽医科大学第一附属医院肾内科,合肥 230022
王 喆,女,硕士研究生;吴永贵,男,博士生导师,责任作者,E-mail:wuyonggui@medmail.com.cn

