畜禽骨蛋白水解及多肽螯合钙研究进展
周小翠 靳国锋 金永国 马美湖 蔡朝霞
摘 要:畜禽骨骼是一种量大并且营养十分丰富的天然资源,但是我国对畜禽骨骼的深加工利用率不足1%。本文针对国内外畜禽骨骼的开发利用现状,结合畜禽骨骼的组成与结构特点,对畜禽骨胶原蛋白水解方法和主要功能性水解产物及其分离纯化方法展开阐述,并重点探讨了畜禽骨胶原多肽螯合钙新型补钙产品的开发研究,对其螯合工艺的主要影响因素以及螯合物的吸收性进行了详细的介绍。最后预测了我国畜禽骨骼制品的开发前景。
关键词:畜禽骨骼;蛋白水解;多肽螯合钙
Current Status and Progress of Studies on Protein Hydrolysis of Livestock and Poultry Bones and Peptide Chelated Calcium
ZHOU Xiaocui, JIN Guofeng, JIN Yongguo, MA Meihu, CAI Zhaoxia*
(National Research & Development Center for Egg Processing, College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract: Livestock and poultry bones are abundant natural resources very rich in nutrients; however, only less than 1% of these resources in China are in depth processed or utilized. This article reviews the current situation in the exploitation and utilization of livestock and poultry bones at home and abroad with respect to chemical composition and structural characteristics, hydrolysis methods, major functional products, and techniques for their separation and purification, with emphasis on the development of bone peptide chelating calcium as a new calcium supplement. A detailed elucidation of the major factors affecting the chelating process as well as the absorption of the chelate is also given. Finally, the future prospect of bone products in China is predicted.
Key words: livestock and poultry bones; proteolysis; peptide chelating calcium
中圖分类号:TS251.1 文献标志码:A 文章编号:
doi: 10.7506/rlyj1001-8123-201508001
我国是畜禽消费大国,几乎达到全世界畜禽消费总量的1/4。2013年1月20日,统计局发布农业生产数据,全年猪牛羊禽肉产量8 373 万t,其中畜禽骨就占了20%~30%,但是其深加工利用率不足1%,大多用来熬汤或生产附加值低的产品,如骨粉、骨泥等。畜禽骨中含有丰富的蛋白质以及人体必需的多种必需氨基酸。同时骨骼中钙的含量是等量鲜肉的几十甚至上百倍,钙磷比近似为2∶1,是适合人体吸收的最佳比例。开发并加工废弃畜禽骨骼,不仅可以充分利用骨中丰富的营养资源,而且还解决了骨骼腐烂造成的环境污染问题。
钙是人体含量最多的无机元素,占体质量的1.5%~2.2%[1],钙在细胞代谢、骨骼生长、血液凝结、肌肉收缩、神经传导以及心脏功能中起重要作用[2]。缺钙是我国人群中普遍存在的问题,根据“中国居民营养与健康现状”调查报告,我国居民钙平均摄入量为0.413 g,仅达到钙的推荐供给量的52%,90%左右的人群钙摄入量严重不足。
现在市面上的补钙产品主要有无机钙、有机钙以及氨基酸螯合钙,但是无机钙生物效价低、有机钙溶解度大易溶失且价格高、氨基酸螯合钙会产生颜色反应并引发脂肪氧化。来自畜禽骨骼水解的胶原多肽,与钙螯合后的新型产品,可以做到胶原与钙同补,有效防止钙流失,起到预防骨质疏松的作用。并且其吸收性比氨基酸螯合钙好,具有广阔的市场前景。因此,水解胶原蛋白是充分利用骨钙的前提,在此基础上开发肽钙产品能够在很大程度上缓解我国居民的缺钙压力,此外,骨胶原肽钙的生产可以变废为宝,原料价格低廉但成品价格十分昂贵,大批量的投入生产可带动畜禽养殖业的发展,同时又可以减少环境污染,对可持续发展具有重要意义。
1 畜禽骨骼开发利用国内外发展概况
骨骼是一种天然复杂的有机体,占动物体质量的10%~20%,主要包括骨基质(胶原与胶原蛋白)和骨矿物质(羟基磷灰石),骨骼的生成首先是形成胶原和基质网,而后钙磷以羟基磷酸钙盐的形式沉积在基质网空隙中。目前,国内外针对畜禽骨骼的综合利用主要是从骨胶原蛋白、骨钙以及多肽的相关产品的开发展开。
20世纪70年代,丹麦等发达国家率先开发出几乎100%利用畜骨的骨泥和骨蛋白粉等制品;20世纪80年代,日本也开发出了食用骨粉、骨糊、骨胶等食品;随后前苏联及美国连珠公司分别从骨中提取了食用蛋白干品及可溶性蛋白[3];丹麦率先运用酶来处理动物骨头,生产食用蛋白粉和明胶[4]。相对来说,我国对畜骨的开发和利用起步较晚,但随着国内研究力度的加大和科研工作者的不懈努力,畜骨产品的开发也取得了一定成绩[5]。畜禽骨产品的研发,大致可分为全骨产品和骨提取物两大类,全骨产品主要有骨粉、骨泥等,骨提取物主要有骨蛋白、骨素、骨明胶、骨多肽、骨油及骨钙等。近年来,国内外众多学者主要致力于畜禽骨骼酶解技术的研究,以期获得功能性多肽产品,并且已经颇有成效。
2 畜禽骨胶原蛋白酶解
骨骼中的蛋白质90%为胶原及软骨素(酸性黏多糖),胶原蛋白具有独特的3 股超螺旋结构,3 条α链相互平行,由链间氢键相连,具有十分稳定的性质,一般的加工温度或短时间的加热都很难使其分解,因此不易被人体吸收,利用率较低。为了开拓其市场,一般将其进行水解制备功能活性肽。
2.1 畜禽骨胶原蛋白多肽的生理功能
自1979年日本学者大岛等[6]确认明胶降解的多肽具有降血压作用以来,已有许多研究证明骨胶原多肽具有很多其他生理功能,如预防和治疗骨质疏松、清除自由基、抗疲劳、抑菌及抗肿瘤等多种活性[7-8]。
骨胶原蛋白水解产物能够有效地清除自由基,对抗氧化和抗衰老有积极作用。研究表明,蛋白水解产物中的缬氨酸、组氨酸、脯氨酸、天冬氨酸具有较高的抗氧化活性[9]。另外,胶原多肽对纤维黏连蛋白具有很高的亲和性,因此胶原多肽对癌细胞的转移过程具有重要作用。
含胶原多肽和明胶的一些产品一直被认为对关节是很有益处的。Zhang He等[10]以胶原多肽饲喂去卵巢雌性小鼠,13 周后发现骨密度显著上升,说明补充胶原多肽可以预防和治疗骨质疏松。另外,畜禽骨骼酶解液具有一定抑菌作用。张顺亮等[11]采用多种酶对牛骨胶原蛋白进行水解并测定酶解液对S.aureus和S.enteria的抑制活性。研究表明,动物复合蛋白酶和胰蛋白酶水解得到的肽只对革兰氏阴性菌起作用,中性蛋白酶水解得到的肽可能只对革兰氏阳性菌起作用,而风味蛋白酶水解得到的肽可能对两种细菌都起作用。
2.2 畜禽骨骼骨胶原蛋白酶解工艺
2.2.1 畜禽骨骼胶原蛋白酶解方法
畜禽骨骼胶原蛋白的水解方式主要有酸法、碱法、高温热解法和生物酶解法[12]。酸法主要是采用强酸在高温下水解,反应条件强烈,连续处理时较难操作,严重腐蚀设备,得到的多肽分子质量参差不齐,多生成氨基酸混合物;碱法生产过程中常发生消旋现象,产生D和L-型的等物质的量混合物,其中D-型氨基酸不能作为有效的氨基酸源,有些还具有毒性甚至有致癌、致畸和致突变风险;高温热解法所得产品优点在于含盐量低,但水解时间长,需带压操作,产物分子质量分布不均匀,也不适合生产食品级胶原多肽;近年来报道最多的是生物酶解法,其优点在于反应条件温和可控,反应时间短,不造成环境污染,产品营养价值高,产物以多肽和L-型游離氨基酸为主,易于人体消化吸收,该法有助于提高蛋白质的质量和功能性质。
2.2.2 胶原蛋白酶解工艺中酶的选择
能使胶原蛋白水解的酶类较多,从来源上可分为植物蛋白酶、动物蛋白酶和微生物蛋白酶;此外,较常用于水解的蛋白酶还有风味复合酶等。一般来说,动物蛋白酶酶解得到的胶原多肽的分子质量范围比植物蛋白酶酶解的更广。
常用的植物蛋白酶有菠萝蛋白酶和木瓜蛋白酶。木瓜蛋白酶属巯基蛋白酶,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N端具有二个羧基的氨基酸或芳香L-氨基酸的肽键。菠萝蛋白酶属于巯基蛋白酶,其作用位点无特异性。常用的动物蛋白酶有胰蛋白酶和胃蛋白酶。胃蛋白酶倾向于剪切氨基端或羧基端为芳香族氨基酸(如苯丙氨酸、色氨酸和酪氨酸)或亮氨酸的肽键;而如果往某一肽键氨基端数第3个氨基酸为碱性氨基酸(如赖氨酸、精氨酸和组氨酸)或者该肽键的氨基端为精氨酸时,则不能有效地对此肽键进行剪切。胰蛋白酶作用位点在赖氨酸和精氨酸之间。常用的微生物蛋白酶如碱性蛋白酶主要存在于细菌、放线菌和真菌中,商业应用的碱性蛋白酶主要来源于地衣芽孢杆菌,大部分碱性蛋白酶的最适pH值为9~11之间,其专一性受切开点两侧氨基酸残基,尤其是羧基端第一位氨基酸的影响。中性蛋白酶是最早发现并广泛应用于工业化生产的蛋白酶制剂,无序列特异性。
2.2.3 酶解条件优化
虽然酶法水解有其不可替代的优越性,但由于骨胶原蛋白结构稳定,酶法水解的水解度一般较低,因此越来越多的工作集中在酶解工艺的优化上。
Dong Xianbing等[13]采用热压提取鸡骨中的胶原蛋白后,再用风味蛋白酶水解提取物,酶解8 h后小分子肽(400~1 000 D)含量比酶解1 h时增加了74倍。韦汉昌等[14]以新鲜牛骨为原料,采用高压脉冲电场协同风味酶提取牛骨蛋白,不仅能够提高骨蛋白溶出率,而且能缩短酶解时间。Kangsanant等[15]用70 W超声波预处理以及超声波辅助风味蛋白酶酶解,发现水解度相对于常规酶解降低了23%~35%,但是水解产物的DDPH自由基清除能力和还原能力分别增加了33%和45%,说明超声波辅助酶解可以作为获取功能活性肽的全新手段。刘小红[16]采用碱性蛋白酶、木瓜蛋白酶、风味蛋白酶分步酶解猪股骨头,可以显著提高酶解液ACE抑制率和水解度。
以上研究的酶解方法大致可以归为两类,一是采用物理处理联合酶解处理的方法,如加热酶解、高压酶解以及超声波辅助酶解等,其中加热酶解和高压酶解都可以显著提高胶原蛋白的水解度;经高压脉冲电场处理再进行酶解,可以显著缩短酶解时间,提高酶解效率;而超声波辅助酶解虽然降低了水解度,但是水解产物的抗氧化性显著增强;二是采用多种蛋白酶协同酶解的研究,利用各种酶特异酶切位点充分水解胶原蛋白。
2.2.4 酶解产物的分离纯化
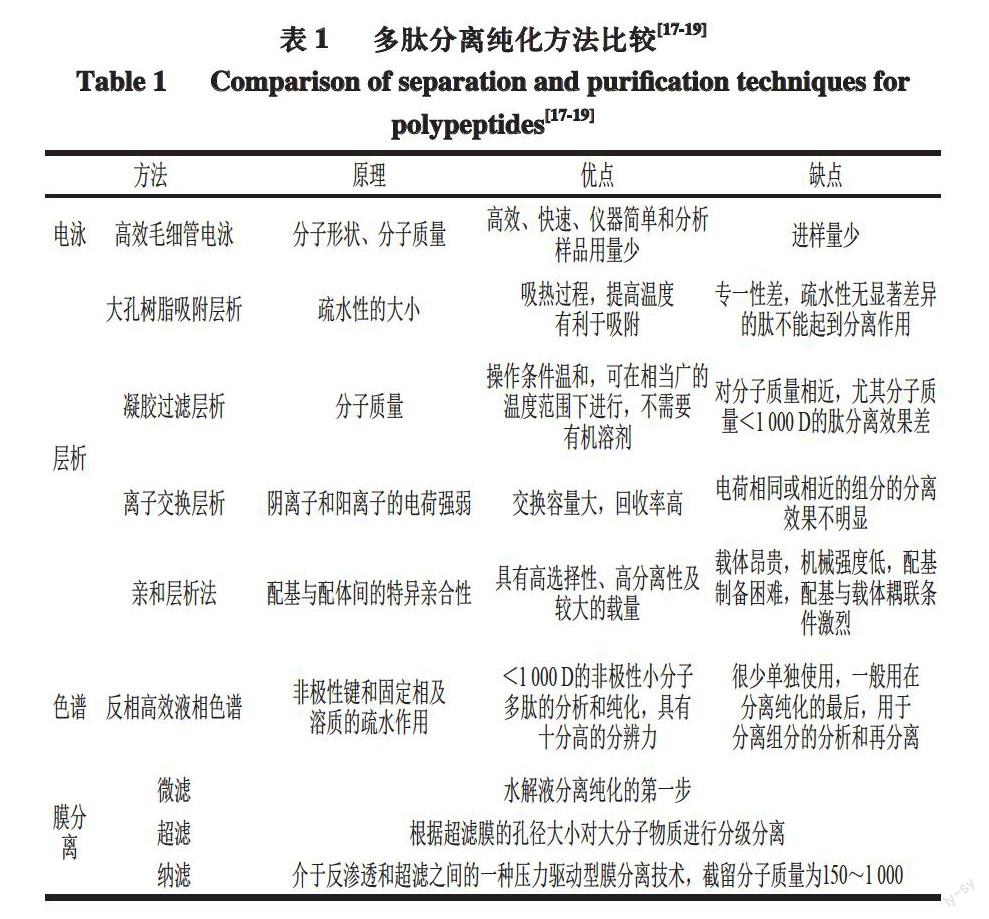
酶解产物中包含不同生物活性、理化特性及分子质量的多肽,出于不同的研究目的,所采用的分离纯化方法也不尽相同。用于多肽分离纯化的技术及特点,如表1所示。
实际应用中,单一的分离方法很难达到预期的分离效果,往往需要将多种方法联合使用,不仅能实现生物活性肽多级分离,还能达到提高产品质量的目的。例如现在多使用连续色谱法纯化金属螯合肽,主要包括固定化金属亲和层析(immobilized metal affinity chromatography,IMAC)、反向高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)、离子交换层析(ion-exchange column chromatography,IEC)、凝胶过滤层析(gel filtration chromatography,GFC),由于IMAC具有杰出的捕捉螯合肽的能力,因此,常常作为纯化的第一步,其次是GFC、IEC和RP-HPLC[20]。
3 骨降解功能性多肽螯合钙
在多肽促钙吸收理论成熟以后,为了充分利用畜禽骨中两大丰富资源—骨蛋白和骨钙,一些学者致力于胶原蛋白功能性多肽螯合钙产品的研发,一方面补充胶原多肽,另一方面在多肽促进下加强钙在体内的生物利用率。
3.1 具有金属螯合功能的多肽
多肽不仅在两端存在未缩合的—NH2和—COOH,在多肽侧链上也有,如Lys的—NH2和Asp和Glu的—COOH、—NH2与Ca2+配位结合,—COOH与Ca2+通过离子键结合。Jamalian等[21]在研究中发现谷氨酸和天冬氨酸残基负责一级结合中金属的配位,苏氨酸和丝氨酸-OH中的氧原子可以提供额外的配位点,同时—OH与邻位氨基之间的质子转移可以加强肽的配位能力,此外天冬氨酸和酪氨酸可以增加潜在的结合位点,这些结果对钙与多肽的结合以及钙载体物质的设计提供了丰富的理论支持。
Huang Guangrong等[22]分别用风味蛋白酶、复合蛋白酶、碱性蛋白酶、胃蛋白酶和胰蛋白酶酶解虾加工副产物时发现,所有酶解液中,胰蛋白酶酶解液与钙的结合能力最强。结合胰蛋白酶的作用位点在精氨酸和赖氨酸之间,可以推测钙结合能力可能与这两种氨基酸含量有关。Liu Fengru等[23]通过研究各种麦胚蛋白酶解物结合钙的能力,证实螯合物中钙的含量在很大程度上取决于水解物所用酶的种类、水解度、氨基酸组成以及分子质量分布,当用碱性蛋白酶水解时,水解度达21.5%,多肽分子质量低于2 000 D,并且螯合物中钙含量达到67.5 mg/g,钙结合肽主要由谷氨酸、精氨酸、天冬氨酸和甘氨酸组成。Charoenphun等[24]发现用碱性蛋白酶2.4 L水解罗非鱼蛋白,其水解度为27.7%时,水解产物螯合钙的能力最强,达65 mg/g,经分离鉴定,该结合态的分子质量为1.2 kD,氨基酸组成为Trp-Glu-Trp-Leu-His-Tyr-Trp,并认为Glu中的羧基和His中的咪唑基对钙结合活性是必不可少的。此外,Zhao Lina等[25]从乳清蛋白水解产物中分离出一种具有钙螯合能力的肽,经鉴定,该肽为甘氨酸-酪氨酸二肽,分子质量为237.99 D,钙螯合能力达75.38 μg/mg,比蛋白水解复合物提高了122%,通过对螯合模式的研究,發现主要的结合位点为羰基中的氧原子和氨基及亚氨基中的氮原子,热重量分析-差动扫描量热法显示甘氨酸-酪氨酸-钙在酸性和碱性条件下均具有很好的热稳定性及溶解性,有利于钙在人体胃肠道中的吸收。
通过以上研究结果,可以初步判断赖氨酸、精氨酸、谷氨酸、组氨酸、甘氨酸、天冬氨酸等可能是跟螯合活性有关的氨基酸,并且具有金属螯合功能的肽一般是寡肽,分子质量低于1 000 D。
3.2 多肽螯合钙的优势与特点
钙制剂的发展经过了无机钙盐到传统的有机钙盐再到新型可溶性有机钙的历程。无机型钙生物学效价低,有机钙盐溶解度大易溶失,为了克服这些缺点,便出现了钙的氨基酸螯合物。氨基酸螯合钙(如His和Met)具有易被吸收的特点,一度成为补钙的首选产品,不只是会产生不期望的颜色反应并可能引发脂肪氧化[26]。多肽螯合钙是通过多肽的N-端氨基、C-端羧基、氨基酸侧链以及肽链中的羰基和亚氨基与Ca2+配位形成,此外,多肽对钙还有吸附作用[27],比氨基酸螯合钙具有更高的配合率和稳定性。刘闪等[28]以白鲢鱼骨和氯化钙为原料制备胶原多肽螯合钙,通过红外光谱和电镜发现钙离子与胶原多肽确实发生了螯合反应,结合方式有离子结合、配位结合及吸附作用。有研究通过傅里叶变换红外光谱证明胶原多肽螯合钙是一种新的物质[29],也说明多肽与钙之间形成了新的化学键。多肽螯合钙具有生物效价高、吸收快、营养高等优点,具有抗氧化、抗菌、免疫调节、降血脂和降血糖等活性,有很高的开发价值和应用前景,日益成为国内外研究的热点[30-32]。
3.3 多肽螯合钙制备的螯合工艺研究
胶原多肽螯合钙目前存在的最大的问题是螯合率不高以及螯合物中钙的含量不高,而研究发现,影响螯合率的因素主要有螯合时间、螯合温度、螯合pH值以及多肽与钙的比例。
3.3.1 螯合时间对螯合率的影响
随着螯合时间的延长,螯合率是增加的,但是关于时间过长,螯合率降低的说法并没有统一的结论。如范鸿冰等[33]以风味蛋白酶酶解鲢鱼骨制备多肽,再经乳酸提取骨钙,多肽液与钙液体积比为1∶1,在pH 8,40 ℃反应条件下,螯合率随反应时间的延长不断增加,到20 min后基本趋于平稳,但是并没有出现下降的趋势。赵妍嫣等[34]采用碱性蛋白酶酶解猪骨粉后再以乳酸菌发酵酶解上清液,从而活化骨钙,最后与胶原多肽溶液进行螯合,在研究螯合时间对螯合率的影响时发现,随着螯合时间的延长,螯合率变化不大,但在50 min后螯合率显著下降。螯合率下降的原因可能是螯合物不稳定而分解。因此,一般可选择螯合时间为40 min左右为宜。
3.3.2 温度对螯合率的影响
随着温度的升高,螯合率一般先增加后下降。夏光华等[35]研究发现50 ℃时螯合率最大。螯合反应属于放热反应,温度过高不利于螯合物的生成。此外,也可能与温度变化影响胶原多肽的性质有关。再者,温度过高也可能使肽钙螯合物发生部分分解。因此,一般螯合反应的温度选用50 ℃左右。
3.3.3 pH值对螯合率的影响
随着pH值的增加,螯合率一般先增加后减少。丁利君等[36]用多肽和无水CaCl2进行螯合反应,比较不同pH值对螯合效果的影响,结果显示在pH 4.0~7.0的范围内,随着pH值的升高,螯合率逐渐增加;当pH值超过7.0时,螯合率急剧下降。因为在酸性条件下,H+与Ca2+争夺供电子基团,不利于螯合物等的生成;随着pH值的升高,胶原多肽的-NH2 和-COOH的配位能力逐渐增大,但pH值过高,溶液中OH-增多,争夺体系中Ca2+而优先生成氢氧化钙沉淀。说明过酸或过碱条件都不利于螯合物的生成,因此螯合反应的pH值是6.5~9.0为最佳。
3.3.4 多肽与钙的比例
多肽和Ca2+的比例是影响螯合反应的重要条件,隨着其比例的增加,螯合率一般先增加后下降。刘永等[37]优化罗非鱼鳞胶原蛋白肽钙螯合物的制备工艺时发现,螯合率随肽与氯化钙质量比的增加而迅速增加,在3∶1时达到最高,继续升高二者比例,螯合率降低。胶原多肽与Ca2+通常以2∶1的比例螯合,过高或过低会导致多肽或钙的利用率有所下降。多肽液与钙液体积比过小,反应体系中过多的游离钙导致螯合率的下降;体积比过大,螯合率基本保持稳定,但会导致多肽利用率的下降,并且螯合物中钙的含量较低。因此,一般螯合反应的质量比是1:1~4:1为最佳。
3.4 多肽螯合钙吸收机理研究
一般认为,通过饮食摄入的钙,被消化分解为游离的可溶解的Ca2+状态,才能被肠道吸收。1986年,Harvey等[38]发现肠道里的钙是与肠道分泌的短肽结合后,以分子状态被肠道整体吸收的,进入细胞后,螯合键自动断开,分解成肽和Ca2+分别被利用。当肠腔内的Ca2+浓度较低时,在VD作用下使细胞膜上Ca2+通道开放,进入细胞液并在钙结合蛋白参与下,可被线粒体摄取,也可由基底侧面膜泵入血浆;当肠腔内的Ca2+浓度较高时,Ca2+通过细胞旁路弥散进入血液循环[39],此外还可经由肠上皮细胞吞饮及钙泵主动转运到血液循环中。
螯合钙结构稳定,可避免Ca2+在肠道吸收时受到其他养分(如植酸)对矿物元素的沉淀或吸附,Hansen等[40]早在1996年已经通过研究摄入高植酸含量膳食的幼鼠模型证明了多肽可以提高钙的生物利用率;Ca2+在螯合状态下是通过肽的吸收通道被吸收而不是金属离子的吸收通道,从而避免与利用同一通道吸收的其他金属离子拮抗竞争,提高吸收效率;肽- Ca2+螯合物吸收速度快且可以减少很多生化过程,节约机体能量消耗[41]。总而言之,肽- Ca2+螯合物可以利用机体对肽的吸收而使Ca2+在消化道中更容易被吸收。
梁春辉等[42]在小鼠基础日粮中添加胶原多肽螯合钙、葡萄糖酸钙和CaCO3等补钙制剂,通过对比小鼠股骨骨质、血钙和血磷含量的变化发现,胶原多肽螯合钙在股骨长度、质量、骨钙、骨磷以及有机质含量方面均显著高于其他补钙制剂。成静等[43]分别用胶原多肽螯合钙、CaCO3饲喂缺钙模型小鼠,通过检测受试动物的血清钙、股骨钙含量及股骨指数,比较多肽螯合钙和CaCO3的补钙效果,结果显示,胶原多肽螯合钙组血清钙含量及股骨钙含量均著性高于模型组(P<0.01),胶原多肽螯合钙高剂量组股骨指数显著高于模型组及CaCO3组(P<0.01),说明胶原多肽螯合钙具有一定的补充钙质的功能,并优于无机型CaCO3。Lü等[44]则使用结肠腺癌细胞通过体外实验判断不同分子质量(1~3 kD、3~10 kD、10~30 kD)大豆水解蛋白-钙复合物在促进钙吸收上的作用,结果表明分子质量为3~10 kD复合物促进钙吸收效果最好。
4 结 语
骨食品营养价值很高,能防治各种营养缺乏症,被营养学家誉为“21世纪新型食品”、“21世纪功能性食品”。特别是在当今世界普遍缺钙的大前提下,迫切需要开发一种安全有效的补钙产品,而畜禽骨富含蛋白质和活性钙,因此无论从资源利用还是环境保护角度出发,畜禽骨产品的开发都具有巨大的经济效益和社会效益。我国对畜禽骨骼及其蛋白质资源的研究已进行了十多年,但是产品开发面临几大问题:胶原蛋白超螺旋结构,导致其水解度较低,但是可以通过物理处理联合酶解或多种酶共同酶解得以改善;螯合物的螯合率不高以及螯合物中钙含量不高,是否可以从骨胶原蛋白水解液中分离纯化得到一种特定氨基酸序列的钙螯合肽还有待进一步实验进行研究。
参考文献:
[1] DAENGPROK W, GARNJANAGOONCHORN W, NAIVKUL O, et al. Chicken eggshell matrix proteins enhance calcium transport in the human intestinal epithelial cells, caco-2[J]. Journal of Agricultural and Food Chemistry, 2003, 51(20): 6056-6061.
[2] BASS J K, CHAN G M. Calcium nutrition and metabolism during infancy[J]. Nutrition, 2006, 22: 1057-1066.
[3] LINDER M, ROZAN P, KOSSORI R L, et al. Nutritional value of veal bone hydrolysate[J]. Journal of Food Science, 1997, 62(1): 183-189.
[4] MORIMURA S, NAGATA H, UEMURA Y, et al. Development of an effective process for utilization of collagen from livestock and fish waste[J]. Process Biochemistry, 2002, 37: 1403-1412.
[5] 蔡杰, 洪玮娣, 熊汉国. 我国畜禽骨骼及其蛋白质资源综合利用进展[J]. 肉类研究, 2011, 25(3): 38-42.
[6] 王杏珠. 日本水产品综合利用研究的概况[J]. 现代渔业信息, 1995, 10(10): 13-15.
[7] MARQUEZ M C, VAZQUEZ M A. Modeling of enzymatic protein hydrolysis[J]. Process Biochemistry, 1999, 35: 111-117.
[8] BENCIVENGO A M, CUDIC M, HOFFMANN R, et al. The efficacy of the antibacterial peptide, pyrrhocoricin, is finely regulated by its amino acid residues and active domains[J]. Letters in Peptide Science, 2002, 8: 201-209.
[9] NAJAFIAN L, BABJI A S. Production of bioactive peptides using enzymatic hydrolysis and identification antioxidative peptides from patin (Pangasiussutchi) sarcoplasmic protein hydolysate [J]. Journal of Functional Foods, 2014, 9: 280-289.
[10] ZHANG He, DONG Ying, QI Bin, et al. Preventive effects of collagen peptide from deer sinew on bone loss in ovariectomized rats[J]. Evidence-Based Complementary and Alternative Medicine, 2014,10: 1-9.
[11] 张顺亮, 成晓瑜, 潘晓倩, 等. 牛骨胶原蛋白抗菌肽的制备及其抑菌活性[J]. 肉类研究, 2012, 26(10): 5-8.
[12] 胡孝勇, 袁晓玲, 蒋寅, 等. 胶原蛋白酶解的研究进展[J]. 现代食品科技, 2008, 24(10): 1075-1078.
[13] DONG Xianbing, LI Xia, ZHANG Chunhui, et al. Development of a novel method for hot-pressure extraction of proteinfrom chicken bone and the effect of enzymatic hydrolysis on the extracts[J]. Food Chemistry, 2014, 157: 339-346.
[14] 韦汉昌, 韦善清, 何建华. 高压脉冲电场协同酶法提取牛骨蛋白的研究[J]. 食品工业科技, 2011, 32(11): 280-282.
[15] KANGSANANT S, MURKOVIC M, THONGRAUNG C. Antioxidant and nitric oxide inhibitory activities of tilapia(Oreochromis niloticus) protein hydrolysate: effect of ultrasonic pretreatment and ultrasonic-assisted enzymatic hydrolysis[J]. International Journal of Food Science and Technology, 2014, 49: 1932-1938.
[16] 刘小红. 猪股骨降血压肽酶解条件的优化及其分离纯化的研究[D]. 雅安: 四川农业大学, 2013.
[17] MITTERMAYR S, OLAJOS M, CHOVAN T, et al. Mobility modeling of peptides in capillary electrophoresis[J]. TrAC Trends in Analytical Chemistry, 2008, 5: 407-417.
[18] GOMEZ-RUIZ J ?, LOPEZ-EXPOSITO I, PIHLANTO A, et al. Antioxidant activity of ovine casein hydrolysates: identi?cation of active peptides by HPLC-MS/MS[J]. European Food Research and Technology, 2008, 227: 1061-1067.
[19] SEGRO S S, CABEZAS Y, MALIK A. Ultra-high-stability, pH-resistant sol-gel titania poly (tetrahydrofuran) coating for capillary microextraction on-line coupled to high-performance liquid chromatography[J]. Journal of Chromatography A, 2009, 1216: 4329-4338.
[20] GUO Lidong, HOU Hu, LI Bafang, et al. Preparation, isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J]. Process Biochemistry, 2013, 48: 988-993.
[21] JAMALIAN A, SNEEKES E J, DEKKER L J M, et al. Dimerization of peptides by calcium ions: investigation of a calcium-binding motif[J]. International Journal of Proteomics, 2014: 1-8.
[22] HUANG Guangrong, REN Lie and JIANG Jiaxin. Purification of a histidine-containing peptide with calcium bindingactivity from shrimp processing byproducts hydrolysate[J]. European Food Research and Technology, 2010, 232: 281-287.
[23] LIU Fengru, WANG Li, WANG Ren, et al. Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptide?calcium complex[J]. Journal of Agricultural and Food Chemistry, 2013, 61: 7537-7544.
[24] CHAROENPHUN N, CHEIRSILP B, SIRIHUPONG N, et al. Calcium-binding peptides derived from tilapia(Oreochromis niloticus) protein hydrolysate[J]. European Food Research and Technology, 2013, 236: 57-63.
[25] ZHAO Lina, HUANG Qimin, HUANG Shunli, et al. Novel peptide with a specific calcium-binding capacity from whey protein hydrolysate and the possible chelating mode[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 10274-10282.
[26] GUO Lidong, HAMEDY P A, LI Bafang, et al. Food protein derived chelating peptides: biofunctional ingredients for dietary mineral bioavailability enhancement[J]. Trends in Food Science and Technology, 2014, 37: 92-105.
[27] 卢玉坤. 鳕鱼皮胶原蛋白肽的促钙吸收作用研究[D]. 青岛: 中国海洋大学, 2013.
[28] 刘闪, 刘良忠, 李小娜, 等. 白鲢鱼骨胶原多肽螯合钙的工艺优化[J]. 食品科学, 2014, 35(10): 76-81.
[29] 彭巧云, 沈菊泉, 魏东芝, 等. 正交试验优化胶原多肽螯合钙的制备工艺[J]. 食品科学, 2013, 34(8): 94-99
[30] WANG Chan, LI Bo, AO Jing. Separation and identification of zinc-chelating peptides from sesame protein hydrolysate using IMAC-Zn2+and LC-MS/MS[J]. Food Chemistry, 2012, 134: 1231-1238.
[31] CHEN Da, LIU Zunying, HUANG Wenqian, et al. Purification and characterisation of a zinc-binding peptide from oyster protein hydrolysate[J]. Journal of Functional Foods, 2013, 5: 689-697.
[32] 付文雯. 牛骨胶原多肽螯合钙的制备及其结构表征[D]. 武汉: 华中农业大学, 2010.
[33] 范鸿冰, 汪之颖, 刘鹏, 等. 鲢鱼骨胶原多肽螯合钙的制备研究[J]. 南方水产科学, 2014, 10(2): 72-79.
[34] 赵妍嫣, 胡林林, 姜绍通. 猪骨粉制备胶原多肽螯合钙工艺优化[J]. 农业工程学报, 2011, 27(增刊2): 277-281.
[35] 夏光華, 申铉日, 酒志强. 罗非鱼皮胶原蛋白小肽螯合钙的制备、鉴定及抗氧化研究[J]. 食品科技, 2013, 8(6): 242-246.
[36] 丁利君, 危雪如. 罗非鱼蛋白酶解液的多肽与钙复合物的制备及其抑菌分析[J]. 食品科学, 2009, 30(20): 198-202.
[37] 刘永, 李夏欣, 刘玲, 等. 鱼鳞胶原蛋白肽钙螯合物制备工艺的优化[J]. 食品工业科技, 2013, 34(20): 235-239.
[38] HAVREY H. Pure amino acid chelates: US Pantent, 45999152[P].1985-05-24.
[39] 蒋金来, 王令充, 吴皓, 等. 钙制剂研究进展[J]. 食品工业科技, 2012, 33(11): 379-387.
[40] HANSEN M, SANDSTROM B, LONNERDAL B. The effect of casein phosphopetides on zinc and calcium absorption from high phytate infant diets assessed in rat pups and caco-2 Cells[J]. Pediatric Research, 1996, 40(4): 547-552.
[41] 王子怀, 胡晓, 李来好, 等. 肽-金属离子螯合物的研究进展[J]. 食品工业科技, 2014, 35(8): 359-362.
[42] 梁春辉, 菅景颖, 张志胜. 胶原多肽螯合钙壮骨作用研究[J]. 河北农业大学学报, 2010, 33(5): 94-97.
[43] 成静, 陈栋梁, 倪萌, 等. 胶原肽螯合钙的吸收试验研究[J]. 食品科技, 2012, 37(5): 64-67.
L? Y, Bao X L,Yang B C, et al. Effect of soluble soybean protein hydrolysate-calcium complexes on calcium uptake by caco-2 cells[J].

