急性脑梗死患者MMP-9、hsCRP、IL-6与颈动脉粥样硬化斑块关系的临床评价
王金树,王力军,陈步巍,裴 芳,尉杰忠,2,纪 宁,2
急性脑梗死(ACI)具有发病率高、致残率高、复发率高、死亡率高、治疗费比例高等特点,在我国疾病死亡原因中占第2位,给社会和家庭带来沉重负担。颈动脉粥样硬化(CAS)斑块脱落以及在斑块基础上形成的血管狭窄是引发ACI的主要原因之一。研究显示,CAS的炎症反应在粥样斑块不稳定和斑块纤维帽的破裂上起着关键性作用,对CAS斑块稳定性的评价和监测研究已经成为防治ACI的重要方法[1]。基质金属蛋白酶(matrix metalloproteinase,MMP)、血清高敏C 反 应 蛋 白(high sensitive C-reactive protein,hsCRP)、白细胞介素-6(interleukin-6,IL-6)均为重要的炎症因子,其对ACI的发生、发展以及动脉硬化斑块从稳定向不稳定进展过程中起到极为重要的作用[2]。本研究通过对ACI患者血清MMP-9、hsCRP、IL-6的测定,进一步了解血清标志物水平与CAS及斑块稳定性的关系,为快速诊断和评价该类疾病的严重程度提供临床试验依据。
1 资料与方法
1.1 研究对象 入住我院神经内科发病3d 内的ACI患者112例。入选条件:符合第四届全国脑血管病会议制定的脑梗死诊断标准[3];头颅核磁弥散成像检查确诊并临床资料完整者。颈内动脉供血区局灶性神经功能缺失。体征且持续24h以上。排除标准:心房纤颤及感染性心内膜炎等明确为心源性的脑栓塞病患;严重心、肝、肾疾病及恶性肿瘤等;有自身免疫性疾病或服用免疫抑制剂病患;近1年有脑卒中、心肌梗死或进行过大手术者;近2周内有感染史者及入院后有继发感染征象者。112例患者中,男65 例,女47 例,年龄71.2岁±12.4岁;高血压病81例,高脂血症62例,糖尿病31例。入院后行颈动脉彩超,依据多普勒超声结果将其分为软斑块组(31 例)、硬斑块组(53例)、无斑块组(28例)。选取30名同期于我院常规体检的未患缺血性脑卒、肿瘤、自身免疫性疾病、感染疾病的老年人为作为正常对照组。4 组在性别、年龄等方面比较具有可比性(P>0.05)。
1.2 仪器及方法
1.2.1 颈动脉超声检侧 采用日立阿尔卡多普勒超声系统。受检者取仰卧位,分别检测颈总、颈内及颈外动 脉 分 支 的 内-中 膜 厚 度(intimamediathickness,IMT)。CAS的斑块定义为颈动脉系统内任一血管节段存有突进管腔中的回声结构,其表面不光滑或IMT>0.13cm。斑块呈强回声,部分伴声影,高低不平者为硬斑,属于稳定性斑块;斑块回声强弱不等,突于管腔,连续者为软斑,属于易损性斑块[4]。结果以发现CAS斑块者为阳性,只计例数,不计斑块数。
1.2.2 MMP-9、hsCRP及IL-6检测 4组在入院后次日晨,空腹静脉采血5 mL,即3 000r/min离心10 min,取上清液装于EP管,置于-70℃冰箱冷冻,送山西大同大学脑科学研究所一批次处理。应用酶联免疫吸附法检测MMP-9、hsCRP、IL-6的水平,试剂盒购自深圳欣博盛生物科技有限公司,严格按说明书操作步骤操作。
1.3 统计学处理 应用SPSS12.0 统计软件分析。两组间率的比较采用χ2检验;计量资料以均数±标准差表示,两组比较采用t检验,多组比较应用方差分析。P<0.05为有统计学意义。
2 结 果
2.1 CAS斑块检出率、MMP-9、hsCRP、IL-6水平ACI组112例病检者出颈动脉粥样斑块共84例,其中软斑31例,硬斑53 例,28 例无斑块形成。对照组检出13例均为硬斑。颈动脉粥样斑块检出率ACI组明 显高于对照组(7 5.0%vs 4 3.3%,χ2=1 0.3 7,P<0.01)。与对照组相比,ACI组血清MMP-9的水平高(t=4.37,P<0.01);ACI组血清hsCRP 的水平高(t=2.1 4,P<0.0 1);ACI组IL-6的水平高(t=6.16,P<0.01)。详见表1。
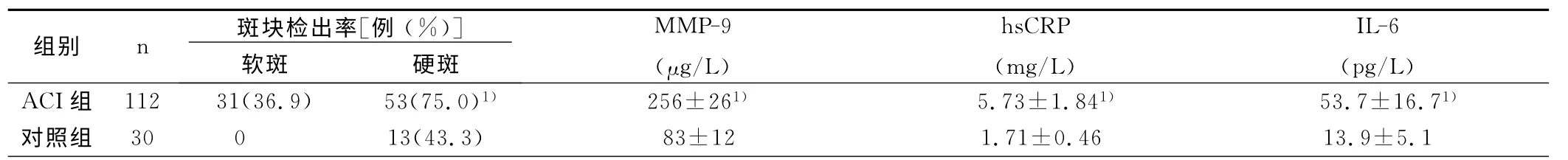
表1 ACI患者与健康对照组颈动脉斑块检出率、MMP-9、hsCRP、IL-6水平比较
2.2 ACI中软斑块组、硬斑块组、无斑块组MMP-9、hsCRP、IL-6 水 平 比 较 软 斑 块 组MMP-9 的 水 平明显高于硬斑块组及无斑块组(F=2 1.3 7,P<0.05);软斑块组hsCRP 的水平明显高于硬斑块组及无斑块组(F=16.26,P<0.05);软斑块组IL-6的水平明显高于硬斑块组及无斑块组(F=18.56,P<0.05)。详见表2。
表2 ACI中软斑块组、硬斑块组、无斑块组MMP-9、hsCRP、IL-6水平比较
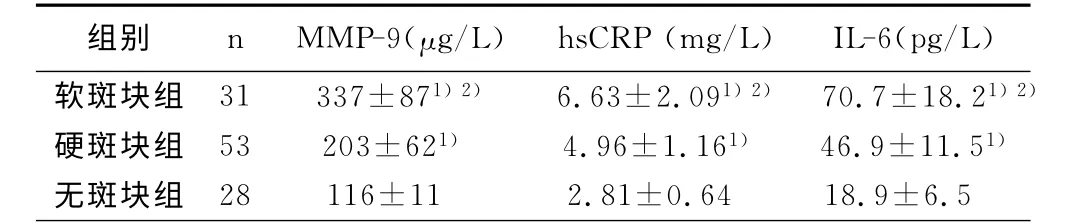
表2 ACI中软斑块组、硬斑块组、无斑块组MMP-9、hsCRP、IL-6水平比较
与无斑块组比较,1)P<0.05;与硬斑块组比较,2)P<0.05。
组别 n MMP-9(μg/L) hsCRP(mg/L) IL-6(pg/L)软斑块组 31 337±871)2) 6.63±2.091)2) 70.7±18.21)2)硬斑块组 53 203±621) 4.96±1.161) 46.9±11.51)无斑块组 28 116±11 2.81±0.64 18.9±6.5
3 讨 论
CAS是引发脑梗死的重要原因之一。国内外众多研究证实,在ACI患者中,有30%源自颈动脉病变,且与狭窄处不稳定型粥样硬化斑块密切相关[5]。CAS斑块的不稳定性乃至斑块纤维帽盖的溶解破裂成为ACI关键性的病理改变,而动脉粥样硬化的慢性炎症反应在其中又起到了极其重要的作用[1]。如何寻找和识别不稳定性CAS斑块目前已成为国内外一项新的研究热点。而颈动脉超声检测已被肯定为评价CAS硬化斑块性质、形态学改变和预测动脉硬化发生、发展及危险分层的常规方法和手段。但不同性质CAS斑块的不稳定性与血清标志物的变化有无相关性仍不甚明确。
MMP是分解细胞外基质的蛋白酶类,其中MMP-9可通过降解血管基膜的主要结构成分而与动脉粥样硬化缺血性脑损伤关系密切。有研究显示,在CAS斑块处可见MMP-9的表达及活性明显升高,MMP-9能通过分解血管壁的细胞外基质,促使管壁平滑肌细胞突破周围组织屏障以及由蛋白多糖和胶原形成的致密网孔,进而从中膜迁移至内膜,在此进行增殖并分泌大量的细胞外基质,最终形成CAS斑块。除此,MMP-9还可损坏覆盖在斑块表层的纤维帽,减少其抵抗应力的能力,容易使斑块发生破裂,进一步继发血栓形成和机化,从而导致CAS进展和不稳定性斑块形成[6]。炎症及其相关血清标志物在动脉硬化和动脉硬化斑块从稳定向不稳定发展变化中的作用尤为重要,它们与ACI的发生密切相关。hsCRP 是一种典型的急性时相反应蛋白,是反映机体各种急慢性炎症的蛋白指标,被认为是最敏感的炎症指标之一。临床研究已证明hsCRP的表达增多与炎症活动相关,能够间接反映动脉硬化斑块的不稳定性。hsCRP 增高也成为急性缺血性脑卒中一项独立的危险因子[7]。国内研究通过对68例ACI患者行hsCRP检测,结果发现ACI患者在发病后不同时间点血清hsCRP 水平均明显高于对照组,提示hsCRP不仅是急性缺血性卒中的致病因素之一,而且还是缺血性脑卒中预后的重要标志物[8]。IL-6主要由活化的单核细胞和巨噬细胞分泌产生,其表达多少与炎症反应轻重相一致[9]。另外,IL-6也可通过刺激巨噬细胞活化产生hsCRP 和MMP-9,增加血小板的聚集,促使血管平滑肌细胞增生,从而使动脉硬化进展及粥样斑块由稳定向不稳定发展[9]。
本研究通过对112例ACI患者CAS性质及血清MMP-9、hsCRP、IL-6的水平进行比较,结果发现ACI各组中MMP-9、hsCRP、IL-6水平均高于健康对照组(P<0.01),软斑块组水平又明显高于硬斑块及无斑块组(P<0.05)。ACI患者血清MMP-9、hsCRP、IL-6水平与CAS斑块稳定性密切相关,可能是不稳定性斑块的临床标志物。临床可对具有一项或数项CAS危险因素的人群进行颈动脉超声检侧,以判断CAS的严重程度,同时结合相关生化指标及炎性因子的水平,为斑块的稳定性评价及疗效监测干预提供试验依据。
[1] Martinet W,Verheye S,De Meyer GR,et al.Selective depletion of macrophage in atherosclerotic plaques via macrophage specific initiation of cell death[J].Trends Cardiovasc Med,2007,17(2):69-75.
[2] Zhang B,Ye S,Herrmann SM,et al.Functional polymorphism in the regulatory region of gelatinase B gene in relation to severity of coronary atherosclerosis[J].Circulation,1999,99(14):1788-1794.
[3] 全国第四届脑血管病学术会议.脑梗死诊断标准[J].中华神经科杂志,1996,29(6):381.
[4] 何文.颈动脉多普勒超声与临床[M].北京:科学文献出版社,2007:57-64.
[5] Jander S,Sitzer M,Wendt A,et al.Expression of tissuefactor in high grade carotid artery stenosis:Association with plaque destabilization[J].Stroke,2001,32(4):850-854.
[6] Formato M,Farina M,Spirito R,et al.Evidence for a proinflammatory and proteolytic environment in plaques from endarterectomy segments of human carotid arteries[J].Arteriowcler Thromb Vasc Biol,2004,24(1):129-135.
[7] 张慧萍,王云,孔玉,等.急性脑梗死患者颈动脉粥样硬化斑块性质与MMP-9、IL-6、hsCRP关系的临床研究[J].中国医疗前沿,2010,23(5):9-10.
[8] 孔祥锋,陈明,王萍,等.高敏C-反应蛋白及颈动脉粥样硬化与急性脑梗死的关系[J].中华老年医学杂志,2010,29(8):629-631.
[9] Futterman LG,Lemberg L.Novel markers in the acute coronary syndrome:BNP,IL-6,PAPP-A[J].Am J Crit Care,2002,11(2):168-172.

