结核分枝杆菌毒素-抗毒素系统mazEF6缺失突变株的构建及其表型的初步探讨
申爱平,曹帅丽,邢建新,袁俐
石河子大学医学院病原生物学与免疫学教研室,石河子 832002
结核分枝杆菌毒素-抗毒素系统mazEF6缺失突变株的构建及其表型的初步探讨
申爱平,曹帅丽,邢建新,袁俐
石河子大学医学院病原生物学与免疫学教研室,石河子 832002
为构建结核分枝杆菌毒素-抗毒素系统mazEF6缺失突变株,并对其表型进行初步探讨,首先用聚合酶链反应(PCR)分别从H37Rv标准株和PUC-19K质粒扩增出mazEF6基因的同源臂及卡那霉素抗性基因kan;然后应用融合PCR技术将mazEF6基因的同源臂与kan基因进行杂交拼接,获得目的融合片段,将该融合片段克隆于pMD-19T(simple)载体形成自杀质粒pMD-19T-ΔmazEF6-kan,并将自杀质粒转化至大肠埃希菌DH5α中;最后利用电穿孔技术将自杀质粒电转至H37Rv标准株中,在卡那霉素抗性改良罗氏培养基上筛选H37RvΔmazEF6缺失突变株单个菌落,提取阳性菌株全基因组DNA为模板,PCR扩增克隆片段并测序。将所获得的H37RvΔmazEF6缺失突变株进行遗传稳定性检测后,对其表型进行初步研究。结果显示,该缺失株在15代内未发生回复性突变;与野生株相比,缺失株生长速度缓慢且细菌形态短小。本研究证实,融合PCR技术便于快速获得结核分枝杆菌缺失突变株;结核分枝杆菌在缺失毒素-抗毒素系统mazEF6基因后生存能力下降,这为进一步研究毒素-抗毒素系统的作用奠定了基础。
结核分枝杆菌;毒素-抗毒素系统;缺失突变株
结核病(tuberculosis,TB)是一种由结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染引起的最常见的人兽共患慢性传染病。随着结核分枝杆菌耐药率升高、人类免疫缺陷病毒(human immunodeficiency virus,HIV)合并结核分枝杆菌感染增多,结核病在全球的流行日趋增强。
结核分枝杆菌的毒素-抗毒素系统(toxinantitoxin system,TAS)也被称为成瘾或自杀模块,由一个自动调节的操纵子组成,该操纵子编码稳定的毒素mazF和不稳定的抗毒素mazE[1]。在应激条件下,亲和性复合物中的抗毒素被降解,毒素释放后干扰或改变细菌的代谢及生物合成,介导细菌死亡、耐药或持留生存形成[2],也可减慢、抑制细胞生长,甚至杀死细胞[3]。结核分枝杆菌的TAS可能与促进细菌适应不断变化的生长速率、长期休眠和产生多重耐药有关[4],对其功能的研究有利于了解结核分枝杆菌致病机制,为开发新的抗结核药提供新靶点。

表1 PCR引物序列Tab.1 Sequences of PCR primers
本研究通过构建结核分枝杆菌TAS mazEF6缺失突变株,并对其表型进行初步研究,为进一步揭示TAS对细菌生存能力的影响提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株结核分枝杆菌H37Rv、PUC-19K质粒、大肠埃希菌(Escherichia coli,E.coli)DH5α由本实验室保存。
1.1.2 引物所用引物均由上海生工生物工程技术服务有限公司合成,序列见表1。
1.2 方法
1.2.1 mazEF6同源臂及卡那霉素抗性基因kan的扩增以结核分枝杆菌H37Rv基因组和PUC-19K质粒为模板,应用高保真DNA聚合酶,扩增出mazEF6的N、C端同源臂及卡那霉素抗性基因kan。反应条件见表2。所得产物经1.5%琼脂糖凝胶电泳检测后用DNA凝胶试剂盒回收,-20℃保存备用。
1.2.2 重叠延伸拼接-聚合酶链反应扩增构建体外mazEF6基因的同源重组片段将回收的mazEF6同源臂及kan基因的聚合酶链反应(polymerase chain reaction,PCR)产物按(N端同源臂的量)×(N端同源臂片段长度)-1∶(kan基因的量)×(kan基因片段长度)-1∶(C端同源臂的量)×(C端同源臂片段长度)-1=1∶1∶1的比例混合,不加引物,用2×Taq PCR MasterMix进行3个片段的互补延伸,以形成全长的融合PCR产物(中间产物)。反应条件为:95℃5 min;95℃30 s,45℃3 min,72℃3 min,1个循环;72℃10 min。再以中间产物为模板,加入引物MazEF6-N-F、MazEF6- C-R,进行融合片段的全长扩增。反应条件为:95℃5 min;95℃30 s,51℃30 s,72℃2 min,35个循环;72℃10 min(图1)。
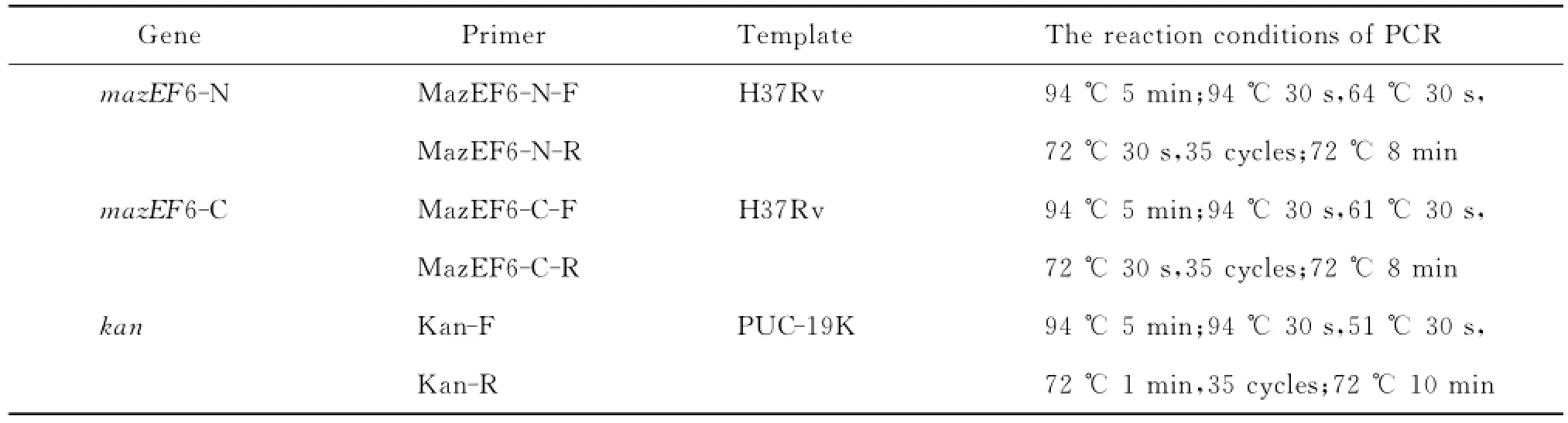
表2 PCR反应条件Tab.2 The reaction conditions of PCR
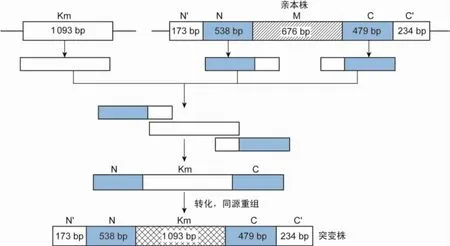
图1 T载体克隆构建结核分枝杆菌突变株的原理Fig.1 The principle of construction of M.tuberculosis mutant using T vector cloning
1.2.3 pMD-19T-ΔmazEF6-kan同源重组质粒的构建所得同源重组片段PCR产物用1.5%琼脂糖凝胶电泳检测后回收,用T4 DNA连接酶(Thermo公司)将所得克隆片段连接pMD19-T(simple)(TaKaRa公司)载体后,转化入大肠埃希菌DH5α克隆菌株,在氨苄西林和卡那霉素双抗培养基上筛选出阳性菌,进行菌液PCR,将能扩增出克隆片段的阳性菌株送上海生工生物工程技术服务有限公司测序。将测序正确的菌株扩大培养后,用质粒小提试剂盒提取质粒,-20℃保存备用。
1.2.4 结核分枝杆菌H37RvΔMazEF6缺失突变株的筛选和鉴定 取约2μl自杀质粒,加入200μl结核分枝杆菌H37Rv感受态细胞中,混匀,冰上静置20 min,移入1 mm电击杯中,E=2.5 kV/cm电击1次,立即加入37℃预热的2 ml 7H9培养基中(BD公司)。37℃摇床培养24 h,8 000 r/min离心3 min,吹打均匀,接种于卡那霉素抗性罗氏培养基(珠海贝索生物技术有限公司)。培养2~3周后,挑取单菌落分别接种至7H9液体培养基,2周后提取结核分枝杆菌全基因组DNA,分别以引物MazEF6-N-F、Kan-R,引物Kan-F、MazEF6-C-R,引物MazEF6-N-F、MazEF6-C-R,外延引物MazEF6-N′-F、MazEF6-C′-R扩增出片段N-K、KC、N-C及外延后片段N′-C′,并对PCR产物进行测序。将测序正确的菌株接种于改良罗氏培养基,传至15代,得到稳定的H37RvΔmazEF6缺失突变株,再次测序。以上实验在石河子大学医学院新疆地方与民族高发病教育部重点实验室内完成。
1.2.5 结核分枝杆菌H37RvΔMazEF6缺失突变株生存能力的初步检测选取在改良罗氏培养基上生长旺盛的结核分枝杆菌标准株H37Rv和H37Rv ΔmazEF6缺失突变菌株,接种至7H9液体培养基,置于37℃恒温摇床培养。当细菌生长达对数期时,将细菌密度调整至1个标准麦氏单位,各取100μl菌液分别接种于10 ml 7H9液体培养基中[5],置于37℃恒温摇床培养。在培养过程中的不同时间点(第3、6、9、12、15、18、21天)对菌液密度进行测定,同时取等量菌液进行一系列10倍稀释后接种至改良罗氏培养基,37℃培养3~4周,观察菌落生长状态,并对各时间点的菌株进行结核分枝杆菌抗酸染色,观察野生株与突变株在显微镜下的形态差异。
2 结果
2.1 mazEF6同源臂和卡那霉素抗性基因kan的扩增及鉴定
以结核分枝杆菌H37Rv标准株为模板扩增出mazEF6的N端同源臂条带大小为538 bp,扩增出mazEF6的C端同源臂条带大小为479 bp(图2),以PUC-19K质粒为模板扩增出kan基因条带大小为1 093 bp(图3),目的条带大小均与预期一致。
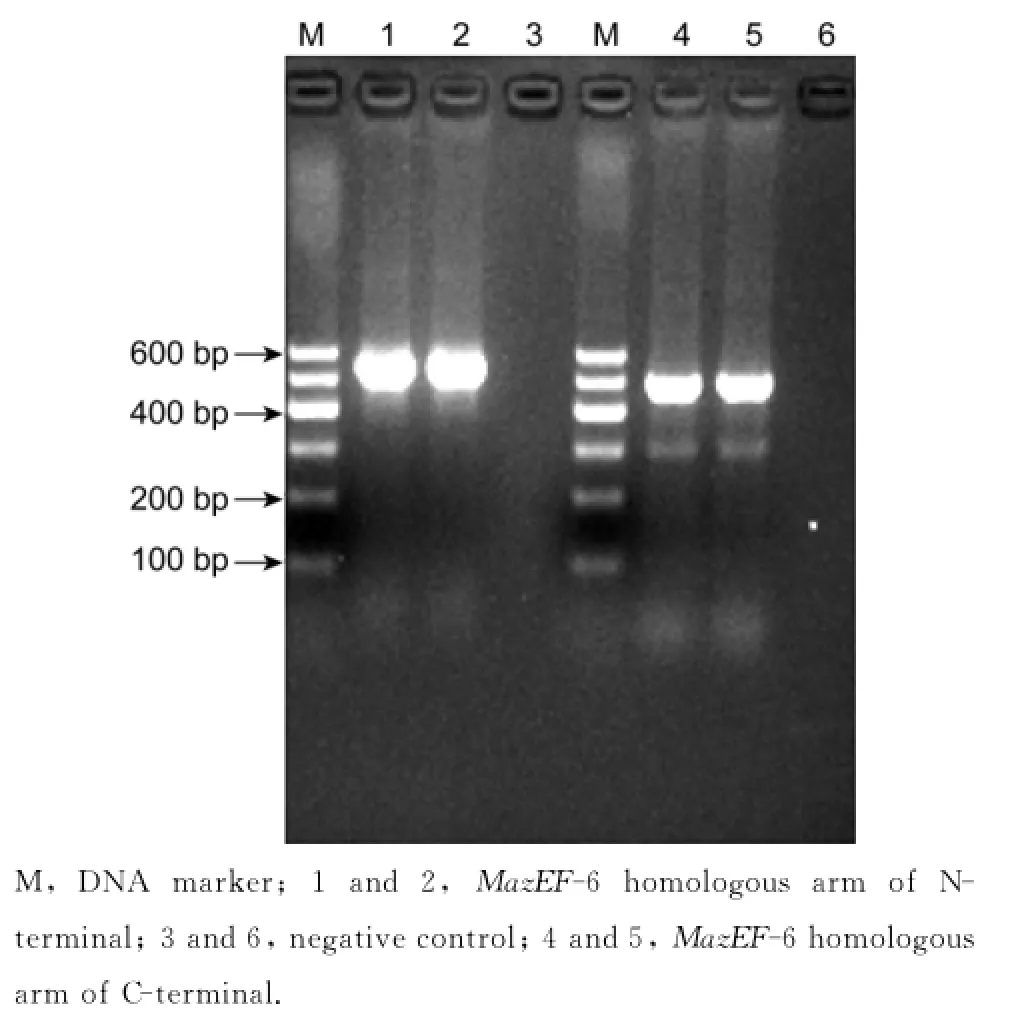
图2 MazEF-6同源臂PCR扩增Fig.2 PCR amplification of MazEF6 homologous arm
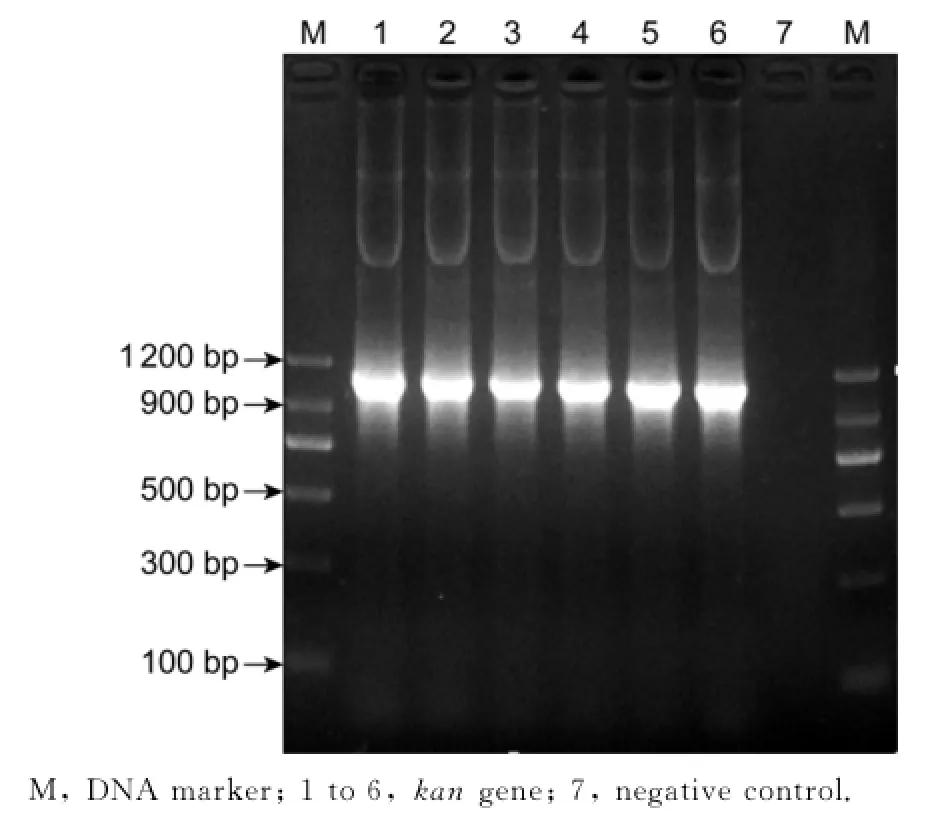
图3 kan基因的扩增片段Fig.3 PCR amplification of kangene
2.2 pMD-19T-ΔmazEF6-kan同源重组质粒的鉴定
由于pMD19-T(simple)载体本身含氨苄西林抗性,克隆片段具有卡那霉素抗性,故构建成功的自杀质粒可在含有氨苄西林和卡那霉素的LB固体培养基上生长。以阳性菌的质粒为模板,用引物MazEF6-N-F和MazEF6-C-R扩增出的同源重组片段大小为2 110 bp,结果与预期一致(图4、5)。
图4 构建成功的同源重组质粒Fig.4 Construction of homologous recombination plasmid
2.3 结核分枝杆菌H37RvΔMazEF6缺失突变株的筛选
挑取电转后在卡那霉素抗性培养基中生长的结核分枝杆菌单个菌落,提取全基因组DNA为模板,分别以引物MazEF6-N-F、Kan-R,引物Kan-F、MazEF6-C-R,引物MazEF6-N-F、MazEF6-C-R,外延引物MazEF6-N′-F、MazEF6-C′-R扩增出的N-K条带大小为1 631 bp,K-C条带大小为1 572 bp,NC条带大小为2 110 bp,外延后N′-C′条带大小为2 517 bp(图6)。目的条带大小均与预期一致,证明成功获得结核分枝杆菌H37RvΔmazEF6缺失突变株。

图5 同源重组质粒的PCR鉴定Fig.5 Identification of homologous recombination plasmid
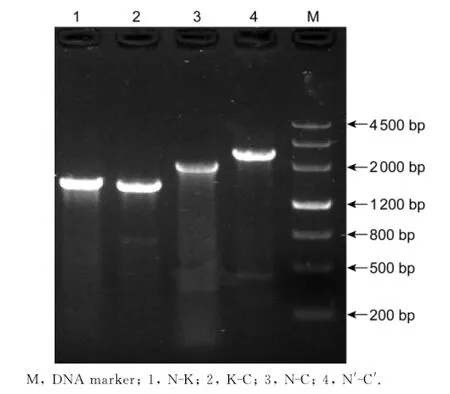
图6 以缺失株为模板扩增出的N-K、K-C、N-C、N′-C′片段Fig.6 Amplification of N-K,K-C,N-C and N′-C′fragments with deletion mutant as a template
2.4 结核分枝杆菌H37RvΔMazEF6缺失突变株的遗传稳定性检测
将所获得的基因缺失株送上海生工生物工程技术服务有限公司测序,所得结果与克隆片段基因比对同源度为100%,传至第15代,再次测序,未发生回复性突变,成功获得具有遗传稳定性的H37Rv ΔmazEF6缺失株。
2.5 结核分枝杆菌H37RvΔMazEF6缺失突变株的生长情况
在改良罗氏培养基上,H37Rv和H37Rv ΔmazEF6缺失突变菌株均为淡黄色菌落,呈菜花样生长。H37Rv和H37RvΔmazEF6缺失突变菌株在各时间点的抗酸染色显示,与野生株相比,突变株形态较短小(图7)。观察比较不同时间点H37Rv与H37RvΔmazEF6缺失突变菌株的活菌数,结果显示,在培养第3、6、9和12天,H37Rv与H37Rv ΔmazEF6缺失突变菌株的活菌数不同,但差异没有统计学意义(P>0.05)。在培养的第15、18和21天,H37Rv菌株的活菌数显著高于H37Rv ΔmazEF6缺失突变菌株,差异有统计学意义(P<0.05)(图8)。
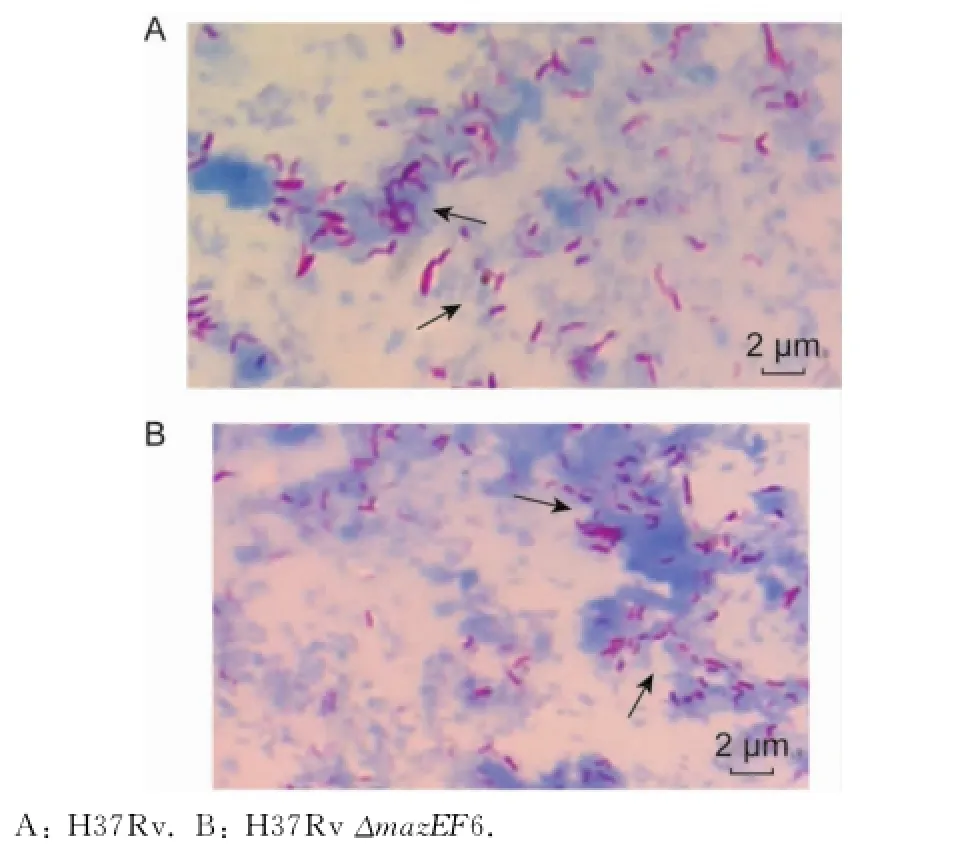
图7 H37Rv和H37RvΔmazEF6对数期染色图片Fig.7 H37Rv and H37RvΔmazEF6in the logarithmic phase
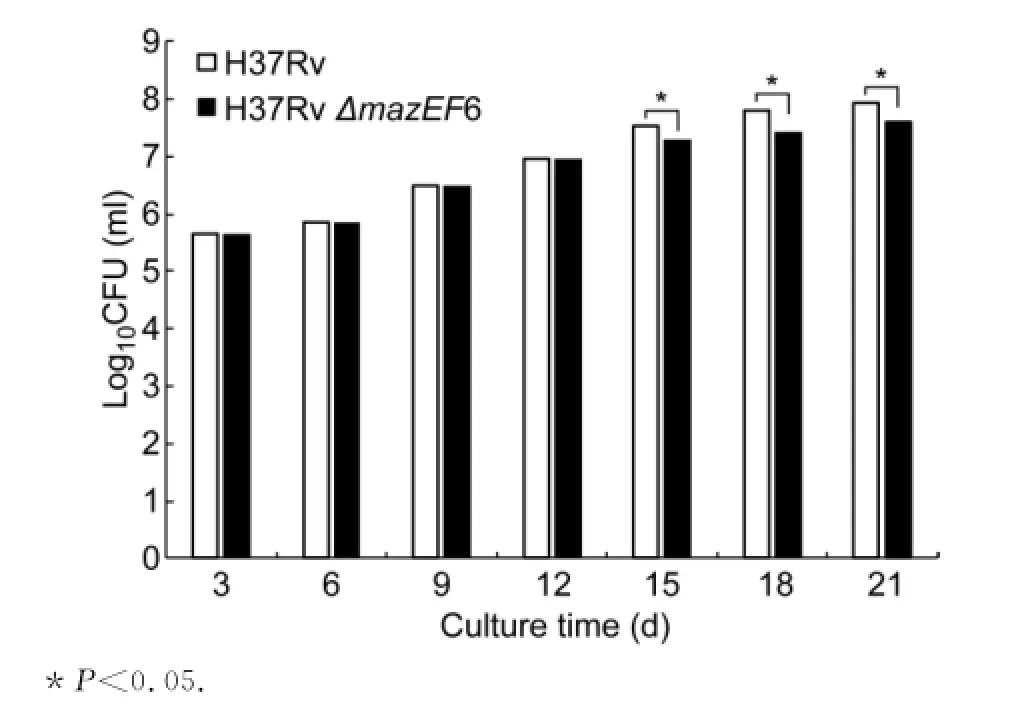
图8 不同培养时间点结核分枝杆菌的活菌数(Log10/ml)Fig.8 The counts of live bacteria at different culture time points
3 讨论
结核病是一种由结核分枝杆菌引起的慢性感染性疾病,严重威胁人类健康,其致死率在感染性疾病中位于第2,仅次于HIV感染。结核分枝杆菌可引起潜伏感染,发病前细菌可持留生存多年。结核分枝杆菌的持留性[6],即于逆境下能保持稳定和对环境适应的特性,对结核分枝杆菌潜伏感染及结核病病程的迁延和复发起着重要作用。分枝杆菌中存在大量TAS模块。在结核分枝杆菌基因组中发现88个假定的TAS,其中30个已被确认具有TAS的功能[7]。在结核分枝杆菌已确定的9个mazF同系物中,有7个在大肠埃希菌中表达时会造成生长停滞[8]。
未知基因功能的研究得力于突变株的构建,因此快速、高效地构建基因突变株可大大提高基因功能研究的效率。基因重叠延伸拼接-PCR(splicing by overlap extension PCR,SOE-PCR)法构建自杀质粒是利用基因搭桥法快速获得目的融合片段(即基因克隆片段),在一定程度上避免了双酶切法的繁琐性。同时,应用抗性基因替换构建基因缺失菌株,不仅减少了质粒整合带来的问题,还提供了一个筛选标记,能通过一次筛选即可得到突变株[9]。基于以上方法,本课题组成功构建了自杀质粒pMD-19T-ΔmazEF6-kan,并利用电穿孔技术成功构建了结核分枝杆菌mazEF6缺失突变株,为结核分枝杆菌突变株的构建提供了快速、有效的方法,也为进一步揭示mazEF6的生物学作用奠定了基础。
TAS在细菌内的相互作用可介导应激诱发的非复制状态[10]。张俊杰等研究表明,毒素蛋白Rv1991c(MazF6)、Rv2801c(MazF9)和Rv1102c(MazF3)通过切割RNA发挥抑菌或杀菌活性;且Rv1991a-1991c(MazEF6)和Rv2801a-2801c(MazEF9)系统可能参与结核分枝杆菌在营养匮乏条件下的生长调控[11]。结核分枝杆菌对Rv1991c(MazF6)的表达非常敏感,即使在非常低的水平也能显著降低细菌存活率[12]。本研究通过在不同培养时间点分别对H37Rv和H37RvΔmazEF6缺失突变菌株进行计数和结核分枝杆菌抗酸染色,比较缺失株与野生株在表型上的差异。结果发现,H37RvΔmazEF6缺失突变菌株不但生长速度较慢,而且在显微镜下的形态也较野生株短小,推测结核分枝杆菌较强的生存能力可能与TAS相关。
关于TAS的功能,Zorzini等提出了不同的观点:①自私的基因;②可保护特定染色体片段的稳定性;③在细菌应激反应和持留形成过程中发挥作用[13]。结核分枝杆菌较强的生存能力可能与TAS相关,但该系统在结核分枝杆菌中的作用机制尚不清楚,有待进一步研究。
[1] Gerdes K,Christensen SK,Løbner-Olesen A.Prokaryotic toxin-antitoxin stress response loci[J].Nat Rev Microbiol,2005,3(5):371-82.
[2] Schuster CF,Bertram R.Toxin-antitoxin systems are ubiquitous and versatile modulators of prokaryotic cell fate[J].FEMS Microbiol Lett,2013,340(2):73-85.
[3] Yamaguchi Y,Inouye M.Regulation of growth and death in Escherichia coli by toxin-antitoxin systems[J].Nat Rev Microbiol,2011,9(11):779-90.
[4] Han JS,Lee JJ,Anandan T,Zeng M,Sripathi S,Jahng WJ,Lee SH,Suh JW,Kang CM.Characterization of a chromosomal toxin-antitoxin,Rv1102c-Rv1103c system in Mycobacterium tuberculosis[J].Biochem Biophys Res Commun,2010,400(3):293-298.
[5] Peñuelas-Urquides K,Villarreal-Treviño L,Silva-Ramírez B,Rivadeneyra-Espinoza L,Said-Fernández S,de León MB.Measuring of Mycobacterium tuberculosis growth.A correlation of the optical measurements with colony forming units[J].Braz J Microbiol,2013,44(1):287-289.
[6] Gomez JE,McKinney JD.M.tuberculosis persistence,latency,and drug tolerance[J].Tuberculosis(Edinb),2004,84(1-2):29-44.
[7] Hansen S,Vulic' M,Min J,Yen TJ,Schumacher MA,Brennan RG,Lewis K.Regulation of the Escherichia coli HipBA toxin-antitoxin system by proteolysis[J].PLoS One,2012,7(6):e39185.
[8] Zhu L,Zhang Y,Teh JS,Zhang J,Connell N,Rubin H,Inouye M.Characterization of mRNA interferases from Mycobacterium tuberculosis[J].J Biol Chem,2006,281(27):18638-18643.
[9] 乔凤,陈泽良,王玉飞,赵瑾,杜昕颖,于雅琴,黄留玉.pUC19K质粒的构建及其在布鲁氏菌突变株构建中的应用[J].中国生物工程杂志,2007,27(12):1-5.
[10] Carroll P,Brown AC,Hartridge AR,Parish T.Expression of Mycobacterium tuberculosis Rv1991c using an arabinoseinducible promoter demonstrates its role as a toxin[J].FEMS Microbiol Lett,2007,274(1):73-82.
[11] 贤一博,崔丽丹,张俊杰.结核分枝杆菌中毒素-抗毒素系统的鉴定[J].微生物学报,2011,51(2):214-223.
[12] Schifano JM,Edifor R,Sharp JD,Ouyang M,Konkimalla A,Husson RN,Woychik NA.Mycobacterial toxin MazF-mt6inhibits translation through cleavage of 23S rRNA at the ribosomal A site[J].Proc Natl Acad Sci USA,2013,110(21):8501-8506.
[13] Zorzini V,Haesaerts S,Donegan NP,Fu Z,Cheung AL,van Nuland NA,Loris R.Crystallization of the Staphylococcus aureus MazF mRNA interferase[J].Acta Crystallogr Sect F Struct Biol Cryst Commun,2011,67(Pt 3):386-389.
Construction and characterization of toxin-antitoxin system mazEF6 deletion in Mycobacterium tuberculosis
SHEN Ai-Ping,CAO Shuai-Li,XING Jian-Xin,YUAN Li
Department of Pathogenic Biology and Immunology,School of Medicine,Shihezi University,Shihezi 832002,China
To study the toxin-antitoxin system mazEF6 of Mycobacterium tuberculosis(M.tuberculosis),deletion mutants were constructed and subjected to phenotype analysis.First,the flanking(homology arms)of mazEF6 gene from H37Rv and kanamycin resistance gene(kan gene)from plasmid PUC-19K were amplified by polymerase chain reaction(PCR)respectively.Second,fusion PCR was used for the hybrid splicing of mazEF6 homology arms and kan gene,and the desired fusion fragment was obtained.Then the fragment was cloned into pMD-19T(simple)vector to form a suicide plasmid(pMD-19T-ΔmazEF6-kan),and the suicide plasmid was transformed into Escherichia coli(E.coli)DH5α.At last,the constructed plasmid was transformed into H37Rv by electroporation.Single colonies of M.tuberculosis were screened on L-J medium with kanamycin,the genomic DNA of positive strains were extracted,and the targeted fragments were amplified by PCR and sequenced.The genetic stability and other phenotypes of the H37Rv ΔmazEF6 deletion mutant were studied.The results showed that the deletion mutant strains did not presentreverse mutant within 15 generations.Compared with the wild-type strains,H37RvΔmazEF6 deletion mutant strains grew more slowly and the bacterial cell was relatively shorter.This study demonstrated that it is practical to obtain M.tuberculosis deletion mutant by fusion PCR technology,and the survival ability ofM.tuberculosiswithout toxin-antitoxin mazEF6 gene is decreased.
Mycobacterium tuberculosis;Toxin-antitoxin system;Deletion mutant strain
.YUAN Li,E-mail:yuanli832000@sina.com
2014-04-08)
国家自然科学基金(81160368、81341079)
袁俐

