表皮葡萄球菌YycG单克隆抗体抗生物膜活性的研究
龚婷,韩海燕,吕智慧,王小飞,曹鋆,程训佳,吴旸,瞿涤
复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032
表皮葡萄球菌YycG单克隆抗体抗生物膜活性的研究
龚婷,韩海燕,吕智慧,王小飞,曹鋆,程训佳,吴旸,瞿涤
复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032
YycFG双组分信号转导系统调控葡萄球菌细胞壁合成、代谢及生物膜形成,PAS是组氨酸激酶YycG的胞外信号感应区域。本研究针对胞外PAS区域制备抗YycG-PAS单克隆抗体(YycG-PAS MAb)。免疫鉴定结果表明,YycG-PAS MAb可与重组YycG-PAS蛋白和表皮葡萄球菌菌体YycG蛋白结合,属于IgG2a亚型,效价为log 215。YycG-PAS MAb(80μg/ml)与表皮葡萄球菌RP62A菌株共培养24 h,对细菌生物膜形成的抑制率达46.5%,与mIgG(80μg/mL)组相比有显著差异(P<0.05)。YycG-PAS MAb(80 μg/ml)与低浓度万古霉素(1μg/ml)联用可增强对24 h细菌生物膜的抑制作用,抑制率由57.6%提高至93.0%(P<0.01)。YycG-PAS MAb对浮游状态表皮葡萄球菌的生长及存活无显著影响。本研究为YycGPAS MAb在抗生物膜感染中的潜在应用价值奠定了一定基础。
表皮葡萄球菌;生物膜;YycG组氨酸激酶;PAS区域;单克隆抗体
表皮葡萄球菌是寄居于人体皮肤及呼吸道入口黏膜表面的正常菌群,通常不致病[1]。但随着植入性医疗器械的广泛应用,表皮葡萄球菌成为医院内感染的主要条件致病菌之一[2,3]。细菌在生物膜形成后,对抗生素的敏感性降低,并能逃避人体免疫系统的清除[4-6],可导致持续性感染,目前尚无有效药物和疫苗治疗以预防生物膜疾病[7]。
YycFG双组分信号转导系统可调控葡萄球菌的生长和生物膜形成[8],存在于GC含量较低的革兰阳性菌中。哺乳类动物中无相应的同源蛋白。YycG为组氨酸激酶,其胞外的PAS功能域可感受外界环境信号[9],传递至胞内组氨酸激酶,使其磷酸化,从而磷酸化反应调节蛋白,调控下游基因表达[10]。本实验室前期研究发现,针对YycG胞内激酶活性区的小分子具有抑制生物膜的活性[11]。阻断YycG胞外信号感受区是否影响细菌生物膜的形成?本课题组通过生物信息学分析发现YycG的胞外PAS区域在葡萄球菌中保守,具有高度同源性;且PAS区域为亲水蛋白,有利于抗体结合。为此,本研究制备了针对表皮葡萄球菌YycG胞外PAS区域的单克隆抗体(简称单抗),研究其对表皮葡萄球菌RP62A菌株生物膜形成的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒表皮葡萄球菌标准菌株ATCC35984(SERP62A,生物膜阳性)购自美国国家标准菌种保藏中心(American Type Culture Collection,ATCC),大肠埃希菌(Escherichia coli,E.coli)DH5α购自天根生化科技有限公司,大肠埃希菌BL21(DE3)为本实验室保存,原核表达载体pET28a由本实验室保存。
1.1.2 主要试剂小鼠IgG购自Abmart公司,羊抗鼠IgG-辣根过氧化物酶(horseradish peroxidase,HRP)购自Santa Cruz公司,羊抗鼠IgG1-HRP及 IgG2a-HRP购自Abcam公司,限制性内切酶(FD series,1 u/μl)、T4 DNA连接酶、Taq DNA聚合酶购自Fermentas公司,RNA抽提试剂盒及Ni-NTA蛋白质纯化填料购自Qiagen公司,反转录试剂盒购自TaKaRa公司,增强化学发光(enhanced chemiluminescence,ECL)底物购自Thermo公司,基因组和质粒抽提试剂盒、聚合酶链反应(polymerase chain reaction,PCR)产物回收试剂盒、DNA Marker等购自天根生物科技有限公司,异丙基-β-D-硫代半乳糖苷(isopropylβ-D-thiogalactoside,IPTG)购自美国Merk公司。引物合成及DNA测序均由生工生物工程(上海)股份有限公司完成。
1.1.3 引物设计与合成根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库公布的表皮葡萄球菌标准菌株RP62A基因组序列(GenBank accession number:NC_009276),利用Beacon designer 8及Oligo 7进行PCR引物设计,以扩增YycG胞外PAS信号感应域。上游引物为:5′-CATGCCATGGGCACGAATAGTTTAGAAAAGGAA-3′,酶切位点为NcoⅠ;下游引物为:5′-CCGCTCGAGCTGATTAATGTTGTTCAGCTG-3′,酶切位点为XhoⅠ。引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 抗YycG-PAS单抗的制备Amart公司根据本研究提供的PAS氨基酸序列,制备了抗YycGPAS单抗,生产并纯化,抗体浓度为5 mg/ml。
1.2.2 重组YycG-PAS蛋白的表达及纯化以RP62A基因组为模板,PCR扩增yycG胞外信号感应区域pas片段,与pET28a质粒连接,命名为pET28a-pas。将含有pET28a-pas质粒的BL21菌液接种于卡那霉素(50μg/ml)抗性的LB培养基中,37℃培养至菌液600 nm处光密度(optical density,OD)值为0.6,用0.5 mmol/L IPTG25℃诱导12~16 h。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析表达的蛋白。取超声裂解菌体的上清液,经Ni-NTA柱亲和层析纯化,通过SDS-PAGE及考马斯亮蓝染色分析重组YycG-PAS蛋白的纯度。
1.2.3 抗YycG-PAS单抗效价和IgG亚型的鉴定
将纯化的重组YycG-PAS蛋白用包被缓冲液稀释至1μg/ml,100μl/孔,4℃包被96孔板过夜。将抗YycG-PAS单抗1∶100稀释后,进行2倍系列稀释,37℃孵育1 h;以羊抗鼠IgG-HRP(1∶2 000)为二抗,37℃孵育1 h。酶标仪检测OD450。以牛血清白蛋白为阴性对照,单抗OD450≥2倍阴性对照OD450的最高稀释倍数为抗体效价。以羊抗鼠IgG1-HRP或IgG2a-HRP(1∶2 000)为二抗,检测抗YycG-PAS单抗的IgG亚型。
1.2.4 抗YycG-PAS单抗的特异性检测利用蛋白免疫印迹法检测单抗与重组YycG-PAS蛋白及RP62A菌株YycG蛋白的特异性结合。超声裂解,离心收集10 h和12 h的细菌,离心收集上清液,经12%SDS-PAGE,转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。以抗YycG-PAS单抗(10 μg/ml)为一抗、羊抗鼠IgG-HRP(1∶2 000)为二抗,作用后ECL显色并观察。
1.2.5 不同生长阶段表皮葡萄球菌中YycG表达的检测将37℃过夜培养的RP62A菌液按1∶200接种于TSB培养基,37℃振荡培养,分别于4、6、8、10和12 h取菌液,提取蛋白,方法同上。将提取的菌体蛋白加样于点杂交仪中(100μl/孔)的硝酸纤维素膜,室温干燥。5%脱脂奶粉室温封闭后,以抗YycG-PAS单抗(10μg/ml)、羊抗鼠IgG-HRP(1∶2 000)作用,加入四甲基联苯胺(tetramethyl benzidine,TMB)显色液显色。以小鼠IgG(mouse IgG,mIgG;10μg/ml)为阴性对照。
1.2.6 抗YycG-PAS单抗对浮游状态表皮葡萄球菌生长和存活的影响将37℃过夜培养的RP62A菌液按1∶200接种于含160μg/ml抗YycG-PAS单抗的TSB培养基中,4℃孵育2 h,37℃振荡培养,每小时测定一次菌液OD600值,连续检测11 h。以160μg/ml mIgG处理的菌液及未经处理的菌液为对照。取6 h及24 h培养物进行菌落形成单位(colony-forming unit,CFU)计数。实验重复3次,取均值。
1.2.7 抗YycG-PAS单抗对表皮葡萄球菌生物膜形成的影响将过夜培养的RP62A菌液(3μl)分别接种于含有单抗或单抗加万古霉素的TSB培养基中,转种至96孔板(200μl/孔),4℃共孵育2 h,37℃静置培养24 h。结晶紫染色,干燥后测定紫外吸光度A570[12]。实验分组包括抗YycG-PAS单抗(80μg/ml)、抗YycG-PAS单抗(80μg/ml)+万古霉素(1μg/ml)、万古霉素(1μg/ml)、mIgG(80μg/ml)及未经处理组。实验重复3次,取均值。
1.3 统计学方法
用SPSS 20.0对数据进行分析处理。两组间比较采用独立样本t检验,P<0.05为有统计学差异。
2 结果
2.1 重组YycG-PAS蛋白的原核表达与纯化
为鉴定抗YycG-PAS单抗,本研究构建了重组YycG-PAS蛋白的原核表达质粒。以RP62A的DNA为模板,PCR扩增yycG胞外感应区pas的基因片段(100~552 bp),PCR产物为453 bp。扩增片段经限制性内切酶XholⅠ及NcoⅠ酶切后与pET28a质粒连接,经酶切鉴定及测序确认,命名为pET28a-pas(图1)。在IPTG诱导下,重组YycGPAS蛋白存在于上清液中,相对分子质量约为18 000(图2)。蛋白免疫印迹结果显示,抗YycGPAS单抗可与重组YycG-PAS蛋白结合(图3B)。

图1 pas的PCR扩增及pET28a-pas重组质粒的酶切鉴定Fig.1 PCR amplification of pas and identification of pET28a-pas plasmid
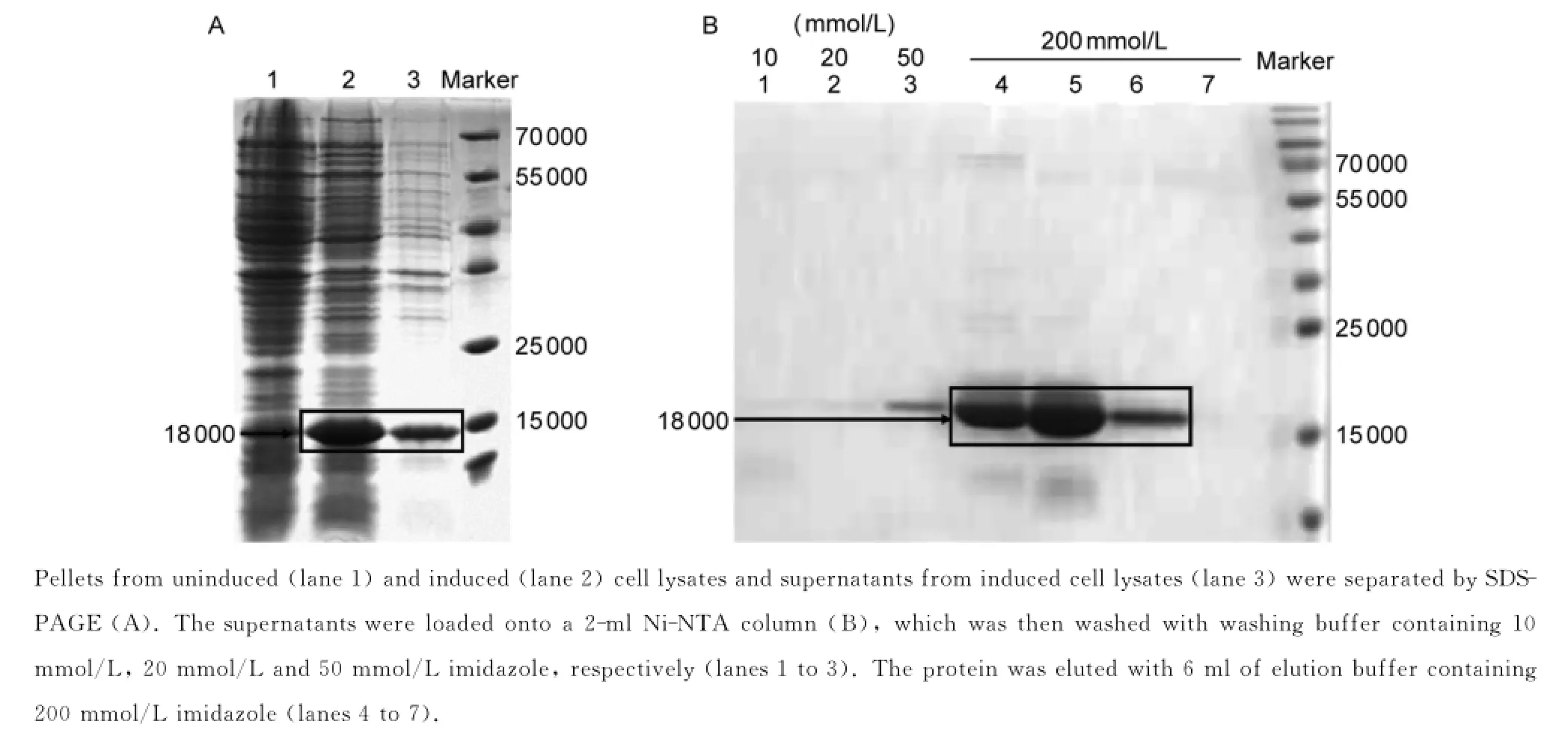
图2 重组YycG-PAS蛋白的表达及纯化Fig.2 Expression and purification of recombinant YycG-PAS protein
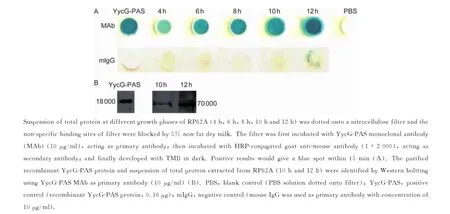
图3 不同生长阶段表皮葡萄球菌中YycG蛋白的表达量Fig.3 Detection of YycG expression in RP62A strain using YycG-PAS monoclonal antibody
2.2 抗YycG-PAS单抗的效价检测及亚型鉴定
以重组YycG-PAS蛋白包板,用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测抗YycG-PAS单抗(5 mg/ml)的效价为log 215,OD450值为0.229。以牛血清白蛋白为阴性对照,OD450值为0.109,阈值为0.218。用羊抗鼠IgG1及IgG2a抗体为二抗检测,显示单抗的IgG亚类为IgG2a。
2.3 不同生长阶段表皮葡萄球菌中YycG表达的检测
用免疫斑点法检测RP62A菌株不同生长期(4、6、8、10、12 h)YycG蛋白的表达。结果显示,所检测时间点的细菌均显示阳性,12 h达高峰,而mIgG检测结果呈阴性(图3A)。蛋白免疫印迹检测结果显示,培养10、12 h表皮葡萄球菌菌体蛋白均可检测到与抗YycG-PAS单抗反应的条带,相对分子质量为70 000(图3B)。
2.4 抗YycG-PAS单抗对浮游细菌生长及存活的影响
检测抗YycG-PAS单抗对浮游RP62A菌株生长及细菌存活(6、24 h)的影响。结果显示,加入抗YycG-PAS单抗(160μg/ml)对RP62A菌株的生长曲线无明显影响,与mIgG(160μg/ml)处理组和未处理组相似(图4)。与抗YycG-PAS单抗共培养6 h菌落数为(6.18±0.38)log CFU/μl,培养24 h菌落数为(6.37±0.25)log CFU/μl,与mIgG组及未处理组无显著差异。

图4 抗YycG-PAS单抗对表皮葡萄球菌RP62A生长曲线的影响Fig.4 Growth curve of S.epidermidis RP62A co-cultured with YycG-PAS monoclonal antibody
2.5 抗YycG-PAS单抗对细菌生物膜形成的影响
将过夜RP62A接种至抗YycG-PAS单抗(80 μg/ml)中,培养6或24 h。生物膜检测结果显示,抗YycG-PAS单抗组、mIgG(80μg/ml)组和未处理组6 h生物膜OD570值分别为0.424±0.008、0.780±0.04及0.904±0.02;24 h生物膜OD570值分别为1.056±0.08、1.857±0.18及1.973±0.14。抗YycG-PAS单抗或mIgG对6 h生物膜的抑制率分别为53.1%和13.7%(P<0.05);对24 h生物膜的抑制率分别为46.5%和5.9%(P<0.05)(图5)。
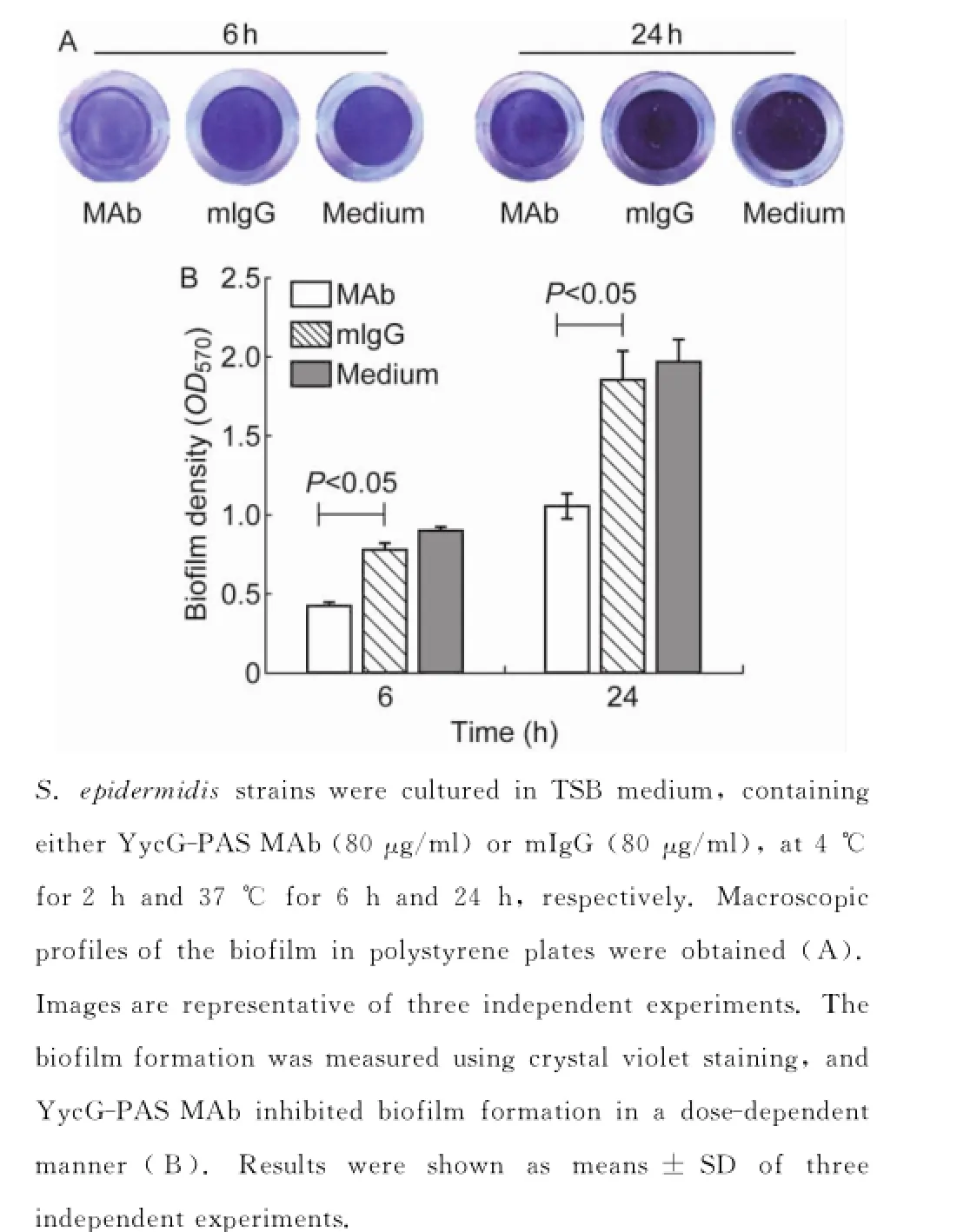
图5 抗YycG-PAS单抗对表皮葡萄球菌RP62A生物膜形成的影响Fig.5 Effect of YycG-PAS monoclonal antibody on biofilm formation of S.epidermidis RP62A
进一步研究抗YycG-PAS单抗与万古霉素联用对表皮葡萄球菌生物膜形成的影响。将过夜RP62A接种至含有抗YycG-PAS单抗(80μg/ml)和万古霉素〔1μg/ml,1/4最低抑菌浓度(minimum inhibitory concentration,MIC)〕的培养基中,24 h后检测生物膜形成情况。结果显示,与未处理组相比,低浓度万古霉素无抗生物膜的作用;抗YycGPAS单抗与万古霉素联用具有显著抑制生物膜形成的作用(P<0.000 1),而mIgG(80μg/ml)与万古霉素(1μg/ml)联用则无显著抑制作用(P>0.05)(表1)。与单用万古霉素相比,抗YycG-PAS单抗与万古霉素联用对细菌生物膜形成有显著抑制作用(P<0.000 1);与抗YycG-PAS单抗相比,联用万古霉素对细菌生物膜形成有显著抑制作用(P<0.01)。
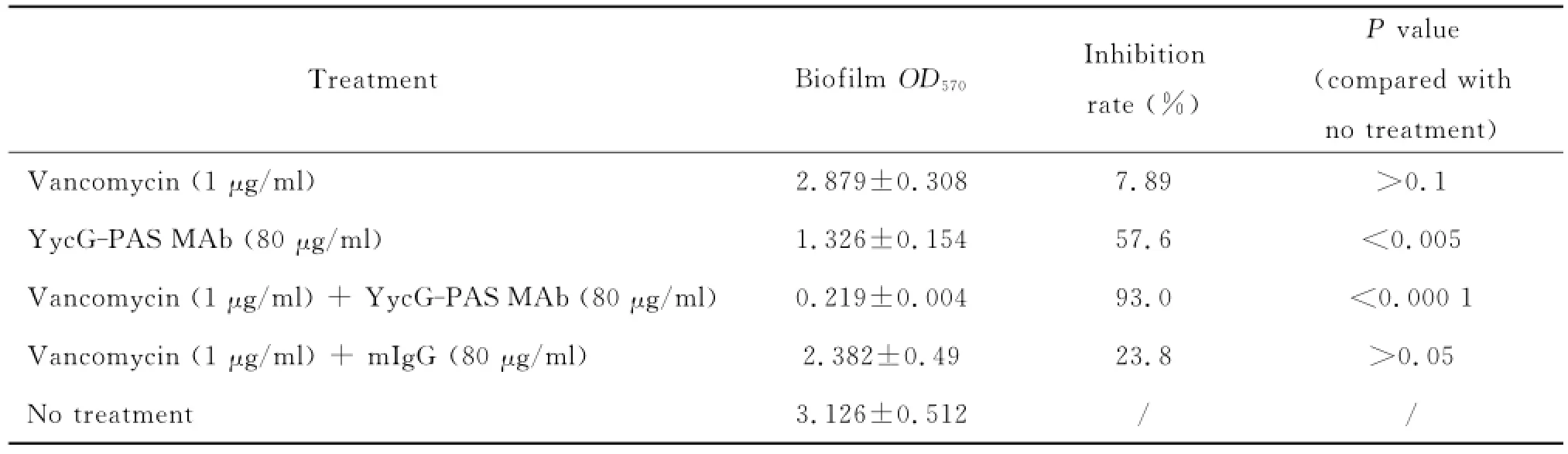
表1 抗YycG-PAS单抗与万古霉素联用对表皮葡萄球菌生物膜形成的影响Tab.1 Effect of YycG-PAS monoclonal antibody in combination with vancomycin on bacterial biofilm formation
3 讨论
YycFG双组分信号转导系统高度保守,存在于GC含量较低的革兰阳性菌,调控细菌生物膜形成、细胞壁代谢、耐药及毒力,是研发抗菌药物的良好靶点[13]。YycFG双组分系统感受外界信号的途径为:组氨酸激酶YycG的膜外配体结合区域感受外界环境的信号,激活激酶,发生自身磷酸化,进而将激酶组氨酸上磷酸基团转移至反应调节蛋白YycF的天冬氨酸残基,激活效应区域,暴露DNA结合位点,从而调控下游基因表达。YycG为跨膜蛋白,含有膜外PAS信号感应区及膜内HATPase_c等激酶区域[10]。
YycG的胞外PAS区域在葡萄球菌中保守,同源度达87%。蛋白二级结构预测分析显示PAS区域为亲水蛋白,二级结构以β转角结构为主。β转角结构多突出于蛋白表面,区域柔性较高,有利于抗体结合。本实验室前期筛选到针对YycG胞内激酶区域的抑制剂,能抑制表皮葡萄球菌的生物膜形成[11]。然而,针对YycG-PAS的单抗能否抑制生物膜的形成?为此,本研究制备了抗YycG-PAS单抗,并用纯化的重组YycG-PAS原核表达蛋白检测和鉴定,结果显示其效价高达log 215,属于IgG2a亚型。抗YycG-PAS单抗能与培养10和12 h的RP62A菌体蛋白结合,大小约70 000,与预测的YycG蛋白大小一致。免疫斑点结果显示,YycG蛋白在RP62A对数生长期表达,12 h达高峰,与yycGmRNA检测结果趋势一致;而用mIgG为对照,检测结果为阴性,提示抗YycG-PAS单抗具有特异性。
YycG在表皮葡萄球菌生物膜的形成中起重要调控作用[8]。PAS为YycG的胞外信号感应区,可接受外界环境信号,与YycH及YycI形成三聚体,调控YycG的激酶活性[14]。本研究显示,抗YycGPAS单抗与表皮葡萄球菌共培养6及24 h,能抑制细菌生物膜的形成。推测抗YycG-PAS单抗可能通过结合PAS区域阻断信号转导,影响YycG对外界信号的磷酸化传递过程,从而影响YycFG双组分系统对生物膜形成的调控,这有待进一步研究。
革兰阳性菌的细胞壁主要由肽聚糖组成,厚度达20~30 nm,可能会阻碍抗Yycg-PAS单抗与PAS结合,使单抗作用浓度达较高水平(80~160 μg/ml)。本研究初步探讨了抗YycG-PAS单抗与低浓度万古霉素(细胞壁肽聚糖抑制剂)联用对表皮葡萄球菌生物膜形成的影响。虽然表皮葡萄球菌生物膜能抵抗万古霉素的抗菌作用[15],但本研究显示低浓度万古霉素(1/4 MIC)可明显增强抗YycGPAS单抗抑制细菌生物膜形成的作用。推测低浓度万古霉素部分抑制细胞壁合成,从而影响细菌细胞壁的完整性,使抗YycG-PAS单抗更易进入细胞壁与胞外PAS区域结合,从而阻断对信号的感应。本研究为单抗在抗生物膜感染中的应用奠定了一定基础,但对抗YycG-PAS单抗作用的B细胞表位鉴定及其抑制表皮葡萄球菌生物膜形成的机制有待进一步研究。
[1] O’Gara JP,Humphreys H.Staphylococcus epidermidisbiofilms:importance and implications[J].J Med Microbiol,2001,50(7):582-587.
[2] Centers for Disease Control and Prevention(CDC).Vital signs:central line-associated blood stream infections——United States,2001,2008,and 2009[J].MMWR Morb Mortal Wkly Rep,2011,60(8):243-248.
[3] Gomes F,Teixeira P,Oliveira R.Mini-review:Staphylococcus epidermidis as the most frequent cause of nosocomial infections:old and new fighting strategies[J].Biofouling,2014,30(2):131-141.
[4] Claessens J,Roriz M,Merckx R,Baatsen P,Van Mellaert L,Van Eldere J.Inefficacy of vancomycin and teicoplanin in eradicating and killing Staphylococcus epidermidis biofilms in vitro[J].Int J Antimicrob Agents,2015,45(4):368-375.
[5] Mark L,Hanke,Tammy K.Deciphering mechanisms of staphylococcal biofilm evasion of host immunity[J].Front Cell Infect Microbiol,2012,62(2):1-12.
[6] Gil C,Cristina S,Saloa B,Cristina L,Begona G,Alejandro TA,Inigo L,Jaione V.Biofilm matrix exoproteins induce a protective immune response against Staphylococcus aureus biofilm infection[J].Infect Immun,2014,82(3):1017-1029.
[7] Kostakioti M,Hadjifrangiskou M,Hultgren SJ.Bacterial biofilms:development,dispersal,and therapeutic strategies in the dawn of the postantibiotic era[J].Cold Spring Harb Perspect Med,2013,3(4):a010306-a010306.
[8] Dubrac S,Boneca IG,Poupel O,Msadek T.New insights into the WalK/WalR(YycG/YycF)essential signal transduction pathway reveal a major role in controlling cell wall metabolism and biofilm formation in Staphylococcus aureus[J].J Bacteriol,2007,189(22):8257-8269.
[9] Mascher T,Helmann JD,Unden G.Stimulus perception in bacterial signal-transducing histidine kinases[J].Microbiol Mol Biol Rev,2006,70(4):910-938.
[10] West AH,Stock AM.Histidine kinases and response regulator proteins in two-component signaling systems[J].Trends Biochem Sci,2001,26(6):369-376.
[11] Huang RZ,Zheng LK,Liu HY,Pan B,Hu J,Zhu T,Wang W,Jiang DB,Wu Y,Wu YC,Han SQ,Qu D.Thiazolidione derivatives targeting the histidine kinase YycG are effective against both planktonic and biofilm-associated Staphylococcus epidermidis[J].Acta Pharmacol Sin,2012,33(3):418-425.
[12] Peeters E,Nelis HJ,Coenye T.Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J].J Microbiol Methods,2008,72(2):157-165.
[13] Dubrac S,Bisicchia P,Devine KM,Msadek T.A matter of life and death:cell wall homeostasis and the WalKR(YycGF)essential signal transduction pathway[J].Mol Microbiol,2008,70(6):1307-1322.
[14] Szurmant H,Mohan MA,Imus PM,Hoch JA.YycH and YycI interact to regulate the essential YycFG two-component system in Bacillus subtilis[J].J Bacteriol,2007,189(8):3280-3289.
[15] Pinheiro L,Brito CI,Pereira VC,Oliveira Ad,Camargo CH,Cunha Mde L.Reduced susceptibility to vancomycin and biofilm formation in methicillin-resistant Staphylococcus epidermidis isolated from blood cultures[J].Mem Inst Oswaldo Cruz,2014,109(7):871-878.
Effect of anti-YycG monoclonal antibody against Staphylococcus epidermidis biofilm formation
GONG Ting,HAN Hai-Yan,LU Zhi-Hui,WANG Xiao-Fei,CAO Yun,CHENG Xun-Jia,WU Yang,QU Di
Department of Microbiology and Parasitology,Key Laboratory of Medical Molecular Virology of Ministries of Education and Health,School of Basic Medical Sciences,Fudan University,Shanghai 200032,China
Bacterial YycFG two-component signal transduction system plays a major role in controlling cell wall synthesis,metabolism and biofilm formation ofStaphylococcus.The extracellular PAS domain of YycG histidine kinase can sense various environmental signals.Therefore,a monoclonal antibody targeting PAS domain ofStaphylococcus epidermidis(S.epidermidis)was produced(YycG-PAS MAb).Enzymelinked immunosorbent assay(ELISA)indicated that YycG-PAS MAb belonged to IgG2a subclass and antibody titer was log 215.Western blotting suggested that YycG-PAS MAb had the ability to bind both recombinant YycG-PAS protein and protein extracted from cells.Further investigation exhibited inhibitory effect of YycG-PAS MAb(80μg/ml)against biofilm formation after co-incubation with S.epidermidis and the inhibitory rate was 46.5%.The anti-biofilm activity of YycG-PAS MAb was improved when combined with low-concentration of vancomycin(1μg/ml).The inhibitory rate was increased from57.6%to 93.0%(P<0.01).No significant effects of YycG-PAS MAb on viability and growth of planktonic bacterial cells were observed.This study indicated that YycG-PAS MAb is a promising candidate antibody for biofilm-related infections.
Staphylococcus epidermidis;Biofilm;YycG histidine kinase;PAS domain;Monoclonal antibody
.QU Di,E-mail:dqu@fudan.edu.cn
2015-04-20)
国家自然科学基金(81101214、81271791)
瞿涤

