mkl基因在海分枝杆菌抵抗宿主免疫中的作用
华亦斐,王晴岚,牛辰,高谦
复旦大学基础医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032
mkl基因在海分枝杆菌抵抗宿主免疫中的作用
华亦斐,王晴岚,牛辰,高谦
复旦大学基础医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032
本研究利用MycoMarT7噬菌体建立了海分枝杆菌随机突变库,鉴定获得1株转座子插在基因MMAR_0994(mkl)上的突变株。用野生株和突变株分别感染斑马鱼成鱼,通过观察斑马鱼的存活情况,研究mkl基因对海分枝杆菌毒力的影响;利用尾静脉注射感染孵出48 h后的斑马鱼幼鱼,于荧光显微镜下观察突变株及野生株在幼鱼体内的播散情况,以检测mkl基因在细菌与宿主天然免疫相互作用中的功能;将野生株和突变株分别感染小鼠来源巨噬细胞,检测其在巨噬细胞内的增殖。此外,还检测了突变株对酸性环境的耐受情况。结果显示,mkl基因突变株感染斑马鱼成鱼后25 d内没有鱼死亡;在斑马鱼幼鱼感染模型和细胞感染模型中,突变株的增殖明显减弱;突变株对酸性环境压力更敏感。以上结果提示,mkl基因在海分枝杆菌抵抗宿主免疫及致病中发挥重要作用。
海分枝杆菌;mkl基因;巨噬细胞;斑马鱼感染模型
结核分枝杆菌(Mycobacterium tuberculosis,M.tuberculosis)是引起人类结核病的元凶,但由于多种因素,如其强致病性和传染性,研究结核分枝杆菌需在生物安全三级(biosafety level 3,BSL-3)实验室中进行;其生长缓慢(倍增时间15~20 h),所以对其致病机制了解很不全面。近年来,将海分枝杆菌(Mycobacterium marinum)作为结核分枝杆菌的模式菌来研究其致病机制逐渐得到人们的认可和重视。海分枝杆菌在基因组水平与结核分枝杆菌复合群最接近,其天然宿主为鱼类和两栖类,能引起鱼类结核病。虽然结核分枝杆菌小鼠感染模型是研究结核分枝杆菌致病机制的有力工具,但常用的C57BL/6或BALB/c小鼠均不能有效模拟人结核病的病理特征[1],特别是其肉芽肿结构模糊,缺少纤维化和低氧[2]。而海分枝杆菌感染斑马鱼(Danio rerio,俗称zebrafish)成鱼后的典型病理特征(肉芽肿的形成)与人结核病的病理非常相似[3,4],成为很好的研究结核病肉芽肿形成等病理机制的模型。此外,使用荧光标记的海分枝杆菌感染透明的斑马鱼幼鱼,结合荧光显微镜技术可实时追踪细菌在体内的感染过程及细菌与宿主细胞的相互作用,可清晰地解析结核病的早期病理[5-7],这也是其他结核病动物模型所不具备的优势。目前利用该模型研究结核分枝杆菌的致病机制取得了很好的成果,越来越受重视并得到广泛应用[8-10],本研究也使用该模型。
结核分枝杆菌Mce蛋白家族最初被认为影响分枝杆菌进入宿主的过程,与分枝杆菌毒力相关。但其操纵子中大多数基因的功能仍未知,可能与脂质代谢或氧化还原反应有关[11]。每个结核分枝杆菌mce操纵子中包含2个yrbE基因(yrbEA和yrbEB)和6个mce基因(mceA、mceB、mceC、mceD、mceE和mceF)。mce操纵子可能编码ATP结合盒(ATP-binding cassette,ABC)转运系统,其编码的YrbE和Mce蛋白分别与ABC转运系统的通透酶和底物结合蛋白(substrate-binding protein,SBP)同源[11]。mce操纵子编码的ABC转运系统需ATPase的参与。以前研究者将Rv0655基因编码的ATPase命名为Mkl[12],可能为mce1和mce4操纵子编码的ABC转运系统提供能量[13]。研究指出,mkl及mce4缺陷型结核分枝杆菌体外摄取及代谢胆固醇的能力急剧下降,当胆固醇作为唯一碳源时突变菌株生长缓慢[14],提示Mkl可能与Mce4介导的胆固醇转运相关。此外,mkl缺陷型结核分枝杆菌在小鼠体内的存活率显著降低[13],提示Mkl对分枝杆菌的致病有重要作用。本研究在海分枝杆菌转座子突变库中鉴定了一株mkl突变株,针对mkl基因对海分枝杆菌致病的影响及相关机制开展了进一步研究。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及噬菌体海分枝杆菌ATCCBAA-535(M菌株)及大肠埃希菌DH5α pir116均由加拿大多伦多大学刘军教授馈赠,耻垢分枝杆菌(Mycobacterium smegmatis,M.smegmatis)mc2155由美国斯坦福大学Small P教授惠赠,分枝杆菌温敏噬菌体phagemid MycoMar T7由美国哈佛大学Rubin EJ教授惠赠,绿色荧光质粒pTEC15由美国华盛顿大学Ramakrishnan L教授惠赠。
1.1.2 动物和细胞斑马鱼成鱼购自上海联友水族;斑马鱼AB品系胚胎:种鱼由国家斑马鱼模式动物中心馈赠,实验室专人繁育饲养,实验前1 d进行孵化准备。小鼠来源巨噬细胞系Raw264.7购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.1.3 仪器和试剂实验仪器包括相差显微镜(Zeiss Axiovert 200M microscope,Carl Zeiss公司)、0.1 mm Zirconia/Silica beads(Biospec公司)和常规聚合酶链反应(polymerase chain reaction,PCR)仪(2720 Thermal Cycler,Applied Biosystems公司)。试剂包括胶回收试剂盒(Tiangen公司)、质粒抽提试剂盒(Tiangen公司)、Trizol(Life Technology公司)、反转录试剂盒(TaKaRa公司)、PTU(Sigma-Aldrich公司)等。
1.2 方法
1.2.1 海分枝杆菌的培养海分枝杆菌为光产色细菌,需32℃避光培养。常规液体培养基为含10%OADC的7H9培养基;常规固体培养基为含10%OADC的7H10培养基[15]。必要时添加抗生素卡那霉素40μg/ml或潮霉素50μg/ml。
1.2.2 引物设计及测序转座子插入位点鉴定测序引物TLP1:5′-CTGGACAAGGGAAAACGC-3′。mkl∷Tn菌株MMAR_0994基因互补PCR引物MMAR_0994 CO Fw:5′-CGGCATTGGAAGGATTTCCC-3′;MMAR_0994 CO Rv:5′-GACTAGTTCAGCGGTGGGTGCCCT-3′。MMAR_0993、MMAR_0994共转录鉴定PCR引物F1:5′-CAATGACGGGCGCGTAACGG-3′;R1:5′-GGG-AAATCCTTCCAATGCCGATGCC-3′。MMAR_0994、MMAR_0995共转录鉴定PCR引物F2:5′-CCGCCGTCCAGGGTCTAGC-3′;R2:5′-CGAACGAACTACCCGGATCTCACGC-3′。引物合成及插入位点测序均由上海Invitrogen公司完成。
1.2.3 突变基因的鉴定抗性标志挽救法确定转座子插入位点,参见文献[16]。
1.2.4 海分枝杆菌mkl基因与上下游基因共转录鉴定收集海分枝杆菌培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)洗后,用Trizol抽提RNA,将所得RNA反转录成cDNA,海分枝杆菌RNA及cDNA制备具体方法参见文献[17]。用相应引物进行PCR,鉴定mkl基因与上下游基因共转录情况。
1.2.5 海分枝杆菌在巨噬细胞内的增殖检测检测方法参见文献[18]。小鼠来源巨噬细胞系Raw264.7培养于含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基中,37℃、0.5% CO2培养箱中培养。胰酶消化细胞,计数并调整密度为105/ml。将上述细胞悬液加入24孔培养板(1 ml/孔),37℃、5%CO2培养箱中培养24 h,待单层细胞贴于板壁上即可用于侵染实验。制备单细胞悬液,于每孔加入1 ml上述菌液,共培养4 h﹝感染复数(multiplicity of infection,MOI)为1﹞。在指定时间点去除培养基,每孔加0.1 ml 0.1%Triton-X100,于32℃培养箱中孵育15 min,裂解细胞,胞内细菌用无菌PBS梯度稀释并铺板,32℃培养,计菌落形成单位(colony-forming unit,CFU)。
1.2.6 斑马鱼成鱼腹腔注射感染斑马鱼的饲养方法见http://zfin.org/zf-info/zfbook/zfbk.html。感染前置于待感染的鱼缸中喂养1周,使其充分适应环境。用0.1%三卡因(tricaine)浸泡5 min以充分麻醉[3]。海分枝杆菌生长到600 nm处光密度(optical density,OD)为1.0时,用PBS将菌液稀释到106CFU/ml。用4号注射器吸取10μl,注射入斑马鱼腹腔,每条鱼注射约10 000 CFU。观察感染后不同天数斑马鱼的存活状况。
1.2.7 斑马鱼幼鱼尾静脉显微注射鱼卵孵出2 d后将鱼卵外层膜去除,置于28℃培养箱中。制备携带有pTEC15荧光质粒的细菌悬液,与酚红染料以10∶1混合,毛细管针管上样5μl。在镜下小心破开针头,并调整注射参数以控制注射量在适当范围,将三卡因麻醉后的幼鱼置于镜下凹玻片中,于尾静脉处注射。将注射好的幼鱼转移入96孔板,每孔保存1条。在感染后不同天数进行观察、拍照及图像分析[19]。
1.2.8 对酸性环境耐受检测配制柠檬酸-磷酸盐缓冲液(pH4.5和pH7.0)。海分枝杆菌接种于含10%OADC的7H9液体培养基中,32℃培养至对数生长期(OD=1.0)。将细菌用PBS洗后稀释入制备好的缓冲液中,调节OD值至0.01,32℃培养2 d,对培养菌进行梯度稀释铺板,统计CFU。
2 结果
2.1 海分枝杆菌mkl基因突变株的鉴定
本研究从构建的海分枝杆菌转座子随机插入文库中鉴定了1株插入位点位于mkl(MMAR_0994)基因的突变株(图1),该基因编码一个ATP结合蛋白,其含有ABC_ATPase超家族蛋白结构域。序列比对发现,海分枝杆菌mkl基因(MMAR_0994)与结核分枝杆菌mkl基因(Rv0655)核酸序列同源度高达89%,氨基酸同源度高达88%。
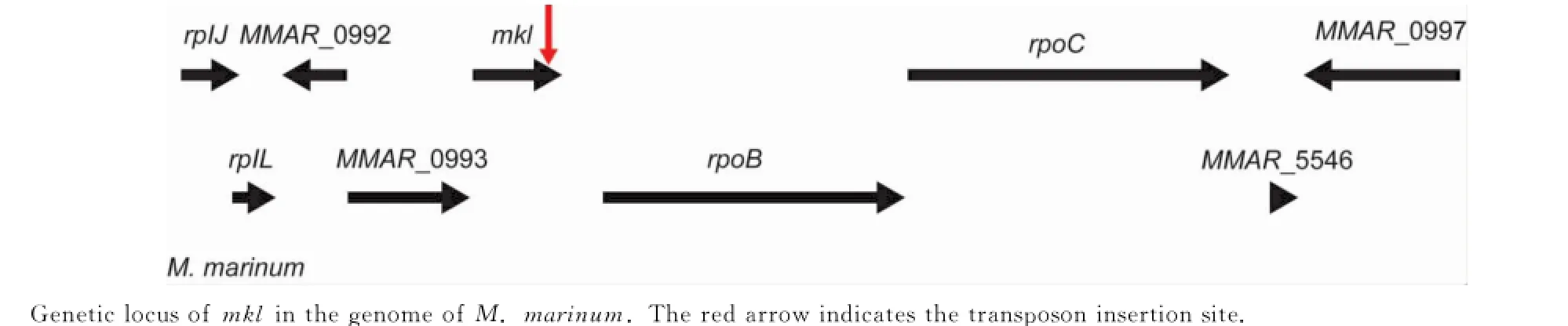
图1 mkl基因在基因组上的位置Fig.1 Genetic locus of mkl in the genome
为验证该突变株中转座子插入是否影响下游基因的转录,本研究用反转录PCR鉴定了mkl基因及其上下游基因的转录方向。结果显示,只有MMAR_0993与MMAR_0994(mkl)共转录,MMAR_0994(mkl)与MMAR_0995(rpoB)非共转录,这与TBDB数据库中预测的同源Rv基因的转录情况一致(图2)。
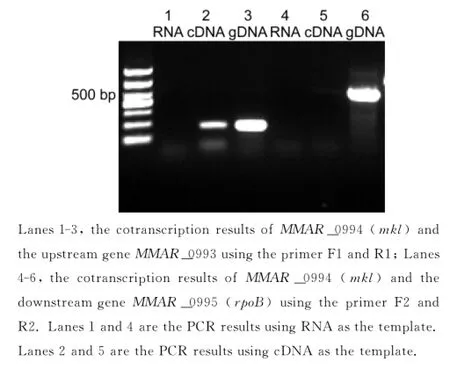
图2 用RT-PCR鉴定海分枝杆菌mkl基因及其上下游基因共转录情况Fig.2 The cotranscription results of mkl,the upstream gene MMAR_0993(the first three lanes),and the downstream gene rpoB(the last three lanes)
2.2 mkl突变使海分枝杆菌在斑马鱼成鱼中的毒力明显减弱
为探讨mkl基因与海分枝杆菌毒力的关系,本研究将野生株与突变株分别感染斑马鱼成鱼并观察斑马鱼的生存情况。在感染后的25 d内,对照PBS组及突变株组斑马鱼没有出现死亡,进食量和活力与感染前无差别。而海分枝杆菌野生株及互补株感染的斑马鱼在1周后逐渐出现活力降低、进食下降、腹部肿胀等症状,直至死亡。统计得到如图3所示的斑马鱼死亡曲线,可见野生株和互补株感染的斑马鱼分别从第15天和第14天开始死亡,斑马鱼半数死亡时间分别是18 d和16 d,而突变株组直至观察结束没有鱼死亡,表明mkl基因对海分枝杆菌的致病十分重要。

图3 斑马鱼感染不同海分枝杆菌后的生存曲线Fig.3 The survival curve of zebrafish infected with wildtype,mutant and complementary strains by intraperitoneal injection of M.marinum
2.3 mkl基因突变不影响海分枝杆菌的体外生长
为检验mkl基因突变对细菌体外生长有无影响,本研究测定了突变株及野生株在液体培养基中的生长情况(图4)。结果显示,两者生长无显著差异,提示mkl基因突变不影响海分枝杆菌的体外生长。
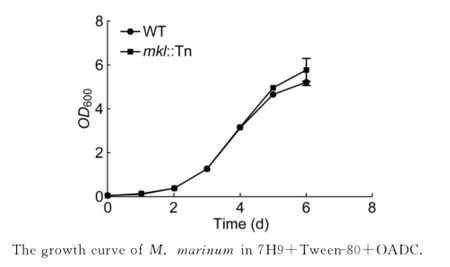
图4 海分枝杆菌生长曲线Fig.4 The growth curve of M.marinum
2.4 用斑马鱼幼鱼模型研究mkl基因对海分枝杆菌毒力的影响
斑马鱼幼鱼在孵化后的2~8 d其免疫力以天然免疫为主,利用斑马鱼幼鱼尾静脉注射模型可评估突变株在宿主天然免疫时期毒力变化情况[20,21]。用突变株和野生株分别感染孵化2 d后的斑马鱼幼鱼,结果如图5A所示,随着感染天数增加,突变株和野生株均有不同程度增殖,且野生株比突变株增殖更明显。野生株感染后,绿色荧光逐渐从感染部位扩散到鱼的其他部位,而突变株感染后荧光扩散不太明显。对所得到的15条幼鱼第4天和第6天的荧光拍照结果进行积分光密度(integrated optical density,IOD)统计,突变株与野生株有显著差异(P<0.01,t test)(图5B),表明在海分枝杆菌感染宿主的天然免疫阶段,mkl影响细菌增殖和扩散。
2.5 mkl突变株在巨噬细胞内增殖减慢
为进一步了解mkl在海分枝杆菌抵抗宿主天然免疫杀伤中的作用,本研究检测了野生株、突变株和互补株在巨噬细胞中的增殖(图6A)。结果显示,在感染巨噬细胞后的第2、3、4天,突变株与野生株在细胞内的数量有显著差异,提示mkl突变使细菌在宿主巨噬细胞内的增殖减慢。

图5 幼鱼尾静脉感染结果Fig.5 The zebrafish larvae infected with wild-type,mutant and complementary strains by caudal vein injection of M.marinum
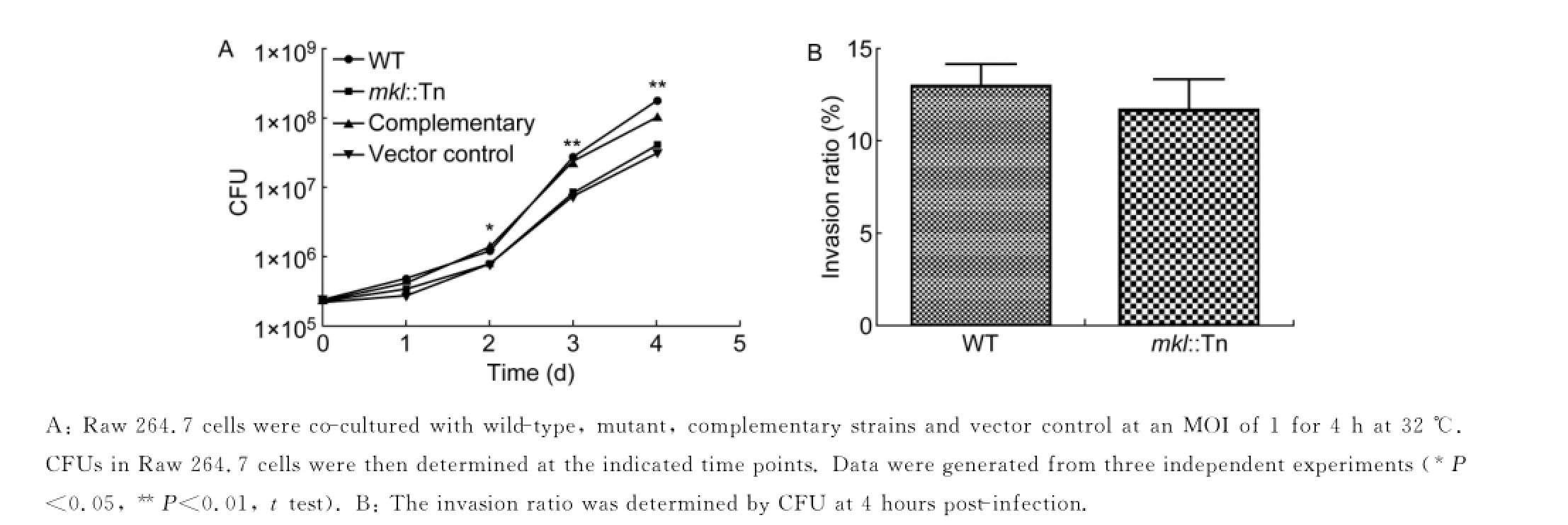
图6 海分枝杆菌感染巨噬细胞系Raw264.7Fig.6 Intracellular survival of the mkl∷Tn mutant
同时,为探讨mkl基因对海分枝杆菌侵染效率的影响,本研究比较了突变株与野生株进入巨噬细胞的数量。结果如图6B所示,与野生株相比,突变株对小鼠巨噬细胞的侵染效率没有显著改变。
2.6 mkl突变株对酸性环境的耐受能力下降
结核分枝杆菌能在宿主体内长期存活,很大一部分原因是其能抵抗吞噬体的酸性环境[22]。本研究检测了mkl突变株对酸性环境的耐受能力,在pH4.5酸性条件下培养细菌,分别统计突变株和野生株的存活量(图7)。结果显示,突变株对酸性环境的耐受能力明显下降(P<0.05,t test),表明mkl对细菌抵抗体内酸性压力环境十分重要。
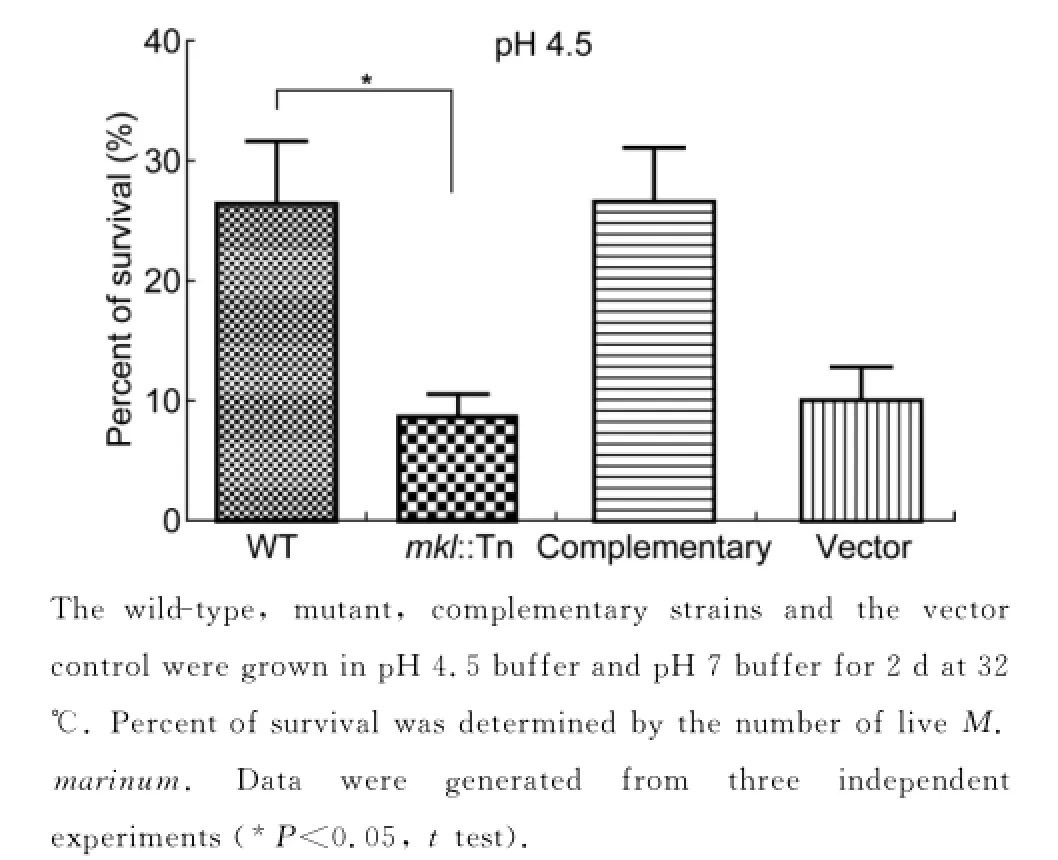
图7 海分枝杆菌对酸性环境的耐受能力Fig.7 Mutant was less resistant to low pH environment
3 讨论
本研究中,mkl突变株在斑马鱼成鱼中的毒力显著减弱,与以前报道的小鼠中结核分枝杆菌感染表型一致,即结核分枝杆菌mkl突变株在免疫正常小鼠中毒力明显下降[13]。本研究进一步发现,mkl突变株在斑马鱼幼鱼中的增殖显著减弱。实验中所用的斑马鱼幼鱼处在孵化后的2~8 d,其适应性免疫尚未发育成熟,处于天然免疫为主阶段[20,21]。此外,巨噬细胞在分枝杆菌与宿主天然免疫系统的相互作用中非常重要,本研究显示突变株在巨噬细胞中增殖速度明显减慢。这些均提示在宿主天然免疫阶段,mkl基因对分枝杆菌的存活及增殖有重要作用。
分枝杆菌侵染巨噬细胞、在巨噬细胞内增殖、有效阻止溶酶体酸化及杀伤,均为其毒力的重要表现。海分枝杆菌野生株与mkl突变株的侵染效率无差异,表明mkl突变株在巨噬细胞中增殖减慢并非由于侵染效率下降导致。同时,本研究观察到在体外培养条件下,mkl突变株对酸性环境(低pH)更为敏感。在巨噬细胞中分枝杆菌会遇到酸性环境,但分枝杆菌具有某些抵抗酸性环境的机制,能避免与溶酶体融合,从而能在巨噬细胞中存活。因此,本研究推测mkl突变株在巨噬细胞中遭遇酸性环境后抵抗能力下降,导致其在巨噬细胞中的增殖减弱。
对于mkl基因功能及其影响毒力的具体机制,目前仍存在许多猜测。有研究发现,mkl编码ATPase,可能为mce4和mce1操纵子编码的转运系统提供能量[13]。Mkl还可能与Mce4介导的胆固醇转运相关[14]。另外,mce4缺陷型、mce1缺陷型及mkl缺陷型结核分枝杆菌在小鼠体内的存活率显著降低[13]。但mce4突变株只在感染后期毒力有所下降,而mkl突变株在感染早期毒力即减弱,且比mce1、mce4突变株毒力下降更明显。本研究也进一步发现,mkl突变株在宿主天然免疫阶段便有显著的毒力下降,表明mkl突变株导致毒力下降的可能原因并不局限于Mkl与mce4操纵子编码的转运系统相互作用,Mkl极可能与mce1或其他mce操纵子编码的蛋白也相互作用。另外,mkl基因在位置上与mce操纵子离得很远,因此Mkl可能也为其他转运系统提供能量。
综上所述,本研究在斑马鱼成鱼和幼鱼及巨噬细胞感染模型中均观察到mkl突变株的毒力相对野生株显著减弱,提示mkl基因在细菌抵抗宿主适应性免疫和天然免疫中均有重要功能。另外,突变株对酸性环境更敏感,也提示mkl突变株在巨噬细胞中增殖减弱可能是其抵抗巨噬细胞酸性环境的能力下降所致。总之,本研究进一步明确了mkl基因在分枝杆菌致病中的重要作用,特别是在抵抗宿主天然免疫中不可或缺。
[1] O’Garra A,Redford PS,McNab FW,Bloom CI,Wilkinson RJ,Berry MP.The immune response in tuberculosis[J].Annu Rev Immunol,2013,31:475-527.
[2] Via LE,Lin PL,Ray SM,Carrillo J,Allen SS,Eum SY,Taylor K,Klein E,Manjunatha U,Gonzales J,Lee EG,Park SK,Raleigh JA,Cho SN,McMurray DN,Flynn JL,Barry CE3rd.Tuberculous granulomas are hypoxic in guinea pigs,rabbits,and nonhuman primates[J].Infect Immun,2008,76(6):2333-2340.
[3] Swaim LE,Connolly LE,Volkman HE,Humbert O,Born DE,Ramakrishnan L.Mycobacterium marinum infection of adult zebrafish causes caseating granulomatous tuberculosis and is moderated by adaptive immunity[J].Infect Immun,2006,74(11):6108-6117.
[4] Tobin DM,Ramakrishnan L.Comparative pathogenesis of Mycobacterium marinum and Mycobacterium tuberculosis[J].Cell Microbiol,2008,10(5):1027-1039.
[5] Davis JM,Clay H,Lewis JL,Ghori N,Herbomel P,Ramakrishnan L.Real-time visualization of Mycobacteriummacrophage interactions leading to initiation of granuloma formation in zebrafish embryos[J].Immunity,2002,17(6):693-702.
[6] Pozos TC,Ramakrishnan L.New models for the study of Mycobacterium-host interactions[J].Curr Opin Immunol,2004,16(4):499-505.
[7] Lesley R,Ramakrishnan L.Insights into early mycobacterial pathogenesis from the zebrafish[J].Curr Opin Microbiol,2008,11(3):277-283.
[8] Clay H,Davis JM,Beery D,Huttenlocher A,Lyons SE,Ramakrishnan L.Dichotomous role of the macrophage in early Mycobacterium marinum infection of the zebrafish[J].Cell Host Microbe,2007,2(1):29-39.
[9] Tobin DM,Vary JC Jr,Ray JP,Walsh GS,Dunstan SJ,Bang ND,Hagge DA,Khadge S,King MC,Hawn TR,Moens CB,Ramakrishnan L.The lta4h locus modulates susceptibility to mycobacterial infection in zebrafish and humans[J].Cell,2010,140(5):717-730.
[10] Roca FJ,Ramakrishnan L.TNF dually mediates resistance and susceptibility to mycobacteria via mitochondrial reactive oxygen species[J].Cell,2013,153(3):521-534.
[11] Casali N,Riley LW.A phylogenomic analysis of the Actinomycetales mce operons[J].BMC Genomics,2007,8:60.
[12] Dassa E,Bouige P.The ABC of ABCS:aphylogenetic and functional classification of ABC systems in living organisms[J].Res Microbiol,2001,152(3-4):211-229.
[13] Joshi SM,Pandey AK,Capite N,Fortune SM,Rubin EJ,Sassetti CM.Characterization of mycobacterial virulence genes through genetic interaction mapping[J].Proc Natl Acad Sci USA,2006,103(31):11760-11765.
[14] Pandey AK,Sassetti CM.Mycobacterial persistence requires the utilization of host cholesterol[J].Proc Natl Acad Sci USA,2008,105(11):4376-4380.
[15] Yu J,Niu C,Wang D,Li M,Teo W,Sun G,Wang J,Liu J,Gao Q.MMAR_2770,a new enzyme involved in biotin biosynthesis,is essential for the growth of Mycobacterium marinum in macrophages and zebrafish[J].Microbes Infect,2011,13(1):33-41.
[16] Alexander DC,Jones JR,Tan T,Chen JM,Liu J.PimF,a mannosyltransferase of mycobacteria,is involved in the biosynthesis of phosphatidylinositol mannosides and lipoarabinomannan[J].J Biol Chem,2004,279(18):l8824-l8833.
[17] Pettersson BM,Nitharwal RG,Das S,Behra KP,Benedik E,Arasu UT,Islam NM,Dasgupta S,Bhattacharya A,Kirsebom LA.Identification and expression of stressosomal proteins in Mycobacterium marinum under various growth and stress conditions[J].FEMS Microbiol Lett,2013,342(2):98-105.
[18] Ramakrishnan L,Falkow S.Mycobacterium marinum persists in cultured mammalian cells in a temperaturerestricted fashion[J].Infect Immun,1994,62(8):3222-3229.
[19] Takaki K,Davis JM,Winglee K,Ramakrishnan L.Evaluation of the pathogenesis and treatment of Mycobacterium marinum infection in zebrafish[J].Nat Protoc,2013,8(6):1114-1124.
[20] Lam SH,Chua HL,Gong Z,Lam TJ,Sin YM.Development and maturation of the immune system in zebrafish,Danio rerio:agene expression profiling,in situ hybridization and immunological study[J].Dev Comp Immunol,2004,28(1):9-28.
[21] Page DM,Wittamer V,Bertrand JY,Lewis KL,Pratt DN,Delgado N,Schale SE,McGue C,Jacobsen BH,Doty A,Pao Y,Yang H,Chi NC,Magor BG,Traver D.An evolutionarily conserved program of B-cell development and activation in zebrafish[J].Blood,2013,122(8):e1-e11.
[22] Ehrt S,Schnappinger D.Mycobacterial survival strategies in the phagosome:defence against host stresses[J].Cell Microbiol,2009,11(8):1170-1178.
The potential role of Mycobacterium marinum mkl gene in bacterial resistance to the host immunity
HUA Yi-Fei,WANG Qing-Lan,NIU Chen,GAO Qian
Key Laboratory of Medical Molecular Virology of Ministries of Education and Health,School of Basic Medical Sciences,Fudan University,Shanghai 200032,China
A Mycobacterium marinum random mutant library using MycoMarT7 phage system was constructed.After screening,a mutant whose transposon insertion site was in MMAR_0994(mkl)gene was obtained.The adult zebrafish were infected with the wild-type and the mutant strains respectively and the survival rates of the zebrafish were compared.The potential impact of the mutant on host innate immune system was tested by infecting the 48-hour post-fertilization zebrafish larvae using caudal vein injection.In vivo distribution of the bacteria was monitored by following green fluorescence in the larvae.The impact of the mutant on mouse macrophage cell line was tested.In addition,the acid tolerance level was also checked.The results showed that mkl mutant displayed attenuated virulence in the zebrafish infection model.The attenuated phenotypes in the zebrafish larvae and mouse macrophage cell line were observed.The invasion rates of the mutant and the wild-type were similar.The growth of the mutant was more sensitive to low pH.These results indicated that mkl may play a functional role in the interaction with host immune system.
Mycobacterium marinum;mkl gene;Macrophage;Zebrafish infection model
s.GAO Qian,E-mail:qiangao@shmu.edu.cn;NIU Chen,E-mail:chniu@fudan.edu.cn
2014-10-31)
国家自然科学基金(81271790、81201256)
高谦,牛辰

