近红外荧光染料在胃癌人源性肿瘤组织异种移植模型研究中的应用
赵宁宁,张彩勤,赵勇,杨丽,张海,刘漪沦,师长宏*
(1.成都医学院,成都 610500;2.第四军医大学实验动物中心,西安 710032)
研究报告
近红外荧光染料在胃癌人源性肿瘤组织异种移植模型研究中的应用
赵宁宁1,2,张彩勤2,赵勇2,杨丽1,2,张海2,刘漪沦1,师长宏1,2*
(1.成都医学院,成都 610500;2.第四军医大学实验动物中心,西安 710032)
目的建立胃癌人源性肿瘤组织异种移植(patient-derived tumor xenograft,PDX)裸鼠模型,探讨近红外荧光(near infrared fluorescence,NIRF)染料IR-783在胃癌PDX模型活体成像研究中的应用。方法取临床胃癌新鲜手术切除标本,裸鼠肾包膜移植建立PDX模型,HE染色比较移植肿瘤组织与患者肿瘤组织形态结构的一致性。将移植肿瘤组织裸鼠皮下接种,20 d后,荷瘤小鼠腹腔注射NIRF染料IR-783(每只10 nmol/L),活体成像连续测定肿瘤部位近红外荧光强度并分析肿瘤体积与荧光强度的相关性;免疫组织化学检测移植肿瘤组织中HIF1α与OATP1B3的表达强度。结果成功建立了3个人胃癌PDX模型,移植肿瘤组织较好的保持了原发肿瘤的特征,NIRF活体成像早期检测到肾包膜部位荧光信号。PDX模型中肿瘤体积与荧光强度的相关性均在98%以上。移植肿瘤组织中HIF1α与OATP1B3表达呈强阳性。结论NIRF染料IR-783可在PDX模型肿瘤部位特异性聚集,用于PDX模型的早期检测,这种肿瘤靶向性可能与HIF1α和OATP1B3的表达相关。
人源性肿瘤组织异种移植模型;近红外荧光染料;低氧诱导因子-1;有机阴离子转运多肽1B3
将患者的新鲜肿瘤组织移植到免疫缺陷小鼠建立的异种荷瘤模型(patient-derived tumor xenograft,PDX),较好的保留了原发肿瘤的微环境和基本特性,复制了患者肿瘤的异质性,保持了人体原发肿瘤分子学,基因学和病理学的复杂性,为肿瘤研究提供了一个很好的体内模型[1-3]。但该类模型制备影响因素较多,每个标本需观察2个月以上才能决定模型是否成功,本研究将近红外荧光活体成像技术应用于人胃癌标本裸鼠肾包膜移植模型的早期影像学诊断[4、5],并成功建立了3个胃癌的PDX模型。
1 材料与方法
1.1 实验动物及标本
6~7周龄SPF级BALB/c雄性裸鼠30只,体重20 g左右,购自北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】,饲养在第四军医大学实验动物中心SPF级屏障系统中【SYXK(陕) 2014-001】。所有胃癌肿瘤标本来自第四军医大学西京医院消化病医院,所有动物实验通过了第四军医大学伦理委员会的批准(编号14013),所有人体标本实验通过了西京医院伦理委员会的批准(编号2015432)。
1.2 试剂
近红外荧光(near infrared fluorescent,NIRF)染料IR-783由美国Cedars-Sinai Medical Center,Leland Chung教授提供,使用浓度为100μmol/L,水合氯醛浓度为7 g/100 mL,基质胶(Matrigel Matrix)购自BD公司。HIF1α兔抗人单克隆抗体购自艾博抗体上海贸易有限公司,OATP1B3鼠抗人单克隆抗体购自Genetex公司。
1.3 人胃癌PDX模型的建立方法
临床胃癌患者手术切除组织标本离体后立即放入4℃培养基中,将组织分为两部分,一部分4%多聚甲醛固定,另一部分切成1 mm×1 mm×3 mm的小块与基质胶混匀。将BALB/c裸鼠腹腔注射水合氯醛,麻醉剂量为5 mL/kg;从左侧背部开1 cm左右切口,剪开肌肉层,把小鼠肾脏托出;在解剖显微镜下,使用眼科镊子分离肾包膜,将混有基质胶的肿瘤组织用玻璃弯头轻轻送入肾包膜下;然后将肾脏送入腹腔,伤口对齐缝好,小鼠置于恒温台上,苏醒后放入笼内。每个肿瘤组织移植5只裸鼠。
1.4 NIRF活体成像检测PDX模型的形成
移植6周后,裸鼠腹腔注射NIRF染料IR-783(100μmol/L),剂量为100μL/20 g,24 h后在Caliper lumina II(美国Caliper公司)小动物光学成像系统中进行近红外荧光活体成像(激发/发射:745 nm/ICG),每5 d测量一次,肾脏部位具有明确荧光信号的小鼠为阳性小鼠。
1.5 PDX模型的稳定传代
持续观察肾脏部位具有荧光信号的小鼠,直至肾脏部位具有明显的隆起,水合氯醛麻醉处死小鼠,取肾脏部位生长的肿瘤组织,采用皮下移植的方法进行传代。将组织剪成2 mm×2 mm×3 mm的小块与基质胶1∶1混合,使用套管针注射于裸鼠后背部或腹股沟等3~4块。患者组织肾膜下移植生长的肿瘤称为原代,首次皮下传代为F1代,当皮下传至F3代时,取部分肿瘤组织用4%多聚甲醛固定,HE染色并与患者肿瘤组织比较。冻存部分F3代肿瘤,作为以后研究使用。
1.6 PDX模型生长曲线
将F3代肿瘤组织切成2 mm×2 mm×3 mm的小块,移植于裸鼠皮下,20 d后开始测量肿瘤体积,每5 d测量一次,测量至第40天。按下列公式计算瘤体积V=1/2×L(长)×W(宽)2,绘制肿瘤生长曲线。
1.7 NIRF强度与肿瘤大小的相关性
将F3代肿瘤组织切成2 mm×2 mm×3 mm的小块裸鼠皮下移植,20 d后按照1.4的方法测量裸鼠皮下肿瘤的发光强度并获得ROI(regions of interest)值。每5 d测量一次,测量至第40天。绘制荧光强度与肿瘤体积的相关性曲线。
1.8 PDX模型肿瘤组织病理形态和免疫组织化学分析
将患者肿瘤组织和裸鼠体内传至F3代的瘤组织用4%多聚甲醛固定后,石蜡包埋,组织切片并进行HE染色,观察组织病理变化,一抗分别为HIF1α兔抗人单克隆抗体和OATP1B3鼠抗人单克隆抗体,二抗分别为辣根过氧化酶标记的羊抗兔和羊抗鼠抗体。
1.9 统计分析
结果以均数±标准差表示,两组间的数据比较采用Student’s t检验,P<0.05为差异有显著性。
2 结果
2.1 胃癌PDX裸鼠模型的建立
本研究共移植5个临床胃癌组织标本,其中有3个标本(样品编号为B86917,C26284和C26414)分别在肾包膜移植后6周,检测到明显的近红外荧光信号,见图1,直至60 d,肾脏部位有明显的组织隆起。70 d后手术切除肾包膜中生长的肿瘤组织进行裸鼠皮下移植,大约在20 d皮下形成明显的隆起,移植30 d后取皮下瘤组织进行传代直至F3代。

图1 人胃癌组织裸鼠肾包膜移植近红外荧光成像Fig.1 Near infrared fluorescence imaging of human gastric cancer tissue xenografted under the renal capsule of nudemice
2.2 PDX模型肿瘤生长曲线
F3代肿瘤组织移植于裸鼠皮下后,在不同时间点测定肿瘤体积,结果见图2,随着时间的延长肿瘤体积增大,其生长特性符合肿瘤增殖的生物学特性。
2.3 NIRF强度与PDX肿瘤体积的相关性
将3例移植成功的PDX模型肿瘤组织皮下移植裸鼠,进行近红外荧光活体成像并测定不同时间点肿瘤部位近红外荧光强度。结果见图3,肿瘤的体积与荧光强度具有较好的相关性,拟合曲线中r值分别达到0.980、0.996、0.996。
2.4 PDX肿瘤组织与患者肿瘤组织病理形态比较
将PDX肿瘤组织与患者肿瘤组织石蜡切片进行HE染色后,光镜下观察肿瘤组织的结构特征。结果如图4,PDX移植肿瘤较好的保持了原发肿瘤的结构特征,二者具有较好的相似性。
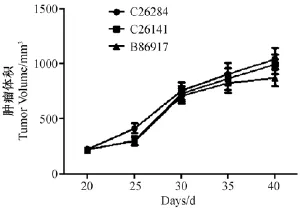
图2 人胃癌组织裸鼠皮下移植生长曲线Fig.2 The growth curves of human gastric cancer tissue transplanted subcutaneously into nudemice
2.5 PDX肿瘤组织免疫组织化学染色
PDX肿瘤组织的免疫组织化学结果见图5。3个PDX模型肿瘤组织中HIF1α和OATP1B3表达均呈强阳性,HIF1α主要表达在肿瘤细胞核内,而OATP1B3主要表达在胞质中。
3 讨论
PDX模型的移植效果除了受肿瘤自身特性影响外,移植部位、手术技巧、移植标本的分选、受体鼠的免疫缺陷状态、甚至移植小鼠的饲养管理等,都会影响到模型的成功率[6-7]。裸鼠皮下移植是建立PDX模型较常使用的方法,该方法简单易于观察,但移植成功率较低,只有约25%,特别是恶性程度较低、分期较早的肿瘤移植后不易生长。肾包膜由于血供丰富,组织相容性好等优点是较理想的移植部位,成功率甚至可达到70%以上。但该方法对移植者的技术要求较高,且成瘤后不易观察,往往失去连续传代的机会[8-10]。
NIRF染料是一类聚甲基菁染料的杂环化合物,它是由两端或中间的杂环、芳环与分子内部的多次甲基链组成的一个大π共轭体系,吸收及发射光谱均处于近红外区(700~1000 nm)之间;自发荧光低,但与体内大分子结合后由于荧光团的聚集展示出强的荧光;具有了良好的组织渗透性,激发的近红外光在生物组织中的穿透深度较大,可直接特异性识别肿瘤细胞,并成功应用于肿瘤活体成像研究[11、12]。
本研究将近红外荧光活体成像技术成功运用于人体肿瘤标本裸鼠肾包膜移植模型的早期筛查,获得了3个人体胃癌PDX移植模型。结果显示通过肾包膜移植辅助近红外荧光活体成像技术,在肿瘤移植6周后均能检测到较强的荧光信号,而常规皮下移植,需要观察2个月以上才能决定移植是否成功。5例标本有3例通过肾包膜移植成功,并能够皮下传至3代以上且冻存复苏后可以生长,移植成功率高于常规皮下移植。为了确保PDX移植肿瘤的异质性,移植肿瘤传代一般维持在5代之内[13、14]。
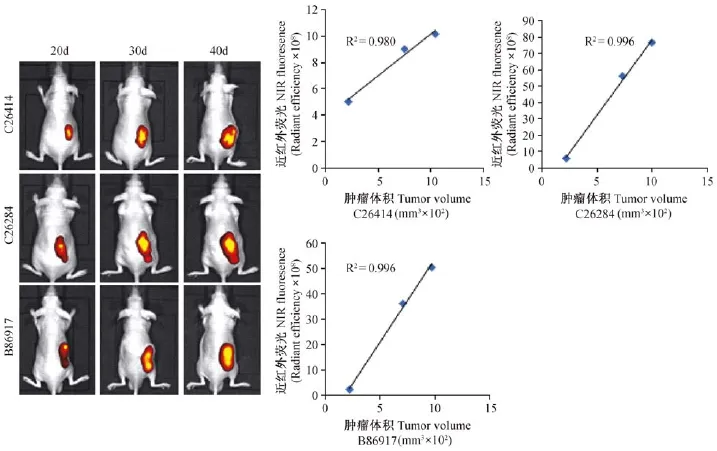
图3 肿瘤体积与近红外荧光强度的相关性Fig.3 The correlation of tumor size and near infrared fluorescence intensity

图4 PDX肿瘤组织与患者肿瘤组织HE染色Fig.4 Histology of PDX tumor tissues and human tumor tissues.HE staining.
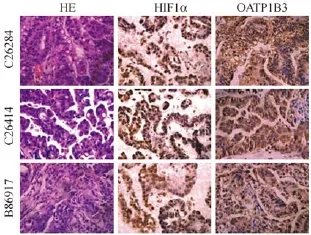
图5 PDX模型肿瘤组织HE染色与免疫组化结果Fig.5 Histology of the PDX tumor tissues.HE and immunohistochemical staining.
本研究使用的近红外荧光染料IR-783具有成像和靶分子的双重功能,不需要连接肿瘤特异性的分子即可识别肿瘤细胞,在肿瘤细胞线粒体中聚集,这可能与肿瘤细胞中HIF1α和OATP1B3的高表达密切相关[15、16]。应用近红外荧光活体成像技术,可早期识别深层组织的肿瘤细胞,完成肿瘤模型的早期诊断,提高PDX模型的移植成功率。通过对肿瘤部位荧光强度的连续测定,证实肿瘤大小与荧光强度密切相关,生长曲线符合肿瘤的增殖特性。病理学分析和免疫组织化学检测显示移植的PDX肿瘤组织较好的保持了原发肿瘤的组织结构特征,为胃癌的发病机制和药物筛选提供了接近临床特征的动物模型。
[1] Tentler JJ,Tan AC,Weekes CD,et al.Patient-derived tumour xenografts asmodels for oncology drug development[J].Nat Rev Clin Oncol,2012,9(6):338-350.
[2] 张振华,沈增丽,侯传玲,等.人源性前列腺癌动物模型的初步建立[J].实验动物与比较医学,2014,34(2):83-88.
[3] Burgenske DM,Monsma DJ,Dylewski D,etal.Establishment of genetically diverse patient-derived xenografts of colorectal cancer [J].Am JCancer Res,2014,4(6):824-837.
[4] Yuan J,Yi X,Yan F,et al.Near-infrared fluorescence imaging of prostate cancer using heptamethine carbocyanine dyes[J].Mol Med Rep,2015,11(2):821-828.
[5] Yang X,Shao C,Wang R,etal.Optical imaging of kidney cancer with novel near infrared heptamethine carbocyanine fluorescent dyes[J].JUrol,201,189(2):702-710.
[6] Dong X,Guan J,English JC,et al.Patient-derived first generation xenografts of non-small cell lung cancers:promising tools for predicting drug responses for personalized chemotherapy[J]. Clin Cancer Res,2010,16(5):1442-1451.
[7] Cho YB,Hong HK,Choi YL,et al.Colorectal cancer patientderived xenografted tumorsmaintain characteristic features of the original tumors[J].JSurg Res,2014,187(2):502-509.
[8] Jin K,Teng L,Shen Y,etal.Patient-derived human tumour tissue xenografts in immunodeficientmice:a systematic review[J]. Clin Transl Oncol,2010,12(7):473-480.
[9] Lee CH,Xue H,Sutcliffe M,et al.Establishment of subrenal capsule xenografts of primary human ovarian tumors in SCID mice:potentialmodels[J].Gynecol Oncol,2005,96(1):48-55.
[10] 欧阳可栋,刘继斌,王科,等.人源性食管癌移植瘤模型的建立、评价及其应用的初步研究[J].实验动物与比较医学,2013,33(2):90-98.
[11] Yi X,Wang F,QinW,et al.Near-infrared fluorescent probes in cancer imaging and therapy:an emerging field[J].Int J Nanomed,2014,9:1347-1365.
[12] Stoffels I,Dissemond J,Pöppel T,et al.Intraoperative fluorescence imaging for sentinel lymph node detection:prospective clinical trial to compare the usefulness of indocyanine green vs technetium tc 99m for identification of sentinel lymph nodes[J]. JAMA Surg,2015,150(7):617-623.
[13] Jung J.Human tumor xenograftmodels for preclinical assessment of anticancer drug development[J].Toxicol Res,2014,30(1):1 -5.
[14] Ilie M,Nunes M,Blot L,et al.Setting up a wide panel of patient-derived tumor xenografts of non-small cell lung cancer by improving the preanalytical steps[J].Cancer Med,2015,4(2): 201-211.
[15] Wu JB,Shao C,Li X,et al.Near-infrared fluorescence imaging of cancermediated by tumor hypoxia and HIF1α/OATPs signaling axis[J].Biomaterials,2014,35(28):8175-8185.
Application of near infrared fluorescent dje in the studj of patient-derived gastric cancer xenograft nudemousemodels
ZHAO Ning-ning1,2,ZHANG Cai-qin2,ZHAO Yong2,YANG Li1,2,ZHANG Hai2,LIU Yi-lun1,SHIChang-hong1,2
(1.Chengdu Medical College,Chengdu 610500,China;2.Laboratory Animal Center of the Fourth Military Medical University,Xi’an 710032)
ObjectiveTo establish a patient-derived gastric cancer xenograft(PDX)model in nudemice and to investigate the application of near infrared fluorescent(NIRF)dye IR-783 in in vivo imaging of gastric cancer xenograftmodels.M ethodsFresh human gastric cancer tissuewas taken and transplanted into the subrenal capsule of nudemice to establish the xenograftmodel.When the transplanted tumors grew,took part of the tumor tissue to do HE staining and compare the structural characteristicswith the primary tumor.Another portion of the tumorwas xenografted into nudemice subcutaneously.Twenty days later,the tumor-bearingmice were injected intraperitoneally with IR-783 dye(10μM)in a dose of 100 mg/20 g.The intensity of the tumor image wasmonitored by optical NIRF imaging.The correction between tumor volume and fluorescence intensitywas analyzed.Finally,the expression of OATP1B3 and HIF1αin the xenografted tumor tissuewas detected by immunohistochemistry.ResultsWe successfully established three patient-derived xenograft(PDH)models of human gastric cancer.The transplanted tumor tissues maintained the histological characteristics of the primary tumor well.NIRF signal can be detec ted in subrenal capsule of the xenografted nudemice.The correlation between tumor size and fluorescence intensity in the PDX models reached higher than 98%.Strong positive expressions of HIF1αandOATP1B3 in the tumor tissues were detected.ConclusionsNIRF dye IR-783 can be specifically accumulated at the tumor site,therefore,can be used to detect PDX in vivo early.The tumor targeting propertymay be related to the expression of OATP1B3 and HIF1α.
Patient-derived tumor xenograft(PDX)model;IR-783;HIF1α;OATP1B3;Nudemice
Q95-33
A
1005-4847(2015)06-0643-05
10.3969/j.issn.1005-4847.2015.06.019
2015-07-16
军队实验动物专项课题资助(SYDW2014-002);国家自然科学基金项目(31572340)。
赵宁宁(1985-),女,硕士生,主管护师,主要研究方向:人体肿瘤模型的分子影像。E-mail:289147229@qq.com。
师长宏(1973-),男,博士生导师,教授,主要研究方向:人类疾病动物模型。E-mail:changhong@fmmu.edu.cn。

