小鼠脐带间充质干细胞的体外诱导分化
朱慧,叶莉,何洁,余璞,2,王金祥,王强,赵晶,庞荣清*,白杰英
(1.成都军区昆明总医院云南省干细胞工程实验室,昆明 650032;2.昆明医科大学昆明总医院临床学院,昆明 650032;3.军事医学科学院实验动物中心,北京 100071)
研究报告
小鼠脐带间充质干细胞的体外诱导分化
朱慧1,2Δ,叶莉3Δ,何洁1,余璞1,2,王金祥1,王强1,赵晶1,庞荣清1*,白杰英3*
(1.成都军区昆明总医院云南省干细胞工程实验室,昆明 650032;2.昆明医科大学昆明总医院临床学院,昆明 650032;3.军事医学科学院实验动物中心,北京 100071)
目的分离扩增小鼠脐带间充质干细胞(mouse umbilical cord mesenchymal stem cells,mUCMSCs)探讨其是否可诱导成软骨、脂肪和成骨细胞。方法通过贴壁培养法将mUCMSCs体外分离、扩增、纯化,倒置显微镜下观察细胞的形态特征,运用流式细胞仪检测分析细胞的抗原标志表达进行鉴定。运用诱导培养液对分离的mUCMSCs分别定向诱导培养为软骨、脂肪和成骨细胞。结果运用组织贴块培养法可从新鲜脐带中分离到贴壁生长的成纤维样细胞,这些细胞高表达CD29、CD90和CD105,低表达CD34。成软骨诱导后阿新兰染色呈蓝色;成脂诱导后油红O染色,出现红色脂滴;茜红素染色成骨诱导的mUCMSC,可见红色结节。结论贴壁培养法分离培养所获得的mUCMSCs在体外可诱导分化为软骨、脂肪和成骨细胞。
小鼠;脐带间充质干细胞;细胞培养;成软骨诱导;成脂诱导;成骨诱导
随着干细胞生物学研究不断发展,分离间充质干细胞用于干细胞治疗疾病动物模型和干细胞自身或诱导为体外细胞模型成为生物疗法、新药研发等应用领域的两个重要发展方向。小鼠是常用的实验动物,分离小鼠间充质干细胞是开展干细胞诱导分化、干细胞治疗实验、干细胞模型研究的前提条件,是拓展小鼠作为实验动物在医学研究中广泛应用的有效手段。间充质干细胞最早从骨髓[1]分离获取,目前较受研究者关注,但骨髓来源的间充质干细胞活性容易受到供体年龄的限制[2],而且骨髓采集数量有限。小鼠骨髓分离间充质干细胞更是如此,一方面其体型小,骨髓数量非常有限,另一方面从小鼠骨髓扩增出间充质干细胞本身就存在一系列困难[3]。我们前期研究发现脐带是间充质干细胞的一个重要来源,本实验首次分离鉴定了小鼠脐带间充质干细胞(mouse umbilical cord mesenchymal stem cells,mUCMSC)并开展了体外诱导分化实验,丰富了小鼠间充质干细胞的来源,为以小鼠作为实验动物开展再生医学和干细胞药物筛选研究提供了技术方法和重要的实验材料。
1 材料与方法
1.1 实验动物
清洁级C57BL/6雌性小鼠,每次取材1~2只,8周龄,怀孕14~15 d,体重25~27 g,由昆明医科大学实验动物中心提供【SCXK(滇)2013-0001】,饲养并取材于昆明总医院动物实验中心【SYXK(滇)2014-0010】。实验过程中对动物的处置符合中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》,按3R原则给予人道关怀。
1.2 主要试剂和仪器
DMEM/F12培养液、胎牛血清和trypsin-EDTA均购自Invitrogen公司;青-链霉素溶液购自Biological Industries。细胞增值分析溶液(CellTiter 96® A-queous One Solution Reagent Cell Proliferation Assay)购自Promega公司;FITC标记的抗小鼠流式单抗CD29、CD34和PE标记的CD105均购自eBioscience公司,APC标记的CD90购自R&D公司。仪器主要有二氧化碳培养箱(Healforce)、显微镜(Nikon)、酶标仪(Rayto)和流式细胞仪(BD)。
1.3 实验方法
1.3.1 mUCMSCs的分离与培养
取怀孕16~17 d的C57BL/6小鼠,采用脱颈处死法处死,将串珠状子宫浸泡于1%双抗液中带入细胞室超净工作台,无菌采集脐带一根或数根混合一起,生理盐水清洗两遍后,置于1.5 mL离心管,用剪刀剪碎成糊状,加入含10%FBS的DMEM/F12培养液(500μL)悬浮组织和细胞,转移至底面积为25 cm2的培养瓶后放入37℃、5%CO2培养箱中静置培养,注意尽量使组织碎片和细胞均匀铺于瓶底。显微镜下观察细胞生长特性及形态特征,培养24 h后可见贴壁细胞,补足全量培养液,72 h全量换液。以后每2~4 d换液,待细胞生长至90%以上融合状态时,用0.25%的trypsin-EDTA消化传代。
1.3.2 mUCMSCs的生长曲线
消化收集第4代细胞,计数后用10%FBS培养液调整细胞浓度为2×104个/mL,取100μL/孔接种于96孔培养板除四周边缘之外的孔,每孔设置9个复孔。第3天和第7天全部细胞换液。接种后24 h开始,每天同一时间点取一组复孔换液后加入细胞增殖分析液200μL,加液后3 h用酶标仪测490 nm处吸光度值,连续测试8 d之内细胞增殖情况。取各时间点吸光度的平均值,以时间为横坐标、吸光度值为纵坐标,绘制细胞生长曲线。
1.3.3 回顾性队列研究的方法和内容 (1)自基线调查以来心脑血管疾病事件的发生情况:采取从医保中心获取数据的方法,回顾性地对队列人群进行调查,收集10年观察期内研究对象发生心脑血管疾病事件的相关资料,包括发生的时间、地点、就诊医院、诊断、治疗和医疗费等信息。(2)随访结局定义:定义为发生结局事件,结局事件包括冠心病事件及脑卒中事件。
1.3.3 mUCMSCs表面标志测定
消化收集第4代细胞,调整细胞浓度至5×105个/mL,取1 mL细胞分别加入单克隆抗体CD29-FITC、CD34-FITC、CD90-APC、CD105-PE充分混匀,避光室温孵育30 min,加入PBS离心(1500 r/min,4 min)漂洗弃除未结合抗体后,流式细胞仪检测细胞表面抗原标志的表达。
1.3.4 mUCMSCs成软骨诱导分化
收集第4代mUCMSCs并调整细胞悬液为1.6 ×107个/mL,每孔加5μL到12孔板的中心,形成一个细胞滴,2 h后再缓慢加入成软骨诱导分化培养液,2~3 d换液一次。连续培养14 d后,4%多聚甲醛固定后石蜡包埋作病理切片,脱蜡后加入阿新蓝染色。
1.3.5 mUCMSCs向脂肪细胞诱导分化
消化收集第4代mUCMSCs以4×104个/孔接种细胞于12孔板中培养6 h后,更换培养液为间充质干细胞成脂诱导分化培养基A液,3 d后吸走A液,加入B液,24 h后换回A液,A、B两液交替左右4次,继续用B液培养,连续培养至第14天,4%多聚甲醛固定后加入油红O染色。
1.3.6 mUCMSCs成骨细胞诱导分化
消化收集第4代mUCMSCs以4×104个/孔接种细胞于12孔板中培养6 h后,更换培养液为成骨诱导分化培养液,3~4 d换液1次,培养21 d后,固定并加入茜素红染色。
2 结果
原代细胞:从1只健康临产的C57BL/6小鼠,一次可获得约1 cm长的脐带约10根,剪碎后贴壁法静置培养24 h以后,即可在倒置显微镜下观察到少许梭形贴壁细胞由组织块边缘或以散在的方式长出(见图1A),48 h后贴壁细胞增多(见图1B),72 h后可见少数细胞集落形成(见图1C),第7~10天可见细胞生长至80%融合状态。
传代细胞:原代细胞培养至第10天左右可第一次传代,之后每3~5 d传代1次,传代后细胞生长较快,镜下可见这些细胞形态较为均一,呈梭形如成纤维细胞样,密集排列呈现漩涡状生长(见图1D)。传代时消化接种后30 min即有细胞贴壁,此时细胞仍为圆形,1.5 h可见较多细胞贴壁且已变为梭形,3 h左右贴壁细胞达70%以上。
单独将一根脐带剪碎后用上述方法培养,也可分离到贴壁生长的成纤维细胞样细胞,只是不太容易分离成功,常见到原代细胞较少或死亡,且生长速度较慢,但细胞数量较多后细胞增殖速度明显加快,传代后生长速度较快。
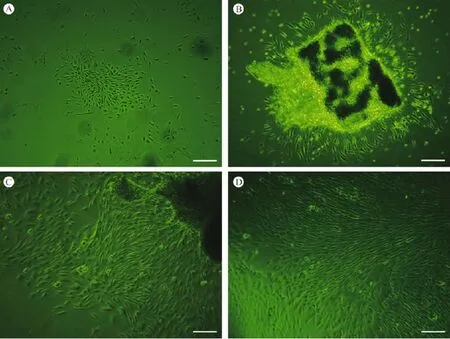
图1 C57BL/6UCMSC在光镜下的形态特征Fig.1 Morphological characteristics of themUCMSC
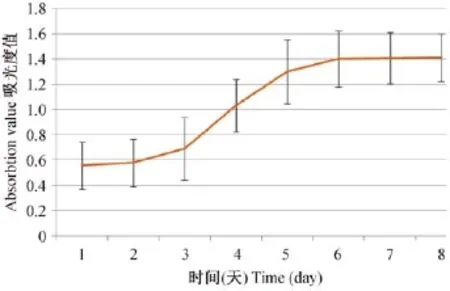
图2 P4 mUCMSC的生长曲线Fig.2 The growth curve of P4 mUCMSC
2.2 m UCMSCs生长曲线
mUCMSCs传代后,经过6~8 d的增殖生长,完成一个细胞传代周期,但细胞传代后不是匀速生长,表现出明显的阶段性,第1~2天细胞增殖缓慢,从第3天开始快速增殖生长,至第5天达到顶点,以后进入相对稳定状态,体现了细胞潜伏期、快速增殖期和平稳期三个典型的细胞增殖生长阶段。
2.3 抗原标志测定
收集生长良好的第4代mUCMSC,加入CD29、CD34、CD90、CD105流式单抗孵育后上机检测,细胞流式抗原标志结果显示:CD34低表达,而CD29、CD90、CD105高表达(见图3),即表达了间充质干细胞的常见抗原标志,低表达造血干细胞常见抗原标志。
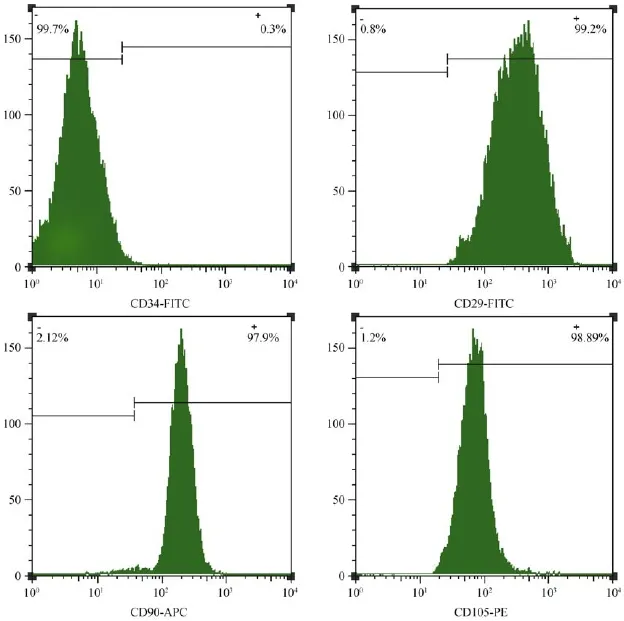
图3 mUCMSC的免疫表型分析Fig.3 Immunophenotype analysis of the cUCMSC
2.4 成软骨诱导分化
第4代mUCMSCs经成软骨分化诱导培养,不断培养细胞会形成一个细胞团漂浮起来,14 d后,对软骨球固定并行石蜡包埋切片,阿新兰染色后可在光镜下观察到部分组织呈蓝色(见图4A)。
2.5 成脂诱导分化
第4代mUCMSCs成脂分化诱导培养6 d左右,镜下可观察到大量脂滴的出现,A、B液交替后,用B液继续培养细胞内脂滴逐渐变大变圆,14 d后行油红O染色,镜下可见脂滴被染成橙红色(见图4B)。
2.6 成骨诱导分化
第4代mUCMSCs成骨分化诱导培养21 d后,可观察到白色结节,行茜素红染色后,可观察到钙质结节被染成红色(见图4C)。
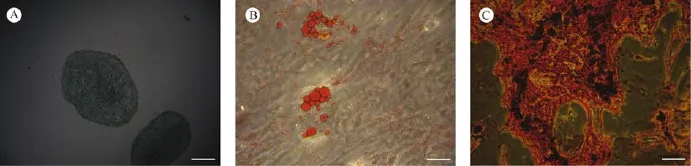
图4 mUCMSC的体外诱导分化Fig.4 Results of induction culture in vitro for differentiation of themUCMSC
3 讨论
本研究结果表明:1次可以从1只C57BL/6小鼠获得约10根脐带,剪碎后在10%FBS的DMEM/ F12培养条件下可以分离到大量贴壁,呈漩涡状生长的成纤维细胞样细胞,细胞生长呈现潜伏期、快速增殖期和平稳期3个典型的生长阶段。流式分析结果显示这些细胞高表达CD29、CD90、CD105,低表达CD34,在体外诱导分化条件下培养一定时间后可以分别分化为阿新兰染色阳性的软骨细胞、油红O染色阳性的脂肪细胞以及茜素红染色阳性的骨细胞,这些结果与李建国[3]、Song等[4]报道的骨髓来源间充质干细胞类似。根据间充质干细胞的鉴定标准[5],可以判定这些细胞就是mUCMSC。实验中我们还发现:采集1根小鼠脐带,也可分离到mUCMSC,但成功率较低,而将1只孕鼠所有脐带混合并剪碎后再直接贴壁培养,可以很容易扩增获得大量mUCMSC。这应该与细胞密度的影响有关,细胞数量越多,细胞自分泌的生长因子越多,越有利于细胞增殖生长。细胞生长曲线显示:第4代mUCMSC经过6~8 d即完成一个扩增周期,从第3天开始加速生长,至第5天进入饱和稳定状态,3 d时间内细胞得到快速扩增,比骨髓来源间充质干细胞生长周期要快[6],表明mUCMSC增殖活性较好。
脐带由两条动脉、一条静脉和大量沃顿胶(Wharton jelly)组成,后者被认为是间充质干细胞的主要来源。因此,从脐带分离间充质干细胞通常要剔除血管和外膜[7]。C57BL/6小鼠脐带长约1 cm,非常柔软娇嫩,几乎不太可能剔除血管和外膜组织。本研究建立的方法可以从C57BL/6小鼠、人[8]、食蟹猴[9]脐带中轻易分离到 CD29、CD90和CD105阳性率高于95%的间充质干细胞,表明血管和外膜组织的存在不影响间充质干细胞的分离,通过传代培养可以达到纯化间充质干细胞的目的。1只临产的C57BL/6母鼠可以提供约10根脐带(约0.3 cm3的组织块),有效解决了组织来源困难的问题,而且,脐带含有阳性表达Oct-4、Nanog等标志的多潜能干细胞[10],它们具有比成体组织来源干细胞更强的增殖活性和分化潜能[11]。可见,从小鼠脐带中分离扩增间充质干细胞,效率更高,品质更好。
本实验建立的分离培养方法,容易规模化生产,可以建立mUCMSC库,专供以小鼠为背景的科技工作者开展相关研究。主要包括:(1)作为种子细胞开展干细胞治疗实验。比如以C57BL/6小鼠构建的mdx小鼠是肌营养不良研究的常用模型[12],开展mUCMSC治疗mdx小鼠实验可以探索临床治疗肌营养不良病人的技术方法。(2)作为细胞模型开展药理或毒理实验。以细胞模型开展药物安全及药物筛选试验是现代生物医学研究常用的实验手段,由于干细胞具有多向分化潜能等独特的生物学特性[13],使用 mUCMSC与药物共培养实验代替C57BL/6小鼠体内实验,可以直接在细胞水平进行药物筛选、毒理机制研究[14,15],具有高效率、低成本、高敏感性等特点。(3)分化机制研究。机体组织器官功能的形成是干细胞分化演变的结果,干细胞分化是干细胞治疗的理论基础。分化机制研究是寻找疾病治疗靶点的重要手段,比如,本实验已经证明3-异丁基-1-甲基黄嘌呤、地塞米松、胰岛素和吲哚美辛等成分与mUCMSC共培养一定时间即可将其诱导为软骨细胞,如果进一步深入研究这些成分对mUCMSC的影响,就可能发现这些制剂用于软骨相关疾病治疗的作用机制和发病机制。因此,本实验研究结果具有一定的理论意义和潜在的使用价值。
[1] Friedenstein AJ,Piatetzky-Shapiro II,Petrakova KV.Osteogenesis in transplants of bonemarrow cells[J].JEmbryol Exp Morphol,1966,16(3):381-390.
[2] Mundra V,Gerling IC,Mahato RI.Mesenchymal stem cellbased therapy[J].Mol Pharmaceut,2013,10(1):77-89.
[3] 李建国,孙永勋,冉丕鑫,等.小鼠骨髓间充质干细胞的分离、培养及鉴定[J].中国比较医学杂志,2008,18(12):28 -31.
[4] Xu S,De Becker A,Van Camp B,et al.An improved harvest and in vitro expansion protocol for murine bone marrow-derived mesenchymal stem cells[J].J Biomed Biotechnol,2010,(2010):1-10.
[5] DominiciM,Le Blanc K,Mueller I,et al.Minimal criteria for definingmultipotentmesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[6] Vidal MA,Walker NJ,Napoli E,et al.Evaluation of senescence inmesenchymal stem cells isolated from equine bonemarrow,adipose tissue,and umbilical cord tissue[J].Stem Cells Dev,2012,21(2):273-283.
[7] Watson N,Divers R,Kedar R,etal.Discarded Wharton jelly of the human umbilical cord:a viable source formesenchymal stromal cells[J].Cytotherapy,2015,17:18-24.
[8] 庞荣清,何洁,李福兵,等.一种简单的人脐带间充质干细胞分离培养方法[J].中华细胞与干细胞杂志,2011,1(2): 162-167.
[9] 庞荣清,何洁,李瑞生,等.食蟹猴脐带间充质干细胞的分离与鉴定[J].中国比较医学杂志,2015,25(4):66-69.
[10] Fong CY,Chak LL,Biswas A,et al.Human Wharton’s jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells[J]. Stem Cell Rev,2011,7(1):1-16.
[11] Bhartiya D,Shaikh A,Nagvenkar P,etal.Very small embryonic-like stem cellswith maximum regenerative potential get discarded during cord blood banking and bonemarrow processing for autologous stem cell therapy[J].Stem Cells Dev,2012,21(1):1 -6.
[12] Lu A,Poddar M,Tang Y,et al.Rapid depletion ofmuscle progenitor cells in dystrophicmdx/utrophin-/-mice[J].Hum Mol Genet,2014,23(18):4786-4800.
[13] Borhani-Haghighi M,Talaei-Khozani T,Ayatollahi M,et al. Wharton’s Jelly-derived mesenchymal stem cells can differentiate into hepatocyte-like cells by HepG2 cell line extract[J].Iran J Med Sci,2015,40(2):143-151.
[14] 贾源君,裴轶劲.干细胞在发育毒性体外模型建立中的应用研究进展[J].中国医药导报,2015,(2):152-155.
[15] 刘楠梅,梅长林,张金元,等.过表达CXCR4的骨髓间充质干细胞对共培养低氧/复氧肾小管上皮细胞的修复作用[J].中华肾脏病杂志,2013,11(29):830-836.
Isolation and differentiation in vitro ofmouse umbilical cord mesenchjmal stem cells
ZHU Hui1,2,YE Li3,HE Jie1,YU Pu1,2,WANG Jin-xiang1,WANG Qiang1,ZHAO Jing1,PANG Rong-qing1*,BAIJie-ying3*
(1.Key Laboratory of Stem Cells and Regenerative Medicine,PLA Kunming General Hospital of Chengdu Military Region,Kunming 650032,China;2.Kunming Medical University Clinical College in Kunming General Hospital Kunming 650032;3.Laboratory Animal Center of the Academy of Military Medical Sciences,Beijing 100071)
ObjectiveTo isolate,culture and identifymouse umbilical cord mesenchymal stem cells(mUCMSCs) and to study whether they can be induced to differentiate into adipocytes,chondrocytes and osteoblasts.M ethodsThe mUCMSCswere isolated and expanded by adherent culture from freshmouse umbilical cord.Themorphological characteristics of the resulting cellswere observed under inverted phase contrastmicroscope,and their expression ofmesenchymal surfacemarkers was identified and analyzed by flow cytometry.Then mUCMSCs were induced to differentiate into chondrocytes,adipocytes and osteoblasts in vitro.ResultsFibroblast-like cells could be isolated from the fresh umbilical cord by adherent culture.These adherent cells highly expressed mesenchymalmarkers including CD29,CD90 and CD105 while low expression of CD34.The cells were successfully induced to differentiate into chondrocytes,adipocytes and osteoblasts.ConclusionsThemUCMSCs isolated from freshmouse umbilical cord by adherent culture have potential of differentiation into chondrocytes,adipocytes and osteoblasts.
Mouse;Umbilical cord mesenchymal stem cells;Cell culture;Chondrocytes induction;Adipocytes induction;Osteoblast induction
Q95-33
A
1005-4847(2015)06-0622-06
10.3969/j.issn.1005-4847.2015.06.015
2015-06-02
云南省基金项目(2011HB050,2013DA004);十二五重大项目(2011ZXJ09201-031);国家自然科学基金(31272385);北京市自然科学基金(5152023)。
朱慧(1982-),女,硕士研究生,研究方向为干细胞工程,E-mail:839589513@qq.com;叶莉(1988-)女,实习研究员.研究方向为人兽共患病疾病模型,E-mail:18066045532@163.com。Δ为本研究的共同第一作者。
庞荣清(1971-),男,副主任医师/副教授,硕士研究生导师,研究方向为干细胞与再生医学,E-mail:pangrq2000@aliyun.com;
白杰英(1977-)男,副研究员,研究方向为人兽共患感染性疾病致病机理,E-mail:baijieying@126.com.

