大鼠椎间盘髓核细胞体外凋亡模型的建立
王厚磊,卢伟,李德芳,丁磊,吴靖平
(复旦大学附属金山医院骨科,上海 201508)
研究报告
大鼠椎间盘髓核细胞体外凋亡模型的建立
王厚磊,卢伟,李德芳,丁磊,吴靖平*
(复旦大学附属金山医院骨科,上海 201508)
目的建立大鼠椎间盘髓核细胞体外凋亡模型。方法为了充分模拟退变椎间盘内营养缺乏的微环境,本实验分别采用含1%,3%,5%,8%,10%胎牛血清的DMEM培养基培养椎间盘髓核细胞,筛选最佳促凋亡浓度,分别检测髓核细胞凋亡率、凋亡相关蛋白Bax、bcl-2、caspase-3酶的表达、细胞增殖曲线及免疫荧光分析。结果流式细胞仪测得髓核细胞凋亡率随着胎牛血清(FBS)浓度降低而升高,3%FBS为最有效诱导凋亡浓度;Western blot示Bax、caspase-3酶表达在3%FBS组明显高于10%FBS组,同时bcl-2表达下降;CCK-8检测结果显示含3%FBS的培养基内,随着凋亡率的增长,髓核细胞增殖的速率越来越慢;免疫荧光分析3%FBS组FAS表达量明显比10%FBS组增高。结论3%FBS能诱导髓核细胞发生凋亡,最终会导致细胞功能丧失,caspase家族参与并执行了这一过程。
椎间盘退变;髓核细胞;凋亡;营养夺获;大鼠
椎间盘退变(intervertebral disc degeneration,IVDD)是椎间盘退变性疾病发生的前提条件和病理基础,是中老年人的常见病和多发病。IVDD是引起中老年腰背痛的主要原因之一[1]。椎间盘退变的主要病理变化为髓核细胞变性、坏死,髓核细胞外基质分泌减少,逐步引起椎间盘基质蛋白多聚糖和水分的丢失,进一步导致胶原构成改变[2]。而有研究称髓核细胞所产生的II型胶原、蛋白多聚糖和其他细胞外基质成分对维持椎间盘的完整性具有重要作用[3,4]。髓核组织异常是引起椎间盘退变的主要因素,髓核组织过早出现纤维化,逐渐引起纤维环裂缝,从而加速椎间盘退变[5]。目前,椎间盘退变的确切发病机制及病理变化过程仍不明确[6]。构建理想的体外椎间盘细胞退变模型对研究椎间盘退变的发生机制,减缓或逆转其发病过程具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
DMEM高糖型培养基、胎牛血清、胰蛋白酶(Gibco公司,美国);Hoechst 33258、二甲基亚砜DMSO(Sigma公司,美国);annexin V-FITC/PI双染试剂盒(BD,美国);caspase-3、bcl-2、Bax抗体、二抗(CST公司,美国);蛋白上样缓冲液、BCA试剂盒、SDS-PAGE凝胶配制试剂盒(碧云天公司,中国);培养瓶、培养板(Corning公司,美国);发光液(Millipore公司);CO2细胞培养箱超净工作台(上海力申科学仪器有限公司,中国);倒置相差显微镜(Olympus公司,日本);流式细胞仪(BD公司,德国)。
1.1.2 实验动物
清洁级SD大鼠10只,10周龄,雌雄各半,体重150~200 g,来源于上海市公共卫生临床中心【SCXK(沪)2010-0024】,无菌手术在上海市公共卫生临床中心实验动物科学部屏障动物实验设施进行【SYXK(沪)2010-0098】,并按实验动物使用的3R原则给予人道关怀。
1.2 方法
1.2.1 SD大鼠椎间盘髓核细胞的分离与培养
10周龄SD大鼠,雌雄各半,水合氯醛腹腔麻醉后颈椎脱臼法处死,常规消毒,无菌条件下取下整个腰椎,解剖显微镜下剥离椎间盘周围筋膜和肌肉并显露椎间盘,将脊柱标本用预先准备的无菌PBS液清洗2次,用尖刀片轻轻刮除椎间盘上层软骨终板,显露软骨终板之间的胶冻样组织,细针轻轻挑出并放入盛有培养基的培养皿中,剪碎为0.5 mm3左右组织块,1000 r/min,5 min离心,离心后用PBS液冲洗3次,采用序贯消化法获取髓核细胞,以约2×104的密度接种于培养瓶中,将培养瓶置于含5%CO2、37℃的细胞培养箱中培养,进行换液、传代、铺板,随机进入各实验分组。
1.2.2 建立低胎牛血清椎间盘髓核细胞凋亡模型
按照本课题组预实验方法建立髓核细胞凋亡模型。传代细胞随机进入各实验分组,分为5组:1%胎牛血清(FBS)组、3%FBS组、5%FBS组、8%FBS组、10%FBS组,检测各组的凋亡率,再进一步行分子生物学检测。
1.2.3 流式细胞仪检测软骨终板细胞凋亡
采用annexin V-FITC联合PI法进行检测样本。结果判断:联合应用annexinV-FITC和PI对培养体系中的细胞进行染色,annexinV(-)/PI(-)代表健康活细胞,annexin V(+)/PI(-)代表早期凋亡细胞,annexin V(+)/PI(+)代表晚期凋亡细胞和坏死细胞。在不同浓度血清下培养48 h后,收集各孔培养基的上清液(其中包含漂浮细胞),贴壁细胞用不含EDTA的胰酶消化收集,二者混合后进行离心弃上清,孵育annexin V-FITC与PI染色剂,上机进行凋亡率检测,本实验中凋亡细胞包括早期和晚期凋亡细胞,实验独立重复三次。
1.2.4 Western blot检测caspase-3、Bax、bcl-2表达
流式筛选凋亡率最高的组别作为实验组,完全培养基10%FBS组作为对照组,传代培养48 h后,去除各孔培养基,用预冷PBS液清洗一次,洗净PBS后每孔加入RIPA裂解液80μL冰上裂解30min,混匀,收集裂解液4℃下14 000 r/min离心20 min取上清液,并测定蛋白浓度,取50μg蛋白与上样缓冲液混合煮沸8 min,电泳、转膜、封闭,4℃时孵育一抗caspase-3(1∶1000)、Bax(1∶5000)、bcl-2、(1∶2000)稀释液,孵育二抗,曝光,以β-actin作为内参。
1.2.5 细胞增殖的检测
收集处于对数增长期的髓核细胞,以4×103/孔接种于96孔板。每组3个复孔。培养于37℃、5%CO2的培养箱内,分别在第0、12、24、48 h检测细胞活性。按照CCK-8试剂盒说明书操作步骤,每孔中加入10μL CCK-8试剂,混匀后于孵箱中孵育2 h,然后在酶标仪中测定450 nm波长的光吸收值。以上实验重复三次。
1.2.6 免疫荧光检测
细胞接种在培养皿中,每孔接种1×105个细胞,24 h后弃去培养基,PBS清洗、4%多聚甲醛固定、0.2%Triton X-100对细胞透化处理、1%FBS浓度PBS封闭,一抗稀释液室温孵育1 h,二抗稀释液避光孵育1 h,Hoechst33258染核,在荧光显微镜下进行观察。
1.2.7 统计学分析
采用SPSS 20.0软件进行统计分析,所有的实验独立重复三次,数据分布以均数±标准差(±s)表示,进行成对样本的独立t检验,P<0.05为差异有统计学意义。
2 结果
2.1 髓核细胞凋亡率
流式细胞仪结果显示:1%FBS组凋亡率(10.62 ±1.33)%,3%FBS组平均凋亡率(35.84± 1.05)%,5%FBS组凋亡率(20.15±0.75)%,8% FBS组凋亡率为(10.99±1.63)%,10%FBS组凋亡率(1.05±0.96)%,与其四组比较,3%FBS组凋亡率明显增高,差异有显著性(P<0.05)(图1)。
2.2 凋亡相关蛋白检测
以3%FBS组与10%FBS组分别作为实验组和对照组,Westernblot对凋亡相关蛋白的检测显示,βactin作为内参,与对照组相比,实验组促凋亡蛋白Bax、caspase-3表达均较高,而抗凋亡蛋白bcl-2表达降低。3%FBS组细胞凋亡,灰度差异有显著性(P<0.05),实验达到预期效果(图2)。
2.3 细胞增殖检测
CCK-8检测结果显示:与10%对照组细胞相比,随着培养时间的增加,3%FBS组细胞活性逐渐降低,说明细胞在含3%FBS的培养基内,随着凋亡率的增长,细胞活性越来越低(图3)。
2.4 免疫荧光检测
FAS在细胞内分布的荧光染色:FAS在细胞中平均分布的定量分析显示,3%FBS组显色强度比10%FBS组的增强(图4)。FAS是细胞表面重要的死亡受体,与其配体结合后活化并传导凋亡信号,表明3%FBS组可能通过死亡受体途径凋亡。
3 讨论
椎间盘退行性疾病是临床上常见病之一,其发病机制至今仍未阐明,被认为是多因素共同作用而导致。目前仍未找到有效的治疗途径缓解椎间盘退变。因此,从细胞分子水平研究其机制,从而找到有效治疗途径成为研究的焦点之一。本课题组着重研究建立可靠模型模拟椎间盘退变时细胞分子学改变,探究其明确发病机制。
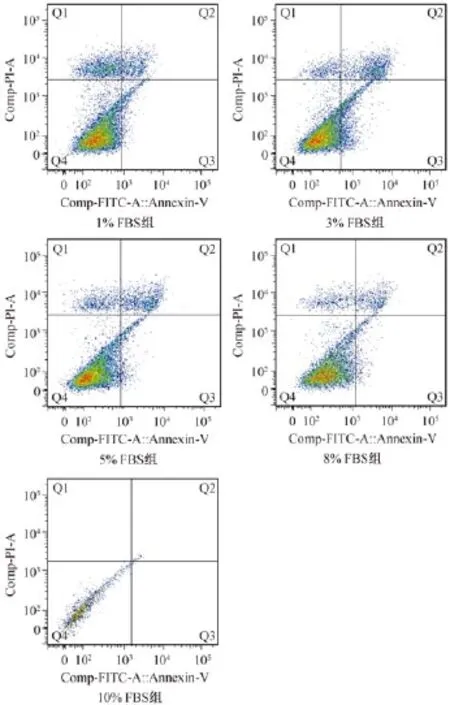
图1 流式细胞仪检测髓核细胞凋亡率Fig.1 Apoptosis rates of the nucleus pulposus cells detected by flow cytometry
构建椎间盘退变细胞模型的方法有很多,比较常见的有化学诱导法和物理诱导法。国外学者研究证实[7]过量的激光照射传代培养的细胞系,会引起DNA碱基突变,导致核酸遗传物质改变,最终导致细胞凋亡。国内研究也发现[8],随着不同剂量梯度紫外线的照射,细胞中凋亡相关蛋白的表达会不断增加;化学试剂诱导法是在细胞培养体系中加入特定化学试剂,常见的有硝普钠(SNAP)[9]、白细胞介素-1β(IL-1β)[10]、过氧化氢(H2O2)[11]、抗 FAS抗体[12]等,这些构建椎间盘细胞凋亡模型都能用于研究椎间盘退变时的细胞分子学改变,但按照上述方法建模时,不仅对细胞本身造成了直接损伤,同时改变了细胞生存的微环境,不能充分模拟椎间盘内部低营养代谢状态。本课题组先前已用此实验方法建模[13],并取得良好效果。此方法不仅能够充分模拟椎间盘退变时内环境变化对细胞造成的影响,而且此方法重复性高,经济成本低。
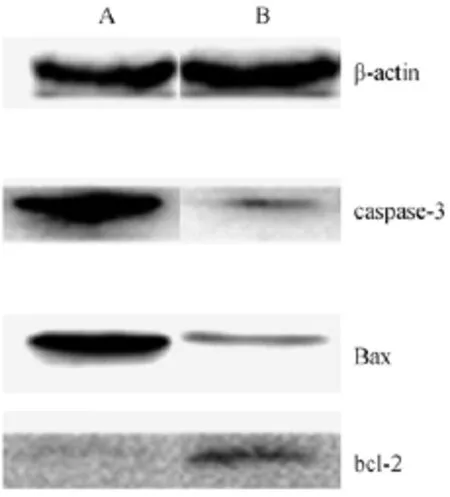
图2 各组的caspase-3、Bax、bcl-2表达变化Fig.2 Changes of the expression of caspase-3,Bax,bcl-2 in each group
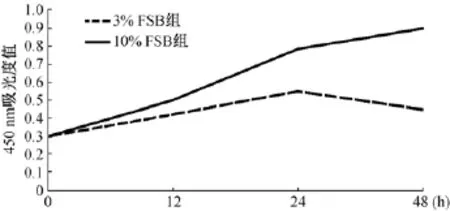
图3 髓核细胞增殖检测Fig.3 Test of the nucleus pulposus cell proliferation
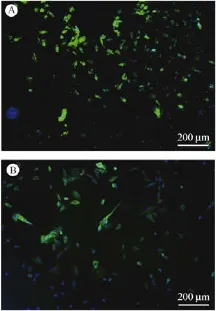
图4 大鼠髓核细胞荧光染色图(×10)Fig.4 Fluorescence staining of the rat nucleus pulposus cells(×10)
随着实验研究的深入,目前已发现[14,15],椎间盘退变是在多种复杂因素共同作用下,引起髓核细胞过度凋亡,使蛋白多聚糖、水分等合成不足,最终导致椎间盘退行性改变,并且退变椎间盘内髓核细胞凋亡率是正常状态的2~3倍。髓核细胞作为椎间盘的重要组成部分,主要维持椎间盘的正常结构及功能,过度凋亡的髓核细胞会破坏椎间盘的稳定,使其发生退变,可见髓核细胞凋亡是椎间盘退变的重要因素[16-18]。
近来,国外研究证实[19]营养物质缺乏是导致椎间盘退变的直接因素,也是导致IVDD的最重要因素。椎间盘作为体内的无血管组织,其营养供应途径主要如下[20,21]:(1)终板途径:椎体内血管的营养物质和代谢废物均可经软骨终板渗透到椎间盘内外,软骨终板发挥中介作用,营养髓核及内层纤维环;(2)纤维环途径:纤维环表面血管营养其外侧1/ 3。当营养物质缺乏时,髓核细胞的数量及活性受到显著影响,进而导致椎间盘的退变。通过模拟椎间盘内营养缺乏导致椎间盘退变的内环境,本实验成功构建了椎间盘退变髓核细胞的体外模型,能更好的模拟体内椎间盘退变时髓核细胞所发生的分子学变化。以annexin V-FITC/PI双染色检测其凋亡率时发现,随着胎牛血清浓度的降低,髓核细胞凋亡率逐渐增加,3%FBS组细胞凋亡率较其余四组明显增高;Western blot发现3%FBS状态下髓核细胞Bax、caspase-3明显升高、而bcl-2明显下降。Bax/bcl-2比值与细胞凋亡关系密切,Bax表达增高时,不仅可形成Bax/Bax同二聚体,诱导细胞凋亡,而且促进caspase-3的活化,但 bcl-2能抑制细胞凋亡[22,23]。Caspase-3作为凋亡执行性酶,能够调节细胞分化、增殖,活化后的caspase-3不断切割底物,逐步放大蛋白酶级联切割过程,最终激活核酸酶裂解核小体间的DNA,形成凋亡小体,导致细胞凋亡[24,25]。
随着年龄的增长,椎间盘外周微血管数量会逐渐减少,椎间盘细胞的营养物质供应逐渐减少而代谢废物逐渐堆积,乳酸大量沉积导致pH值下降,椎间盘细胞活性受损,最终导致椎间盘细胞凋亡。因此,本课题组认为3%FBS导致髓核细胞活性降低,细胞外基质成分的含量及含水量等减少,导致椎间盘力学性质及稳定性下降,从而引起椎间盘退变。
目前,对于椎间盘退变的研究主要集中于软骨终板及纤维环,而体外髓核细胞凋亡模型的建立更是鲜有报道。本实验介绍的建模采用3%FBS培养方法充分模拟体内椎间盘营养缺乏状态下髓核细胞的改变,筛选3%FBS浓度既能满足髓核细胞的基础代谢,也能获得较好的凋亡率效果,本模型不但证实了髓核细胞凋亡的存在,而且还发现在营养缺乏条件下髓核细胞凋亡很可能是通过死亡受体途径实现的。本实验采用3%FBS培养法处理髓核细胞成功建立体外髓核细胞凋亡模型,并初步探讨髓核细胞的凋亡机制,为进一步研究髓核细胞凋亡机制及干预措施提供了基础。
[1] Manek N J,MacGregor A J.Epidemiology of back disorders: prevalence,risk factors,and prognosis[J].Curr Opin Rheumatol,2005,17(2):134-140.
[2] Anderson D G,Tannoury C.Molecular pathogenic factors in symptomatic disc degeneration[J].Spine J,2005,5(6 Suppl): 260S-266S.
[3] Li Z,Liang J,Wu W K,et al.Leptin activates RhoA/ROCK pathway to induce cytoskeleton remodeling in nucleus pulposus cells[J].Int JMol Sci,2014,15(1):1176-1188.
[4] Li Z,Shen J,WuW K,etal.The role of leptin on the organization and expression of cytoskeleton elements in nucleus pulposus cells[J].JOrthop Res,2013,31(6):847-857.
[5] HaefeliM,Kalberer F,Saegesser D,etal.The course ofmacroscopic degeneration in the human lumbar intervertebral disc[J]. Spine(Phila Pa 1976),2006,31(14):1522-1531.
[6] Sakai D.Future perspectives of cell-based therapy for intervertebral disc disease[J].Eur Spine J,2008,17 Suppl4:452-458.
[7] Sato M,Ishihara M,Kikuchi M,et al.The influence of Ho: YAG laser irradiation on intervertebral disc cells[J].Lasers Surg Med,2011,43(9):921-926.
[8] 郑敏,SPGrogan,TSchaffner,等.被激光损伤软骨释放的凋亡因子诱导软骨细胞凋亡的研究[J].中华医学杂志,2007(21):1496-1500.
[9] Nakagawa S,Arai Y,Mazda O,et al.N-acetylcysteine prevents nitric oxide-induced chondrocyte apoptosis and cartilage degeneration in an experimental model of osteoarthritis[J].J Orthop Res,2010,28(2):156-163.
[10] Abouheif M M,Nakasa T,Shibuya H,et al.SilencingmicroRNA-34a inhibits chondrocyte apoptosis in a ratosteoarthritismodel in vitro[J].Rheumatology(Oxford),2010,49(11):2054-2060.
[11] Lo M Y,Kim H T.Chondrocyte apoptosis induced by hydrogen peroxide requires caspase activation but not mitochondrial pore transition[J].JOrthop Res,2004,22(5):1120-1125.
[12] 王拥军,施杞,周泉,等.抗Fas抗体诱导软骨细胞凋亡及胰岛素样生长因子-1对其的保护作用[J].中华骨科杂志,2007,27(12):920-924.
[13] 李德芳,吴靖平,朱斌,等.大鼠椎间盘软骨终板细胞凋亡体外模型的建立[J].中国矫形外科杂志,2013(02):173-177.
[14] Kokubun S,Sakurai M,Tanaka Y.Cartilaginous endplate in cervical disc herniation[J].Spine(Phila Pa 1976),1996,21(2):190-195.
[15] Zhao C Q,Jiang L S,Dai L Y.Programmed cell death in intervertebral disc degeneration[J].Apoptosis,2006,11(12):2079 -2088.
[16] Wei A,Brisby H,Chung S A,et al.Bonemorphogenetic protein-7 protects human intervertebral disc cells in vitro from apoptosis[J].Spine J,2008,8(3):466-474.
[17] Zhang C C,Zhou JS,Hu JG,et al.Effects of IGF-1 on IL-1beta-induced apoptosis in rabbit nucleus pulposus cells in vitro [J].Mol Med Rep,2013,7(2):441-444.
[18] Murata Y,Rydevik B,Nannmark U,et al.Local application of interleukin-6 to the dorsal root ganglion induces tumor necrosis factor-alpha in the dorsal root ganglion and results in apoptosis of the dorsal root ganglion cells[J].Spine(Phila Pa 1976),2011,36(12):926-932.
[19] Vernon-Roberts B,Moore RJ,Fraser RD.The natural history of age-related disc degeneration:the influence of age and pathology on cell populations in the L4-L5 disc[J].Spine(Phila Pa 1976),2008,33(25):2767-2773.
[20] Grunhagen T,Shirazi-Adl A,Fairbank JC,et al.Intervertebral disk nutrition:a review of factors influencing concentrations of nutrients and metabolites[J].Orthop Clin North Am,2011,42(4):465-477.
[21] Nerlich AG,Schaaf R,WalchliB,etal.Temporo-spatial distribution of blood vessels in human lumbar intervertebral discs[J]. Eur Spine J,2007,16(4):547-555.
[22] Croker B A,O’Donnell JA,Nowell C J,et al.Fas-mediated neutrophil apoptosis is accelerated by Bid,Bak,and Bax and inhibited by Bcl-2 and Mcl-1[J].Proc Natl Acad Sci U S A,2011,108(32):13135-13140.
[23] Renault T T,Teijido O,Antonsson B,et al.Regulation of Bax mitochondrial localization by Bcl-2 and Bcl-x(L):keep your friends close but your enemies closer[J].Int JBiochem Cell Biol,2013,45(1):64-67.
[24] Contreras J L,Vilatoba M,Eckstein C,et al.Caspase-8 and caspase-3 small interfering RNA decreases ischemia/reperfusion injury to the liver inmice[J].Surgery,2004,136(2):390-400.
[25] Connolly P F,Jager R,Fearnhead H O.New roles for old enzymes:killer caspasesas the engine of cellbehavior changes[J]. Front Physiol,2014,5:149.
Establishment of an apoptosismodel of rat disc nucleus pulposus cells in vitro
WANG Hou-lei,LUWei,LIDe-fang,DING Lei,WU Jing-ping*
(Department of Orthopedics,Jinshan Hospital of Fudan University,Shanghai201508,China)
ObjectiveTo develop an apoptosismodel of nucleus pulposus cells in cell culture.M ethodsTo mimic the nutrient-deficientmicroenvironmentof degenerative intervertebral disc,nucleus pulposus cells derived from infant SD rat disc were cultured under serum limiting conditions.Nucleus pulposus cellswere cultured in culturemedium containing 1%,3%,5%,8%and 10%fetalbovine serum(FBS)respectively to select the optimum FBA concentration.Apoptosis was assessed by flow cytometry,Western blot,cell counting kit,and immunofluorescence technique.ResultsThe flow cytometry revealed that apoptosis rate of the nucleus pulposus cells increased with decreasing concentration of FBS,and 3% FBSused in the experimentalgroup was themosteffective concentration to induce apoptosis(P<0.05).Western blotdemonstrated significantly higher expression of Bax and caspase-3 enzyme in the 3%FBS group than in the 10%FBS group,while bcl-2 activity decreased.The results of CCK-8 test indicated that the nucleus pulposus cells gotslower proliferation in themedium containing 3%FBS.Immunofluoresence analysis showed that FASexpression was significantly higher in the 3% FBS group than in the 10%FBS group.Conclusions3%FBS condition may induce apoptosis in the nucleus pulposus cells and compromise the cell function to induce intervertebral disc degeneration.The caspase family should be involved in the process.
Intervertebral disc degeneration;Nucleus pulposus cells;Apoptosis;Nutrition deprivation;Rat
Q95-33
A
1005-4847(2015)06-0607-05
10.3969/j.issn.1005-4847.2015.06.012
2015-06-24
上海市卫生局科研项目(编号:2012-341)。
王厚磊(1989-),男,骨科硕士在读、研究方向为椎间盘退变预防与治疗,E-mail:13211270011@fudan.edu.cn
吴靖平,主任医师,硕士生导师,研究方向为椎间盘退变预防与治疗,E-mail:drwujp@126.com

