桔梗皂苷D对人乳腺癌细胞体外杀伤效应及机制研究
章英宏
桔梗皂苷D对人乳腺癌细胞体外杀伤效应及机制研究
章英宏
目的 探讨桔梗皂苷D对人乳腺癌细胞体外杀伤效应及机制。方法 将人乳腺癌细胞系MCF-7和MDA-MB-231用桔梗皂苷D干预后,采用MTT法检测桔梗皂苷D对这两种乳腺癌细胞系的抑制率;采用流式细胞术检测桔梗皂苷D对MCF-7细胞凋亡的影响;Western blot法检测桔梗皂苷D干预后MCF-7细胞caspase-3、Bcl-2和Bax表达水平。结果 MCF-7细胞抑制率:2.5μg/ mL桔梗皂苷D组(8.9±2.4)%,5μg/mL桔梗皂苷D组(24.6±3.6)%,10μg/mL桔梗皂苷D组(39.7± 4.1)%,20μg/mL桔梗皂苷D组(64.8±5.2)%,40μg/mL桔梗皂苷D组(82.4±6.5)%;MDA-MB-231细胞抑制率:2.5μg/mL桔梗皂苷D组(5.3±1.7)%,5μg/mL桔梗皂苷D组(17.3±2.9)%,10μg/mL桔梗皂苷D组(28.4±3.5)%,20μg/mL桔梗皂苷D组(50.5±4.0)%,40μg/mL桔梗皂苷D组(71.3± 6.1)%,与对照组比较,差异有统计学意义(P均<0.05);MCF-7细胞的凋亡诱导率:5μg/mL桔梗皂苷D组为(9.7±1.6)%,20μg/mL桔梗皂苷D组(29.8±3.1)%,高、低剂量桔梗皂苷D组与对照组比较,差异有统计学意义(P均<0.05);与相同剂量桔梗皂苷D组比较,zVAD-fmk可有效抑制桔梗皂苷D对MCF-7细胞的凋亡诱导效应(P<0.05);桔梗皂苷D能显著降低MCF-7细胞Bcl-2表达水平(0.43±0.07、0.24±0.04 vs 0.78±0.09,P均<0.05),但对Bax表达无影响(0.38±0.05、0.41±0.04 vs 0.42±0.05,P>0.05)。结论 桔梗皂苷D诱导乳腺癌细胞进入caspase-3依赖的凋亡过程,其机制可能与降低Bcl-2表达,降低Bcl-2/Bax比例有关。
乳腺癌;桔梗皂苷D;凋亡;caspase-3;Bcl-2;Bax
KEY WORDSbreast cancer;platycodin D;apoptosis;caspase-3;Bcl-2;Bax
目前临床治疗乳腺癌的方法包括手术切除、化疗、放疗和生物治疗,然而由于乳腺癌的高转移性和耐药性,这些治疗方法都无法治愈乳腺癌[1-2]。本研究观察桔梗皂苷D对人乳腺癌体外杀伤效应,并探讨其机制。
1 材料与方法
1.1 细胞培养 人乳腺癌细胞系MCF-7和MDAMB-231购于上海中科院细胞库,培养在RPMI-1640培养基中,含10%胎牛血清,培养环境为37℃恒温且通入5%的CO2。
1.2 试 剂 RPIM-1640培养基购自于美国Gibco公司,胎牛血清于杭州四季青生物工程有限公司。桔梗皂苷D,MTT(噻唑蓝),AnnexinⅤ-FITC凋亡试剂盒购于美国Sigma公司。Cleaved caspase-3、βactin、Bcl-2,Bax兔抗人抗体购自美国Cell signaling公司。
1.3 MTT法检测桔梗皂苷D对乳腺癌细胞系的抑制活性 将MCF-7,MDA-MB-231细胞分别接种于96孔板,设置3个复孔,分别加入2.5、5、10、20、40μg/mL的桔梗皂苷D培养48h,对照组为相同培养条件下不加桔梗皂苷D培养48h。之后加5mg/mL MTT 20μL,继续培养4h。弃上清,往孔中加150μL二甲亚砜,570nm波长下检测OD值,细胞生长抑制率按以下公式计算:抑制率=[OD(对照组)-OD(药物组)/OD(对照组)]×100%。
1.4 细胞凋亡试验 MCF-7细胞凋亡检测分组如下:5μg/mL桔梗皂苷D组,20μg/mL桔梗皂苷D组,5μg/mL桔梗皂苷D+10μmol/L zVAD-fmk组,20μg/ mL桔梗皂苷D+10μmol/L zVAD-fmk组。分组加药后培养48h,对照组为不加药物培养48h。收集细胞,用生理盐水洗2次,加195μL凋亡试剂盒中的结合缓冲液及5μL Annexin-V在暗处孵育10min,之后加入10μL碘化丙啶(PI)孵育10min,用流式细胞仪检测MCF-7细胞凋亡,凋亡率为Annexin V阳性细胞占所有细胞的比例。
1.5 Western blot试验 在MCF-7细胞中分别加入5μg/mL或20μg/mL桔梗皂苷D培养48h,对照组为不加药物培养48h,收集细胞,将细胞裂解后取裂解液进行聚丙烯酰氨凝胶电脉(SDS-PAGE),之后将分离后的蛋白转到PVDF膜上,将膜在Cleaved caspase-3,β-actin,Bcl-2或Bax一抗稀释液中孵育过夜,将膜清洗后在羊抗兔二抗稀释液中孵育2h,用ECL显色试剂盒显色,X线胶片曝光后,目标蛋白表达量由它们在胶片上显色后的灰度与相应β-actin的灰度比表示。
1.6 统计学方法 所有实验重复3次,实验数据用均值±标准差(±s) 表示,应用SPSS13.0软件进行统计处理,采用t检验以及单因素方差分析。
2 结 果
2.1 桔梗皂苷D对人乳腺癌细胞系的抑制作用 与不加桔梗皂苷D的对照组比较,不同剂量的桔梗皂苷D均能明显抑制MCF-7和MDA-MB-231细胞的生长(P<0.05),且MCF-7细胞对桔梗皂苷D的敏感性高于MDA-MB-231细胞系(P<0.05),见表1。
2.2 桔梗皂苷D诱导MCF-7细胞凋亡 高、低剂量的桔梗皂苷D均能显著诱导MCF-7细胞caspase-3的活化,使激活型(cleaved caspase-3)表达显著增加,进而诱导MCF-7细胞发生凋亡(P<0.05)。caspase特异性抑制剂zVAD-fmk能显著抑制桔梗皂苷D诱导的caspase-3活化和凋亡的发生(P<0.05),见表2。
2.3 桔梗皂苷D下调Bcl-2表达 与不加桔梗皂苷D的对照组比较,高、低剂量的桔梗皂苷D均可显著抑制MCF-7细胞Bcl-2表达(P<0.05),但对Bax表达无影响(P>0.05)。高、低剂量桔梗皂苷D均使MCF-7细胞的Bcl-2/Bax比值下降,见表3。
表1 桔梗皂苷D体外MCF-7细胞和MDA-MB-231细胞抑制作用(±s)

表1 桔梗皂苷D体外MCF-7细胞和MDA-MB-231细胞抑制作用(±s)
注:与对照组比较,*P<0.05;与同浓度桔梗皂苷D处理的MCF-7比较,△P<0.05
组别对照组2.5μg/mL桔梗皂苷D组5μg/mL桔梗皂苷D组10μg/mL桔梗皂苷D组20μg/mL桔梗皂苷D组40μg/mL桔梗皂苷D组孔数333333桔梗皂苷D浓度(μg/mL)0 2.5 5 10 20 40 MCF-7细胞抑制率(%)0 8.9±2.4* 24.6±3.6* 39.7±4.1* 64.8±5.2* 82.4±6.5* MDA-MB-231细胞抑制率(%)0 5.3±1.7* 17.3±2.9*△28.4±3.5*△50.5±4.0*△71.3±6.1*△
表2 桔梗皂苷D对MCF-7细胞凋亡的影响(±s)
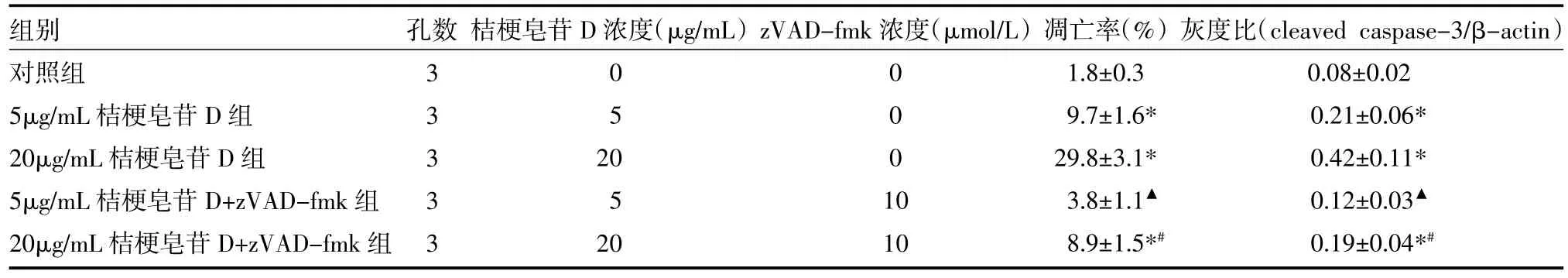
表2 桔梗皂苷D对MCF-7细胞凋亡的影响(±s)
注:与对照组比较,*P<0.05;与5μg/mL桔梗皂苷D组比较,▲P<0.05;与20μg/mL桔梗皂苷D组比较,#P<0.05
组别对照组5μg/mL桔梗皂苷D组20μg/mL桔梗皂苷D组5μg/mL桔梗皂苷D+zVAD-fmk组20μg/mL桔梗皂苷D+zVAD-fmk组孔数 桔梗皂苷D浓度(μg/mL)zVAD-fmk浓度(μmol/L)33333 05 20 5 20 0001 0 10凋亡率(%)1.8±0.3 9.7±1.6* 29.8±3.1* 3.8±1.1▲8.9±1.5*#灰度比(cleaved caspase-3/β-actin)0.08±0.02 0.21±0.06* 0.42±0.11* 0.12±0.03▲0.19±0.04*#
表3 桔梗皂苷D对MCF-7细胞Bcl-2及Bax蛋白表达的影响(±s)

表3 桔梗皂苷D对MCF-7细胞Bcl-2及Bax蛋白表达的影响(±s)
注:与对照组比较,*P<0.05
组别对照组5μg/mL桔梗皂苷D组20μg/mL桔梗皂苷D组孔数 桔梗皂苷D浓度(μg/mL)333 052 0灰度比(Bcl-2/β-actin)0.78±0.09 0.43±0.07* 0.24±0.04*灰度比(Bax/β-actin)0.42±0.05 0.38±0.05 0.41±0.04 Bcl-2/Bax 1.86±0.18 1.13±0.08 0.59±0.06
3 讨论
桔梗皂苷D是桔梗总皂苷的主要活性成分,具有抗炎、镇痛和免疫调节的作用,最近也有文献报道桔梗皂苷D具有显著的抗肝癌和肺癌的生物活性,能诱导肝癌和肺癌细胞凋亡和周期阻滞[3-5]。
诱导肿瘤细胞发生凋亡是肿瘤治疗药物杀伤肿瘤细胞的关键机制,能否显著造成肿瘤细胞凋亡往往是肿瘤药物治疗成功与否的标志,而肿瘤细胞对化疗药物的抵抗则常常表现为对凋亡的抵抗[6-7]。本实验结果发现桔梗皂苷D能诱导MCF-7细胞caspase-3的活化同时显著诱导MCF-7细胞发生凋亡,当用zVAD-fmk抑制caspase-3的活化后,桔梗皂苷D对MCF-7细胞的凋亡诱导效应下降。证实桔梗皂苷D能诱导乳腺癌细胞凋亡,且依赖于caspase-3的活化。
Bcl-2蛋白家族是细胞内重要的凋亡调控因子,当Bcl-2与Bax的比值下降时,细胞线粒体膜孔道会开放,细胞色素C释出,进而激活caspase-3,导致细胞发生凋亡[8-9]。Western blot检测结果发现桔梗皂苷D尽管不能诱导Bax表达,但能显著增加Bcl-2表达水平,使Bcl-2/Bax比值显著下降。这可能是桔梗皂苷D诱导MCF-7细胞凋亡的作用机制之一。
综上所述,桔梗皂苷D具有良好的体外抗乳腺癌生长的活性,并能诱导乳腺癌细胞发生凋亡。
[1]McCrudden CM,McCarthy HO.Current status of gene ther apy for breast cancer:progress and challenges[J].Appl Clin Genet,2014,7:209-220.
[2]Miller E,Lee HJ,Lim B,et al.Current treatment of early breast cancer:adjuvant and neoadjuvant therapy[J].F1000 Res,2014,3:198.
[3]Li T,Xu WS,Lu JJ,et al.Platycodin D induces apoptosis,and inhibits adhesion,migration and invasion in HepG2 hepatocellular carcinoma cells[J].Asian Pac JCancer Prev,2014,15(4):1745-1749.
[4]Qin H,Du X,Wang R,et al.Platycodin D,a triterpenoid saponin from Platycodon grandiflorum,induces G2/M arrest and apoptosis in human hepatoma HepG2 cells bymodulating the PI3K/Akt pathway[J].Tumour Biol,2014,35(2):1267-1274.
[5]Dai Q,Chen Z,Wu BH,et al.Mechanism of platycodin D-induced apoptosis in A549 human lung cancer cells[J]. Zhongguo Zhong Yao Za Zhi,2012,37(17):2626-2629.
[6]Jayasooriya RG,Choi YH,Hyun JW,et al.Camptothecin sensitizes human hepatoma Hep3B cells to TRAIL-mediated apoptosis via ROS-dependent death receptor 5 upregulation with the involvement of MAPKs[J].Environ Toxicol Pharmacol,2014,38(3):959-967.
[7]Zhang H,Tang J,Lai M,et al.MiR-22 regulates 5-FU sensitivity by inhibiting autophagy and promoting apoptosis in colorectal cancer cells[J].Cancer Lett,2015,356(2 Pt B):781-790.
[8]Zhao B,He T.Chidamide,a histone deacetylase inhibitor,functions as a tumor inhibitor by modulating the ratio of Bax/Bcl-2 and P21 in pancreatic cancer[J].Oncol Rep,2015,33(1):304-310.
[9]Li CL,Chang L,Jiang CL,et al.β-elemene Induces Caspase-dependent Apoptosis in Human Glioma Cells in vitro through the Upregulation of Bax and Fas/FasL and Downregulation of Bcl-2[J].Asian Pac JCancer Prev,2014,15(23):10407-10412.
(收稿:2014-12-26 修回:2015-02-14)
Viability Inhibition of Human Breast Cancer Cells Treated w ith Platycodin D in Vitro and the UnderlyingM echanism
ZHANG Yinghong. Clinical Laboratory,Xinchang Hospital of Traditional Chinese Medicine, Xingchang(312500),China
Objective To investigate the anticancer activity of platycodin D in breast cancer cells and the mechanism.M ethods Human breast cancer cell lines MCF-7 and MDA-MB-231 were treated with platycodin D. Cell viability was then measured by using the MTT assay.Apoptosis of MCF-7 treated with platycodin D was determined by flow cytometry.The expression of cleaved caspase-3,Bcl-2 and Bax on MCF-7 was detected by western blot.Results The viability inhibition rate of MCF-7 were as follows:8.9%±2.4%in 2.5μg/mL platycodin D group,24.6%±3.6%in 5μg/mL platycodin D group,39.7%±4.1%in 10μg/mL platycodin D group,64.8%±5.2% in 20μg/mL platycodin D group,82.4%±6.5%in 40μg/mL platycodin D group.The viability inhibition rate of MDA-MB-231 were as follows:5.3%±1.7%in 2.5μg/mL platycodin D group,17.3%±2.9%in 5μg/mL platycodin D group,28.4%±3.5%in 10μg/mL platycodin D group,50.5%±4.0%in 20μg/mL platycodin D group,71.3%± 6.1%in 40μg/mL platycodin D group.Statistical differences was found between MCF-7 and MDA-MB-231 treated with platycodin D group and control group(P<0.05).The apoptosis rate of MCF-7 cells was 9.7%±1.6%in 5μg/mL platycodin D group and 29.8%±3.1%in 20μg/mL platycodin D group,which were significantly different from that of control group(P<0.05).Compared to the equal dose of platycodin D group,Zvad-fmk significantly inhibited the apoptosis induced by platycodin D(P<0.05).Pplatycodin D decreased the expression of Bcl-2 on MCF-7 cells(0.43±0.07 and 0.24±0.04 vs 0.78±0.09,P<0.05),while it did not affect the expression of Bax on MCF-7 cells(0.38±0.05 and 0.41±0.04 vs 0.42±0.05,P>0.05). Conclusion Platycodin D can induce caspase-3-dependant apoptosis of breast cancer cells by down-regulating the expression of Bcl-2 and the ratio of Bcl-2 to Bax.
浙江省新昌县中医院检验科(新昌 312500)
——辨别味之苦甜

