结核分枝杆菌北京基因型菌株的流行特征及其与耐药的关系
——2007年全国结核病耐药基线调查资料分析
王胜芬 周杨 逄宇 赵雁林
结核分枝杆菌北京基因型菌株的流行特征及其与耐药的关系
——2007年全国结核病耐药基线调查资料分析
王胜芬 周杨 逄宇 赵雁林
目的 探讨结核分枝杆菌北京基因型菌株的流行特征及其与耐药的关系。方法 2007年我国开展全国结核病耐药基线调查,调查覆盖除香港、澳门和台湾地区外的全国31省(自治区、直辖市),含70个调查点。本研究对来自基线调查的3861例涂阳结核病患者的分离菌株进行分析,采用比例法进行药物敏感性试验,以间隔区寡核苷酸分型(Spoligotyping)方法对结核病患者的分离株进行基因分型。采用Epi Info 3.5.1建立数据库,SAS 9.1软件进行统计学分析,以卡方检验分析不同变量之间的关系,以P<0.05为有统计学意义。结果 北京基因型菌株在我国广泛流行,占总分离菌株的63.97%(2470/3861)。感染北京基因型菌株与年龄(<30岁和≥60岁:OR=0.9604,95%CI=0.7995~1.1536;30~岁和≥60岁:OR=1.0620,95%CI=0.9071~1.2434,χ2=0.3885,Ptrend=0.6977)、性别(OR=1.1526,95%CI=0.9973~1.3321,χ2=3.7024,P=0.0543)无关;北京基因型菌株与抗结核药物INH(OR=0.9020,95%CI=0.766~1.0619,χ2=1.5356,P=0.2153)、RFP(OR=1.0017,95%CI=0.8166~1.2288,χ2=0.0003,P=0.9868)、Sm(OR=0.9406,95%CI=0.8139~1.08711,χ2=0.6869,P=0.4072)、EMB(OR=0.9222,95%CI=0.7205~1.1804,χ2=0.4140,P=0.5199)、Ofx(OR=0.9624,95%CI=0.6923~1.3378,χ2=0.0520,P=0.8196)和Km(OR=1.1666,95%CI=0.7624~1.7852,χ2=0.5049,P=0.4774)任何耐药均无关联;与单耐INH(OR=0.9955,95%CI=0.7206~1.3753,χ2=0.0007,P=0.9783)、RFP(OR=0.9615,95%CI=0.4880~1.8944,χ2=0.0129,P=0.9096)、EMB(OR=0.5533,95%CI=0.2023~1.5136,χ2=1.3675,P=0.2422)、Ofx(OR=0.8445,95%CI=0.3965~1.7984,χ2=0.1926,P=0.6608)、Km(OR=1.7779,95%CI=0.4440~7.1203,χ2=0.6791,P=0.4099)也均无关联;与耐多药(MDR)(OR=0.9884,95%CI=0.7594~1.2284,χ2=0.0110,P=0.9166)和广泛耐药(XDR)(OR=1.1502,95%CI=0.5372~2.4626,χ2=0.1300,P=0.7185)均无显著性关联。结论 我国是北京基因型菌株的高流行区,感染北京基因型菌株与年龄、性别无关,北京基因型菌株与耐药无关。
结核分枝杆菌; 基因型; 抗药性, 细菌; 患病率
自从1995年首次报道结核分枝杆菌北京基因型菌株以来,北京基因型菌株备受关注[1]。中国是北京基因型菌株的高流行区,有报道中国1/2以上的结核病患者感染了北京基因型菌株[2],有文献报道北京基因型菌株已经在世界范围内广泛流行[3-4]。另外,北京基因型菌株具有较强的毒力[5],感染北京基因型菌株与治疗失败[6]和结核病复发[7]的有关报道引起了公共卫生领域的高度重视。感染北京基因型菌株与抗结核药物耐药之间的关系引发全球关注,来自俄罗斯[8]、越南[9-10]、伊朗[11]和意大利[12]的报道表明,北京基因型菌株与耐药相关。在中国,有研究显示感染北京基因型菌株容易发生耐药[13],另有研究报道感染北京基因型菌株与耐药无关[14-16]。感染北京基因型菌株与抗结核药物耐药之间的关系尚无定论。
中国既是北京基因型菌株高流行区,又是全球结核病高负担国家,同时也是耐多药结核病高负担国家[17]。因此,分析和研究北京基因型菌株的流行特征及其与耐药的关系,对我国结核病控制工作具有积极意义。
材料和方法
一、菌株来源
2007年我国开展全国结核病耐药基线调查,从除“港澳台地区”外的全国31省(自治区、直辖市)抽取70个调查点,每个调查点纳入新诊断(登记)的涂阳结核病初治患者51例,复治患者17例。调查共纳入4600例患者,每例患者有一份信息表和相应的分离菌株,经过菌种鉴定,3929例患者感染的菌株为结核分枝杆菌。本研究对98.27%(3861/3929)结核病患者的分离株进行了基因型分析。3861例患者中,男2767例,占71.67%;女1094例,占28.33%;年龄17~93岁,平均年龄(45.79±18.47)岁。
二、方法
1.信息收集:本次调查以信息表收集患者的基本信息、用药史和治疗史等信息。
2. 药物敏感性试验(简称“药敏试验”):药敏试验采用WHO推荐的比例法,含药培养基中药物浓度为INH 0.2 μg/ml, RFP 40 μg/ml, Sm 4 μg/ml, EMB 2 μg/ml, Ofx 4 μg/ml和Km 40 μg/ml。
3.基因组DNA提取:取Lowenstein-Jensen培养基(L-J培养基)斜面上的菌落于400 μl TE缓冲液中,85 ℃灭活30 min,煮沸20 min,12 000 r/min,离心半径10 cm,离心5 min,取上清置于-20 ℃保存备用。
4.间隔区寡核苷酸分型(Spoligotyping)法进行基因分型:依据Kamerbeek等[18]建立的Spoligotyping标准化方法对结核分枝杆菌进行基因分型。典型的北京基因型菌株与间隔区35~43的寡核苷酸探针杂交,北京样基因型菌株也会与间隔区35~43的寡核苷酸探针杂交,但是杂交的探针少于9个(除外仅与间隔区37、38探针杂交的菌株,田鼠分枝杆菌)。本研究中典型的北京基因型菌株和北京样基因型菌株统称为北京基因型菌株。
5.质量控制:药敏试验采用标准菌株H37Rv进行质控,Spoligotyping基因分型采用标准菌株H37Rv和牛结核分枝杆菌的DNA进行质控。
三、统计学分析
以Epi Info 3.5.1(美国CDC出品)建立数据库,以SAS 9.1统计软件进行统计学分析,以卡方检验分析不同变量之间的关系并计算比值比与其95%可信区间,以P<0.05为有统计学意义。
结 果
一、我国不同区域北京基因型菌株的流行情况
对3861株结核分枝杆菌临床分离株采用Spoligotyping 基因分型,结果显示北京基因型菌株2470株,占63.97%;非北京基因型菌株1391株,占36.03%。由于我国幅员辽阔,不同区域人口密度、民族分布等不同,如果按照区域将我国分成6区,即华北、东北、华东、中南、西南、西北6区,可以看到不同区域北京基因型菌株的比率差异有显著统计学意义(χ2=201.9132,P<0.0001)。进一步分析发现,华北与东北区北京基因型菌株的比率差异无统计学意义(χ2=0.4249,P=0.5145);中南与西北区北京基因型菌株的比率差异无统计学意义(χ2=0.7575,P=0.3841)。如将华北、东北片区合并统称为北部地区,中南、西北片区合并后再与华东区、西南区比较,发现4个区域两两比较北京基因型菌株的比率差异均有显著统计学意义(P值均<0.0001),其中北部地区北京基因型菌株的比率最高,为80.75%(579/717);其次为华东区,北京基因型菌株的比率为70.44%;西南区北京基因型菌株的比率为59.97%;中南-西北区北京基因型菌株的比率为51.90%(725/1397)(表1)。
二、北京基因型菌株的易感因素分析
患者感染北京基因型菌株与性别(OR=1.1526,95%CI=0.9973~1.3321)、年龄(<30岁和≥60岁:OR=0.9604,95%CI=0.7995~1.1536;30~岁和≥60岁:OR=1.0620,95%CI=0.9071~1.2434)无关;相对于其他少数民族,汉族人群更易感染北京基因型菌株(OR=2.2185,95%CI=1.8090~2.7207)(表2)。以地区进行分层,分别分析新疆、青海、宁夏、广西等少数民族聚集的区域,没有发现汉族较维吾尔族、回族、壮族人群易感北京基因型菌株(表3)。

表1 2007年我国不同地区结核分枝杆菌北京基因型菌株的流行情况
注 表中数据不包括“港澳台地区”
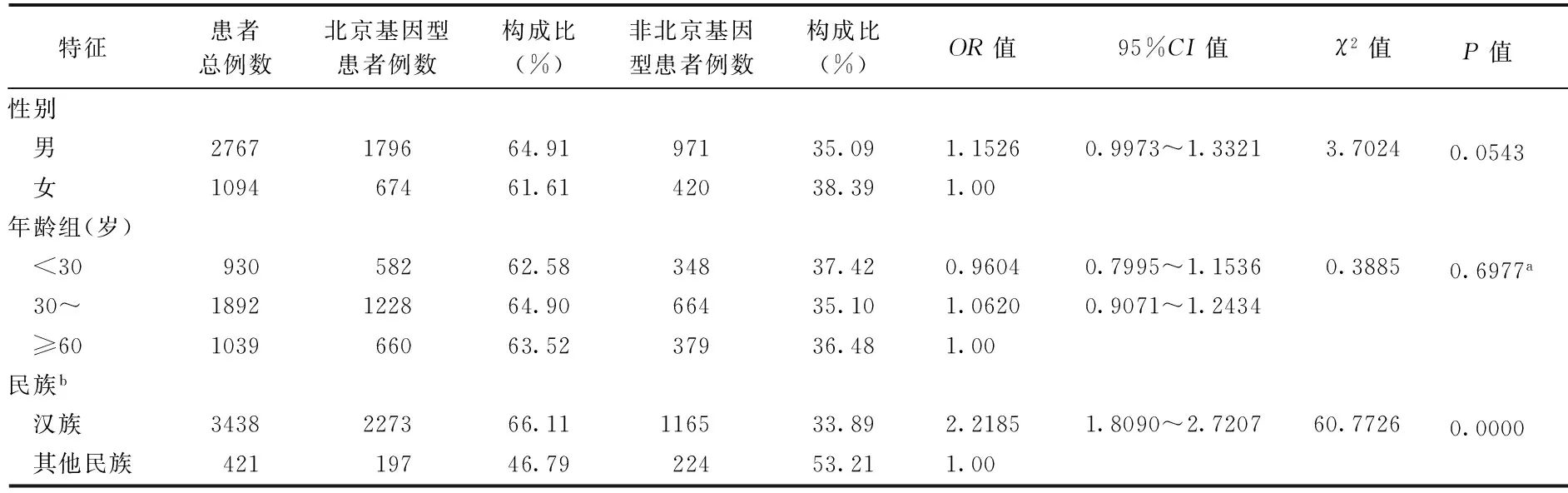
表2 2007年我国不同特征人群对结核分枝杆菌北京基因型菌株易感因素分析
注 表中数据不包括“港澳台地区”;a: 趋势卡方检验;b: 本研究患者总数3861例,但有2例缺失值,故此处患者总数为3859例

表3 2007年不同民族地区结核分枝杆菌北京基因型菌株易感性的分层分析
注a: 精确概率法;“-”为 不适用
三、北京基因型菌株与耐药的关系
结核分枝杆菌北京基因型菌株与任何耐INH(OR=0.9020,95%CI=0.766~1.0619)、RFP(OR=1.0017,95%CI=0.8166~1.2288)、EMB(OR=0.9222,95%CI=0.7205~1.1804)、Sm(OR=0.9406,95%CI=0.8139~1.08711)、Km(OR=1.1666,95%CI=0.7624~1.7852)、Ofx(OR=0.9624,95%CI=0.6923~1.3378)均无显著性关联;感染北京基因型菌株与耐多药(OR=0.9884,95%CI=0.7594~1.2284)、广泛耐药(OR=1.1502,95%CI=0.5372~2.4626)也均无显著性关联;同样,感染北京基因型菌株也与单耐EMB(OR=0.5533,95%CI=0.2023~1.5136)、INH(OR=0.9955,95%CI=0.7206~1.3753)、RFP(OR=0.9615,95%CI=0.4880~1.8944)、Km(OR=1.7779,95%CI=0.4440~7.1203)、Ofx(OR=0.8445,95%CI=0.3965~1.7984)均无显著性关联(表4)。

表4 2007年我国结核分枝杆菌北京基因型菌株与耐药的关系
注 表中数据不包括“港澳台地区”;“-”为不适用
四、北京基因型菌株与耐药的分层分析
考虑到患者产生耐药的影响因素众多,一个常见的因素即患者的抗结核药物治疗不规范也可能导致耐药。为了控制混杂因素,本研究参照《中国结核病防治规划实施工作指南(2008年版)》的患者登记分类,按照治疗史将研究对象分为4层,分别是未用药的新患者、新患者用药少于1个月、复发患者、其他复治患者(包括初治失败、返回和其他复治),分别分析北京基因型菌株与任何耐INH、RFP、 EMB、Sm、Km、Ofx之间的关系,以及北京基因型菌株与MDR和XDR的关系。无论是未用药的新患者、新患者用药少于1个月、复发患者还是其他复治患者,各层分析的结果显示,北京基因型菌株与任何耐INH、RFP、EMB、Sm、Km、Ofx均无关联,与MDR、XDR也均无关联(表5,6)。
讨 论
一、结核分枝杆菌北京基因型菌株的流行情况
中国是北京基因型菌株的高流行区,既往来自不同区域的研究报告显示,北京基因型菌株的比率在62.2%~91.7%之间[19-20]。本研究采用具有代表性的、来自全国70个监测点的结核分枝杆菌临床分离株菌株3861株进行分析,发现我国北京基因型菌株占临床分离株的比率为63.97%,不同区域北京基因型菌株所占的比率不同,其中北部地区(包括东北、华北区)最高,达80.75%(579/717),其次华东区70.44%,西南区为59.97%,中南和西北区较低,为51.89%(725/1397)。这与相关报道相似但不完全相同[2,13],可能在地域划分和菌株选择方面存在不同。促使北京基因型菌株流行的因素,以及不同区域北京基因型菌株所占比率差异的原因有待进一步阐明。
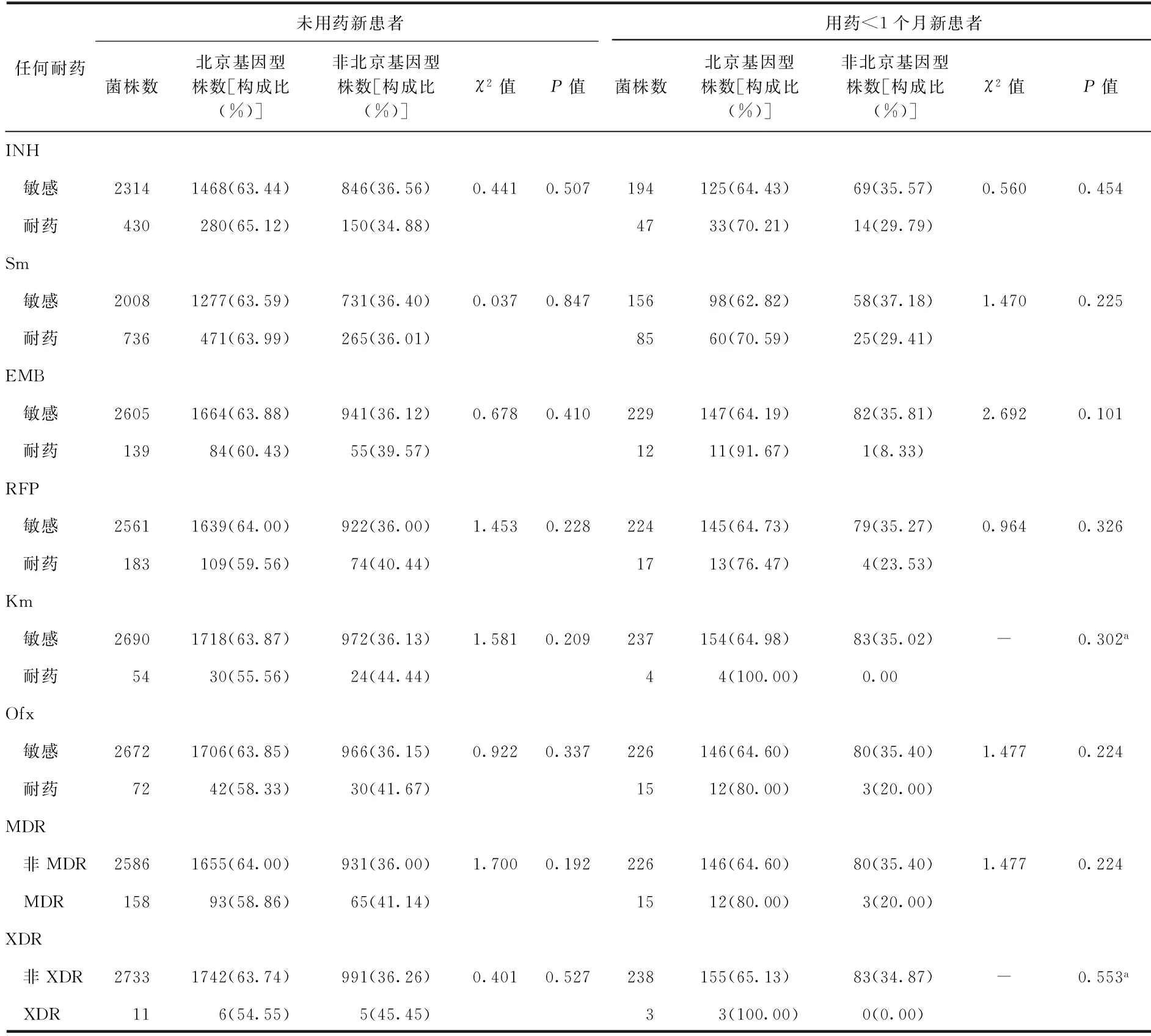
表5 2007年我国结核分枝杆菌北京基因型菌株与耐药关系的分层分析(新患者)
注a:Fisher 精确概率法; “-”为不适用;表中数据不包括“港澳台地区”
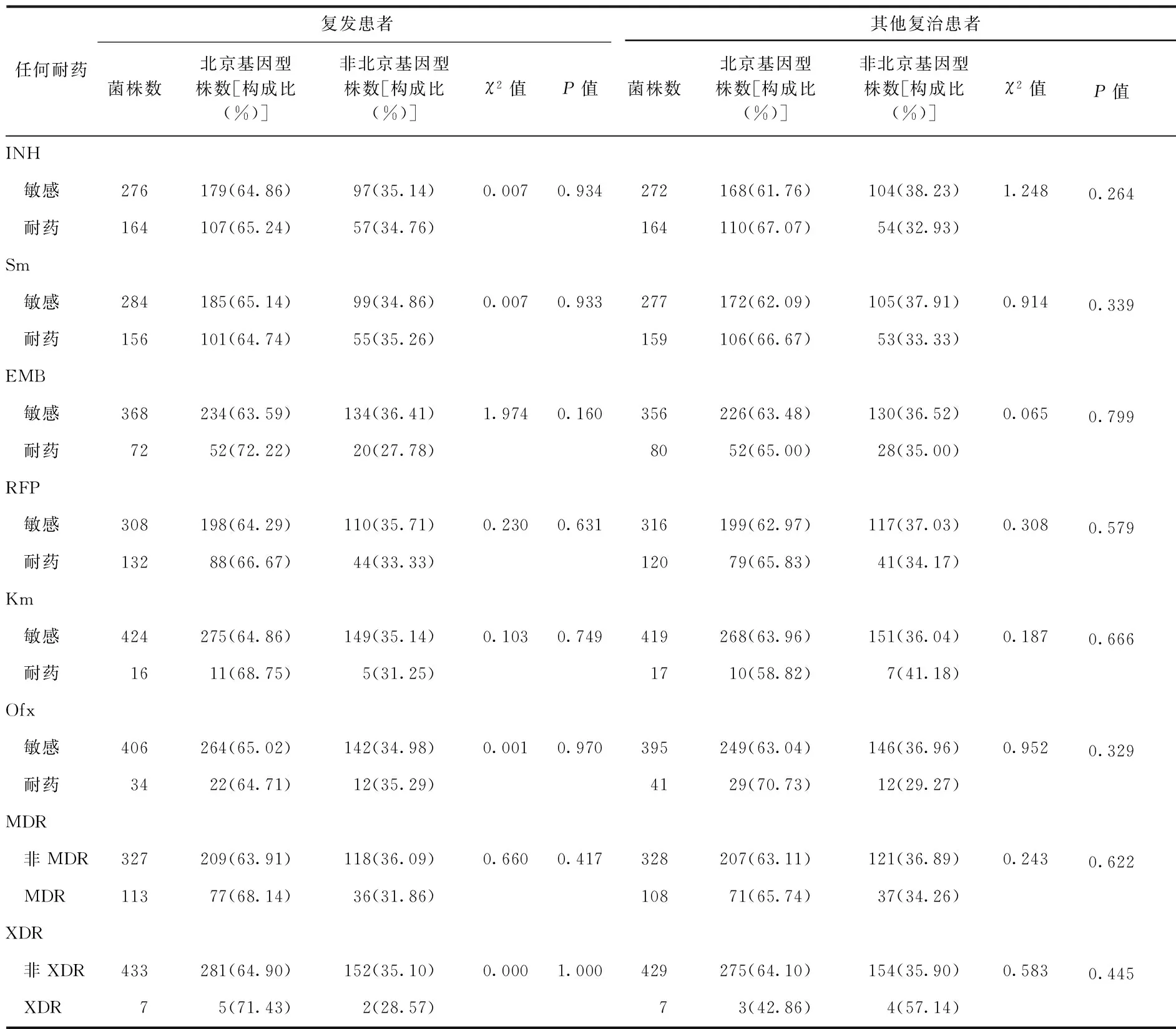
表6 2007年我国结核分枝杆菌北京基因型菌株与耐药关系的分层分析(复治患者)
注 表中数据不包括“港澳台地区”;“其他复治患者”包括除复发外的其他登记分类的复治患者,包括返回、初治失败、迁入和医疗机构不规则治疗1个月以上的患者
二、结核分枝杆菌北京基因型菌株的易感因素
为了解与北京基因型菌株流行有关的因素,本研究对常见的变量如年龄、性别等与感染北京基因型菌株的关系进行了分析。结果显示,感染北京基因型菌株与性别无关,也与年龄无关。研究发现,感染北京基因型菌株与民族有关,相对于少数民族,汉族人群更容易感染北京基因型菌株;但考虑地域可能是一个混杂因素,因为地域不同,人口密度等可能大不相同,北京基因型菌株的传播也可能不同。研究进一步分析了少数民族集中的3个区域中民族与感染北京基因型菌株的关系。在新疆主要为汉族和维吾尔族,研究没有发现汉族人群较维吾尔族人群更易感染北京基因型菌株;在青海、宁夏的研究没有发现汉族人群较回族人群更容易感染北京基因型菌株;同样,在广西壮族自治区的研究也没有发现汉族较壮族人群更容易感染北京基因型菌株。在国内有关文献报道中,同一地区没有发现汉族与其他民族人群在北京基因型菌株易感性方面差异存在统计学意义[20]。因此,本研究得出的汉族较其他民族人群易感北京基因型菌株的结果可能是由于地域这一混杂因素作用的结果。
三、结核分枝杆菌北京基因型菌株与耐药的关系
中国是结核病和耐药结核病高负担国家,关于北京基因型菌株与耐药之间的关系国内也有不同报道,有研究提示北京基因型菌株与耐药有关[2,13],也有研究报道北京基因型菌株与耐药无关[14-16,21]。不同的结论有可能是由于在研究地域和菌株的选择方面存在差异。本研究采用具有中国流行代表性的菌株,研究结果显示,北京基因型菌株与任何耐INH、RFP、EMB、Sm、Km、Ofx均无显著性关联;感染北京基因型菌株与MDR、XDR无显著性关联;感染北京基因型菌株与单耐INH、RFP、EMB、Sm、Km、Ofx均无显著性关联。考虑到患者不同的治疗史可能对耐药产生影响,在研究中按照治疗史进行了分层,分别研究了感染北京基因型菌株与任何耐药、MDR、XDR的关系,各层研究的结果均显示,北京基因型菌株与任何耐药、耐多药、广泛耐药均无显著性关联。本研究结果与有关研究结果一致[22],即北京基因型菌株在中国广泛流行但与耐药无关,这也与国内其他研究结果一致[16]。
本研究的局限性:本研究采用具有中国代表性的菌株分析了北京基因型菌株与耐药表型之间的关系,但是北京基因型菌株是一大家族,根据不同的分子标示可将北京基因型菌株分为不同的亚型或谱系,不同亚型或谱系的北京基因型菌株其耐药表型或许不同,应进行深入研究。
[1] van Soolingen D, Qian L, de Haas PE, et al. Predominance of a single genotype ofMycobacteriumtuberculosisin countries of east Asia. J Clin Microbiol, 1995, 33(12):3234-3238.
[2] Pang Y, Zhou Y, Zhao B, et al. Spoligotyping and drug resistance analysis ofMycobacteriumtuberculosisstrains from national survey in China. PLoS One, 2012, 7(3):e32976.
[3] Glynn JR, Whiteley J, Bifani PJ, et al. Worldwide occurrence of Beijing/W strains ofMycobacteriumtuberculosis: a systematic review. Emerg Infect Dis, 2002, 8(8):843-849.
[4] Bifani PJ, Mathema B, Kurepina NE, et al. Global dissemination of theMycobacteriumtuberculosisW-Beijing family strains. Trends Microbiol, 2002, 10(1): 45-52.
[5] Ribeiro SC, Gomes LL, Amaral EP, et al.Mycobacteriumtuberculosisstrains of the modern sublineage of the Beijing family are more likely to display increased virulence than strains of the ancient sublineage. J Clin Microbiol, 2014, 52(7): 2615-2624.
[6] Parwati I, Alisjahbana B, Apriani L, et al.MycobacteriumtuberculosisBeijing genotype is an independent risk factor for tuberculosis treatment failure in Indonesia. J Infect Dis, 2010, 201(4): 553-557.
[7] Burman WJ, Bliven EE, Cowan L, et al. Relapse associated with active disease caused by Beijing strain ofMycobacteriumtuberculosis. Emerg Infect Dis, 2009, 15(7): 1061-1067.
[8] Toungoussova OS, Sandven P, Mariandyshev AO, et al. Spread of drug-resistantMycobacteriumtuberculosisstrains of the Beijing genotype in the Archangel Oblast, Russia. J Clin Microbiol, 2002, 40(6): 1930-1937.
[9] Duong DA, Nguyen TH, Nguyen TN, et al. Beijing genotype ofMycobacteriumtuberculosisis significantly associated with high-level fluoroquinolone resistance in Vietnam. Antimicrob Agents Chemother, 2009, 53(11): 4835-4839.
[10] Hang NT, Maeda S, Lien LT, et al. Primary drug-resistant tuberculosis in Hanoi, Viet Nam: present status and risk factors. PLoS One, 2013, 8(8):e71867.
[11] Haeili M, Darban-Sarokhalil D, Fooladi AA, et al. Spoligotyping and drug resistance patterns ofMycobacteriumtuberculosisisolates from five provinces of Iran. Microbiologyopen, 2013, 2(6): 988-996.
[12] Zanini F, Carugati M, Schiroli C, et al.MycobacteriumtuberculosisBeijing family: analysis of the epidemiological and clinical factors associated with an emerging lineage in the urban area of Milan. Infect Genet Evol, 2014, 25: 14-19.
[13] Jiao W, Liu Z, Han R, et al. A country-wide study of spoligotype and drug resistance characteristics ofMycobacteriumtuberculosisisolates from children in China. PLoS One, 2013, 8(12): e84315.
[14] Zhao LL, Chen Y, Chen ZN, et al. Prevalence and molecular characteristics of drug-resistantMycobacteriumtuberculosisin Hunan, China. Antimicrob Agents Chemother, 2014, 58(6): 3475-3480.
[15] Zhang Z, Lu J, Wang Y, et al. Prevalence and molecular cha-racterization of fluoroquinolone-resistantMycobacteriumtubercu-losisisolates in China. Antimicrob Agents Chemother, 2014, 58(1): 364-369.
[16] Yang C, Luo T, Sun G, et al.MycobacteriumtuberculosisBeijing strains favor transmission but not drug resistance in China. Clin Infect Dis, 2012, 55(9):1179-1187.
[17] World Health Organization. Global tuberculosis report. WHO/HTM/TB/2012.6. Geneva: World Health Organization,2012.
[18] Kamerbeek J, Schouls L, Kolk A, et al. Simultaneous detection and strain differentiation ofMycobacteriumtuberculosisfor diagnosis and epidemiology. J Clin Microbiol, 1997, 35(4): 907-914.
[19] 柴利泉,李卫民,李丽,等. 天津地区临床分离结核分枝杆菌分型的初步研究. 中华流行病学杂志,2007, 28(8):785-788.
[20] 余琴,苏云开,吕冰,等. 内蒙古自治区结核分枝杆菌Spoligotyping分型及北京家族分析.中国防痨杂志,2013, 35(4):276-281.
[21] Yuan L, Huang Y, Mi LG, et al. There is no correlation between sublineages and drug resistance ofMycobacteriumtuberculosisBeijing/W lineage clinical isolates in Xinjiang,China. Epidemiol Infect, 2015, 143(1): 141-149.
[22] European Concerted Action on New Generation Genetic Mar-kers and Techniques for the Epidemiology and Control of Tuber-culosis. Beijing/W genotypeMycobacteriumtuberculosisand drug resistance. Emerg Infect Dis, 2006, 12(5): 736-743.
(本文编辑:薛爱华)
Epidemic characteristics ofMycobacteriumtuberculosisof Beijing genotype strains and its association with drug resis-tance——Analysis of the data from national drug resistant tuberculosis baseline survey in 2007
WANGSheng-fen,ZHOUYang,PANGYu,ZHAOYan-lin.
DepartmentofTuberculosisReferenceLaboratory,NationalCenterforTuberculosisPreventionandControl,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
ZHAOYan-lin,Email:zhaoyanlin@chinatb.org
Objective To explore epidemic characteristics ofMycobacteriumtuberculosisof Beijing genotype and associations of Beijing genotype strains with drug resistance. Methods National tuberculosis (TB) drug resistance baseline survey was conducted in 2007, 70 clusters were randomly selected from 31 provinces (Autonomous region, Municipalities), excepting Hongkong, Macao and Taiwan regions. 3861Mycobacteriumtuberculosisstrains isolated from smear positive TB patients participating in the survey were analyzed in this study. Drug susceptibility test was determined by the proportion method,Mycobacteriumtuberculosisstrains were genotyped by spacer oligonucleotide typing (spoligotyping). Database was set up by use of Epi Info software, version 3.5.1 (CDC), and the data was analyzed by SAS software, version 9.1, Chi-square test was used to explore associations between different variables and the level of significance was set toP<0.05. Results Beijing strains ofMycobacteriumtuberculosiswere widespread in China, the total prevalence was 63.97% (2470/3861). There were no statistical significant associations between Beijing genotype strains infected with age (<30 vs ≥60:OR=0.9604,95%CI=0.7995-1.1536;30- vs ≥60:OR=1.0620,95%CI=0.9071-1.2434,χ2=0.3885,Ptrend=0.6977), sex (OR=1.1526,95%CI=0.9973-1.3321,χ2=3.7024,P=0.0543), respectively; there were no statistical significant associations between Beijing genotype strains and any resistant to INH (OR=0.9020,95%CI=0.766-1.0619,χ2=1.5356,P=0.2153), RFP (OR=1.0017,95%CI=0.8166-1.2288,χ2=0.0003,P=0.9868), Sm (OR=0.9406,95%CI=0.8139-1.08711,χ2=0.6869,P=0.4072), EMB (OR=0.9222,95%CI=0.7205-1.1804,χ2=0.4140,P=0.5199), Ofx (OR=0.9624,95%CI=0.6923-1.3378,χ2=0.0520,P=0.8196), Km (OR=1.1666,95%CI=0.7624-1.7852,χ2=0.5049,P=0.4774), respectively; and we did not find any associations between Beijing genotype strains and monodrug resistant to INH (OR=0.9955,95%CI=0.7206-1.3753,χ2=0.0007,P=0.9783), RFP (OR=0.9615,95%CI=0.4880-1.8944,χ2=0.0129,P=0.9096), EMB (OR=0.5533,95%CI=0.2023-1.5136,χ2=1.3675,P=0.2422), Ofx (OR=0.8445,95%CI=0.3965-1.7984,χ2=0.1926,P=0.6608), Km (OR=1.7779,95%CI=0.4440-7.1203,χ2=0.6791,P=0.4099), respectively; also, there were no significant associations between Beijing genotype strains and multidrug resistance (MDR) (OR=0.9884,95%CI=0.7594-1.2284,χ2=0.0110,P=0.9166), extensively drug resistance (XDR) (OR=1.1502,95%CI=0.5372-2.4626,χ2=0.1300,P=0.7185)TB. Conclusion Beijing genotype strains are highly prevalent in China, there are no significant associations with age or sex, and there are no significant associations between Beijing genotype strains and drug resistance.
Mycobacteriumtuberculosis; Genotype; Drug Resistance, Bacterial; Prevalence
10.3969/j.issn.1000-6621.2015.08.008
“十二五”国家重大科技专项(2014ZX10003001-001)
102206 北京,中国疾病预防控制中心结核病预防控制中心参比实验室
赵雁林,Email: zhaoyanlin@chinatb.org
2015-05-20)

