不同靶点环介导等温扩增技术对结核分枝杆菌检测的比较研究
刘洋 郭艳玲 姜广路 孙琦 郑素华 张宗德
不同靶点环介导等温扩增技术对结核分枝杆菌检测的比较研究
刘洋 郭艳玲 姜广路 孙琦 郑素华 张宗德
目的 探讨针对hspX、gyrB、IS6110靶基因设计引物,采用环介导等温扩增技术(LAMP)检测对结核病的诊断价值。方法 肺结核组为我院收治的68例肺结核患者,对照组为我院收治的45例肺癌患者和20名健康体检者,收集痰标本后采用LAMP、定量PCR及涂片法进行分析,评价LAMP 技术的临床应用价值。采用LAMP及定量PCR分别对结核分枝杆菌标准株H37Rv的DNA样品进行检测,评价LAMP技术的检测限;同时对鸟分枝杆菌、胞内分枝杆菌、瘰疬分枝杆菌、偶发分枝杆菌、耻垢分枝杆菌、海分枝杆菌、龟分枝杆菌和堪萨斯分枝杆菌等8种非结核分枝杆菌菌株及4株普通菌标准株包括大肠埃希菌(ATCC25922)、阴沟肠杆菌(ATCC700323)、铜绿假单胞菌(ATCC 27853)和金黄色葡萄球菌标准菌株(ATCC29213)进行鉴定,评价LAMP的敏感度和特异度。结果 本研究采用hspX、IS6110和gyrB靶基因进行LAMP检测,对H37Rv的DNA样品检测限分别为320 amol/L,320 amol/L和32 amol/L。 LAMP对 8种非结核分枝杆菌和4种普通菌检测结果为阴性。对照组中健康志愿者定量PCR ,涂片法及LAMP 方法的结果均为阴性,对照组中肺癌患者中hspX,gyrB,IS6110 LAMP 方法和定量PCR阳性结果2例,3种靶基因位点的LAMP和定量PCR检测的特异度均为96.9%(63/65)。针对hspX、gyrB、IS6110靶基因进行LAMP检测,对68例肺结核患者痰标本检测的敏感度分别为75.0%(51/68),77.9%(53/68),73.5%(50/68);定量PCR检测的敏感度为79.4%(54/68)。3种不同基因位点LAMP技术与定量PCR检测的敏感度比较差异无统计学意义(χ2=0.82,P>0.05),但均高于涂片法的38.2%(26/68),LAMP技术与涂片法之间差异均有统计学意义(χ2=18.71,χ2=22.02,χ2=17.18,P值均<0.01)。结论hspX、gyrB、IS6110 LAMP技术检测的敏感度和特异度均较高,尤其是针对gyrB靶基因位点进行 LAMP 检测的敏感度与定量PCR接近,并且高于涂片法;如果结合不同基因位点LAMP技术的检测结果进行评判可以提高该技术的敏感度。
结核分枝杆菌; 核酸扩增技术; 结核, 肺/诊断
目前,结核病仍然是感染性疾病致死的主要原因,特别是在发展中国家。以培养为金标准的细菌学诊断方法由于结核分枝杆菌生长较为缓慢,不能为结核病的诊断提供快速、及时的帮助。因此找到一种快速、准确、低成本的诊断方法显得尤为重要。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是一种比较新型的等温核酸扩增方法。该方法针对靶基因的特定区域设计特异引物,使用链置换BstDNA聚合酶在恒温条件即可完成核酸扩增反应,扩增出LAMP特征性梯状条带。本研究采用针对3种不同靶基因位点(包括hspX基因、gyrB基因、IS6110基因)设计引物,采用LAMP方法对结核分枝杆菌标准株及临床痰标本进行检测,评价不同靶基因位点进行LAMP检测对结核病的诊断价值。
材料和方法
一、 研究对象
肺结核组来自2012年3月至12月在我院结核科就诊的肺结核患者68例,所有患者均经涂片法、培养法和放射学检查确诊,诊断标准参照《肺结核诊断和治疗指南》[1],年龄18~63岁,平均(42±6)岁。对照组包括同期我院收治的肺癌患者45例及我院健康体检合格的志愿者20名,年龄22~60岁,平均(39.2±5)岁。收集肺结核患者、肺癌患者和健康志愿者晨痰2~4 ml,采用金胺O染色法进行痰涂片镜检,其中涂阳肺结核患者26例,涂阴肺结核患者42例,对照组中肺癌患者和健康志愿者涂片均为阴性。本研究经北京市胸科医院伦理委员会批准,所有纳入研究者均签署了知情同意书。
二、分枝杆菌培养和DNA提取
H37Rv标准菌株和鸟分枝杆菌、胞内分枝杆菌、瘰疬分枝杆菌、偶发分枝杆菌、耻垢分枝杆菌、海分枝杆菌、龟分枝杆菌和堪萨斯分枝杆菌等8种非结核分枝杆菌菌株由国家结核病参比实验室提供。另外有4株普通菌标准株包括大肠埃希菌(ATCC25922)、阴沟肠杆菌(ATCC700323)、铜绿假单胞菌(ATCC 27853)和金黄色葡萄球菌标准菌株(ATCC29213)。分枝杆菌采用Middlebrook 7H9 液体培养基 (BD公司生产,美国) 进行培养2~3周后,将培养基混匀后分装、冻存用于提取DNA。大肠埃希菌等4种菌株经麦康凯或哥伦比亚培养基过夜培养后进行DNA提取。采用DNA 提取纯化试剂盒(QIAamp DNA mini kit,Qiazen公司生产,德国)提取,定量。
痰液标本经液化处理后进行DNA提取。
三、 定量PCR 反应
反应在My IQTM iCycler(Bio-Rad公司生产,美国)定量PCR 仪进行。采用SsoFast EvaGreen Supermix(Bio-Rad公司生产,美国)试剂盒。反应体系是20 μl[2]。包括10 μl试剂混合液(Supermix),8 μl无菌水,1 μl DNA模板,1 μl 10 μmol/L引物(引物序列见表1)。PCR 反应条件是: 95 ℃ 10 min,1个循环; 95 ℃ 15 s, 60 ℃ 1 min,40个循环。
四、 环介导等温扩增技术
LAMP采用荧光目测试剂盒(荣研生物科技有限公司,中国)对临床痰标本及菌株DNA样本进行测定,具体操作按说明书进行。反应体系为25 μl,反应条件统一为: 63 ℃ 1 h后80 ℃ 2 min对酶进行灭活(3种基因靶点引物及定量PCR引物序列见表1)。
五、 检测限测定
1 ml H37Rv菌悬液经提取、纯化DNA后,定量,将纯化的DNA进行10倍连续倍比稀释。将稀释后的DNA 样品用做标准品用于LAMP 和定量PCR 检测限的测定[3]。
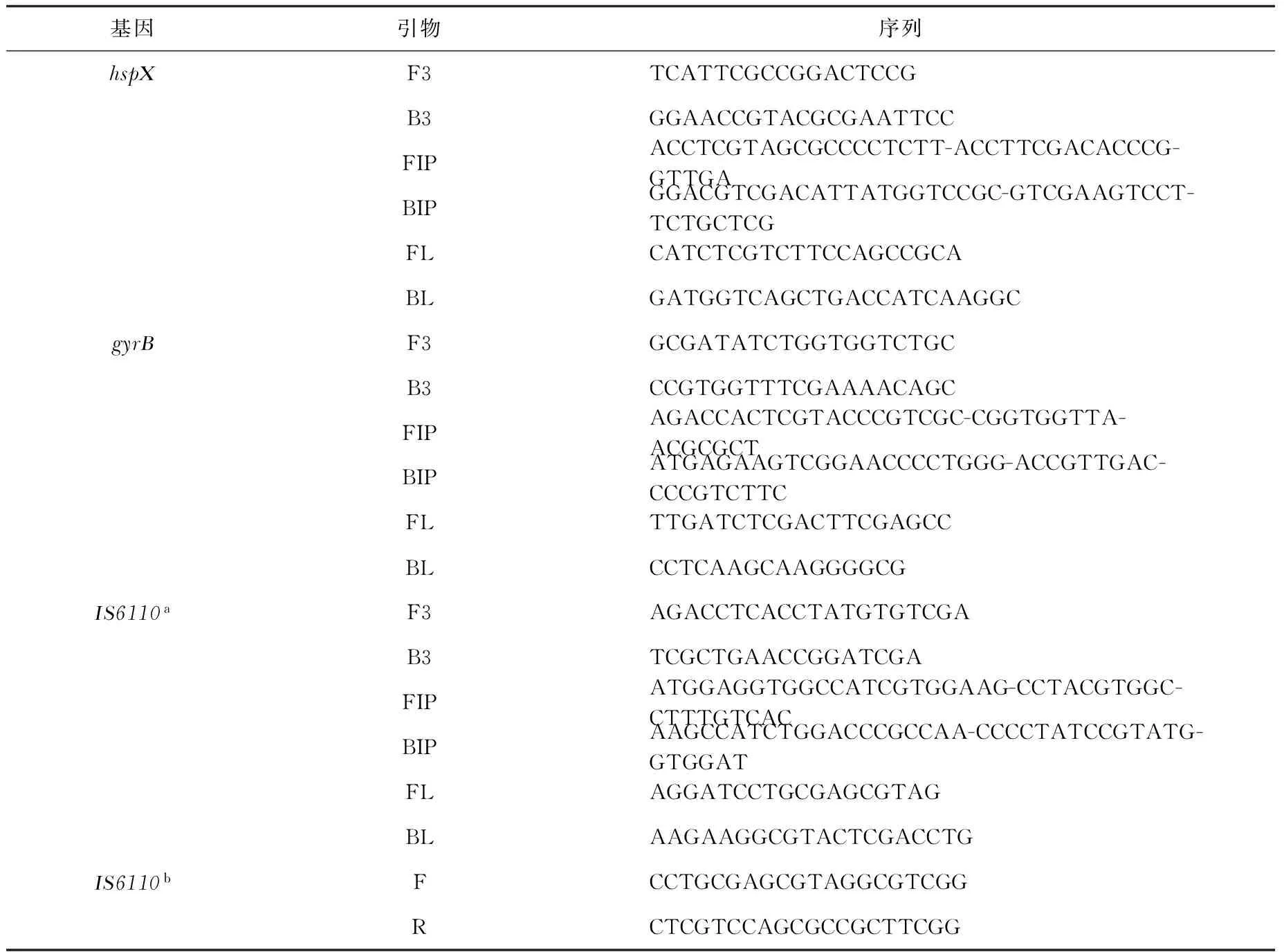
表1 hspX、gyrB、IS6110靶基因位点进行LAMP检测所需引物及IS6110定量PCR引物序列
注a:IS6110-LAMP基因;b:定量PCR所用引物基因。FIP和BIP为LAMP前内引物和后内引物,F3和B3为前外引物和后外引物,环引物为FL和BL
六、统计学处理
采用SPSS 17.0统计学软件进行数据分析。3种不同靶基因位点LAMP技术检测结果与定量PCR方法、涂片法检测结果之间采用χ2检验,以P<0.05为差异有统计学意义。
结 果
采用针对3种不同靶基因位点包括hspX、gyrB、IS6110基因设计引物的LAMP 技术和定量PCR方法,对H37Rv结核分枝杆菌标准菌株检测均为阳性;而鸟分枝杆菌、胞内分枝杆菌、瘰疬分枝杆菌、偶发分枝杆菌、耻垢分枝杆菌、海分枝杆菌、龟分枝杆菌和堪萨斯分枝杆菌等8种非结核分枝杆菌,以及大肠埃希菌、阴沟肠杆菌、铜绿假单胞菌和金黄色葡萄球菌等4种标准菌株进行检测,结果均未见扩增条带。
检测限的测定是用来分析LAMP技术和定量PCR方法在样品中检测的最小浓度。通过对连续倍比稀释H37Rv DNA 样品的检测,hspX和IS6110采用LAMP对DNA样品的检测限为320 amol/L,gyrB采用LAMP(图1)和定量PCR检测的检测限为32 amol/L。
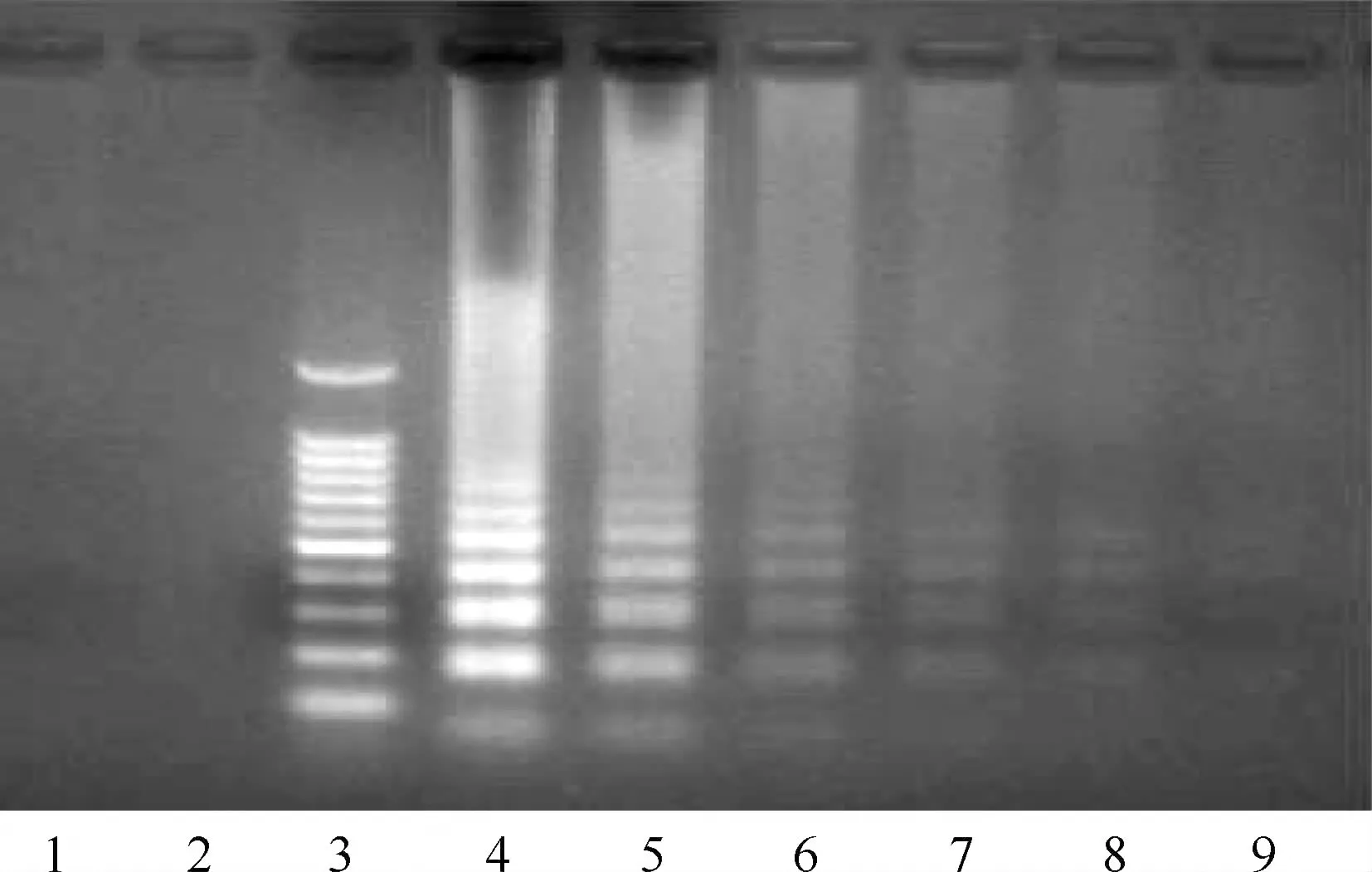
第3泳道为分子量标准,1为阴性对照,2为3.2 amol/L; 4~9泳道分别为3.2×106 amol/L,3.2×105 amol/L,3.2×104 amol/L,3.2×103 amol/L,3.2×102 amol/L,3.2×10 amol/L图1 结核分枝杆菌H37Rv标准株gyrB采用LAMP进行检测的电泳图
68例肺结核患者,hspX、gyrB、IS6110采用LAMP 检测的阳性结果分别为51、53和50 例。定量PCR 和涂片法的阳性例数分别为54和26例。hspX、gyrB、IS6110位点LAMP检测的敏感度分别是75.0%(51/68)、77.9%(53/68)和73.5%(50/68)。如果将3种靶基因检测结果进行联合评判,则敏感度可以达到82.4%(56/68)。3种不同靶基因位点LAMP检测的敏感度之间差异无统计学意义(χ2=0.37,P>0.05),但是均高于涂片法[38.2%(26/68)],差异具有统计学意义(P值均<0.01) (表2)。定量PCR 的检测敏感度为79.4%(54/68),与3种不同靶基因位点LAMP检测的敏感度之间差异无统计学意义(χ2=0.82,P>0.05)。
在26例涂阳肺结核患者的临床分离株采用3种靶基因位点进行LAMP检测的敏感度均为100%(26/26)(表2)。在42例涂阴肺结核患者的临床分离株采用3种靶基因位点进行LAMP检测和定量PCR检测,敏感度分别为59.5%(25/42)、64.3%(27/42)、 57.1% (24/42)和64.3%(27/42),LAMP与定量PCR检测的敏感度之间差异无统计学意义(χ2=1.01,P>0.05)。对照组中健康志愿者采用定量PCR、涂片法及LAMP 方法检测,结果均为阴性;对照组中肺癌患者hspX、gyrB、IS6110靶基因采用LAMP和定量PCR检测,阳性结果2例,特异度为96.9%(63/65)。
讨 论
本研究针对3种不同靶基因位点(包括hspX、gyrB、IS6110 )采用LAMP对结核分枝杆菌标准株、8种非结核分枝杆菌及大肠埃希菌等4种普通菌标准菌株进行检测。结果表明3种基因位点进行LAMP检测的特异度较高。在检测限的分析中,gyrB靶基因位点进行LAMP检测与定量PCR进行检测的检测限相同,其他2种靶基因位点进行LAMP检测与定量PCR进行检测的结果相差一个数量级。Bi等[4]采用hspX进行LAMP检测,对牛结核分枝杆菌的检测限为500株分枝杆菌/ml,与定量PCR进行检测的检测限相同。由于本研究采用H37Rv结核分枝杆菌标准株,与Bi等[4]的研究不同;另外可能由于3种靶基因在结核分枝杆菌基因组的拷贝数不同导致检测限存在差异。由于本研究采用统一的反应温度和时间,如果分别对不同靶基因位点进行LAMP检测的反应时间和温度进行优化,会进一步提高各自基因位点进行LAMP检测的检测限。
此外,几种方法进行临床痰标本的检测表明,LAMP检测的敏感度较高,3种靶基因位点进行LAMP检测的敏感度均显著高于涂片法;尤其是基于gyrB基因的LAMP检测其敏感度与定量PCR检测结果接近,即使检测涂阴肺结核患者,LAMP检测也表现出较好的敏感度,提示具有较大的应用价值。Nagdev 等[5]采用针对IS6110基因设计引物的LAMP技术对结核性脑膜炎患者的脑脊液标本进行分析,发现该方法的敏感度为88.23%、特异度为80%。本研究中hspX、gyrB、IS6110进行LAMP检测的敏感度分别为75.0%(51/68)、77.9%(53/68)、73.5%(50/68),如果将3种靶基因检测结果进行联合评判,则敏感度可以达到82.4%(56/68)。如果针对2种以上不同靶基因进行联合测定,通过联合不同靶基因位点的LAMP检测结果进行分析,有可能获得更高的敏感度和特异度,从而使该技术成为一种经济可行的肺结核诊断技术[4,6-8]。
本研究中对照组中健康志愿者LAMP 方法的检测结果均为阴性。对照组中肺癌患者中采用LAMP和定量PCR对2例患者进行检测,结果均为阳性;经查阅病历,2例肺癌患者在1年前均有结核病治疗史,分别经4个月和6个月抗结核治疗后由涂阳转阴。由于LAMP是针对DNA样品进行检测,无法区分活菌还是死菌,这也是LAMP技术的缺点之一。在特异度的分析中,对照组纳入了肺癌患者和健康志愿者,如果能增加肺炎等其他肺部感染患者将使特异度的分析更加全面。
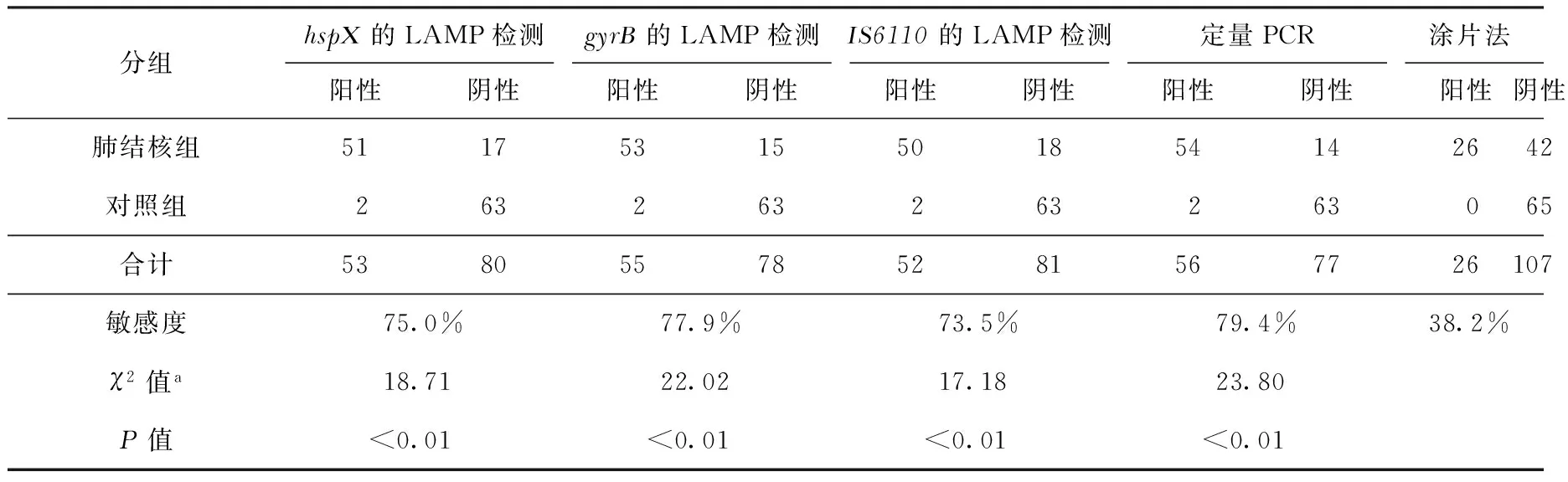
表2 LAMP、定量PCR和涂片法检测结果的比较(例)
注a:表中χ2值为3种LAMP方法及定量PCR技术分别与涂片法之间敏感度进行比较所得
目前,多个研究结果表明LAMP检测在微生物鉴别诊断中有较为广泛的应用前景,包括结核分枝杆菌、金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌,甚至是肝炎病毒的检测[9-13],由于该方法操作简单,并且不需特殊仪器,反应在1 h 左右即可完成,更适于在临床大规模推广。由于结核分枝杆菌培养时间较长,常规PCR检测费用较为昂贵,并且需要几个小时才能完成实验,如果采用LAMP进行检测,则可大大缩短反应时间,降低检测成本,更适于对临床痰等标本进行检测。
总之,hspX、gyrB、IS6110靶基因采用 LAMP检测的敏感度与定量PCR接近,远远好于涂片法,如果联合不同靶基因位点进行LAMP检测,可以提高诊断的敏感度和特异度。并且LAMP技术操作简单,适宜于在基层实验室推广。
[1] 中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001, 24(2): 70-74.
[2] Aldous WK, Pounder JI, Cloud JL, et al. Comparison of six methods of extractingMycobacteriumtuberculosisDNA from processed sputum for testing by quantitative real-time PCR. J Clin Microbiol, 2005,43(5): 2471-2473.
[3] Liu Y, Guo YL, Jiang GL, et al.Application of hyperbranched rolling circle amplification for direct detection ofmycobacteriumtuberculosisin clinical sputum specimens.PLoS One, 2013,8(6): e64583.
[4] Bi A, Nakajima C, Fukushima Y,et al. Rapid loop-mediated isothermal amplification assay targetinghspXfor the detection ofMycobacteriumtuberculosiscomplex. Jpn J Infect Dis, 2012,65(3): 247-251.
[5] Nagdev KJ, Kashyap RS, Parida MM, et al. Loop-mediated isothermal amplification for rapid and reliable riagnosis of tuberculous meningitis. J Clin Microbiol, 2011,49(5):1861-1865.
[6] Boehme CC, Nabeta P, Henostroza G,et al. Operational feasibility of using loop-mediated isothermal amplification for diagnosis of pulmonary tuberculosis in microscopy centers of deve-loping countries. J Clin Microbiol, 2007, 45(6): 1936-1940.
[7] George G, Mony P, Kenneth J. Comparison of the efficacies of loop-mediated isothermal amplification, fluorescence smear microscopy and culture for the diagnosis of tuberculosis. PLoS One, 2011,6(6):e21007.
[8] Aryan E, Makvandi M, Farajzadeh A, et al. A novel and more sensitive loop-mediated isothermal amplification assay targeting IS6110 for detection ofMycobacteriumtuberculosiscomplex. Microbiol Res,2010,165(3): 211-220.
[9] 于霞,马异峰,付育红,等. 环介导等温扩增法检测临床标本中结核分枝杆菌的系统评价. 中国防痨杂志, 2014,36(4): 260-266.
[10] Yang AK, Lu H, Wu SY, et al.Detection of Panton-Valentine Leukocidin DNA from methicillin-resistantStaphylococcusaureusby resistive pulse sensing and loop-mediated isothermal amplification with gold nanoparticles. Anal Chim Acta, 2013,782: 46-53.
[11] 刘孝波,蒋栋能,项贵明,等.LAMP 结合示差脉冲伏安法快速检测肺炎克雷伯菌的方法建立及临床应用.国际检验医学杂志,2014,35(12): 1539-1541.
[12] 戴然然,刘嘉琳,万欢英,等. 环介导等温扩增技术在检测细菌性肺炎常见致病菌中的应用.国际呼吸杂志,2011, 31(8):576-580.
[13] 张永乐,刘寿荣,杨劲,等. 荧光定量环介导逆转录等温扩增技术检测丙型肝炎病毒反应体系的建立. 中华微生物学和免疫学杂志,2011, 31(6): 564-566.
(本文编辑:范永德)
Detection ofMycobacteriumtuberculosisby loop-mediated isothermal amplification assay targeting different genes
LIUYang,GUOYan-ling,JIANGGuang-lu,SUNQi,ZHENGSu-hua,ZHANGZong-de.
BeijingChestHospital,CapitalMedicalUniversitiy;BeijingTuberculosisandThoracicTumorResearchInstitute,Beijing101149,China
ZHANGZong-de,Email:zzd417@163.com
Objective To evaluate a loop-mediated isothermal amplification (LAMP) assay targeting thehspX,gyrB, andIS6110 genes for the diagnosis of tuberculosis (TB). MethodsMycobacteriumtuberculosispre-sent in sputum samples from 68 pulmonary tuberculosis patients and control groups consisting of 45 lung cancer patients and 20 healthy controls were tested by LAMP, quantitative real-time PCR and smear microscopy to evaluate the value of the LAMP assay. The detection limit of the assay was evaluated by detectingMycobacteriumtuberculosisH37Rv reference strains with PCR and LAMP targeting the three genes. Specificity was evaluated using the follo-wing non-tuberculous mycobacteria (NTM):M.avium,M.intracellulare,M.srofulaceum,M.fortuitum,M.smegmatis,M.marinum,M.chelonaeandM.kansasii, and four other species of bacteria:E.coli(ATCC25922),Enterobactercloacae(ATCC700323),Pseudomonasaeruginosa(ATCC 27853) andStaphylococcusaureus(ATCC29213). Results The H37Rv reference strain was successfully detected by this method and no false-positive results were obtained for NTM or common bacteria. The detection limit of PCR for purified DNA from H37Rv was 32 amol/L and that forhspXLAMP,gyrBLAMP, andIS6110 LAMP were 320 amol/L, 32 amol/L and 320 amol/L, respectively. The detection sensitivity of the three LAMP methods for sputum from 68 pulmonary tuberculosis patients was 75.0% (51/68), 77.9% (53/68), and 73.5% (50/68), all of which were higher than that of smear microscopy, 38.2% (26/68), (χ2=18.71,χ2=22.02,χ2=17.18,P<0.01). There was no significant difference between the sensitivity of LAMP and that of quantitative real-time PCR (χ2=0.82,P>0.05). The specificity of detection usinghspXLAMP,gyrBLAMP, andIS6110 LAMP and PCR was 96.9% (63/65) in each case. Conclusion The sensitivity and specificity of the TB LAMP methods targeting thehspX,gyrBandIS6110 genes were higher than that of smear microscopy and close to that of PCR. Sensitivity could be improved by using a combination of TB LAMP methods targeting different genes.
Mycobacteriumtuberculosis; Nucleic acid amplification techniques; Tuberculosis, pulmonary/diagnosis
10.3969/j.issn.1000-6621.2015.08.009
北京市科技新星计划(2008A040); 北京市医院管理局临床医学发展专项(ZYLX201304);重大传染病防治协同创新中心(PXM2015_014226_000058)
101149 首都医科大学附属北京胸科医院流行病学研究室(刘洋、郑素华),检验科 (郭艳玲),国家结核病临床实验室(姜广路),分子生物学实验室(孙琦、张宗德)
注:刘洋与郭艳玲为并列第一作者
张宗德 ,Email: zzd417@163.com
2015-01-07)

