马西利亚分枝杆菌临床分离株的多位点序列鉴定和药物敏感性试验分析
魏剑浩 郭倩 李桂莲 刘海灿 李马超 吴移谋 楼永良 吕建新 万康林
·论著·
马西利亚分枝杆菌临床分离株的多位点序列鉴定和药物敏感性试验分析
魏剑浩 郭倩 李桂莲 刘海灿 李马超 吴移谋 楼永良 吕建新 万康林
目的 对单基因比对不能区分的马西利亚分枝杆菌(M.massiliense)临床分离株进行菌种鉴定,补充其药物敏感谱,为临床诊治提供依据。 方法 2013年中国疾病预防控制中心传染病预防控制所结核病室共收集了47例疑似非结核分枝杆菌(NTM)感染的临床样本,用对硝基苯甲酸、噻吩-2-羧酸肼培养基和多位点PCR方法区分鉴别得到的分枝杆菌,采用基因序列比对进行NTM菌种鉴定,其中未能准确鉴定菌种的6株临床分离株进一步通过多位点序列分析(MLSA)方法进行定种鉴定。采用微孔板阿尔玛蓝测定法(MABA)对马西利亚分枝杆菌菌株开展36种药物的药物敏感性试验(简称“药敏试验“)。 结果 47例临床样本中鉴定出34株NTM,其中6株临床分离株综合5个管家基因(16S rRNA、hsp65、rpoB、sodA和recA)的单基因比对结果仍不能鉴定菌种,因此本研究采用MLSA方法构建邻位相加法进化树确认6株均为马西利亚分枝杆菌。药敏试验结果显示M.massiliense对阿米卡星为敏感(16 μg/ml)或中度敏感(32 μg/ml),对利福平、异烟肼、乙胺丁醇、环丙沙星、乙硫异烟胺、卷曲霉素、对氨基水杨酸、氧氟沙星、卡那霉素、环丝氨酸、美罗培南、米诺环素12种药物耐药。 结论 MLSA方法能有效鉴定马西利亚分枝杆菌;马西利亚分枝杆菌耐药程度较高。
分枝杆菌属; 多位点测序分型; 微生物敏感性试验
马西利亚分枝杆菌(Mycobacteriummassiliense,M.massiliense)属于脓肿分枝杆菌复合群(Mycobacteriumabscessuscomplex),首次报道于2004年,由Adékambi等[1]从一位50周岁的女性患者的血痰中分离到该菌并对其命名。目前有报道的马西利亚分枝杆菌感染患者并不多见,相关的试验研究也不甚清楚,因此少数临床分离株仍有比较分析的必要。多位点序列分析(multilocus sequence analysis,MLSA)是近年来兴起的一种新的分类学方法,国内外已有报道应用于各类细菌的菌种鉴定[2-6],但国内用于非结核分枝杆菌(non-tuberculous Mycobacteria,NTM)的研究却少有报道。MLSA通过多基因位点的组合,能够更加直观、准确地将种类繁多的NTM进行菌种鉴定。本研究以2013年间中国疾病预防控制中心传染病预防控制所结核病室鉴定分离的NTM临床分离株中疑似马西利亚分枝杆菌的样本为研究对象,扩增测序16S rRNA、hsp65、rpoB、sodA和recA5个管家基因位点[5, 7],采用MLSA的方法最终确定6株马西利亚分枝杆菌,并进一步结合马西利亚分枝杆菌标准株DSM 45103进行微孔板阿尔玛蓝测定法(microplate Alamarblue assay,MABA)对36种抗结核药物进行体外药物敏感性试验(简称“药敏试验”),补充了马西利亚分枝杆菌对这些药物的敏感性数据。
材料和方法
一、菌株来源
2013年间中国疾病预防控制中心传染病预防控制所结核病室共接收到47例高度疑似NTM感染(分离培养后得到NTM、线型探针等技术检测疑似为NTM及诊断为“结核病”后治疗无效或效果不佳等情况)患者的临床样本,经初步培养鉴定后,分离到8株结核分枝杆菌,1株牛分枝杆菌(Mycobacteriumbovis),34株NTM。NTM临床分离株中最终确定了6株马西利亚分枝杆菌。其中湖南省结核病防治所2例,长春市传染病医院、福建省胸科医院、北京市胸科医院、北京协和医院各1例。马西利亚分枝杆菌标准株DSM 45103购自德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganis-men und Zellkulturen,DSMZ)。所有菌株均由本实验室培养保存并提供。
二、方法
(一)NTM筛选
本室接收的样本经过前处理后接种于改良罗氏培养基(L-J培养基)上,37 ℃培养4周后累计分离到43株临床分离株。挑选生长状态良好的菌落,经磨菌比浊制备成10-2mg/ml菌悬液,分别接种0.1 ml于对硝基苯甲酸(p-nitrobenzoic acid,PNB)和噻吩-2-羧酸肼(2-thiophene carboxylic acid hydrazide,TCH)培养基上并记录生长情况,同时能在PNB和TCH培养基上生长的菌株划归为NTM[8]。同时结合多位点PCR方法进行菌种鉴定[9],综合2种方法的结果分离到34株NTM。
(二)初步鉴定菌种
采用水煮法提取NTM菌株DNA,并于-20 ℃保存备用[10]。扩增测序hsp65和rpoB2个管家基因位点的序列信息,扩增引物见表2。PCR扩增体系为50 μl:10 μmol/L引物各2 μl,2×Taq Master Mix 25 μl,DNA模板5 μl,双蒸水(ddH2O)16 μl;阴性对照体系中不加DNA模板,ddH2O 21 μl,其他不变。扩增产物由北京天一辉远生物科技有限公司测序,并将基因序列提交美国国立生物技术信息中心(NCBI)数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对。

表1 马西利亚分枝杆菌感染患者情况
(三)多位点序列分析定种鉴定
选取疑似马西利亚分枝杆菌的临床分离株以16S rRNA、hsp65、rpoB、sodA和recA5个管家基因位点为目的片段进行扩增,扩增引物见表2。扩增体系同前文述。将各位点的序列拼接后用分子进化遗传分析(MEGA)5.10软件建立系统进化树,并选取脓肿分枝杆菌标准株CIP 104536、马西利亚分枝杆菌标准株CCUG 48898(与DSM 45103为同一菌株,此处为瑞典Göteborg大学菌物保藏中心编号,见文献[1])及2株龟分枝杆菌(Mycobacteriumchelonae,M.chelonae)标准株ATCC 19237和CIP 104535作为参照,采用多位点序列分析方法确定菌种。脓肿分枝杆菌、马西利亚分枝杆菌、龟分枝杆菌4株标准株的序列信息获取自NCBI数据库(http://www.ncbi.nlm.nih.gov/genbank)。
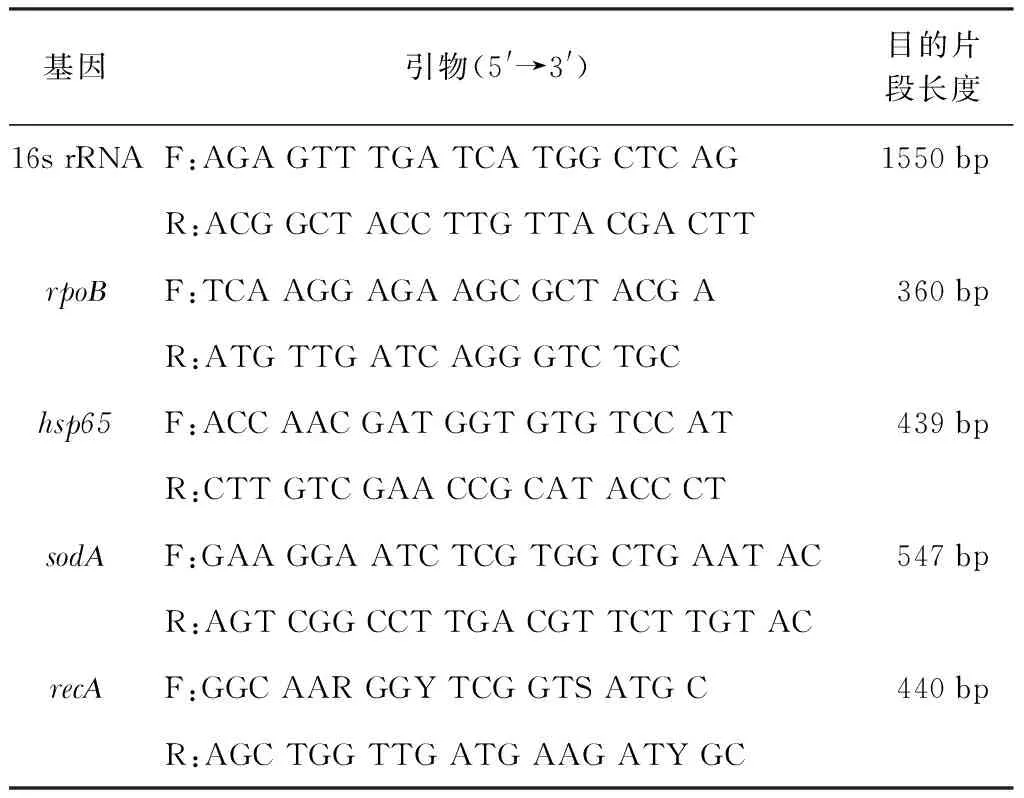
表2 各基因的引物序列[5, 7]
注 “F”表示上游引物,“R”表示下游引物
(四) 药敏试验
制备稀释菌液:刮取罗氏培养基上生长良好(约3周)的菌落,用生理盐水混悬成1个麦氏浓度(约为1 mg/ml),然后再以1∶20的比例用液体培养基稀释菌液,制成终浓度约为107CFU/ml的接种菌悬液。构建药物浓度梯度:在96孔板中除边缘各孔外,每孔加入100 μl液体培养基,并在板中对测试药物进行倍比稀释,制成表4所示相应药物的测试范围。最后每孔加入100 μl接种菌悬液。同时设置不含药物的生长对照孔及空白对照孔。实验结果判读:37 ℃培养3 d后每孔加入70 μl显色剂(20 μl阿尔玛蓝和50 μl 5%吐温-80)后再孵育1 d判读结果,其中阿米卡星、头孢西丁和阿奇霉素药敏试验于37 ℃孵育2 d后判读结果;而克拉霉素孵育时间应延至14 d后判读结果。96微孔板中颜色由蓝变红提示有菌株生长,没有变色的实验孔中读取到的最小药物浓度和已发生变色的实验孔中读取到的最大药物浓度即为该实验菌株对此药物的最小抑菌浓度(minimum inhibitory concentrations,MIC)[11-13]。数值大小反映药物对菌株的抑菌活性,数值越小,对应药物的抑菌活性越高。
本研究共选取了文献中有较多报道用于分枝杆菌病治疗的36种药物开展试验,并将接种菌悬液浓度稀释为107CFU/ml。试验中所用药物均购自美国Sigma-Aldrich集团公司。
结 果
一、分枝杆菌分离鉴定
47例疑似NTM感染患者的临床样本经过前处理后接种培养,累计成功分离到43株临床分离株。经PNB/TCH鉴别培养基和多位点PCR方法鉴定后,34株为NTM,8株为结核分枝杆菌,1株为牛分枝杆菌。测序34株NTMhsp65、rpoB2个管家基因位点的序列,并与NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对分析,发现6株临床分离株疑似为马西利亚分枝杆菌。
表3中,hsp65基因不能有效区分鉴定马西利亚分枝杆菌与脓肿分枝杆菌,rpoB基因仅能有效地将马西利亚分枝杆菌和脓肿分枝杆菌与龟分枝杆菌区分鉴定。在进一步补充测序16S rRNA、sodA和recA3个管家基因位点的序列并分析后,综合5个管家基因的比对结果仍不足以确认6株临床分离株均为马西利亚分枝杆菌。
因此,本研究采用MLSA方法进一步对疑似为马西利亚分枝杆菌的临床分离株进行菌种确定。综合16S rRNA、hsp65、rpoB、sodA和recA5个管家基因位点的序列分析,采用邻位相加法(Neighbor-joining method)建立进化树,迭代次数(bootstrap values)设定为1000,结果显示6株临床分离株与马西利亚分枝杆菌标准株CCUG 48898具有高度的同源性,聚类于同一簇,见图1。因此确定6株临床分离株均为马西利亚分枝杆菌。
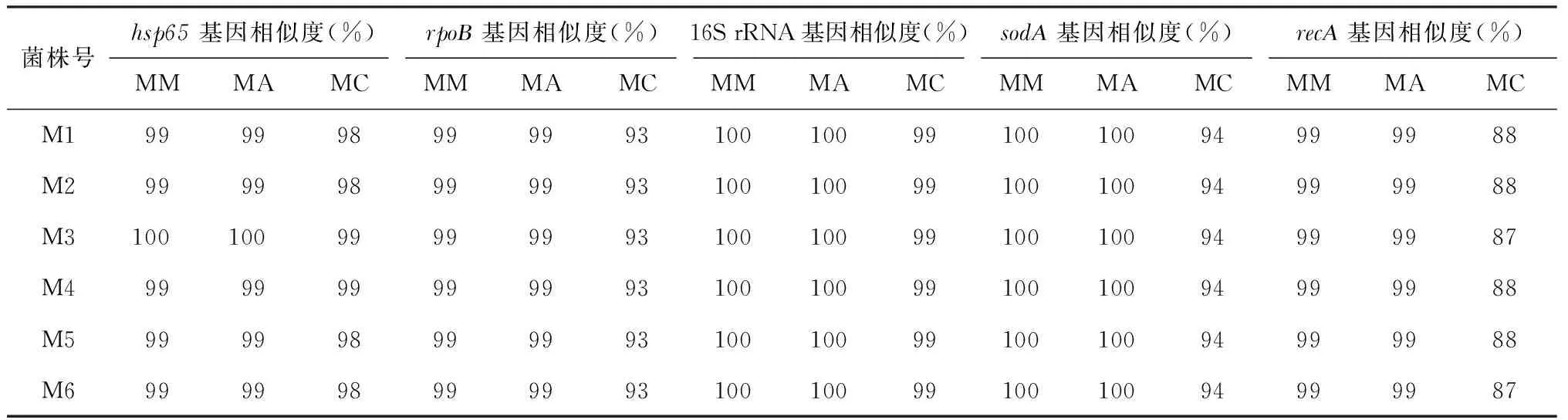
表3 hsp65与rpoB基因比对结果
注 MM:M.massiliense;MA:M.abscessus;MC:M.chelonae
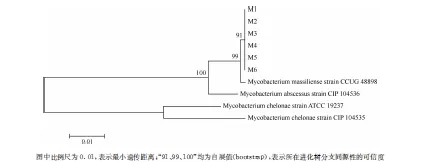
图1 MLSA方法菌种鉴定邻位相加法进化树
分析6例马西利亚分枝杆菌感染患者情况后发现,咳嗽、咯痰、咯血、咽痛、头痛、发热是最常见的疾病症状,其中咳嗽和咯痰是这些马西利亚分枝杆菌感染患者共有的临床表现。
二、药敏试验
参照快速生长分枝杆菌(rapidly growingMycobacterium,RGM)体外药物敏感试验参考界值[17-20],马西利亚分枝杆菌对氧氟沙星、卡那霉素、利福平、异烟肼、乙胺丁醇、环丙沙星、乙硫异烟胺、卷曲霉素、对氨基水杨酸、环丝氨酸、美罗培南、米诺环素12种药物均耐药,对阿米卡星为敏感或中度敏感,对克拉霉素、利奈唑胺、头孢西丁的敏感率较高(>50%)。其中6株马西利亚分枝杆菌临床分离株(M1~M6)对力克菲蒺、头孢哌酮、氨硫脲、氨苯砜4种药物高度不敏感;对氧氟沙星、卡那霉素、莫西沙星、异烟肼、利福平、乙胺丁醇、环丙沙星、乙硫异烟胺、卷曲霉素、对氨基水杨酸、多西环素、复方新诺明、环丝氨酸、美罗培南、米诺环素15种药物均耐药,罗红霉素、司帕沙星、四环素、加替沙星、头孢美唑、阿奇霉素、红霉素、利福喷丁8种药物对临床分离株有不同的抑制作用。与标准株的结果相比,临床分离株对莫西沙星、利奈唑胺、利福平、多西环素、复方新诺明、氨苯砜6种药物的敏感度均较马西利亚分枝杆菌标准株差,对异烟肼、乙硫异烟胺、卷曲霉素、对氨基水杨酸、力克菲蒺、环丝氨酸、头孢哌酮、米诺环素8种药物的敏感度与马西利亚分枝杆菌标准株一致且均为耐药或高度不敏感,M3、M4、M5菌株对头孢吡肟的敏感度优于标准株,M1、M6菌株对红霉素的敏感度优于标准株(表4)。
讨 论
一、菌种鉴定与菌株分析
长期以来,因为分枝杆菌特殊的生长特性,一直使其快速分离鉴定较为困难。随着分子生物学研究和基因测序技术的发展,基于基因序列检测的菌种鉴定技术已开始应用于分枝杆菌的菌种鉴定。近年来有研究表明,单个基因测序比对或基因的组合比对,已不能满足现有的菌种鉴定需求[18-19]。单个基因序列所携带的遗传信息有限,用于菌种鉴定时分辨能力也受到限制,对于该基因同源性较高的菌种甚至不能有效区分[如西瓦堤分枝杆菌(M.silvaticum)与副结核分枝杆菌(M.paratuberculosis)][20];而基因的组合比对则可能面临比对结果不一致的局面,特别是近些年来的研究证实在NTM菌种间存在着横向基因转移(lateral gene transfer,LGT)事件[如永宫分枝杆菌(M.yongonense)与副瘰疬分枝杆菌(M.parascrofulaceum)][21]。随着hsp65、rpoB等基因在菌种鉴定中的广泛应用,sodA、recA等管家基因也被证明能通过片段比对区分和鉴定菌种,并有文献报道了一种多位点序列分析(MLSA)方法鉴定分枝杆菌的新思路[2-6]。与基因位点的单独比对相比,MLSA的结果更加真实高效的反应了细菌基因组的特征,能有效避免基因单独比对时掩盖其他基因特征的情况,又同时避免全基因组测序的高昂成本和时间损失,因此对于种类繁多且同源性较高的NTM有较高的鉴别区分能力。针对本研究所遇到的菌种不易区分鉴定的问题,我们选取了MLSA方法鉴定菌种。由表3可见,不论是初次鉴定选取的hsp65和rpoB基因还是后来补充的其他3种基因均不能区分马西利亚分枝杆菌与脓肿分枝杆菌,尝试对5个管家基因序列进行组合也仅能将马西利亚分枝杆菌和脓肿分枝杆菌与龟分枝杆菌进行有效的鉴定区分,并不能准确将6株临床分离株鉴定到种,而MLSA方法则直观准确的解决了这一问题。由图1可以看出,各临床分离株之间虽互有差异,但仍有较高的同源性;而临床分离株所在的分支与马西利亚分枝杆菌标准株聚类于同一簇且同源性可信度高(自展值99),由此确认6株临床分离株均为马西利亚分枝杆菌。
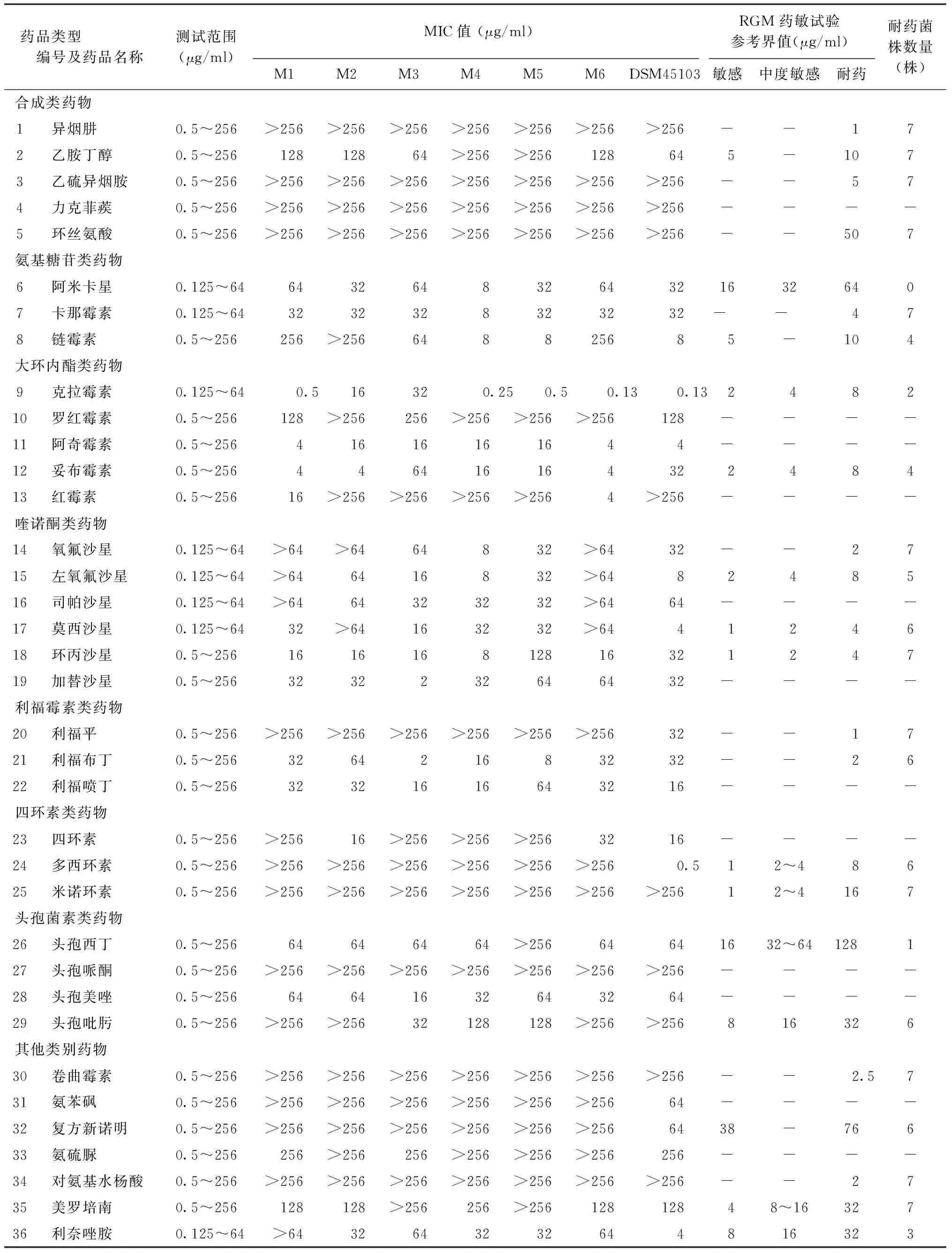
表4 马西利亚分枝杆菌临床分离株及标准株DSM 45103药敏试验结果
注 以上表中数据(除明确标注外)单位均为:μg/ml;MIC:最小抑菌浓度;RGM:快速生长分枝杆菌;“-”表示未找到该数据;M1、M2、M3、M4、M5、M6分别表示6株临床分离株;DSM 45103为马西利亚分枝杆菌标准株;复方新诺明的参考界值表示抑制80%细菌生长的药物浓度;药敏试验参考界值详见参考文献[14-17]
在目前的文献报道中,对RGM的研究日益增多,但马西利亚分枝杆菌的相关资料却并不充分,这可能与马西利亚分枝杆菌的低感染率和菌种鉴定方法滞后有关[22]。仅就本次研究而言,马西利亚分枝杆菌感染与年龄和性别无明显关系,而咳嗽和咯痰则是这些患者共有的临床表现。
二、药敏试验结果分析
由于NTM对常见的抗结核药物的普遍耐药和马西利亚分枝杆菌感染患者的报道相对匮乏,临床对马西利亚分枝杆菌感染患者的治疗仍未形成统一标准,实际工作中常对患者采取经验性用药控制症状[22-23]。为了筛选出对马西利亚分枝杆菌感染患者有效的治疗药物,本次试验除按照美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)(M24-A2,2011)[14]方案中推荐的药物开展试验外,我们另选取了文献中有较多报道用于NTM病治疗的26种药物同时开展试验。在制定试验方法时,为更好的对药敏实验结果进行判读,我们结合参考文献[11-17]最终选定终浓度约为107CFU/ml的菌悬液开展试验,并在判读结果时使用阿尔玛蓝作为显色剂。在本次试验中,马西利亚分枝杆菌临床分离株对力克菲蒺、头孢哌酮、氨硫脲、氨苯砜4种药物在最高测试浓度时仍显示耐药,因此判定其为高度不敏感。罗红霉素、司帕沙星、四环素、加替沙星、头孢美唑、阿奇霉素、红霉素、利福喷丁 8种药物虽未查阅到可参考的药敏界值,但均在试验浓度范围内对部分临床分离株有抑制作用,特别是阿奇霉素在较低浓度范围时即有抑制作用,可成为今后进一步验证的目的药物。马西利亚分枝杆菌临床分离株与标准株的药物敏感度有所不同,且各临床分离株之间对药物的敏感度也各有差异,这可能与患者在疾病过程中的治疗经历有关[22]。结合马西利亚分枝杆菌标准株的药敏试验结果,马西利亚分枝杆菌对氧氟沙星、卡那霉素、利福平、异烟肼、乙胺丁醇、环丙沙星、乙硫异烟胺、卷曲霉素、对氨基水杨酸、环丝氨酸、美罗培南、米诺环素12种药物均耐药,对力克菲蒺、头孢哌酮和氨硫脲在最高试验浓度仍高度不敏感,以上药物均应在临床治疗时谨慎使用。
韩国学者Lyu等[24]在对比分析了26株脓肿分枝杆菌肺病患者与22例马西利亚分枝杆菌肺病患者的治疗效果后认为:马西利亚分枝杆菌肺病患者的疗程相对较短且愈后较好;并结合体外药敏试验的结果认为一种大环内酯类药物(如克拉霉素)与阿米卡星、头孢西丁等药物的联合应用对马西利亚分枝杆菌肺病有较好的疗效(21/22,治愈率95.5%)。我国学者聂文娟等[12]对21株马西利亚分枝杆菌的药敏试验表明:阿米卡星、阿奇霉素、亚胺培南和头孢西丁的体外抑菌活性较好。韩国学者Choi等[25]的研究则表明大环内酯类药物(克拉霉素和阿奇霉素)在治疗马西利亚分枝杆菌感染方面效果较好。尽管现阶段难以确定体外药敏试验结果与临床治疗效果的相关性,但在制定NTM病的治疗方案时,仍应尽可能结合药敏试验结果和用药史[8]。综合本次药敏试验结果,在对确诊为马西利亚分枝杆菌感染的患者进行治疗时,可考虑一种大环内酯类药物(如克拉霉素或阿奇霉素)与阿米卡星、头孢西丁等药物的联合应用。
2010年我国第五次结核病流行病学抽样调查结果显示:NTM在分枝杆菌分离株中占比高达22.9%[26]。在实际工作中,如何快速准确的将日益增多的NTM分离株鉴定菌种仍是一个亟需解决的问题。本研究受限于样本菌株数量较少,未能对马西利亚分枝杆菌的流行特征和致病机制做更多分析,但MLSA方法最终成功的将基因序列相似较高的马西利亚分枝杆菌与脓肿分枝杆菌区分鉴定,为日后开展NTM菌种鉴定特别是基因相似度较高的“复杂”菌株的鉴定提供了新的参考和思路。
[1] Adekambi T,Reynaud-Gaubert M,Greub G,et al. Amoebal coculture of “Mycobacterium massiliense” sp. nov. from the sputum of a patient with hemoptoic pneumonia. J Clin Microbiol, 2004, 42(12): 5493-5501.
[2] König C, Meinel DM1, Margos G, et al. Multilocus sequence typing of Corynebacterium ulcerans provides evidence for zoonotic transmission and for increased prevalence of certain sequence types among toxigenic strains. J Clin Microbiol, 2014, 52(12): 4318-4324.
[3] Mignard S,Flandrois JP. A seven-gene, multilocus, genus-wide approach to the phylogeny of mycobacteria using supertrees. Int J Syst Evol Microbiol, 2008, 58(Pt 6): 1432-1441.
[4] McTaggart LR,Doucet J,Witkowska M,et al. Antimicrobial susceptibility among clinical Nocardia species identified by multilocus sequence analysis. Antimicrob Agents Chemother, 2015, 59(1): 269-275.
[5] Adékambi T, Drancourt M. Dissection of phylogenetic relationships among 19 rapidly growing Mycobacterium species by 16S rRNA,hsp65,sodA,recAandrpoBgene sequencing. Int J Syst Evol Microbiol, 2004, 54(Pt 6): 2095-2105.
[6] 赵婷,程池. MLSA用于双歧杆菌快速鉴定研究进展. 中国乳品工业, 2011, 39(6): 46-50.
[7] Ben Salah I, Cayrou C, Raoult D, et al. Mycobacterium marseillense sp. nov., Mycobacterium timonense sp. nov. and Mycobacterium bouchedurhonense sp. nov., members of the Mycobacterium avium complex. Int J Syst Evol Microbiol, 2009, 59(Pt 11): 2803-2808.
[8] 中华医学会结核病学分会,《中华结核和呼吸杂志》编辑委员会. 非结核分枝杆菌病诊断与治疗专家共识. 中华结核和呼吸杂志, 2012, 35(8): 572-580.
[9] Huard RC, Lazzarini LC, Butler WR, et al. PCR-based me-thod to differentiate the subspecies of theMycobacteriumtuberculosiscomplex on the basis of genomic deletions. J Clin Microbiol, 2003, 41(4):1637-1650.
[10] 赵秀芹,连璐璐,易松林,等. 湖南省51株疑似非结核分枝杆菌临床分离株的菌种鉴定. 中国预防医学杂志, 2013,14(3):161-166.
[11] 张朝宝,王洪海,张舒林. 结核分枝杆菌最低抑菌浓度测定方法及临界值设置研究进展. 上海交通大学学报(医学版), 2012, 32(5): 661-666.
[12] 聂文娟,段鸿飞,黄海荣,等. 脓肿分枝杆菌菌种鉴定及药物敏感试验研究. 中华结核和呼吸杂志, 2014, 37(7): 517-521.
[13] Franzblau SG, Witzig RS, McLaughlin JC, et al. Rapid, low-technology MIC determination with clinicalMycobacteriumtuberculosisisolates by using the microplate Alamar Blue assay. J Clin Microbiol, 1998, 36(2):362-366.
[14] Clinical and Laboratory Standards Institute. Susceptibility Testing of Mycobacteria, Nocardiae, and Other Aerobic Actinomycetes. 2nd ed. Wayne:Clinical and Laboratory Standards Institute, 2011.
[15] van Ingen J, van der Laan T, Dekhuijzen R, et al. In vitro drug susceptibility of 2275 clinical non-tuberculous Mycobacterium isolates of 49 species in The Netherlands. Int J Antimicrob Agents, 2010, 35(2): 169-173.
[16] Broda A, Jebbari H, Beaton K, et al. Comparative drug resistance ofMycobacteriumabscessusandM.chelonaeisolates from patients with and without cystic fibrosis in the United Kingdom. J Clin Microbiol, 2013, 51(1): 217-223.
[17] Li G,Lian LL,Wan L,et al. Antimicrobial susceptibility of standard strains of nontuberculous mycobacteria by microplate Alamar Blue assay. PLoS One, 2013, 8(12): e84065.
[18] 王桂荣,付育红,梁倩,等. 应用多重PCR方法快速鉴定结核分枝杆菌复合群与非结核分枝杆菌的研究. 中国防痨杂志, 2013, 35(9): 686-689.
[19] 黄明翔. 非结核分枝杆菌病的实验室诊断技术进展. 中国防痨杂志, 2013, 35(7): 538-541.
[20] Ben Salah I, Adékambi T, Raoult D, et al.rpoBsequence-based identification ofMycobacteriumaviumcomplex species. Microbiology, 2008, 154(Pt 12): 3715-3723.
[21] Kim BJ,Hong SH,Kook YH,et al. Molecular evidence of la-teral gene transfer in rpoB gene of Mycobacterium yongonense strains via multilocus sequence analysis. PLoS One, 2013, 8(1): e51846.
[22] van Ingen J,Boeree MJ,van Soolingen D,et al. Resistance mechanisms and drug susceptibility testing of nontuberculous mycobacteria. Drug Resist Updat, 2012, 15(3): 149-161.
[23] 吴晓光,高孟秋,马丽萍. 非结核分枝杆菌病50例临床分析. 中国防痨杂志, 2009, 31(8): 481-483.
[24] Lyu J,Kim BJ,Kim BJ,et al. A shorter treatment duration may be sufficient for patients with Mycobacterium massiliense lung disease than with Mycobacterium abscessus lung disease. Respir Med, 2014, 108(11):1706-1712.
[25] Choi GE,Shin SJ,Won CJ,et al. Macrolide treatment for Mycobacterium abscessus and Mycobacterium massiliense infection and inducible resistance. Am J Respir Crit Care Med, 2012, 186(9): 917-925.
[26] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室. 2010年全国第五次结核病流行病学抽样调查报告. 中国防痨杂志, 2012, 34(8): 485-508.
(本文编辑:郭萌)
Species identification with multilocus sequence analysis and drug-sensitivity test inMycobacteriummassilienseclinical isolates
WEIJian-hao*,GUOQian,LIGui-lian,LIUHai-can,LIMa-chao,WUYi-mou,LOUYong-liang,LÜJian-xin,WANKang-lin.
*SchoolofLaboratoryMedicineandLifeScience,WenzhouMedicalUniversity,Wenzhou325035,China(*NowinStateKeyLaboratoryforInfectiousDiseasePreventionandControl,NationalInstituteforCommunicableDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China)Correspondingauthor:WANKang-lin,Email:wankanglin@icdc.cn;LÜJian-xin,Email:jxlu313@163.com
Objective To confirm the species of the clinical isolates suspectedMycobacteriummassiliense(M.massiliense) which could not be identified by the single gene comparison, and test their drug-sensitivity spectrum to provide the basis of clinical diagnosis and treatment. Methods In 2013,we collected 47 clinical samples of the patients suspected with non-tuberculous Mycobacteria (NTM) infection in Tuberculosis Laboratory of National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention. TheMycobacteriaisolates were determined with the media containing p-nitrobenzoic acid (PNB) and 2-thiophene carboxy-lic acid hydrazide (TCH) respectively and multilocus PCR. Five house-keeping genes (16S rRNA,hsp65,rpoB,sodAandrecA) were analyzed by DNA sequencing, and compared by Basic Local Alignment Search Tool (BLAST) to identifying the species of NTM, in which the species of 6M.massilienseisolates were confirmed by means of multilocus sequence analysis (MLSA). The drug-sensitivities ofM.massilienseisolates to 36 antibiotics were tested with the minimal inhibitory concentrations (MICs) by Microplate AlamarBlue Assay(MABA). Results Of 47 clinical samples from the patients suspected with NTM infection, 34 NTM strains were isolated, in which 6 strains could not be identified by DNA sequencing and BLAST using the single gene sequence comparison with five house-keeping genes. These strains were confirmed asM.massilienseby MLSA with a Neighbor-joining tree. The drug sensitive spectrum to 36 antibiotics showed thatM.massilienseisolates were sensitive to Amikacin (16 μg/ml or 32 μg/ml), resistant to 12 kinds of anti-tuberculosis drugs, rifampin, isoniazid, ethambutol, ciprofloxacin, ethionamide, capreomycin, para-aminosalicylic acid, ofloxacin, kanamycin, cycloserine, meropenem, and minocycline; and extremely insensitive to isoniazid aminosalicylate, cefoperazone and thioacetazone. Conclusion The MLSA method is effective in identification ofM.massiliensestrain.M.massiliensestrains had a higher degree of drug resistance.
Mycobacterium; Multilocus sequence typing; Microbial sensitivity tests
10.3969/j.issn.1000-6621.2015.03.016
“十二五”国家科技重大专项(2013ZX10003006-002-001);传染病预防控制国家重点实验室重点项目(2014SKLID104)
325035 温州医科大学检验医学院生命科学学院[魏剑浩、楼永良、吕建新、万康林(特聘教授)];中国疾病预防控制中心传染病预防控制所 传染病预防控制国家重点实验室[魏剑浩(研究生)、郭倩(研究生)、李桂莲、刘海灿、李马超、万康林];南华大学病原生物学研究所[郭倩、吴移谋、万康林(特聘教授)];感染性疾病诊治协同创新中心[万康林(特聘研究人员)]
万康林,Email:wankanglin@icdc.cn;吕建新,Email:jxlu313@163.com
2014-12-01)

