传统培养法与PCR-荧光探针法鉴定分枝杆菌的对比研究
张洁 邢青 王甦民 易俊莉 杨新宇 丁北川 苏建荣
·论著·
传统培养法与PCR-荧光探针法鉴定分枝杆菌的对比研究
张洁 邢青 王甦民 易俊莉 杨新宇 丁北川 苏建荣
目的 比较传统培养法和PCR-荧光探针法在分枝杆菌的鉴定中有无差异。方法 对1552 株分枝杆菌临床分离株同时用传统培养法对硝基苯甲酸(PNB)、噻吩二羧酸肼(TCH)培养基生长试验及PCR-荧光探针法进行鉴定,结果有差别的菌株用16SrRNA基因测序的方法进行确认。结果 两种方法非结核分枝杆菌的符合率为75.4%(46/61),结核分枝杆菌复合群的符合率为99.0%(1491/1506),总体符合率为99.0%(1537/1552)。两种方法检测结果不同的15株样本经16SrRNA基因测序进行鉴定,PCR-探针法与16SrRNA结果一致的有14株,另外1株经传代分离纯化后测序结果为结核分枝杆菌和戈登分枝杆菌的混合菌。非结核分枝杆菌对PNB培养基的敏感度为21.7%(13/60),有0.1%(1/1492)的结核分枝杆菌复合群对PNB表现耐受性。对PNB敏感的13株非结核分枝杆菌中,有76.9%(10/13)为堪萨斯分枝杆菌。结论 部分非结核分枝杆菌使用PNB-TCH生长试验进行鉴定时会出现误判,而PCR-荧光探针法鉴定结核分枝杆菌复合群和非结核分枝杆菌的准确性较高。
非结核分枝杆菌; 结核分枝杆菌; 细菌学技术; 聚合酶链反应; 对比研究
非结核分枝杆菌(non-tuberculosis mycobacteria, NTM)是分枝杆菌属内除结核分枝杆菌复合群和麻风分枝杆菌外的其他分枝杆菌的统称,是一类具有独特生物学特征,在形态、染色等性状方面类似结核分枝杆菌的不典型抗酸杆菌。2010年第五次全国结核病流行病学抽样调查数据显示,NTM的分离率为22.9%[1];NTM对大多数抗结核药物呈天然耐药性,因此,NTM病的早期诊断,对指导临床开展有效化疗意义重大。当前,实验室区分结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex, MTBC)与NTM,主要的生物表型鉴定方法之一是对硝基苯甲酸-噻吩二羧酸肼 (PNB-TCH)培养基生长试验,该方法是根据PNB在500 μg/ml的浓度下选择性抑制MTBC生长,而不抑制大多数NTM的生长来做区分,一般需要28 d才能给出报告。分子生物学理论及技术特别是以PCR为基础的分子鉴定技术的快速发展,为分枝杆菌分类鉴定开辟了新的途径。荧光定量PCR采用双重PCR技术和Taqman探针技术相结合,对分枝杆菌中提取的分枝杆菌核酸进行定性检测,分别针对MTBC和分枝杆菌的特异性序列设计引物和探针,两个探针分别标记不同的荧光发光基团,检测时,当反应体系中有目的基因存在时,随着PCR反应的进行,就会释放出荧光,通过检测不同荧光通道的荧光信号变化,进而实现对MTBC和NTM的鉴别,方法简便、快速,1个工作日可获得结果。
材料和方法
一、菌株和实验材料
1. 菌株:本研究所用的1552株临床分离株均由北京市结核病控制研究所菌株库提供,涂片均为抗酸染色阳性菌株。胞内分枝杆菌(ATCCl3950)、堪萨斯分枝杆菌(ATCCl2478)、戈登分枝杆菌(ATCCl4470) 3种NTM的标准株及结核分枝杆菌标准菌株(H37Rv)均由国家结核病参比实验室提供。
2. 材料:分枝杆菌培养管均由珠海贝索生物技术有限公司提供。中性罗氏培养管批号为20140429;含PNB的罗氏培养管批号为20140514;含TCH的罗氏培养管批号为20140506。分枝杆菌核酸检测试剂盒(批号为20080703)由博奥生物有限公司提供;核酸提取仪为博奥生物有限公司ExtractorTM36;低温高速离心机为德国Sigma 3K15;实时荧光定量PCR仪为罗氏480。
二、试验方法
1.复活菌株库中的1552株分枝杆菌临床分离株:将菌株库中的菌株从-80 ℃超低温冰箱转移到-40 ℃超低温冰箱1周后,从-40 ℃超低温冰箱转移到-20 ℃超低温冰箱;搁置1周后,再从-20 ℃冰箱转移到4 ℃冰箱保存。从冻存管中用加样枪吸取100 μl菌液转种于中性罗氏培养管中,在培养管上记录菌株的库号、患者姓名及接种日期,37 ℃孵育,每周观察1次生长状态,直至菌落长出。若培养4周还未长出,则重新吸取菌液传代,同时放入28 ℃、37 ℃孵箱孵育,直至菌落长出。
2.菌种生物表型鉴定:所有菌株均按照文献[2],使用含PNB和含TCH的罗氏培养管鉴定区分MTBC和NTM。取培养的阳性分枝杆菌菌株的菌悬液0.1 ml分别接种到含PNB和含TCH的罗氏培养管及对照管(普通罗氏培养基)中,36 ℃恒温培养4周,如对照管中分枝杆菌生长良好,则报告菌种初步鉴定实验结果;如果在对照管中没有生长,则需重新进行实验。TCH阳性、PNB阴性定为MTBC;TCH阳性、PNB阳性定为NTM。
3. PCR-荧光探针法:(1)核酸的提取:在核酸提取管中加入50 μl核酸提取液,再加入30 μl菌液,放入核酸提取仪,最大转速振荡5 min后95 ℃水浴5 min,3000×g离心2 min后放置于-20 ℃保存备用。(2)PCR扩增:配制扩增反应液,冰上放置,每个标本取2 μl(尽量吸取上层液体核酸),加入PCR扩增体系,将PCR管放入实时荧光定量PCR仪,设置扩增程序:37 ℃ 300 s、94 ℃ 180 s后,94 ℃ 15 s、60 ℃ 30 s,40个循环,50 ℃ 10 s。同时选择FAM和VIX通道,荧光采集点选择60 ℃ 30 s。(3)结果的判定:PCR结束后,根据样品的循环阈值(Ct值)及扩增曲线判断是否存在结核分枝杆菌和(或)非结核分枝杆菌。FAM通道阳性,VIC通道阴性或者阳性,均为MTBC;FAM通道阴性,VIC通道阳性,为NTM;FAM通道阴性,VIC通道阴性,无分枝杆菌。
4. 基因测序:两种方法检测结果不同的菌株,经传代分离纯化后提取核酸送至北京中科希林生物有限公司对16S rRNA基因测序,引物序列为:5′-CACATGCAAGTCGAACGGAAAGG-3′,5′-AG-CGTGCGGGCGATACGGGC-3′;测序结果与文库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对确定菌种类型。
5. 数据统计分析方法:两种方法检测结果使用配对四格表资料χ2检验,P<0.05为差异有统计学意义。
结 果
1.PNB-TCH生长试验与PCR-探针法检测结果:1552株培养阳性菌株中,PNB-TCH生长试验检出48株NTM,1504株MTBC,NTM分离率为3.1%(48/1552);PCR-探针法检出59株NTM,1493株MTBC,NTM分离率为3.8%(59/1552);两种方法检测结果不一致的菌株一共有15株。检测结果显示,NTM符合率为75.4%(46/61),MTBC符合率为99.0%(1491/1506),总体符合率为99.0%(1537/1552),差异有统计学意义(χ2=6.66,P<0.05) (表1)。
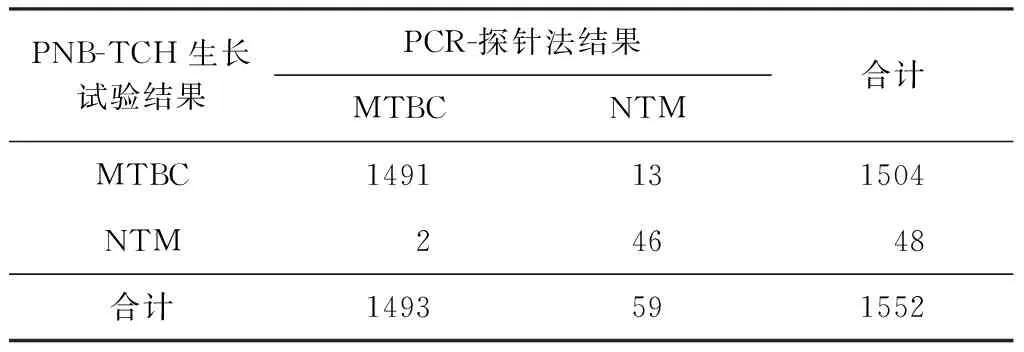
表1 临床菌株两种方法检测结果的比较(株)
2. 16S rRNA基因测序检测结果:以广泛应用的分枝杆菌核酸16SrRNA序列分类方法为标准,对PCR-探针法与PNB-TCH生长试验结果不同的15株样本进行验证:其中,PCR-探针法与16S rRNA测序结果一致者有14株;1个样本经传代分离纯化后测序结果显示,样本中包括结核分枝杆菌和戈登分枝杆菌 (表2)。NTM对PNB培养基的敏感度为21.7%(13/60),有0.1%(1/1492)的MTBC对PNB产生耐受性;对PNB敏感的13株NTM中,有76.9%(10/13)为堪萨斯分枝杆菌。
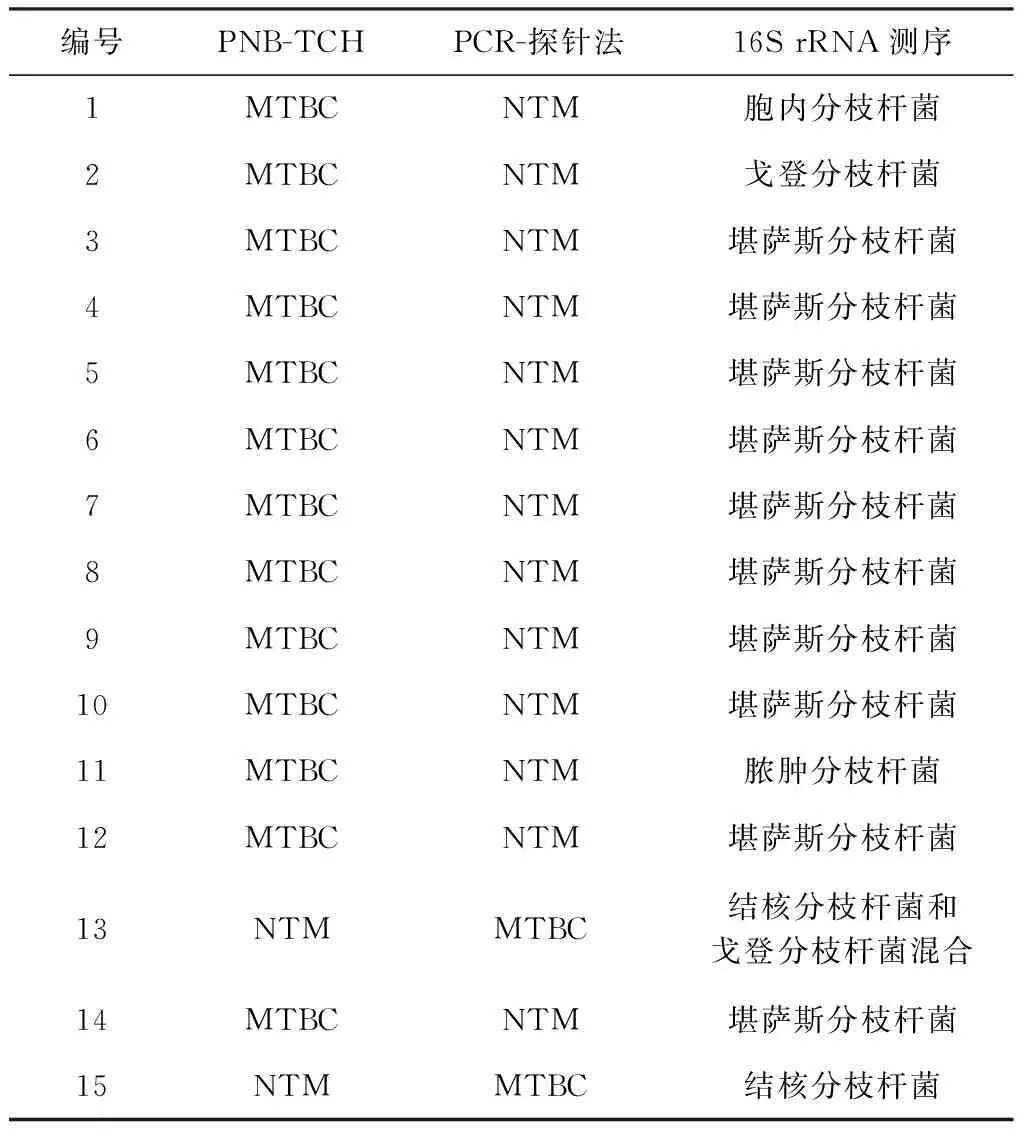
表2 15株分枝杆菌菌型鉴定结果
讨 论
近年来,随着实验室技术能力的发展,实验室鉴定出NTM的菌株逐年增加,导致文献报道的NTM病数量呈上升趋势[3]。众所周知,NTM导致的肺部疾病在痰涂片、胸部影像学等常规检测方面无法与MTBC区分, 但MTBC与NTM在治疗方案上存在巨大差异。近期的报道显示,NTM对任何一种抗结核药物不敏感度达95.5%[4],在没有进行分枝杆菌菌种鉴定结果的情况下,一些NTM患者会因误诊为结核病而接受不恰当的治疗,从而导致NTM病患者病情恶化,进而加重个人及国家的负担。因此,在诊疗活动中,及时有效的确定致病菌是否为NTM十分必要。由于PNB-TCH 生长试验具有操作简单、费用低等优势,国内绝大部分实验室使用这种方法来初步区分MTBC和NTM。
本研究结果显示,PNB-TCH生长试验和PCR-探针法检出的NTM符合率为75.4%,MTBC的符合率为99.0%,总体符合率为99.0%;13株经PNB-TCH鉴定为MTBC的菌株,最终经测序鉴定的结果全部是NTM,说明部分NTM使用PNB-TCH生长试验进行鉴定时会出现误判[5],而PCR-探针法鉴定MTBC和NTM的准确性较高。
PNB-TCH生长试验主要是利用PNB在500 μg/ml的浓度下选择性抑制MTBC生长,而不抑制大多数NTM的生长的原理。有文献报道,12%的NTM菌株受到PNB抑制,即对PNB敏感[5]。本研究涉及的样本中,结果显示有21.7%的NTM菌株对PNB敏感。同时,本研究显示只有0.1%的MTBC对PNB产生耐受性,明显低于文献报道的结果[6]。本试验中对PNB敏感的NTM样本中,需要光学照射才能产生色素的堪萨斯分枝杆菌占大多数(76.9%)。该结果提示,在NTM中,特别是堪萨斯分枝杆菌对PNB敏感的现象应该引起重视。此前有文献报道,堪萨斯分枝杆菌对PNB的敏感度达到了60.9%[6]。所以在采用PNB培养基进行分枝杆菌菌群初步分类时,如出现菌株对PNB敏感,但菌落呈橘黄色、且对一线,二线抗结核药物耐药等符合NTM的特征时,应进行系统的生物表型试验,或使用PCR-探针法进行鉴定,以免将此类NTM误判为MTBC导致误诊。
本试验中的一个样本为结核分枝杆菌和戈登分枝杆菌的混合菌,提示极少数待检样本可能含有两种、甚至多种分枝杆菌。造成该结果的原因很多,其中尽管不能排除发生实验室交叉污染的可能,但同时提示临床上分枝杆菌混合感染而导致疾患的情况也应引起注意。
目前我国分枝杆菌菌种生物表型鉴定实验,主要在专业技能较高的结核病专业实验室开展,且大部分是在药敏试验的同时进行PNB-TCH 生长试验,结果报告需要1 个月的时间,无论从方法的特异性、还是检测结果的时效性,均不能满足临床诊疗活动的需求。作为分子水平检测的金标准,核酸测序技术发展很快,但是,16S rRNA测序操作要求相对较高,而且需要特殊专业仪器的支持,绝大多数的实验室均无法作为常规手段用于临床。同时,由于样本需送测序公司检测,导致检测报告周期也存在极大的不确定性,并且,基因测序的成本也制约了相应方法的大范围应用。近年来,荧光定量PCR技术实现了PCR技术从定性到定量的飞跃,具有特异性强、敏感度高、定量准确、简单易行等优点,被越来越多的应用于分枝杆菌的检测[7],本研究采用的PCR-荧光探针法,其鉴定结果与测序相比,符合率达100%;同时,从提取核酸扩增开始到出具检测结果仅仅需要 2 h,其快速的检测报告周期和准确的检测结果可以满足临床确诊的需求。本研究结果及相关的文献报道,均证实PCR-探针法有较高的特异度和敏感度,特别是可以直接利用抗酸染色阳性的痰标本进行检测[8],这些特点使其应用性较强,为该方法的普及提供了有力的依据。
[1] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室.2010年全国第五次结核病流行病学抽样调查报告.中国防痨杂志,2012,34(8):485-508.
[2] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:54,56-57.
[3] 王忠仁,张宗德,张本.非结核分枝杆菌病的流行趋势.中华结核和呼吸杂志,2000,23:263-265.
[4] 王巍.重视非结核分枝杆菌病诊断和治疗的研究. 传染病信息, 2009, l:14-17.
[5] 李国利,张灵霞,陈澎.对硝基苯甲酸生长试验鉴别结核与非结核分枝杆菌应用评价. 临床肺科杂志,2009,14(12): 1648-1649.
[6] 吴龙章,谭守勇,等.对硝基苯甲酸与盐酸羟胺对分枝杆菌菌群进行初筛的比较.中华结核和呼吸杂志,2013,36(11):833-835.
[7] ParasharD,ChauhanDS,SharmaVD,etal.Applications of real-time PCR technology to mycobactcrial research.Indian J Med Res,2006,124(4):385-398.
[8] 梁建琴,高华方,李洪敏,等.PCR-荧光探针法快速检测结核分枝杆菌和非结核分枝杆菌.中华医学会结核病学分会2011年学术会议论文汇编,2011,20(1):20-23.
(本文编辑:范永德)
Comparative study between the traditional culture method and PCR-fluorescent probe method in the identification of mycobacterium species
ZHANGJie*,XINGQing,WANGSu-min,YIJun-li,YANGXin-yu,DINGBei-chuan,SUJian-rong.
*LaboratoryofBeijingFriendshipHospitalaffiliatedtoCapitalMedicalUniversity(on-the-jobpostgraduatestudentofBenjingResearchInstituteforTuberculosisControl),Beijing100050,ChinaCorrespondingauthor:SUJian-rong,Email:youyilab@163.com
Objective To compare the traditional culture method with PCR-fluorescence probe method for the identification of mycobacteria. Methods One thousand five hundred and fifty two mycobacterial strains from clinical isolates were tested by PNB-TCH growth test and PCR-fluorescent probe method, in which the strains with different testing results were confirmed by 16S rRNA gene sequencing method. Results Between two methods, the coincidence rate of non-tuberculosis mycobacteria (NTM) was 75.4% (46/61), the coincidence rate ofMycobacteriumtuberculosiscomplex (MTBC) was 99.0% (1491/1506), and the overall coincidence rate was 99.0% (1537/1552). 15 strains with different testing results were sequenced with 16S rRNA gene, in which 14 were consistent with the results of PCR-probe method, and 1 was isolated and cultured, then confirmed with mixed bacteria ofMycobacteriumtuberculosisandMycobacteriumGordon. The sensitivity of PNB culture for NTM was 21.7% (13/60), and the PNB-resistant rate of MTBC was 0.1%(1/1492). Of 13 PNB-sensitive NTM stains, 10 (76.9%) wereMycobacteriumkansasii. Conclusion The identification of part NTM isolates was misjudged using the PNB-TCH growth tests, while the PCR-fluorescent probe method for the identification of MTBC and NTM strains had higher accuracy.
Nontuberculous mycobacteria;Mycobacteriumtuberculosis; Bacteriological techniques; Polymerase chain reaction; Comp study
10.3969/j.issn.1000-6621.2015.03.014
100050 首都医科大学附属北京友谊医院检验科[张洁(北京结核病控制研究所在职研究生)、苏建荣];北京结核病控制研究所中心实验室(邢青、王甦民、易俊莉、杨新宇、丁北川)
苏建荣,Email:youyilab@163.com
2014-08-29)

