重组人γ-干扰素在耐多药结核病小鼠治疗作用中的研究
侯江厚 李琦 张灵霞 王仲元 孙卫国 赵伟杰 操敏
·论著·
重组人γ-干扰素在耐多药结核病小鼠治疗作用中的研究
侯江厚 李琦 张灵霞 王仲元 孙卫国 赵伟杰 操敏
目的 探讨重组人γ-干扰素(rh-IFN-γ)在MDR-TB小鼠中的治疗作用及其免疫学机制。方法 72只成年雄性Balb/c小鼠,用含耐多药Mtb的气溶胶感染,感染后第2天处死4只以确定小鼠肺脏植入的菌量,感染后21 d(设定治疗0周)脱颈处死4只小鼠作空白对照;余下64只小鼠采用随机数字表法分为对照组、rh-IFN-γ组、莫西沙星组和联合治疗组(莫西沙星+ rh-IFN-γ),每组16只,于治疗0周开始给药。治疗4、8、16、20周各组分别脱颈处死4只,以测定小鼠的肺、脾质量指数和肺、脾菌落形成单位(CFU)、8周血清细胞因子IFN-γ和白细胞介素(IL)-10的水平。两组间比较采用t检验,多组间比较采用单因素方差分析,组内两两比较采用SNK法和Games-Howell法。 结果 肺脾质量指数:莫西沙星组8周肺指数为“5.99±0.72”、低于对照组的“8.01±0.91”(F=6.28,P<0.01);莫西沙星组8周脾指数为“2.87±0.15”,低于对照组的“3.87±0.41”(F=8.37,P<0.01)。肺、脾CFU:莫西沙星组、联合治疗组4周肺组织CFU分别为(4.37±0.20)lg CFU/ml和(4.35±0.18)lg CFU/ml,均低于对照组[(5.30±0.21)lg CFU/ml]和rh-IFN-γ组[(5.29±0.13)lg CFU/ml](F=35.55,P<0.01),莫西沙星组、联合治疗组8周肺组织CFU分别为(2.86±0.29)lg CFU/ml和(2.63±0.08)lg CFU/ml,均低于对照组[(5.00±0.23)lg CFU/ml]和rh-IFN-γ组[(4.82±0.55)lg CFU/ml](F=56.83,P<0.01),且均于16周始无菌化(即无Mtb生长);rh-IFN-γ组20周脾组织CFU为(3.21±0.40)lg CFU,低于对照组的(4.31±0.06)lg CFU/ml(t=5.45,P<0.01);莫西沙星组和联合治疗组的脾组织从4周始无菌化。治疗8周小鼠血清γ-干扰素和IL-10的水平:rh-IFN-γ组、莫西沙星组和联合治疗组血清IFN-γ水平分别为(3.40±0.64)ng/L、(1.32±0.53)ng/L和(0.47±0.44)ng/L,低于对照组的(10.34±2.09)ng/L(F=55.973,P<0.01),莫西沙星组和联合治疗组血清IFN-γ水平分别为(1.32±0.53)ng/L和(0.47±0.44)ng/L,低于rh-IFN-γ组的(3.40±0.64)ng/L(F=55.973,P<0.01)。 对照组、rh-IFN-γ组、莫西沙星组和联合治疗组血清IL-10水平分别为(6.68±1.30)ng/L、(9.76±3.97)ng/L、(8.74±4.48)ng/L和(21.34±17.58)ng/L,差异无统计学意义(F=2.013,P>0.05)。 结论 rh-IFN-γ可降低MDR-TB小鼠脾组织的菌量负荷,下调小鼠血清γ-干扰素水平,但对降低肺组织的菌量负荷和减轻肺脾组织炎症上无明显作用。rh-IFN-γ辅助莫西沙星治疗耐多药结核病小鼠,在降低病变器官的菌量负荷和减轻炎症方面无辅助作用。
结核, 抗多种药物性/药物疗法; 干扰素γ; 小鼠
γ-干扰素(IFN-γ)是机体控制结核病感染最重要的保护性免疫细胞因子之一[1],它能通过多条途径促进巨噬细胞活化,诱导自噬[2]、一氧化氮的产生[3]及细胞凋亡[4]来清除杀灭Mtb。MDR-TB患者体内IFN-γ水平低于健康人群和对药物敏感的结核病患者[5],分泌IFN-γ的CD4+T淋巴细胞频数也低于健康人群和对药物敏感的结核病患者[6],因此,给MDR-TB患者补充外源性IFN-γ可能有助于杀灭Mtb。本实验采用重组人γ-干扰素(rh-IFN-γ)治疗MDR-TB小鼠,探讨其对MDR-TB小鼠的治疗作用及其免疫学机制,为临床MDR-TB患者的免疫治疗提供实验基础。
材料和方法
一、材料
雄性6~8周龄清洁级Balb/c小鼠72只,体质量18~20 g,购自中国药品生物制品检定所实验动物中心。羧甲基纤维素钠(CMC)(国药集团化学试剂有限公司生产),rh-IFN-γ(100万U/支,由上海凯茂生物医药有限公司生产);莫西沙星(0.4 g/片,拜耳医药保健股份公司生产);异烟肼低度耐药、利福平高度耐药Mtb临床菌株(北京结核病胸部肿瘤研究所药物研究室提供),鼠源IFN-γ和白细胞介素(IL)-10的酶联免疫吸附试验试剂盒(美国R&D公司提供;批号:272899和269773)。负压感染实验动物房由北京市结核病胸部肿瘤研究所提供。
二、方法
1.模型建立和给药方法:用含有耐多药 Mtb的7H9液体培养基共10 ml[在450 nm处的吸光度值(A值)约为0.8],在气溶胶感染装置中建立气溶胶感染小鼠MDR-TB模型[7]。小鼠感染后21 d开始给药(设定为治疗0周),按照药品说明书或相关文献,以及小鼠体质量设计给药方法,具体为:CMC(浓度为0.5%)0.2 ml/只,1次/d,灌胃[8];rh-IFN-γ 1万U · kg-1·d-1,皮下注射,2次/周(周二、五)[9];莫西沙星100 mg· kg-1·d-1,灌胃,1次/d,5次/周(周一至周五)[10]。
2.动物分组、处置和标本采集:72只BALB/c小鼠感染后第2天处死4只,确定小鼠肺脏感染耐多药 Mtb的菌量,感染后21 d(治疗0周)处死4只小鼠;余下64只小鼠采用随机数字表法分为对照组、rh-IFN-γ组、莫西沙星组和联合治疗组(莫西沙星+ rh-IFN-γ),每组16只,并于当天开始给药,对照组给予CMC灌胃,rh-IFN-γ组给予rh-IFN-γ皮下注射,莫西沙星组给予莫西沙星灌胃,联合治疗组给予莫西沙星灌胃和rh-IFN-γ皮下注射;治疗4、8、16、20周各组分别脱颈处死小鼠4只,每次处死的小鼠均取全肺和整脾,治疗8周处死的小鼠还取静脉血,在离心半径6 cm,4000 r/min离心10 min后取上层血清于-80 ℃下保存。
3. 肺指数和脾指数计算:每次处死的小鼠均取全肺和整脾,同时称取体质量、肺质量和脾质量,计算肺质量指数和脾质量指数。肺质量指数=肺质量(mg)/体质量(g);脾质量指数=脾质量(mg)/体质量(g)。
4. 菌落形成单位(CFU)计数:每次处死小鼠后对取出的肺脏和脾脏立即进行均浆,按一定比例稀释,接种7H11培养基,于37 ℃培养4周,记录菌落形成单位,计算整肺和全脾组织中的CFU。
5. 血清IFN-γ和IL-10检测:采用酶联免疫吸附试验法检测血清中的IFN-γ和IL-10的浓度。严格按照说明书要求操作,酶标仪450 nm处测吸光度(A值),建立标准曲线,求其A值。为了避免rh-IFN-γ对小鼠血清IFN-γ的检测产生影响,我们处死小鼠的时间都是在周一,因为rh-IFN-γ皮下注射时间都是在周二、五,皮下注射的半衰期为9.35 h,故不影响小鼠自身血清IFN-γ的检测。
三、统计学处理
结 果
1.rh-IFN-γ对小鼠肺质量指数和脾质量指数的影响:仅莫西沙星组8周肺、脾指数均低于对照组(P<0.05)。rh-IFN-γ组和对照组各时间段肺、脾质量指数差异无统计学意义(P>0.05),莫西沙星组和联合治疗组各时间段肺、脾质量指数差异无统计学意义(P>0.05)(表1)。
2.rh-IFN-γ对小鼠肺组织Mtb活菌计数(CFU)的影响:感染后第2天小鼠肺组织的菌量为[(2.96±0.06)lg CFU/ml]。对照组8、16、20周肺组织CFU均较其0周降低(P值均<0.05或<0.01),rh-IFN-γ组各时间段肺组织CFU与对照组差异无统计学意义(P值均>0.05),莫西沙星组、联合治疗组各时间段肺组织CFU低于对照组和rh-IFN-γ组(P值均<0.01),且均于16周始无Mtb生长,但莫西沙星组、联合治疗组各时间段肺组织CFU差异无统计学意义(P值均>0.05)(表2)。
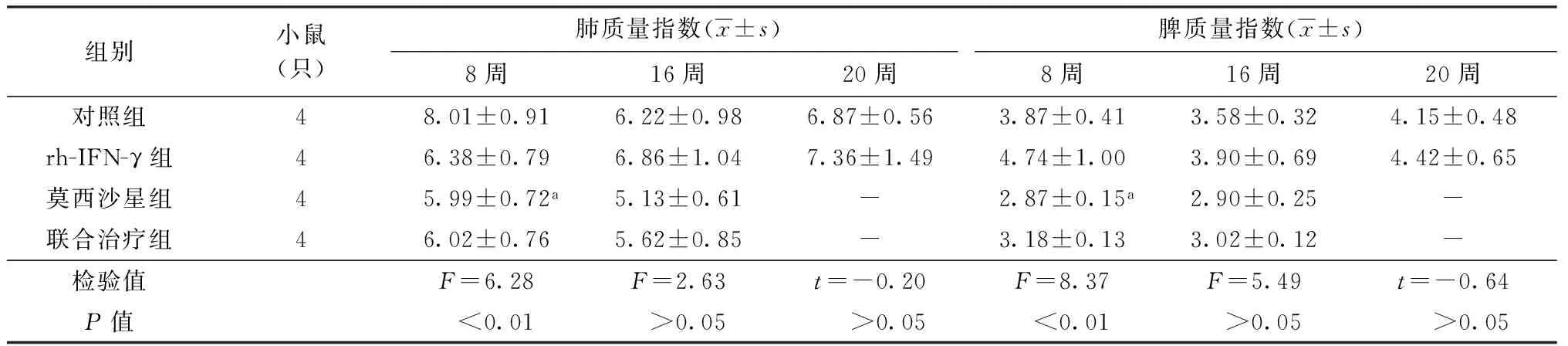
表1 4组小鼠肺质量指数和脾质量指数在不同时间点的变化
注 与对照组比较,a:P值均<0.05;莫西沙星组和联合治疗组小鼠16周始肺脾组织无Mtb生长,故20周时未检测肺脾指数。“-”表示未做肺、脾指数检测

表2 4组小鼠肺组织培养不同时间点的菌落计数变化
注 与肺组织菌落计数0周比较,a:P<0.05;b:P<0.01;与对照组比较,c:P<0.01,d:P<0.01;与rh-IFN-γ组比较,d:P<0.01。“-”表示无Mtb生长
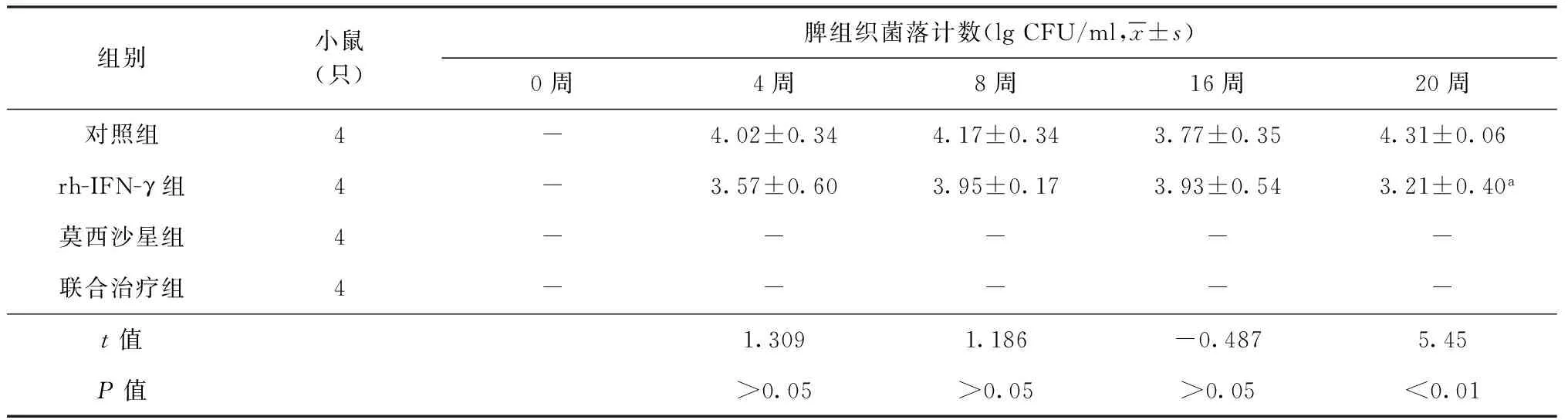
表3 4组小鼠脾组织培养菌落计数在不同时间点的变化
注 与对照组比较,a:F=5.45,P<0.01。“-”表示无Mtb生长
3.rh-IFN-γ对小鼠脾组织Mtb活菌计数(CFU)的影响:rh-IFN-γ组20周脾组织CFU低于对照组(P<0.01)。莫西沙星组和联合治疗组的脾组织从4周始无Mtb生长(表3)。
4. rh-IFN-γ治疗8周时对小鼠血清IFN-γ和IL-10水平的影响:rh-IFN-γ组、莫西沙星组和联合治疗组血清IFN-γ水平低于对照组(P<0.05或0.01),莫西沙星组和联合治疗组血清IFN-γ水平低于rh-IFN-γ组(P<0.01),但莫西沙星组和联合治疗组血清IFN-γ差异无统计学意义(P>0.05)。此外,4个观察组血清IL-10水平差异无统计学意义(F=2.013,P>0.05)(表4)。
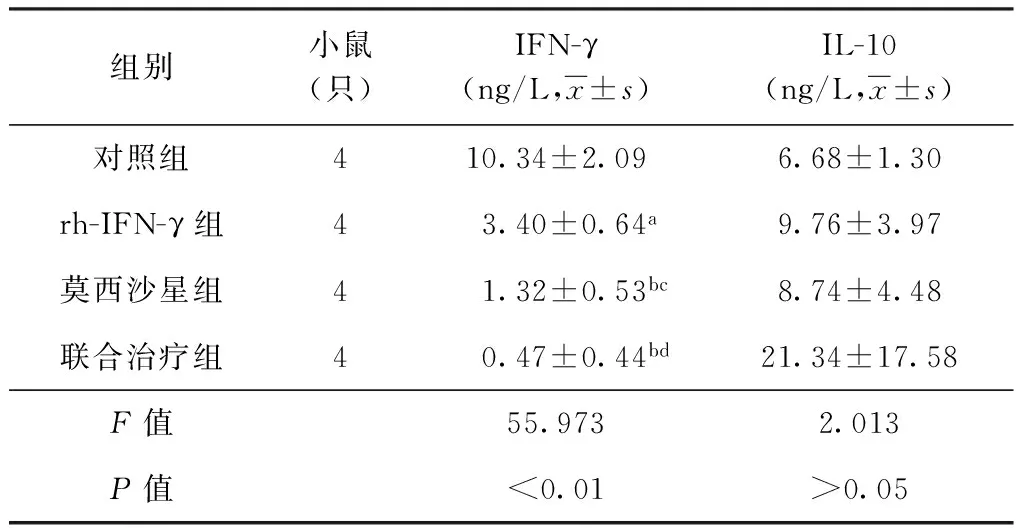
表4 4组小鼠治疗8周时血清IFN-γ和IL-10水平的比较
注 与对照组比较,a:F=55.973,P<0.05,b:F=55.973,P<0.01;与rh-IFN-γ组比较,c:F=55.973,P<0.05,d:F=55.973,P<0.01。4个组血清IL-10水平差异均无统计学意义(F=2.013,P值均>0.05)
讨 论
IFN-γ是体内巨噬细胞活化和免疫保护必不可少的细胞因子[1,11],也是诱导自噬产生的关键性细胞因子之一。由巨噬细胞、活化T细胞、自然杀伤细胞和白细胞产生。Gao等[12]采用系统性回顾研究9例IFN-γ联合抗结核药物治疗的肺结核患者,发现IFN-γ辅助抗结核药物能促进肺结核患者痰菌转阴和肺部病变面积缩小。华树成等[13]用IFN-γ治疗结核分枝杆菌H37Rv感染的小鼠7周,发现IFN-γ能减轻肺组织炎症,降低肺组织中的菌量负荷和肺组织中的IFN-γmRNA水平。以上这些研究提示rh-IFN-γ能调节对药物敏感的结核病患者的免疫,具有一定的治疗作用或辅助性治疗作用。然而,MDR-TB患者和对药物敏感的结核病患者的机体免疫存在着差别[5-6],rh-IFN-γ在MDR-TB患者中是否有作用并没有做过系统性的基础研究。
从表1可见, rh-IFN-γ单独或者辅助莫西沙星治疗MDR-TB小鼠时,均不能降低小鼠肺脾质量指数,减轻小鼠肺脾组织的炎症。这可能是耐多药Mtb的毒力较敏感菌株H37Rv弱[5],使所有感染小鼠的肺脾组织炎症程度较轻,从而观察不出rh-IFN-γ减轻炎症的作用。从莫西沙星组和联合治疗组的肺脾质量指数也可以看出, 治疗16周莫西沙星组和联合治疗组肺脾组织无Mtb生长,肺脾组织基本无炎性病变,而此时4个组的肺、脾质量指数均相接近(P值均>0.05),说明对照组肺与脾的炎症程度较轻,从而看不出rh-IFN-γ和莫西沙星在减轻炎症方面的作用了。
从表2、3看出,rh-IFN-γ对抑制和杀灭耐多药结核分枝杆菌有影响。rh-IFN-γ降低小鼠20周脾组织的CFU,说明rh-IFN-γ主要作用于脾脏,可能是脾脏为机体最大的免疫器官,含有大量的淋巴细胞、巨噬细胞、树突状细胞和自然杀伤细胞,是机体细胞免疫和体液免疫的中心,便于rh-IFN-γ通过多种机制诱导自噬和一氧化氮的产生[2],从而杀灭耐多药结核分枝杆菌。
IFN-γ是机体抗感染关键性保护因子,它通过影响包括2000多个基因的转录程序来发挥这种作用。这些转录因子标志中最突出的是鸟苷三磷酸酶(GTPases)家族[14],这个家族包括相对分子质量为47 000(47 kDa)与免疫相关的GTPases(P47IRGs),相对分子质量为65 000~73 000(65~73 kD)的鸟苷酸结合蛋白(P65GbPs),和相对分子质量为285 000(285 kD)的可诱导的GTPases(Vligs/Gvins)。IFN-γ主要通过影响P47IRGs和P65GbPs来诱导自噬的。
小鼠中P47IRGs有24个基因,其中包括20个受干扰素调控的完整干扰素调节基因(interferon-regulated genes,IRGs)和2个假基因(Irgm 1~3、Irga 1~8、Irgb 1~10和Irgd),2个与免疫无关的基因(Irgc和Irgq)[2]。小鼠的Irgb 6、Irgd、Irgm 1~3和Irga 6基因参与防御细胞内的Mtb,特别是Irgm 1在抗细胞内Mtb过程中起着重要的保护作用,在清除小鼠巨噬细胞内的Mtb时,Irgm 1是依赖IFN-γ的效应器和自噬调节器。小鼠巨噬细胞中的Irgm 1基因通过IFN-γ活化,诱导自噬清除Mtb[2]。
P65GbPs中的GbP1、GbP6、GbP7和GbP10与细胞的自主免疫和巨噬细胞抗Mtb密切相关。这些GbPs能被IFN-γ活化,能够触发宿主防御蛋白,包括巨噬细胞氧化酶,抗菌肽,自噬效应因子,杀死细胞内的Mtb[14]。
从表4看出,rh-IFN-γ调节抗炎细胞因子的分泌,本实验结果显示在rh-IFN-γ治疗8周时,rh-IFN-γ组小鼠机体分泌的IFN-γ水平低于对照组(P<0.05),可能与rh-IFN-γ诱导的自噬能抑制IL-1β的表达[15]相关。IL-1β诱导T(H)17生成IFN-γ[16],故IL-1β受到抑制时IFN-γ的生成也减少。
IFN-γ存在种属特异性,用人源IFN-γ来治疗耐多药结核病小鼠可能影响治疗效果,因而下一步需要用鼠源IFN-γ来印证此实验结果的准确性。
综上所述,rh-IFN-γ可降低MDR-TB小鼠脾组织的菌量负荷,下调小鼠血清IFN-γ水平,但对降低肺组织的菌量负荷和减轻肺脾组织炎症上无明显作用。rh-IFN-γ辅助莫西沙星治疗耐多药结核病小鼠,在降低病变器官的菌量负荷和减轻炎症方面无辅助作用。
[1] O’Garra A, Redford PS, McNab FW, et al. The immune response in tuberculosis. Annu Rev Immunol,2013,31:475-527.
[2] 侯江厚,李琦.自噬在结核病免疫应答中的作用.中华结核和呼吸杂志,2012,35(3):206-209.
[3] Liao D, Fan Q, Bao L. The role of superoxide dismutase in the survival ofMycobacteriumtuberculosisin macrophages. Jpn J Infect Dis,2013,66(6):480-488.
[4] Herbst S, Schaible UE, Schneider BE. Interferon gamma activated macrophages kill mycobacteria by nitric oxide induced apoptosis. PLoS One,2011,6(5):e19105.
[5] Tan Q, Xie WP, Min R, et al.Characterization of Th1- and Th2-type immune response in human multidrug-resistant tuberculosis. Eur J Clin Microbiol Infect Dis,2012,31(6):1233-1242.
[6] Pinheiro RO, de Oliveira EB, Dos Santos G, et al. Different immunosuppressive mechanisms in multi-drug-resistant tuberculosis and non-tuberculous mycobacteria patients. Clin Exp Immunol,2013,171(2):210-219.
[7] 徐建,陆宇,郑梅琴,等.气溶胶感染小鼠急性结核病模型的建立及应用. 中国防痨杂志,2010,32(8):462-465.
[8] Wang J, Ji L, Liu H, et al. Study of the hepatotoxicity induced by Dioscorea bulbifera L. rhizome in mice. Biosci Trends,2010,4(2):79-85.
[9] 严玉兰.IFN-λ重组腺病毒载体的构建、转染及对肺癌影响的体内外实验研究.临床检验诊断学,2009,29(1):107-109.
[10] Poissy J, Aubry A, Fernandez C, et al. Should Moxifloxacin Be Used for the Treatment of Extensively Drug-Resistant Tuberculosis An Answer from a Murine Model. Antimicrob agents Chemother,2010,54(11):4765-4771.
[11] Thakur A, Pedersen LE, Jungersen G. Immune markers and correlates of protection for vaccine induced immune responses. Vaccine, 2012, 30(33):4907-4920.
[12] Gao XF, Yang ZW, Li J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a syste-matic review. Int J Infect Dis, 2011,15(9):e594-600.
[13] 华树成,许力军,吕晓红,等.IFN-γ治疗结核的动物实验研究.中国老年学杂志,2002,22(5):391-393.
[14] Kim BH, Shenoy AR, Kumar P, et al. A family of IFN-γ-inducible 65-kD GTPases protects against bacterial infection. Science,2011, 332(6030):717-721.
[15] Kleinnijenhuis J, Oosting M, Plantinga TS, et al. AutoPhagy modulates theMycobacteriumtuberculosis-induced cytokine response. Immunology,2011,134(3):341-348.
[16] Zielinski CE, Mele F, Aschenbrenner D, et al. Pathogen-induced human T(H)17 cells Produce IFN-γ or IL-10 and are regulated by IL-1β. Nature,2012;484(7395):514-518.
(本文编辑:范永德)
Study on the therapeutic effect with recombinant human IFN-γ on multidrug-resistantMycobacteriumtuberculosisinfected mice
HOUJiang-hou*,LIQi,ZHANGLing-xia,WANGZhong-yuan,SUNWei-guo,ZHAOWei-jie,CAOMin.
*ArmyTuberculosisPreventionandControlKeyLaboratory,BeijingKeyLaboratoryofNewTechniquesofTuberculosisDiagnosisandTreatment,InstituteforTuberculosisResearch,the309thHospitalofChinesePLA,Beijing100091,ChinaCorrespondingauthor:LIQi,Email:lq0703@hotmail.com
Objective To study the therapeutic effect and immunological mechanism of recombinant human interferon γ (rh-IFN-γ) in treating the mice with multidrug-resistant tuberculosis (MDR-TB). Methods Seventy-two adult male Balb/c mice were infected with multidrug-resistantMycobacteriumtuberculosisvia aerosol. Four mice were sacrificed at second day after infection to determine the colony forming units (CFUs) implanted in the lungs. Four mice were sacrificed at 21- day post infection (0 week of treatment). The remaining 64 mice were randomly divided into control group,rh-IFN-γ group,moxifloxacin group and combination therapy group (moxifloxacin+rh-IFN-γ),16 mice in each group,and started to give medicine treatment at 0 week of treatment.Four mice per group were sacrificed at 4-, 8-, 16- and 20- weeks of treatment, to observe the mass index and live bacteria counting (CFUs) of lung and spleen at each time-point,and to detect the levels of IFN-γ and IL-10 in sera at 8 weeks of treatment.Comparison between the two groups usedttest.Comparison among groups were tested by One-Way analysis of variance (ANOVA),comparison in pairs within group used SNK method and Games-Howell method. Results Lung and spleen mass index:the lung mass index of moxifloxacin group (5.99±0.72)at 8 weeks were significantly lower than that of control group(8.01±0.91)(F=6.28,P<0.01).The spleen mass index of moxifloxacin group(2.87±0.15) at 8 weeks were significantly lower than that of control group (3.87±0.41)(F=8.37,P<0.01). Lung and spleen CFUs: the lung CFUs of moxifloxacin group [(4.37±0.20)lg/ml] and combination therapy group [(4.35±0.18)lg/ml] at 4 weeks respectively were significantly lower than that of control group [(5.30±0.21)lg/ml] and rh-IFN-γ group [(5.29±0.13)lg/ml](F=35.55,P<0.01),the lung CFUs of moxifloxacin group [(2.86±0.29)lg/ml] and combination therapy group [(2.63±0.08)lg/ml] at 8 weeks respectively were significantly lower than that of control group [(5.00±0.23)lg/ml] and rh-IFN-γ group [(4.82±0.55)lg/ml](F=56.83,P<0.01),and were sterile from 16 weeks (without the growth ofMycobacteriumtuberculosis).Spleen CFUs of rh-IFN-γ group [(3.21±0.40)lg/ml] at 20 weeks were significantly lower than that of control group [(4.31±0.06)lg/ml](t=5.45,P<0.01).Spleen tissue of moxifloxacin group and combination therapy group were sterile from 4 weeks.IFN-γ and IL-10 levels in the sera at 8 weeks:the serum IFN-γ levels of rh-IFN-γ group [(3.40±0.64)ng/L], moxifloxacin group [(1.32±0.53)ng/L] and combination therapy [(0.47±0.44)ng/L] were significantly lower than that of control group [(10.34±2.09)ng/L](F=55.973,P<0.01), the serum IFN-γ levels of moxifloxacin group and combination therapy group respectively were obviously lower than that of rh-IFN-γ group(F=55.973,P<0.01); the serum IL-10 levels had no significant difference among control group [(6.68±1.30)ng/L],rh-IFN-γ group [(9.76±3.97)ng/L],moxifloxacin group [(8.74±4.48)ng/L] and combination therapy group [(21.34±17.58)ng/L](F=2.013,P>0.05). Conclusion Rh-IFN-γ can reduce the number ofMycobacteriumtuberculosisin splenic tissue and lowered serum IFN-γ levels of MDR-TB mice,but had no significant effect on reducing the number ofMycobacteriumtuberculosisand the inflammation in lung tissue of MDR-TB mice.Rh-IFN-γ in combination with moxifloxacin had also no auxiliary role on the treatment of MDR-TB, and on reducing bacteria loads and inflammation of organs in mice.
Tuberculosis, multidrug-resistant/drug therapy; Interferon-gamma; Mice
10.3969/j.issn.1000-6621.2015.03.015
“十一五”国家科技重大专项(2008ZX-10003-014)
100091北京,解放军第三○九医院结核病研究所 全军结核病防治重点实验室 结核病诊疗新技术北京市重点实验室(侯江厚、张灵霞、孙卫国),结核三病区(王仲元);首都医科大学附属北京胸科医院肺功能室(李琦、操敏),药物研究室(赵伟杰)
李琦,Email:lq0703@hotmail.com
2014-06-23)

