基因芯片表达分析4Gyγ射线对小鼠骨髓c-kit阳性细胞影响
张俊伶 路璐 李德冠 孟爱民
·论著·
基因芯片表达分析4Gyγ射线对小鼠骨髓c-kit阳性细胞影响
张俊伶 路璐 李德冠 孟爱民
目的 利用基因芯片技术分析经4 Gyγ射线照射后c-kit(CD117,正常表达于干祖细胞表面的细胞因子受体)阳性细胞与代谢过程相关的基因及信号通路表达变化。方法 利用磁珠分选系统分选出骨髓c-kit阳性细胞。实验分为对照组、4Gy照射组。取1×106个c-kit阳性细胞进行照射,照射剂量率为0.99Gy/min。照射后将细胞培养18 h后取出,进行全基因组的高通量基因芯片检测,并进行Gene Ontology聚类分析和Kyoto Encyclopedia ofGenesand Genomes信号通路分析。结果 4 Gyγ射线照射引起c-kit阳性细胞包括Pld5、Neu2、Bpgm、Alas2、Satl1、Rdh16、Mccc1、Sat2、Smug1、Cml5、Adhfe1、Idh3a、Slc27a5在内的13个基因表达上调3倍以上,包括Acss2、Phgdh、Psat1、Glb1、Gpam、Dus3l、Fuca2、Impdh1、Dlat、Glb1、Enpp4、Prim2、Mettl10、Slc27a2、Dera、Qdpr、Dus1l、Cdyl2、Dhodh、Srr、Spr、Mical2在内的22个基因表达下调3倍以上,这些基因主要参与嘌呤代谢、嘧啶代谢、三羧酸循环等信号通路。结论4Gyγ射线照射能引起c-kit阳性细胞中与代谢过程相关的许多基因表达发生变化,这些变化的基因有待进一步的实验验证。
原癌基因蛋白质c-kit;寡核苷酸序列分析;辐射,电离;细胞代谢
【Keywords】Proto-oncogene proteins c-kit;Oligonucleotide array sequence analysis;Radiation, ionizing;Metabolic process
电离辐射能够引起造血系统损伤,包括急性骨髓抑制和持久性骨髓损伤,前者主要是快速增殖的造血祖细胞(hematopoietic progenitor cell,HPC)损伤所致,后者主要是由于电离辐射引起的造血干细胞(hematopoietic stem cell,HSC)损伤所致。已有的研究显示,电离辐射引起HSC和HPC损伤的机制主要是细胞内活性氧升高激活下游一系列信号通路,最终引起造血系统急性损伤和HSC、HPC衰老[1]。应用系列抗氧化剂能够部分缓解电离辐射引起的造血干祖细胞损伤。细胞内活性氧水平升高同样引起细胞代谢发生变化[2],细胞代谢是近年研究的热点,也是细胞最基本、最重要的活动之一。代谢通路在肿瘤的发生发展、糖尿病、衰老等病理生理过程中发挥着重要作用[3-5],然而在电离辐射引起造血系统损伤中的作用却少有研究。c-kit又称为CD117,是正常表达于干祖细胞表面的细胞因子受体。c-kit阳性细胞是一群经过富集的富含HPC和HSC的一类细胞,利用磁珠分选系统能在短时间内快速分选出大量的c-kit阳性细胞,对c-kit阳性细胞电离辐射损伤的研究能够初步反映HPC和HSC的损伤情况。因此,本研究以c-kit阳性细胞为对象,利用基因表达谱芯片技术筛选出经4Gyγ射线照射后在代谢过程中表达发生变化的基因,并分析这些基因的性质和功能,为寻找电离辐射引起造血系统损伤的分子机制奠定基础。
1 材料与方法
1.1 试剂与仪器
无血清扩增培养基SFEM购自美国Stem Cell Technologies公司;c-kit磁珠和磁珠分选柱购自德国美天旎公司;137Csγ射线辐射源(型号USD,Autocell40)购自加拿大原子能有限公司。
1.2 实验动物
无特定病原体级C57BL/6雄性小鼠10只,体质量21~23 g,8~10周龄,购自中国北京维通利华实验动物有限公司,合格证号SCXK(京)2012-0001。小鼠饲养于我所实验动物中心。
1.3 c-kit阳性细胞分离
无菌分离小鼠双侧股骨胫骨,去除表面附着肌肉,将全部股骨胫骨放入研钵内,轻轻研磨直至骨髓细胞完全释放,裂解红细胞后对获取的细胞进行计数。按照每1×108个细胞加入20μl的c-kit磁珠,室温孵育15min,孵育结束后加入5ml PBS,以离心半径25 cm,1500 r/min,离心5min。离心完毕用10ml PBS重悬细胞,利用磁珠分选系统进行c-kit阳性细胞分离[6]。
1.4 实验分组
实验分为2组,其中,对照组:取含1×107个c-kit阳性细胞的悬液1ml加入至2ml离心管内,作为未照射对照组;4 Gy照射组:在对照组基础上进行4Gyγ射线照射。每组设置6个平行孔。
1.5 基因芯片表达谱分析
照射组细胞照射后在37℃、5%CO2培养箱中培养18 h,之后取出,以离心半径25 cm,1500 r/min,离心5min后弃上清。加入1ml体积的Trizol试剂,交由上海康成生物工程有限公司进行全基因组的基因芯片分析后,再进行Gene Ontology(GO)聚类分析和Kyoto Encyclopedia of Genes and Genomes(KEGG)信号通路分析。
1.6 统计学方法
差异表达上调及下调3倍以上的参与代谢过程的基因带入KEGG数据库进行信号通路分析,结果采用Fisher精确检验进行统计学分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 基因表达芯片散点图
在基因表达芯片散点图上,每个点代表1个基因探针,X轴表示对照组c-kit阳性细胞信号强度,Y轴表示照射组c-kit阳性细胞信号强度。散点图中共有3条斜线,最上端的斜线代表上调超过2倍的差异基因,最下端的斜线代表下调超过2倍的差异基因,由图1可见,电离辐射引起c-kit阳性细胞的许多基因的表达发生显著改变。
2.2 电离辐射诱导与代谢过程相关的表达上调3倍以上的基因
GO聚类分析结果显示,与对照组比较,照射组经4 Gyγ射线照射后参与代谢过程(GO通路编号:0008152)的差异表达基因中,62个基因表达上调2倍以上,其中13个基因表达上调3倍以上(表1)。
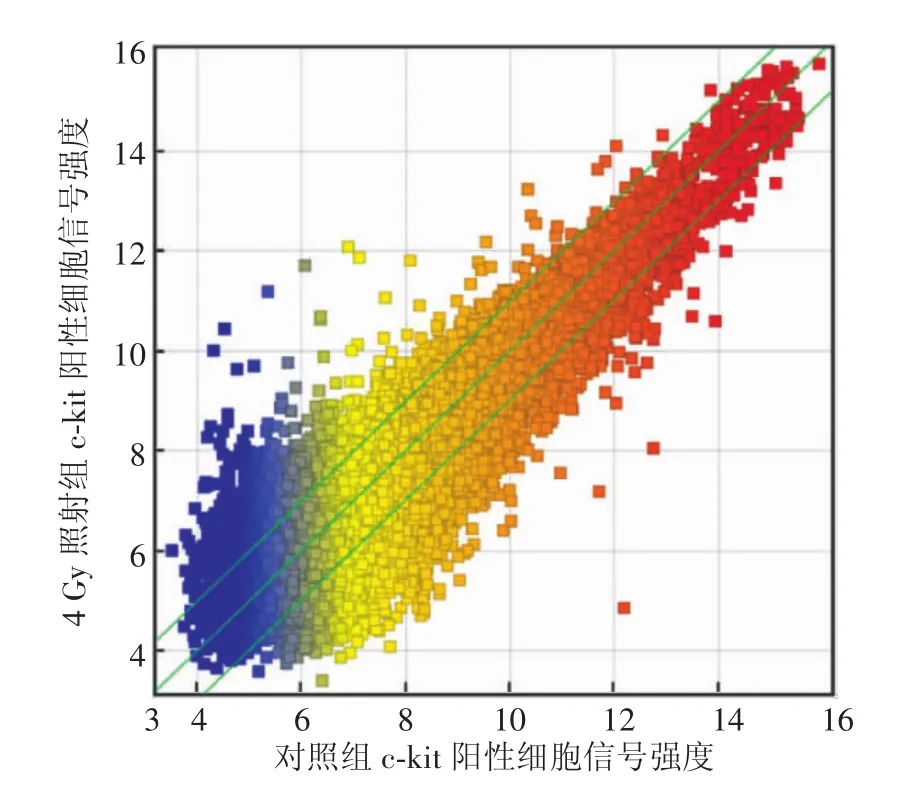
图1 c-kit阳性细胞基因表达谱芯片杂交信号散点图Fig.1 Scatter plots for hybridization signals by gene expression in c-kitpositive cells

表1 4Gyγ射线照射后与代谢过程相关的表达上调3倍以上的基因Table1 Metabolic process related genesup-regulatedmore than 3 timesafter4Gyγ-ray irradiation
2.3 电离辐射诱导与代谢过程相关的表达下调3倍以上的基因
GO聚类分析结果显示,与对照组比较,照射组经4Gyγ射线照射后参与代谢过程(GO通路编号:0008152)的差异表达基因中,89个基因表达下调2倍以上,其中22个基因表达下调3倍以上(表2)。
2.4 电离辐射诱导的差异表达基因所在信号通路分析
将上述差异表达上调及下调3倍以上的参与代谢过程的基因带入KEGG数据库进行信号通路分析(Fisher精确检验,P<0.05),涉及8条信号通路(表3)。
3 讨论
电离辐射能够引起骨髓HSC损伤,已有研究显示,引起损伤的机制主要包括以下几方面:①通过p53-p53 up-regulatedmodulatorofapoptosis(puma)途径引起 HSC凋亡;②通过激活 Granulocyte colony-stimulating factor/Signal transducersand activators of transcription 3/basic leucine zipper transcription factor(G-CSF/Stat3/BATF)依赖的分化调控点促进HSC分化;③通过 Reactive oxygen species-p38 mitogen-activated protein kinase(ROS-p38MAPK)途径诱导HSC衰老;④HSC微环境损伤导致其损伤[7]。然而,应用以上各种信号通路激活剂或抑制剂不能完全缓解电离辐射引起的HSC损伤,因此需要对电离辐射引起的其他信号通路变化进行深入研究。细胞代谢是细胞生命活动的重要形式之一,主要包括糖代谢、脂质代谢、线粒体和三羧酸循环代谢、氧化还原代谢等代谢过程。成体干细胞通过代谢途径及信号通路为自我更新与定向分化等功能提供能量,从而实现细胞与周围环境信号及营养信号的相互应答,维持机体的生命活动[8]。由于以往研究很少涉及到电离辐射后HSC代谢通路发生的变化,因此本研究利用高效基因芯片检测技术,筛选出经4Gyγ射线照射后的骨髓c-kit阳性细胞内发生表达变化的参与代谢过程的相关基因,并分析这些基因参与的信号通路变化情况。0~10Gy的电离辐射主要引起造血系统损伤,低于3.5Gy的电离辐射主要引起成熟细胞及HPC等快速增殖细胞的损伤,当骨髓细胞受到4Gyγ射线照射后,HSC及HPC均出现损伤[7]。因此选用4 Gyγ射线照射剂量才能同时反映出造血干祖细胞的损伤情况。基因芯片技术能够同时、快速、准确地分析数以千计的基因组信息,对所获取的信息进行分析后能够得到表
达发生变化的基因以及信号通路的很多有意义的信息,缩短了基因筛选的时间,提高了效率,具有重要的意义。本研究提示,与对照组比较,照射组经4Gyγ射线照射后差异表达基因共有6368个,差异表达2~3倍的上调基因比下调基因少740个,差异表达3倍以上的上调基因比下调基因少6个。经4Gyγ射线照射后,参与代谢过程的62个基因表达上调2倍以上,其中13个基因表达上调3倍以上;89个基因表达下调2倍以上,其中22个基因表达下调3倍以上。将这些表达上调及下调3倍以上的基因进行KEGG数据库的信号通路分析发现,表达上调3倍以上的基因Slc27a5参与到初级胆汁酸生物合成信号通路过程,表达下调3倍以上的基因Impdh1、Prim2、Dhodh、Dlat参与到嘌呤代谢、嘧啶代谢、三羧酸循环等代谢相关的信号通路,Nat10、Prim2、Dhodh基因参与到真核生物核糖体合成、DNA复制、RNA转运等细胞合成信号通路。说明受照射后的骨髓c-kit阳性细胞存在着代谢通路异常改变及DNA合成障碍。

表2 4Gyγ射线照射后与代谢过程相关的表达下调3倍以上的基因Table 2 Metabolic process related genes down-regulatedmore than 3 timesafter4Gyγ-ray irradiation
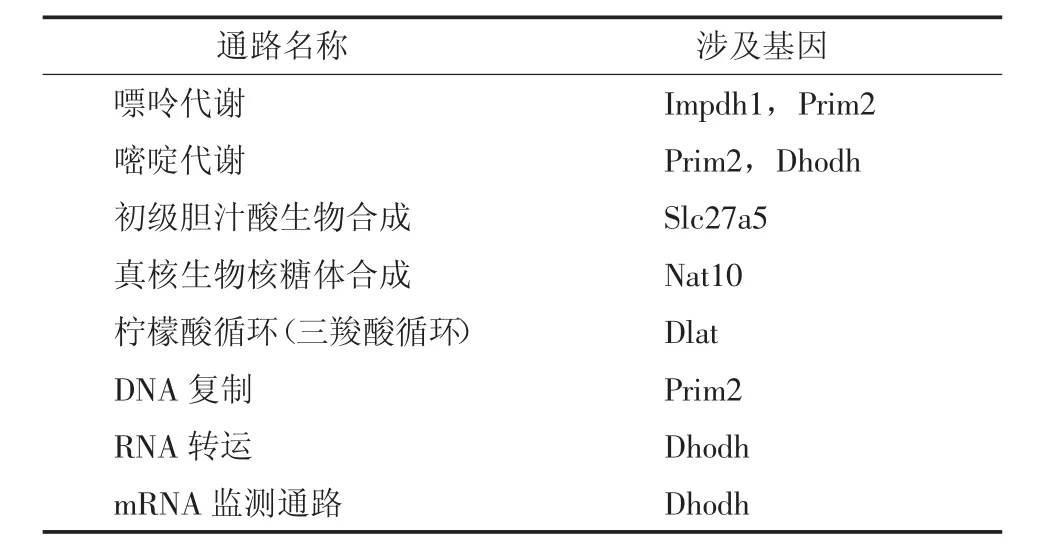
表3 差异表达基因的KEGG通路富集分析Table 3 KEGG pathway enrichment analysis of differentially expressed genes
综上所述,电离辐射能够引起很多代谢相关的基因及信号通路发生改变,本研究初步筛选出了这些尚未在辐射引起HSC损伤领域研究过的代谢相关基因,这一研究结果为探讨辐射引起HSC代谢变化的机制提供了思路。基因表达谱芯片分析是一种高通量的分析方法,具有高效、快速地获取大量基因表达变化信息的特点,在确定基因与基因间的相互关系,揭示疾病发生、发展的分子机制研究中起到了重要作用。然而,由于杂质、背景、实验操作等一系列人为因素的影响,确实会出现部分结果假阳性的现象。可以通过增加平行样本及实验次数尽量减少假阳性结果的出现。针对出现的阳性结果,需要使用实时PCR及Western blot等方法进行mRNA水平和蛋白水平的验证,才能最终确定电离辐射引起了哪些代谢相关基因的变化,这也是笔者目前正在进行的一项重要工作。
[1]Zhang H,ZhaiZ,Wang Y,etal.Resveratrolameliorates ionizing irradiation-induced long-term hematopoietic stem cell injury inmice [J].FreeRadic BiolMed,2013,54:40-50.
[2]Ghesquiere B,Wong BW,Kuchnio A,etal.Metabolism of stromal and immune cells in health and disease[J].Nature,2014,511(758):167-176.
[3]De Mas IM,Aguilar E,Jayaraman A,etal.Cancer cellmetabolism as new targets for novel designed therapies[J].Future Med Chem, 2014,6(16):1791-1810.
[4]Yun JS,Ko SH.Avoiding or coping with severe hypoglycemia in patients with type 2 diabetes[J].Korean J Intern Med,2015,30(1):6-16.
[5]Kushiyama A,Tanaka K,Hara S,et al.Linking uric acid metabolism to diabetic complications[J].World JDiabetes,2014,5(6):787-795.
[6]Ema H,Morita Y,Yamazaki S,et al.Adultmouse hematopoietic stem cells:purification and single-cellassays[J].NatProtoc,2006, 1(6):2979-2987.
[7]Shao L,Luo Y,Zhou D.Hematopoietic stem cell injury induced by ionizing radiation[J].Antioxid Redox Signal,2014,20(9):1447-1462.
[8]Vacanti NM,Metallo CM.Exploringmetabolic pathways that contribute to the stem cell phenotype[J].Biochim Biophys Acta, 2013,1830(2):2361-2369.
Expression changes of genes in c-kit positive cells after 4 Gyγ-ray irradiation:a gene chipanalysis
Zhang Junling,Lu Lu,LiDeguan,Meng Aimin.Tianjin Key Laboratory of Radiation Medicine and Molecular NuclearMedicine,Institute of Radiation Medicine,Chinese Academy of Medical Sciences, Tianjin 300192,China
Meng Aimin,Email:ai_min_meng@126.com
Objective To analyze themetabolic process-related genes and pathway variations in the c-kit(CD117,a cytokine receptorexpressed on the surface ofhematopoietic stem cells)positive cells after 4 Gy irradiation by using gene chip technology.Methodsc-kit positive cells were sorted by microbead separation system.Two groupswere involved:controlgroup and 4Gy irradiation group.A total of 1×106c-kit positive cells received 4 Gy irradiation ata dose rate of 0.99 Gy/min.After the two groups were cultured for 18 h,all the cellswere collected and detected by gene chip arrays.Datawere processed and analyzed via Gene Ontology and Kyoto Encyclopedia ofGenesand Genomes pathways.ResultsAfter 4 Gyγ-ray irradiation,13 metabolic process-related genes were up-regulated more than 3 times:Pld5, Neu2,Bpgm,Alas2,Satl1,Rdh16,Mccc1,Sat2,Smug1,Cml5,Adhfe1,Idh3a,and Slc27a5.Additionally, 22 genes were down-regulated more than 3 times:Acss2,Phgdh,Psat1,Glb1,Gpam,Dus3l,Fuca2, Impdh1,Dlat,Glb1,Enpp4,Prim2,Mettl10,Slc27a2,Dera,Qdpr,Dus1l,Cdyl2,Dhodh,Srr,Spr,and Mical2.These geneswere involved in pyrimidinemetabolism,purinemetabolism,and citrate cycle(TCA cycle)pathways.ConclusionMany variations of genesand pathways in c-kitpositive cellsexisted after 4Gy irradiation.However,further laboratory technology is required to confirm these variations.
2015-01-21)
10.3760/cma.j.issn.1673-4114.2015.02.003
国家自然科学基金海外合作基金项目(81129020);国家重点基础研究发展计划(“973”项目)重大专项(2011CB964800-G);国家自然科学基金面上项目(81372928);国家自然科学基金青年项目(81402633);协和青年基金资助和中央高校基本科研业务费专项资金资助项目(33320140033)
300192,中国医学科学院放射医学研究所,天津市放射医学与分子核医学重点实验室
孟爱民(Email:ai_min_meng@126.com)

