耐辐射奇球菌中多效蛋白PprA功能的研究进展
范美婷 马云 何淑雅
·综述·
耐辐射奇球菌中多效蛋白PprA功能的研究进展
范美婷 马云 何淑雅
耐辐射奇球菌(DR)是研究辐射抗性的模式生物,PprA蛋白(pleiotropic protein promoting DNA repair)是DR中一种特有的、促进DNA修复的多效蛋白。笔者对PprA蛋白在DNA损伤修复和维持基因组稳定性等方面的功能进行了综述,另通过运用生物信息学方法预测其结构域及与PprA蛋白相互作用的蛋白,进一步了解其发挥作用的机制和途径。
PprA蛋白;DNA损伤修复;基因组稳定;辐射,电离;生物信息学;耐辐射奇球菌
耐辐射奇球菌(Deinococcus radiodurans,DR)是一种红色、非致病性的革兰氏阴性菌,对电离辐射、紫外线、干燥和过氧化氢等一些其他DNA损伤因素都具有极强抗性。DR是1956年由美国科学家Anderson等[1]在经辐照灭菌后仍然变质的肉罐头中首次分离出来的,是地球上发现的辐射抗性最强的生物之一。DR并不具有特别的保护DNA不受辐射损伤的机制,其超强的辐射抗性主要得益于高效准确的DNA修复能力[2-3]。另外,DR超强的辐射抗性与其特殊的细胞结构[4]、超强的抗氧化能力[5]以及细胞清除能力[6]密不可分。
White等[7]在1999年公布了DR最常用的一个菌R1的完全基因组序列。DR R1基因组由4个环状分子构成,包括2条染色体,一大一小2个质粒,全长3 284 156 bp,共携有3197个可预测基因,其中功能未知的独特基因有1002个。在这1002个独特的基因中,pprA基因(pleiotropic gene promoting DNA repair)是于1998年由杜泽吉等[8]首次在DR中发现并克隆。PprA蛋白是DR中独有的功能未知的一种多效蛋白,pprA基因在促进DNA损伤修复和维持基因组的稳定性等方面可能发挥重要作用,但机制不清,且推测其作用可能涉及其他方面。
1 促进DNA损伤修复
在DR中发现并克隆pprA基因之后,到目前为止,在已有的数据库里还没有找到与其同源的模序。Devigne等[9]的体外实验表明,pprA基因产物能够优先与双链断裂的DNA结合,抑制大肠杆菌核酸外切酶Ⅲ的活性,并刺激ATP依赖性假定蛋白DRB0100和辅酶Ⅰ(NAD)依赖性的DNA连接酶以及T4连接酶[10]催化的DNA的末端连接反应。PprA的作用类似于真核的Ku蛋白,推测PprA在DR中参与非同源重组的末端连接(nonhomollogousend joining,NHEJ)[10],在DNA损伤修复中发挥重要作用。但是NHEJ在DR中从未在实验上成立过,DR中是否存在NHEJ也存在争议[11]。Tanaka等[12]研究证实,pprA基因产物是DR辐射抵抗所必需的,并且认为PprA能促进同源重组修复过程的顺利进行。电离辐射和紫外线辐照后PprA高度表达[13],pprA突变株比野生株生长缓慢,且对电离辐射、紫外线、丝裂霉素C高度敏感。ΔpprAΔrecA双突变株与recA单突变株辐射抗性相当,表明PprA可能与RecA存在相互作用,可能通过同一途径发挥作用。进一步的实验表明,ΔpprAΔrecA双突变株DNA片段重组的慢动力学与ΔrecA单突变株的一样,提示PprA在RecA依赖的重组修复中并不占有重要地位[9]。在自然状态下,pprA基因产物在同源重组中是非必要的,但尽管如此,在辐射损伤的修复过程中,PprA可能参与RecA依赖的修复过程[9]。最近的研究表明,pprA突变株对γ照射极度敏感,而回补pprA基因能够恢复其对γ照射的抗性[14]。
辐射造成DNA损伤后,PprI感受到损伤信号后上调RecA与PprA蛋白的表达;RecA通过与DNA损伤后产生的单链片段结合而被激活,从而促进LexA1与LexA2的裂解;被LexA2下调的某未知蛋白表达量升高而进一步增强pprA启动子的活性。细胞最终通过RecA蛋白参与的重组修复与PprA蛋白参与的末端连接修复来应对辐射造成的DNA损伤[15]。但是recA与pprA却都只能部分回补pprI突变株的电离辐射抗性,表明PprI在响应辐射损伤应答时很可能调控其他修复基因的参与。而且Lu等[15]通过比较DR野生型与pprI突变株在辐射前后的蛋白组差异后发现,作为低剂量电离辐射下的应答,pprI基因存在时,RecA与PprA在内的31种蛋白表达量显著上调,染色体免疫共沉淀实验证实,PprI蛋白能够与recA和pprA的启动子结合[16]。
PprA作为一种DNA结合蛋白,可以通过与其他蛋白相互作用发挥抗辐射功能。Das等[17]发现一种蛋白DRA0282,该蛋白为一种双链DNA结合蛋白,该蛋白缺失突变株的辐射生存率比野生菌株降低约 10倍,而 ΔpprA缺失突变体和 ΔpprAΔdrA0282双缺失突变株在相同的辐射剂量下其生存率则降低了100倍,因此推测DRA0282主要作用于pprA介导的DNA损伤修复过程。
PprA在电离辐射和干燥后高度表达,并且能够被LexA2[18]、pprM[19]和RecX[20]所抑制,与LexA2下调导致pprA启动子的活性增强相对应。而且PprM属于PprI依赖的信号转导途径,PprI能够调控PprM的表达[18]。pprA在体内外都能够介导刺激大肠杆菌还原酶KatE的表达,大肠杆菌中过表达pprA能够使其对过氧化氢抗性增强2到3倍[21]。但是目前没有相关实验表明DR中pprA介导KatE的表达。
另外有研究证实,ΔpprA-ΔrqkA(RqkA、DR2518、真核型丝氨酸/苏氨酸蛋白激酶)双缺失突变株增强了ΔpprA单突变株的辐射敏感性,但是与ΔrqkA单缺失突变株的辐射抗性相似,表明磷酸化的PprA在DR辐射抵抗中发挥作用。PprA磷酸化可能增强了其与DNA的亲和力,提高了T4 DNA连接酶在分子间连接的支撑作用[22]。
通过分析PprA与双链DNA的相互作用发现,PprA结合到DNA双链断裂处与PprA浓度有关。当PprA浓度大于1.3μmol/L时,PprA形成大的分子复合物[23]。
2 维持基因组的稳定性
近来发现,PprA有助于DR抵抗萘啶酮酸(一种拓扑异构酶Ⅱ、Ⅳ抑制剂),并且在DNA损伤后,PprA能够与DR拓扑异构酶相互作用,纯化的PprA蛋白能增强IB型拓扑异构酶(DraTopoIB)催化DNA超螺旋的松散,有利于维护基因组的稳定性[24]。
辐射和干燥处理后,ddrA(DR0423)、ddrB(DR0070)、ddrC(DR0003)、ddrD(DR0326)和pprA的转录明显升高[12],在ΔddrA及ΔddrD背景下引入pprA缺失的菌株对致死剂量的紫外线照射极度敏感,在1000 J/m2的紫外线照射下,ΔddrA-ΔpprA和ΔddrD-ΔpprA双缺失突变株比ΔpprA单缺失突变株的敏感性分别增加了100倍和1000倍。这些结果表明,PprA可能在功能上与DdrA和DdrD有重复,可能是因为它们具有相同的催化功能或者它们在独立的过程中对紫外线照射具有相同的影响。同源重组和切除修复在紫外线介导下的DNA损伤启示我们,DdrA、DdrD和PprA可能在这些过程中发挥作用。在DR中DdrA[25-26]结合到DNA链末端防止DNA在高剂量电离辐射下被内源性核酸外切酶降解,DdrA可能是DNA末端保护系统的一部分,能够协助维持DNA损伤后基因组的稳定性。因此,DdrA和PprA对紫外线损伤修复共同发挥作用。但是DdrD和PprA在紫外线抗性中似乎是独立过程的两个成员,DdrD似乎在电离辐射抗性中仅仅是个小角色。推测这3种蛋白通过维持基因组的稳定性,为DR提供足够长的修复时间[27]。通过将Deinococcus deserti暴露于3 kGyγ照射后分析可溶性蛋白质组学发现[27],在照射后的第一个阶段DNA损伤相应蛋白DdrB、SSB和两种不同的RecA蛋白(RecAP和RecAC)出现积聚,PprA、DdrD和两种解旋酶亚基(GyrA和GyrB)也能够被检测到。PprA、DdrD、DdrB、SSB、RecA和解旋酶出现在辐照修复早期,推测可能参与辐射早期修复途径。
最近的研究表明,在正常条件下,PprA在拟核及其他位置均有定位,但是在辐射修复早期PprA定位于拟核内,4Gy辐射2 h后细胞恢复增长,PprA开始出现于其他位置。萘定酮酸处理后,PprA跨越拟核开始扩散。DRΔgyrA突变株表现出生长抑制,ΔgyrA-ΔpprA双突变株表现出更明显的抑制。有趣的是ΔgyrA-ΔpprA双突变株对γ射线的辐射抗性是野生株的1/20,但是与ΔgyrA单突变株的辐射抗性类似。根据PprA在辐射后定位的动态改变以及其与解旋酶A功能的相互作用,推测PprA与解旋酶A有共同通路,可能通过拓扑异构酶II在子代细胞基因组分离的保真性中起作用[14]。ddrO的缺失会使PprA与GyrA蛋白高表达,PprA与GyrA都受到DdrO的负性调控,进一步说明两者在功能上的一致性[28]。
3 PprA蛋白功能预测
为了进一步分析PprA在DR中发挥作用的机制和途径,我们从其结构出发,利用生物信息学对其结构域进行分析,推测其功能。利用CDD(Conserved domains Database,http://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi)在线工具对pprA基因的结构域进行分析,发现其结构域中有3种预测E-value值小于10-5,分别是在其85~840个碱基处的COG4941 domain,预测E-value值为1.37e-06,预测含有TPR重复结构域的RNA聚合酶σ因子,与基因DNA的遗传信息转录为RNA相关;在140~ 685个碱基中含有RecX超家族结构域,预测E-value值为2.44e-06,RecX是一种假定的细菌调节蛋白,编码RecX的基因位于recA下游,且与RecA蛋白存在相互作用;在138~854个碱基中含有PHA03307 domain,预测E-value值为8.54e-06,具有转录调控功能;另外还有DUF566超家族、PRP38_assoc超家族、Cupin_2超家族和 Protamine_P1超家族,预测E-value值大于10-5,多为未知功能蛋白家族。推测PprA可能具有转录调控作用,与RNA的合成有关,且属于RecX超家族,与RecA蛋白存在相互作用(已有实验证实)。
此外我们还利用在线软件STRING(Search Tool for the Retrievalof Interacting Genes/Proteins,http:// string-db.org/newstring_cgi/show_input_page.pl)预测了与PprA相互作用的蛋白。通过分析,选择中等可信得分(4分以上)得到19个可能与PprA相互作用的蛋白,而且这些蛋白之间也存在着相互作用,构成了蛋白相互作用的网络(图1)。其关联越强,线条越粗。虽然与PprA相互作用的19个蛋白得分不是很高,但是根据已有文献报道可知,PprA与其中的LexA2(DRA0074)[18]、PprI[15-16](DR0167)、RecA(DR2340)[16]、DdrA(DR0423)[12,25-26]和 GyrA(DR0906)[14,28]的关系非常密切,说明所预测的结果可信。其中有4个蛋白是通过基因组的相关性得到的,分别是位于pprA下游的DRA0347和aldA(DRA0348),分别编码具有水解酶活性的假定蛋白和参与代谢的乙醛脱氢酶(aldA),位于pprA上游的lexA(DRA0344)和orf144c(DRA0345),分别发挥抑制DNA的损伤修复和红霉素酯酶的作用,LexA与PprA的关系已有实验证实。通过分析与PprA相互作用的这19个蛋白质的功能,分析PprA的功能涉及到:DNA损伤修复、维持基因组稳定性、抗氧化、RNA合成与修复和DNA合成等多个方面。其中DNA损伤修复、维持基因组稳定性已被文献报道所证实,另外预测到的与PprA蛋白有相互作用的蛋白涉及到RNA连接酶、还原酶、tRNA核苷酸基转移酶、乙醛脱氢酶等,推测PprA可能参与到转录后加工等过程,参与DR的代谢、抗氧化性、RNA修复和DNA合成等。
综上所述,PprA的文献提示功能、结构预测及相互作用预测功能本文总结见图2。
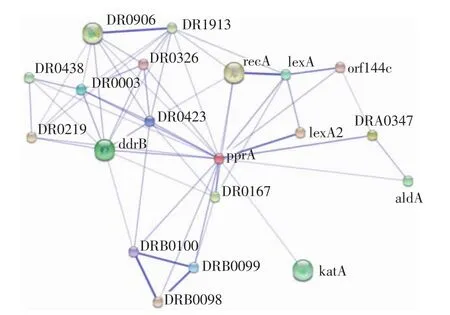
图1 STRING预测PprA相互作用蛋白Fig.1 Prediction interaction proteinwith PprA by STRING
4 总结与展望
PprA是一种DNA结合蛋白,能够与多种蛋白发生相互作用,不仅能在辐射抗性方面发挥作用,也是维持基因组稳定性方面的重要成员。关于预测的PprA的氧化抗性、RNA修复、DNA合成等功能,虽然目前暂无实验数据支持,但不失为值得今后重点研究及关注的领域。
pprA只是DR中一个相对重要的基因,DR的辐射抗性不能单单归因于某一个方面,而是细胞内所有因素综合调控的结果。DR的耐辐射损伤与修复是一个复杂的网络系统,各种基因与其表达的蛋白在网络中发挥各自的作用,保障了DR在高强度辐射下的生存。PprA蛋白结合免疫荧光技术,可用于哺乳动物细胞培养中可视化辐射诱导的DNA链断裂,从而用来评估DNA损伤应答。这种检测方法也适用于在环境和制药领域的基因毒性试验[29]。随着转录组学等技术的发展,PprA蛋白的调控机制研究将不断深入,对揭示DNA损伤的修复机理具有重要理论意义,进而对DR在环境保护、能源利用、农业生产和生物修复、人类健康等方面具有重要实践指导意义。
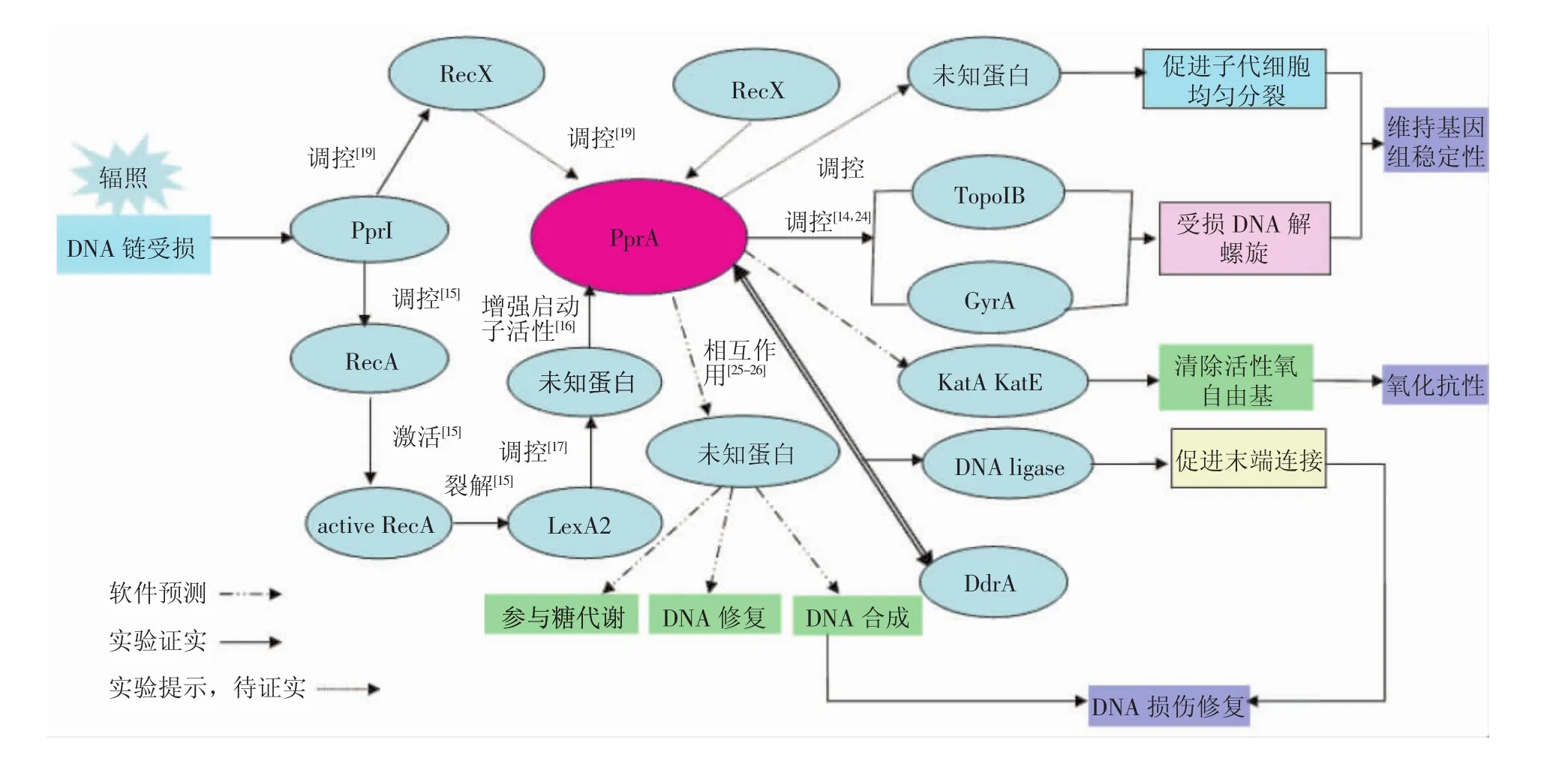
图2 辐照后耐辐射奇球菌PprA调控模型Fig.2 PprA regulatorymodel from Deinococcus radioduransafter irradiated
[1]Anderson AW,Nordan HC,Can RF,etal.Studieson a radio-resistant micrococcus Isolation,morphology,cultural characteristics, and resistance to gamma radiation[J].Food Techmol,1956,10(3):575-578.
[2]Minton KW.Repair of ionizing radiation damage in the radiation resistantbacterium Deinococccus radiodurans[J].Mutat Res,1996, 363(1):1-7.
[3]Repar J,Cvjetan S,Slade D,et al.RecA protein assures fidelity of DNA repair and genome stability in Deinococcus radiodurans[J]. DNARepair(Amst),2010,9(11):1151-1161.
[4]Levin-Zaidman S,Englander J,Shimoni E,etal.Ringlike structure of the Deinococcus radiodurans genome:a key to radioresistance? [J].Science,2003,299(564):254-256.
[5]GhosalD,OmelchenkoMV,Gaidamakova EK,etal.How radiation kills cells:survival of Deinococcus radiodurans and Shewanella oneidensisunderoxidative stress[J].FEMSMicrobiolRev,2005,29(2):361-375.
[6]Slade D,Lindner AB,Paul G,etal.Recombination and replication in DNA repair of heavily irradiated Deinococcus radiodurans[J]. Cell,2009,136(6):1044-1055.
[7]WhiteO,Eisen JA,Heidelberg JF,etal.Genome se2 quenceof the radioresistant bacterium Deinococcus radiodurans R1[J].Science, 1999,286(5444):1571-1577.
[8]杜泽吉,田海林,鸣海一成,等.抗辐射菌Deinococcus radiodurans一种新的DNA修复基因pprA的分子克隆测序及特性研究(英文)[J].辐射研究与辐射工艺学报,1998,16(4):26-32.
[9]Devigne A,Mersaoui S,Bouthier-De-La-Tour C,et al.The PprA protein is required for accurate cell division ofγ-irradiated Deinococcus radiodurans bacteria[J].DNA Repair(Amst),2013, 12(4):265-272.
[10]Narumi I,Satoh K,Cui S,et al.PprA: a novel protein from Deinococcus radiodurans that stimulates DNA ligation[J].MolMicrobiol,2004,54(1):278-285.
[11]Zahradka K,Slade D,Bailone A,et al.Reassembly of shattered chromosomes in Deinococcus radiodurans[J].Nature,2006,443(7111):569-573.
[12]Tanaka M,Earl AM,Howell HA,et al.Analysis of deinococcus radiodurans's transcriptional response to ionizing radiation and desiccation reveals novel proteins that contribute to extreme radioresistance[J].Genetics,2004,168(1):21-33.
[13]Liu Y,Zhou J,Omelchenko MV,et al.Transcriptome dynamics of Deinococcus radiodurans recovering from ionizing radiation[J].Proc NatlAcad SciUSA,2003,100(7):4191-4196.
[14]Kota S,Charaka VK,Misra HS.PprA,a pleiotropic protein for radioresistance,works through DNA gyrase and shows cellular dynamics during postirradiation recovery in Deinococcus radiodurans [J].JGenet,2014,93(2):349-354.
[15]Lu H,Gao G,Xu G,et al.Deinococcus radiodurans PprIswitches on DNA damage response and cellular survivalnetworksafter radiation damage[J].MolCellProteomics,2009,8(3):481-494.
[16]Lu H,Chen H,Xu G,etal.DNA binding isessential for PprI function in response to radiation damage in Deinococcus radiodurans[J]. DNARepair(Amst),2012,11(2):139-145.
[17]Das AD,Misra HS.Characterization ofDRA0282 from Deinococcus radiodurans for its role in bacterial resistance to DNA damage[J]. Microbiology,2011,157(Pt8):2196-2205.
[18]Satoh K,Ohba H,Sghaier H,et al.Down-regulation of radioresistanceby LexA2 in Deinococcus radiodurans[J].Microbiology,2006, 152(Pt11):3217-3226.
[19]Ohba H,Satoh K,Sghaier H,etal.Identification of PprM:amodulator of the PprI-dependentDNA damage response in Deinococcus radiodurans[J].Extremophiles,2009,13(3):471-479.
[20]Sheng D,Jao J,LiM,etal.RecX is involved in the Switch between DNA damage response and normalmetabolism in D.radiodurans [J].JBiochem,2009,146(3):337-342.
[21]Kota S,Misra HS.PprA:A protein implicated in radioresistanceof Deinococcus radioduransstimulates catalaseactivity in Escherichia coli[J].ApplMicrobiolBiotechnol,2006,72(4):790-796.
[22]Rajpurohit YS,Misra HS.Structure-function study of deinococcal serine/threonine protein kinase implicates its kinase activity and DNA repair protein phosphorylation roles in radioresistance of Deinococcus radiodurans[J].Int J Biochem Cell Biol,2013,45(11):2541-2552.
[23]Adachi M,Hirayama H,Shimizu R,et al.Interaction of doublestranded DNAwith polymerized PprA protein from Deinococcus radiodurans[J].Protein Sci,2014,23(10):1349-1358.
[24]Kota S,Charaka VK,Ringgaard S,et al.PprA contributes to Deinococcus radiodurans resistance to nalidixic acid,genome maintenance after DNA damage and interacts with deinococcal topoisomerases[J/OL].PLoSOne,2014,9(1):e85288[2015-02-01].http://journals.plos.org/plosone/article?id=10.1371/journal. pone.0085288.
[25]Harris DR,Ngo KV,Cox MM.The stable,functional core of DdrA from Deinococcus radiodurans R1 does not restore radioresistance in vivo[J].JBacteriol,2008,190(19):6475-6482.
[26]Harris DR,Tanaka M,Saveliev SV,et al.Preserving genome integrity:the DdrA protein of Deinococcus radiodurans R1[J/OL]. PLoS Biol,2004,2(10):e304[2015-02-01].http://journals. plos.org/polsiology/article?id=10.1371/journal.pbio.0020304.
[27]Selvam K,Duncan JR,Tanaka M,et al.DdrA,DdrD,and PprA:componentsof UV andmitomycin C resistance in Deinococcus radiodurans R1[J/OL].PLoSOne,2013,8(7):e69007[2015-02-01].http://journals.plos.org/plosone/article?id=10.1371/journal.pone. 0069007.
[28]Devigne A,Ithurbide S,Bouthier de la Tour C,etal.DdrO isan essentialprotein that regulates the radiation desiccation response and the apoptotic-like cell death in the radioresistant Deinococcus radiodurans bacterium[J/OL].Mol Microbiol,2015[2015-03-05]. http://www.ncbi.nlm.nih.gov/pubmed/25754115.[Epub ahead ofprintMar J,2015].
[29]Satoh K,Wada S,Kikuchi M,et al.Method for detecting DNA Strand breaks inmammalian cells using the Deinococcus radioduransPprA protein[J].MutatRes,2006,596(1-2):36-42.
Research progressand prediction on pleiotropic protein PprA from Deinococcus radiodurans
Fan Meiting*,Ma Yun,He Shuya.*Departmentof Radiation Medicine,School of Public Health,University of South China,Hengyang 421001,China
He Shuya,Email:skyhe2000@Hotmail.com
Deinococcus radiodurans(DR) is amodel organism to study radiation resistance. PprA protein(pleiotropic protein promoting DNA repair) is a unique,pleiotropic protein promoting DNA repair in DR.This article reviewed its possible function in DNA damage repairing,maintenance of genome stability and other aspects.Furthermore,we analyze its domain of pprA genes and by bioinformatics and predict interaction protein with PprA protein,in order to predict its function and understand themechanismsand pathways itplays.
PprA protein;DNA damage repair;Genomestability;Radiation,onizing;Bioinformatics; Deinococcus radiodurans
2015-03-07)
10.3760/cma.j.issn.1673-4114.2015.02.010
国家自然科学基金(81272993)
421001衡阳,南华大学公共卫生学院放射医学教研室(范美婷,何淑雅);421001衡阳,南华大学生物化学与分子生物学教研室(马云,何淑雅);421001衡阳,湖南省分子靶标新药协同创新中心(马云,何淑雅)
何淑雅(Email:skyhe2000@Hotmail.com)

