过表达枸杞LmPSY基因提高洋桔梗抗逆性的研究
季 静,曹海燕,王 罡,柳 洁,李招娣,武卫党
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
过表达枸杞LmPSY基因提高洋桔梗抗逆性的研究
季 静1,2,曹海燕1,王 罡2,柳 洁1,李招娣1,武卫党2
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
类胡萝卜素与植物的光保护及耐盐有很大关系,八氢番茄红素合成酶(PSY)是类胡罗素合成重要酶.将来自枸杞(Lycium chinense Miller)的八氢番茄红素合成酶(LmPSY)基因在洋桔梗中过表达,旨在提高其抗逆性.RT-qPCR结果发现LmPSY基因在转基因洋桔梗中有组织差异表达.高效液相色谱结果说明转基因洋桔梗叶片总类胡萝卜素提高 1.3倍,玉米黄质和叶黄素含量提高 1.1倍.强光胁迫条件下,转基因洋桔梗鲜重和干重较非转基因植株有显著提高.200,mmol/L氯化钠胁迫条件下,转基因洋桔梗过氧化物酶(POD)和超氧化物酶(SOD)含量有显著提高,转基因植株的荧光参数(Fv/Fm)提高 8.0%~9.3%.强光和盐胁迫条件下对转基因植株生理生化指标的测定证明洋桔梗的耐强光性及耐盐性有显著提高.
洋桔梗;八氢番茄红素合成酶基因;耐强光性;耐盐性
洋桔梗(Eustoma grandiflorum)别名草原龙胆,有绿色、白色、紫色、红色、粉色等花色.原产于北美洲,后引种至日本和欧洲,经过杂交改良后成为异常新奇、妖媚动人的花卉[1-2].自 1982年推出单瓣的海地系列和重瓣的回音系列以来,洋桔梗的销售量急剧增加.目前,年销售量达到 1×108支,年销售额1.1×108美元,列切花排名第7位[3].洋桔梗适宜在温暖、湿润和阳光充足的地区种植,是一种较耐寒、不耐盐和强光照射的植物.而天津市为重盐碱城市,土壤盐渍化严重,盐碱地绿化难度大,而且夏季强光照射较严重,因此无法大面积种植洋桔梗.于是研究人员开始培育新的洋桔梗品种增强其抗逆性,目前普遍认为植物基因工程的手段速度快并且见效快[4],已经利用植物基因工程手段培育了大豆、玉米、番茄、小麦等许多植物的抗逆性较强的新品种[5-7].关于洋桔梗基因工程的研究大都是关于花色及花香的研究,2004年我国学者毛元荣等[8]将类黄酮途径相关基因NPRI通过农杆花色菌介导法导入洋桔梗中,研究其花色的改变,2007年Aranovich等[9]将来自仙女扇的BEAT基因导入洋桔梗,对其花香变化进行了研究.关于通过基因工程手段增强洋桔梗抗逆性的研究并不是很多,2012年本研究室 Wu等[10]通过农杆菌介导法将与类胡萝卜素相关基因AtchyB导入洋桔梗发现洋桔梗耐强光性有显著提高.
在类胡萝卜素生物合成途径上游,两分子的牦牛儿基牦牛儿基焦磷酸(GGPP)在八氢番茄红素合成酶(PSY)的作用下形成一种复杂的类胡萝卜素——八氢番茄红素,经过后续几步反应可以形成 ABA (abscisic acid)[11]. 关于类胡萝卜素生物合成的研究已经比较清楚.由于类胡萝卜素镶嵌于叶绿体和有色体膜中,它们消除活性氧,淬灭活性的三重态分子、单线态氧,抑制有害自由基的形成,防止植物的光灭活和光破坏,并参与消耗过剩光能的反应,与光保护的作用相关[12].而脱落酸是植物体内的胁迫相关激素,在介导植物抗逆信号应答过程中起着重要作用,在盐碱及干旱条件下,植物内源ABA水平会提高.自2008年Li等[13]发现玉米中的PSY3基因转录水平与非生物胁迫相关,表明 PSY基因与非生物胁迫抗性相关后,研究人员相继发现将盐角草 PSY基因在拟南芥中过表达,可以提高拟南芥的抗非生物胁迫能力[14],将葡萄柚果实中的 PSY基因在烟草中过表达可以提高烟草的抗非生物胁迫能力[15].
笔者运用农杆菌转化法,将从枸杞中分离的八氢番茄红素合成酶基因(LmPSY)转入 Green品种洋桔梗中,进行强光和盐胁迫处理,并且对其生理生化指标进行了测定[16-17].旨在培育出具有耐强光、耐盐碱的洋桔梗品种,适宜在天津这样土地盐碱化较严重并且有强光直射的地区种植,从而扩大洋桔梗的种植范围,培育出更多洋桔梗以满足市场需求.
1 材料与方法
1.1 材 料
1.1.1 植物材料
Green品种的洋桔梗.
1.1.2 质粒载体和农杆菌菌株
本实验所用质粒载体为本实验室(天津大学遗传工程研究所)保存的植物双元表达质粒载体pCAMBIA2300,含有卡那霉素抗性基因质粒图谱见图 1.本实验所用根癌农杆菌株为本实验室保存的含有pCAMBIA2300-LmPSY质粒的C58菌株.
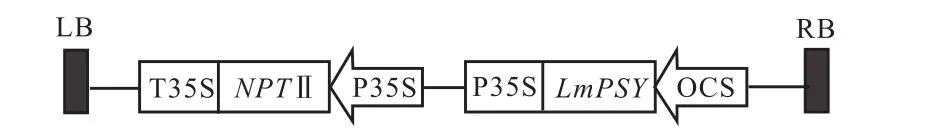
图1 pCAMBIA2300-LmPSY载体图谱Fig.1 Schematic representation of plasmid pCAMBIA2300-LmPSY
1.1.3 培养基
培养基成分及种类见表1.

表1 培养基Tab.1 Medium formulation
1.2 洋桔梗遗传转化
1.2.1 外植体
将洋桔梗种子灭菌后接种到种子萌发培养基上,待其长出4~5片叶子时,取叶片将其切成0.5,cm2大小的叶盘备用.
1.2.2 农杆菌浸染液的制备
挑取Kana(质量浓度为100,mg/L)的YEP固体培养基上生长的单菌落至Kana浓度相同的50,mL YEP液体培养基中,振荡培养至 OD600值为 0.6~0.8,3,800,r/min离心3,min收集菌体,用相同体积农杆菌重悬液重悬菌体,作为浸染液[10,18].
1.2.3 洋桔梗叶盘的浸染转化
将上一步中制得的农杆菌浸染液转移至盛有洋桔梗叶盘的无菌三角瓶中,浸泡 15,min,将洋桔梗叶盘接种至共培培养基,于22,℃暗培养3,d.
将共培后的洋桔梗叶盘从共培培养基上转移至筛选培养基,每2周继代1次,头孢霉素的质量浓度由400,mg/L逐渐降低至100,mg/L,叶盘边缘长出愈伤组织后,将愈伤组织块切下,接种至新的筛选培养基.
1.2.4 不定芽的生根与移栽
当抗性不定芽高度超出 3,cm后,将其切下,放入生根培养基培养.待不定芽的根伸长至 4,cm左右时将其移栽至含有蛭石、珍珠岩和营养土的花盆中.待洋桔梗结种子后,收取种子在 Kana(质量浓度为50,mg/L)的1/2,MS培养基中萌发,待植株到四叶期时移栽至花盆中进行后续研究.
1.3 转基因洋桔梗分子检测与表达分析
1.3.1 转基因洋桔梗分子的检测
(1) 抗性植株的PCR检测. 采用CTAB法提取对照和抗性植株基因组DNA,根据LmPSY基因设计引物PSYF、PSYR,进行PCR检测.
(2) 转基因植株的RT-PCR检测. 采用Trizol法提取对照和转基因植株叶片总 RNA,用天根公司TransScript TransStartTM one-step gDNA Removal and cDNA Synthesis SuperMix反转录合成的cDNA第一链作为模板.用引物PSYF和PSYR检测LmPSY基因的表达.根据洋桔梗泛素合成酶基因(EgUBi,作为内参)设计引物 EgUbiF、EgUbiR进行 RT-PCR检测.引物序列见表2.

表2 引物序列Tab.2 Primer sequences
1.3.2 实时定量PCR检测转基因洋桔梗组织差异表达
用软件primer3(http://frodo.wi.mit.edu/primer 3/)设计荧光定量 PCR引物:PSYQPCRF、PSYQPCRR.仍然用泛素合成酶基因作内参基因,其引物仍然用EgUbiR 和 EgUbiF.用 RNeasy Plant Mini Kit (QIAGEN,德国)分别提取转基因洋桔梗根、茎、新叶、老叶总RNA,合成cDNA第一链方法见RT-PCR检测.用Top Green qPCR SuperMix(TRANS,中国)做实时定量 PCR检测,反应体系为:PSYQPCRF (10,μmol/L)0.5,μL,PSYQPCRR (10 μmol/L)0.5 μL,2×TransStartTMTop Green qPCR SuperMix 12.5,μL, passive Reference Dye 0.5,μL,cDNA 1,μL.反应条件为 94,℃ 30,s,94,℃ 5,s,60,℃ 15,s,72,℃ 10,s,40个循环.
1.3.3 类胡萝卜素含量检测
(1) 总类胡萝卜素的提取及检测.称取 0.2,g新鲜洋桔梗叶片转移至离心管中,用组织研磨器进行研磨之后加入2,mL 60% KOH和20,mL甲醇剧烈振荡混匀,60,℃水浴 20,min,用 15,mL含有 50%乙醚的石油醚作为萃取剂萃取总类胡萝卜素.将提取的类胡萝卜素溶于丙酮,用紫外分光光度计测定样品在450,nm 处的吸光值,叶片中总类胡萝卜素含量计算式为
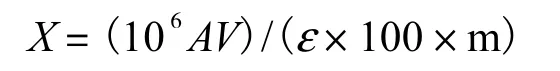
式中:X为总类胡萝卜素含量,μg/g;A为样品在450,nm 处的吸光度;V为提取液的体积;ε 为类胡萝卜素分子平均消光系数,2,100;m为称取的洋桔梗叶片质量,g.
(2) 洋桔梗叶片色素的高效液相色谱分析.将样品溶于60,μL丙酮,取20,μL进样进行高效液相色谱分析(high performance liquid chromatography,HPLC).流动相为异丙醇、乙腈和甲醇,体积比为 5∶85∶10.使用Thermo二极管阵列检测器全波长扫描类胡萝卜素谱图.
1.3.4 表型的变化
类胡萝卜素是植物重要的色素物质之一,由于植物不同组织中类胡萝卜素各成分组成的不同,使植物茎、叶、花和果实等呈现不同的颜色.PSY基因是类胡萝卜素合成途径中的关键酶基因,PSY基因的过表达往往会引起一些下游代谢产物(如玉米黄质和叶黄质等)的积累量发生变化,从而导致植物的表型发生变化.
1.3.5 光胁迫洋桔梗
将长势相同的L1品系、L4品系、非转基因植株分为2组,每组中每个品系设置3个重复.其中一组为实验组,另一组为对照组.对照组在正常光照条件(180,μmol/(m2·s))下培养,实验组置于弱光照(75,μmol/(m2·s))条件下培养,1周后,测叶片的干重与鲜重比(mD/mF).然后,将实验组在正常光照条件下培养 1周后,在强光(1,000,μmol/(m2·s))胁迫下培养6周,测量mD和mF.mD和mF的测定方法参见文献[10].
1.3.6 200,mmol/L氯化钠处理洋桔梗
采用200,mmol/L的氯化钠对转基因洋桔梗和非转基因型洋桔梗施以胁迫 20,d后,测定其荧光参数(Fv/Fm),并且取叶片,提取细胞可溶性蛋白,测定其超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性.用光合仪(LI-6400,XT)对荧光参数进行测定.SOD、POD、CAT的测定分别使用南京建成生物工程研究所的试剂盒:A001-1超氧化物歧化酶(SOD)测试盒(测总 SOD);A084-2过氧化物酶(POD)测定试剂盒;A007-1 过氧化氢酶(CAT)测试盒.
2 结果与分析
2.1 LmPSY基因在洋桔梗中的表达分析
(1) 提取抗性和非转基因型洋桔梗基因组 DNA为模板,以引物PSYF和PSYR做PCR检测,并以质粒pCAMBIA2300-LmPSY为阳性对照,取PCR产物进行琼脂糖凝胶电泳,PCR检测结果如图2所示.结果表明有 4个细胞系出现目的条带(1,341,bp).分别将其标记为品系L1、L2、L3和L4和进行后续研究.
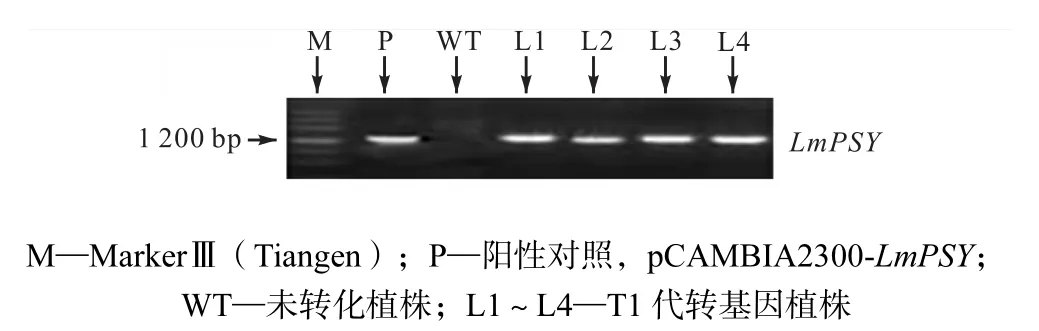
图2 洋桔梗叶片基因组PCR检测结果Fig.2 Result of PCR assay of eustoma leaf genome
(2) 对PCR检测呈阳性的4个细胞系和未转化植株进行 RT-PCR检测,4个细胞系 L1、L2、L3、L4都扩增出泛素合成酶基因并且扩增出与目的基因大小相同的片段,而非转基因型植株未扩增出相应目的条带,如图3所示.
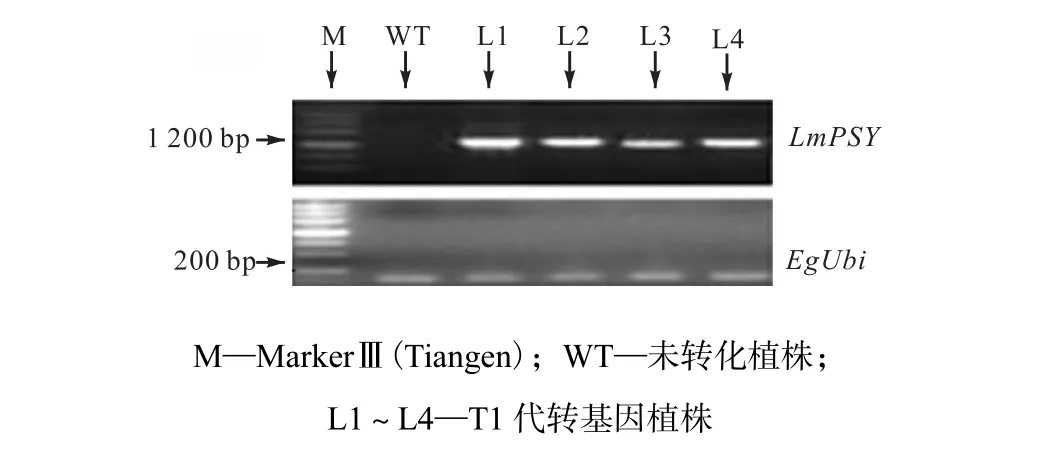
图3 RT-PCR检测LmPSY表达Fig.3 RT-PCR assay of LmPSY expression
2.2 实时定量PCR检测转基因植株不同组织表达
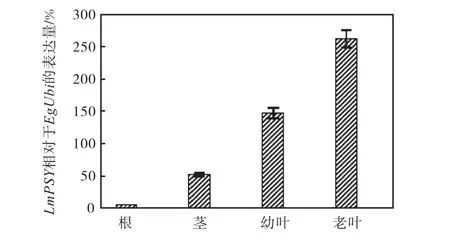
图4 通过实时定量 PCR测定转基因洋桔梗不同组织的LmPSY相对表达量Fig.4 Real-time quantitative PCR analysis of LmPSY relative expression in different eustoma tissues
2.3 转基因植株的HPLC检测
分别测定非转基因型和转基因洋桔梗叶片中的类胡萝卜素含量.用吸光度法测得转基因洋桔梗品系 L1和 L3叶片中总类胡萝卜素含量分别为58.1,μg/g和 59.0,μg/g,非转基因型洋桔梗叶片中总类胡萝卜素含量为 46.5,μg/g,L1和 L3总类胡萝卜素含量分别提高了 25.0%和 26.9%.β类胡萝卜素、玉米黄质和叶黄素是绿色叶片中的主要类胡萝卜素,LmPSY是类胡萝卜素生物代谢途径中的关键酶,它的过量表达使转基因洋桔梗叶片中的玉米黄质和叶黄素含量与非转基因型洋桔梗相比都有显著提高.如表3所示.
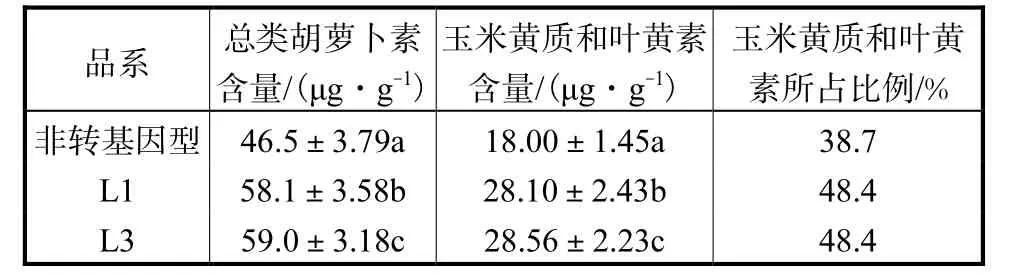
表3 转基因洋桔梗叶片类胡萝卜素含量Tab.3 Leaf carotenoid compositions of transgenic eustoma leaves
2.4 转基因洋桔梗表型的变化
在洋桔梗中过表达 LmPSY基因后,其表型的改变如图5所示.由图可以看出转基因洋桔梗叶片的叶型和颜色与非转基因洋桔梗有所不同,转基因洋桔梗的叶片较宽厚,并且叶片中镶嵌的黄色部分较多[10].

图5 转基因洋桔梗叶片的变化Fig.5 Changes in transgenic eustoma leaves
2.5 光胁迫条件下生理指标的测定
弱光(75,μmol/(m2·s))条件下,测叶片的干重与鲜重比(mD/mF)结果如图 6所示,在低光照条件下转基因植株的mD/mF明显比野生型植株的高,在正常光照下(180,μmol/(m2·s))转基因比非转基因的mD/mF略有提高,但差异并不显著.
将实验组在强光(1,000,μmol/(m2·s))胁迫下培养 6周后,其生物量测量情况如图 7所示,结果显示,光胁迫对非转基因植株生物量的影响比对转基因型植株影响大,强光胁迫下非转基因型植株mF和mD分别是正常光照下的54%和58%.而光胁迫下两个品系L1和L4的转基因植株的mF和mD分别为正常光照条件下的 89%、88%和 86%、85%.这也进一步验证 LmPSY基因在提高植物抗强光和弱光胁迫中有作用.
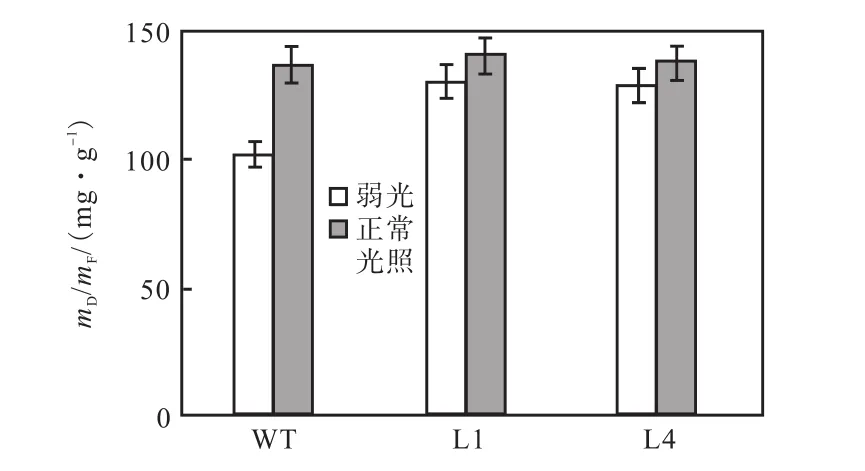
图6 弱光和正常光照条件下非转基因植株和转基因植株叶片的mD/mFFig.6 Ratio of dry mass to fresh mass(mD/mF)of wildtype (WT)and transformants L1 and L4 under low light and normal light conditions
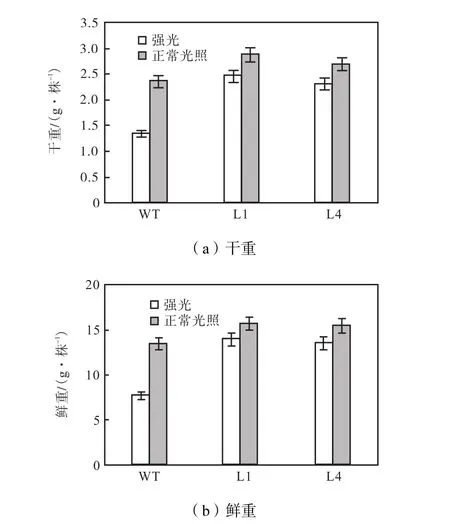
图7 强光和正常光照条件下非转基因植株和转基因植株的干重和鲜重Fig.7 Fresh mass(mF)and dry mass(mD)of wild-type (WT)and transformants L1 and L4 under high light and normal light condition
2.6 盐胁迫后生理指标的测定
(1) 抗氧化物酶活性 SOD、POD的测定结果如图8所示,在正常生长条件下,非转基因型与转基因的SOD、POD值没有差异,SOD为56.9~64.2,U/mg,POD为 64.9~67.2,U/mg.盐胁迫条件下,非转基因型SOD提高到86.2,U/mg,L3提高到133.5,U/mg,非转基因型 POD提高到 96.1,U/mg,L3提高到161.8,U/mg.而未检测到CAT活性.
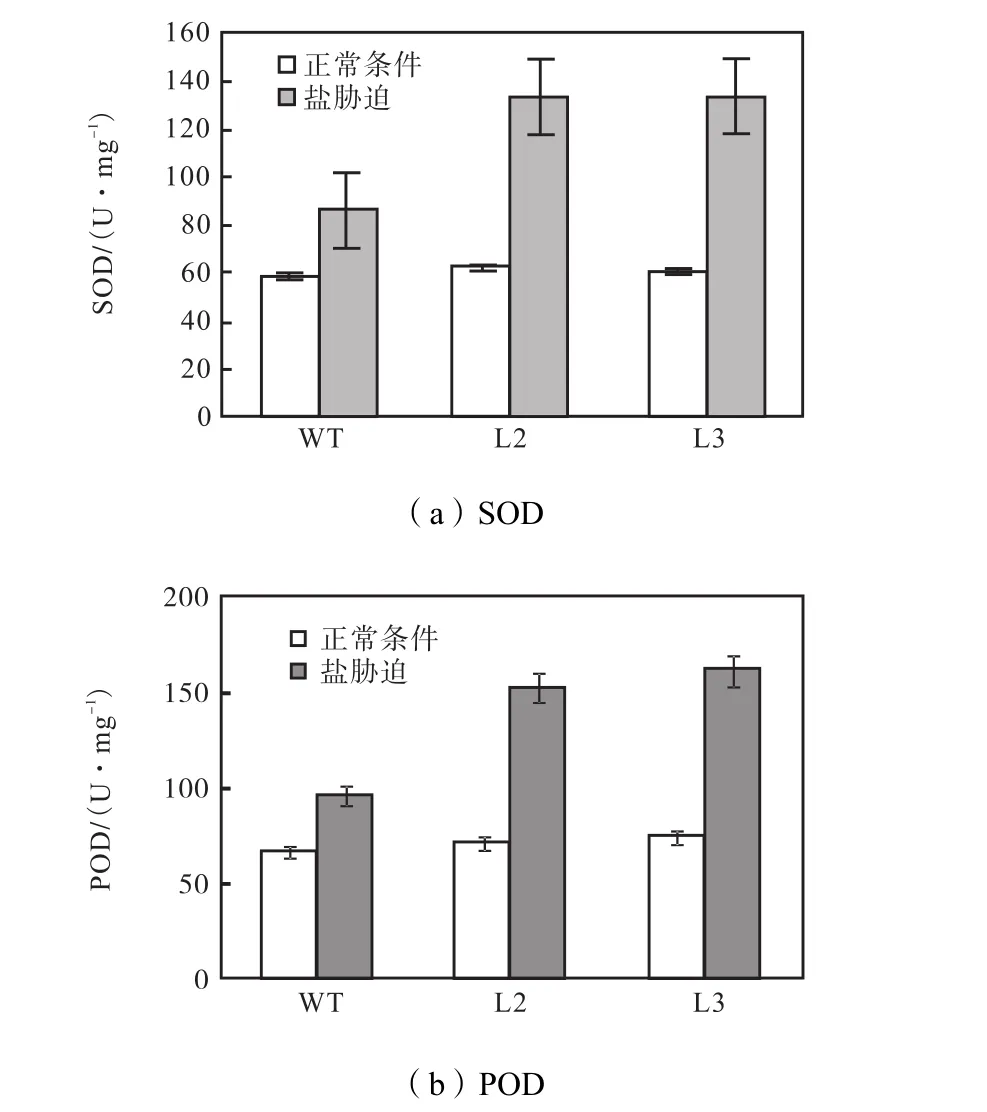
图8 抗氧化物酶活性Fig.8 Antioxidant enzyme activity
(2) 由于逆境胁迫对光合作用各过程产生的影响可通过体内叶绿素荧光诱导动力学变化反映.因此,叶绿素荧光参数(Fv/Fm)可作为逆境条件下植物抗逆反应指标之一.Fv/Fm反映最大光化学量子产量,反映 PSⅡ反应中心光能转换效率.在正常生长条件下,测得转基因植物与非转基因植物 Fv/Fm并无差异,皆为 0.83.为确定转基因植物对盐胁迫的适应能力,笔者测定L1、L2、L3 3个品系洋桔梗盐胁迫后的Fv/Fm,结果如表4所示.在盐胁迫条件下,对照和转基因洋桔梗的Fv/Fm都有所降低.但在盐胁迫条件下,3个品系转基因洋桔梗的Fv/Fm分别为0.81、0.82及 0.81;而对照为 0.75,转基因植株比非转基因型植株的Fv/Fm提高了8.0%~9.3%.
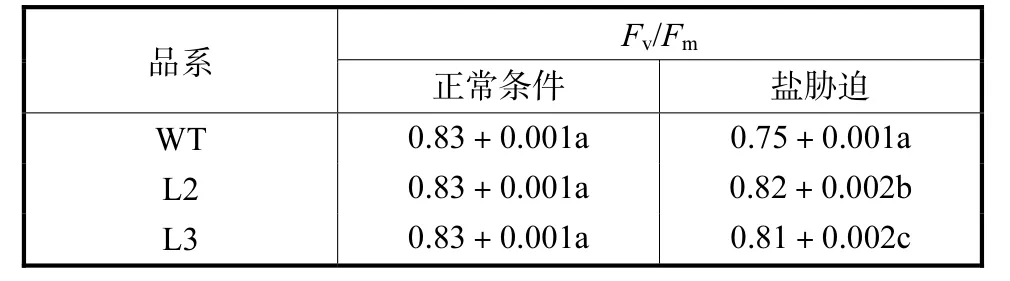
表4 盐胁迫条件下洋桔梗的Fv/Fm值Tab.4 Fv/Fmunder salt treatment
3 讨 论
Giuliano等[19]报道番茄 PSY基因表达是相对恒定的,在叶子成熟过程中 PSY基因表达下调.Salvini等[15]研究向日葵发现HAPSY表达在叶子成熟过程中是受到调控的.而本研究发现转基因洋桔梗老叶较新叶表达量高,与Salvini结论相符.
1999年 Götz等[20]将来自细菌的八氢番茄红素合成酶基因(PSY)和β-胡萝卜素羟化酶基因(ChyB)转化入藻青菌 Synechococcus PCC794中,使该菌株能够积累高含量的 β-胡萝卜素和玉米黄质,经紫外线处理后,发现转基因藻清菌 Synechococcus PCC7942的抗紫外辐射的能力有很大提高,同时发现内生玉米黄质较β-类胡萝卜素抗紫外线更有效.2002年,Götz等[21]为了研究类胡萝卜素在植物光胁迫中的作用,将来自细菌的 CrtZ基因通过农杆菌介导法导入烟草中,使烟草中玉米黄质积累量增加,从而提高烟草对紫外线辐射的抗性.2006年 Schafer等[22]研究发现在藻青菌 Synechococcus PCC7942中强光刺激下类胡萝素生物合成上调. 2014年本研究室 Zhao等[23]将来自拟南芥中的 chyB基因转入烟草,发现烟草中叶黄素含量提高后改善了其 UV抗性.本研究中强光胁迫洋桔梗后,发现转基因植株较非转基因型植株受影响小,而非胁迫条件下 HPLC分析结果显示转基因洋桔梗中玉米黄质和叶黄素含量更高.所以有可能是因为玉米黄质和叶黄素的提高,叶黄素循环池被放大可以进一步提高植物的抗强光能力.由此可以推断本研究中的洋桔梗的UV抗性也可能有所提高,笔者将会对其进行进一步研究.
在盐胁迫过程中,开始用100,mmol/L、200,mmol/ L、300,mmol/L和 500,mmol/L NaCl胁迫洋桔梗发现,300,mmol/L NaCl以上浓度洋桔梗生长缓慢,不适宜测定生理数据,因此选择200,mmol/L NaCl进行胁迫.Han等[13]于2008年在拟南芥中高表达盐角草PSY基因,在 100,mmol/L NaCl胁迫下,发现转基因拟南芥比非转基因型拟南芥的 Fv/Fm提高 9.3%~ 16.6%.而本研究中发现在洋桔梗中过表达枸杞 PSY基因,在 200,mmol/L NaCl胁迫下,转基因植株比非转基因型植株的Fv/Fm提高8.0%~9.3%. Salvini等[15]证明 PSY对于植物在胁迫条件下合成 ABA非常重要,本研究中枸杞 LmPSY基因提高植物的耐盐能力较显著,可能是由于在盐胁迫条件下,LmPSY基因过表达提高了植物中合成的ABA.
Salvini等[15]的研究表明将葡萄柚果实中的 PSY基因在烟草中过表达可以提高烟草的耐干旱能力,本研究未对转基因植物进行干旱胁迫,在接下来的工作中会进一步研究转LmPSY基因洋桔梗抗干旱能力是否有所提高.
虽然洋桔梗有白色、绿色、紫色、粉色多种花色,但市场对于深黄色或橙色洋桔梗需求仍然很大.到目前为止,并没有通过传统育种或转基因方法得到黄色洋桔梗.本研究中 LmPSY基因也可以引起花中类胡萝卜素的积累,产生黄绿色花.本研究中共得到 4个细胞系,L1有10株,L2有8株,L3有7株,L4有10株.接下来将会进一步研究是否可以得到稳定遗传黄绿色抗逆洋桔梗,以满足市场需求.
4 结 语
本研究将来自枸杞的LmPSY基因成功在洋桔梗中过表达.高效液相色谱结果发现转基因洋桔梗叶片总类胡萝卜素提高1.3倍,玉米黄质和叶黄质含量提高 1.1倍.强光胁迫条件下,转基因洋桔梗鲜重和干重较非转基因植株有显著提高.200 mmol/L氯化钠胁迫条件下,转基因洋桔梗过氧化物酶(POD)和超氧化物酶(SOD)含量有显著提高,转基因植株的荧光参数(Fv/Fm)提高 8.0%~9.3%.强光和盐胁迫条件下对转基因植株生理生化指标的测定证明洋桔梗的耐强光性及耐盐性有显著提高.本研究为类胡萝卜素生物合成途径中相关酶基因可以用来提高植物的抗逆性提供依据,同时为运用基因工程技术培育花卉品种提供依据.
[1] Davies K,Winefield C,Lewis D. Research into control of flower colour and flowering time in Eustoma grandiflorum(Lisanthus)[J]. Flowering Newsletter,1997: 23:24-32.
[2] Ochiai M,Matsumoto S,Yamada K. Methyl jasmonate treatment promotes flower opening of cut Eustoma by in-ducing cell wall loosening proteins in petals[J]. Postharvest Biology and Technology,2013,82:1-5.
[3] Jamal Uddin A F M,Islam M S,Mehraj H,et al. An evaluation of some Japanese lisianthus(Eustoma grandiflorum)varieties grown in Bangladesh[J]. The Agriculturists,2013,11(1):56-60.
[4] Josine T L,Ji J,Wang G,et al. Advances in genetic engineering for plants abiotic stress control[J]. African Journal of Biotechnologys,2011,10(28):5402-5413.
[5] Sparks C A,Doherty A,Jones H D. Genetic Transformation of Wheat via Agrobacterium-Mediated DNA Delivery[M]. Cereal Genomics:Humana Press,2014.
[6] Zhang W K,Wang Y J,Luo G Z,et al. QTL mapping of ten agronomic traitson the soybean(Glycine max L. Merr. )genetic map and their association with EST markers[J]. Theor Appl Genet,2004,108(6):1131-1139.
[7] Jiang Lili,Yu Xiaoming. Multigene engineering of starch biosynthesis in maize endosperm increases the total starch content and the proportion of amylose[J]. Transgenic Rsearch,2013,22(6):1133-1142.
[8] 毛元荣,汤 敏,路 群,等. 洋桔梗组织培养生根的初步研究[J]. 广西农业科学,2004,35(2):94-96. Mao Yuanrong,Tang Min,Lu Qun,et al. Preliminary study on tissue rooting Eustoma grandiflorum[J]. Guangxi Agricultural Sciences,2004,35(2):94-96(in Chinese).
[9] Aranovich D,Lewinsohn E,Zaccai M. Post-harvest enhancement of aroma in transgenic lisianthus (Eustoma Grandiflorum) using the Clarkia breweri benzyl clcohol acetyltransferase (BEAT) gene[J]. Postharvest Biology and Technology,2007,43:255-260.
[10] Wu Weidang,Ji Jing,Wang Gang,et al. Overexpression of AtchyB in Eustoma grandiflorum Shinn enhances its tolerance to high-light via zeaxanthin accumulation[J]. Plant Molecular Biology Reporter,2012,30(6):1433-1443.
[11] Ji Jing,Wang Gang,Wang Jiehua,et al. Functional analysis of multiple carotenogenic genes from Lycium barbarum and Gentiana lutea L for their effects on βcarotene production in transgenic tobacco[J]. Biotechnology Letters,2009,31(2):305-312.
[12] Li Faqiang,Vallabhaneni R,Wurtz E T,et al. PSY3,a new member of the phytoene synthase gene family conserved in the poaceae and regulator of abiotic stress induced root carotenogenesis[J]. Plant Physiology,2008,146(3):1333-1345.
[13] Han Heping,Li Yinxin,Zhou Shufeng. Overexpression of phytoene synthase gene from Salicorniaeuropaea alters response to reactive oxygen species under salt stress in transgenic Arabidopsis[J]. Biotechnol Lett,2008,30(8):1501-1507.
[14] Cidade L C,de Oliveira T M,Mendes A F S. Ectopic expression of a fruit phytoene synthase from citrus paradisi Macf. promotes abiotic stress tolerance in transgenic tobacco[J]. Mol Biol Rep,2012,39(12):10201-10209.
[15] Salvini M,Bernini A,Fambrini M,et al. cDNA cloning and expression of the phytoene synthase gene in sunflower[J]. Journal of Plant Physiology,2005,162:479-484.
[16] Li W F,Ji J,Wang G,et al. Oxidative stress resistance assay for screening yeast strains overproducing heterologous proteins[J]. Russian Journal of Genetics,2011,47(9):1039-1046.
[17] Wang Min,Wang Gang,Ji Jing,et al. The effect of PDS gene silencing on chloroplast pigment compostion,thylakoid membrane structure and photosynthesis efficiency in tobacco plants[J]. Plant Science,2009,177(3):222-226.
[18] 季 静,汪婷婷,王 罡,等. HAK基因对玉米的遗传转化及耐性研究[J]. 天津大学学报:自然科学与工程技术版,2013,46(7):659-665. Ji Jing,Wang Tingting,Wang Gang,et al. Genetic transformation of maize with HAK gene and its effect on salt tolerance[J]. Journal of Tianjin University:Science and Technology,2013,46(7):659-665(in Chinese).
[19] Giuliano G,Bartley G E,Scolnik P A. Regulation of carotenoid biosynthesis during tomato development[J]. Plant Cell,1993,5(4):379-387.
[20] Götz T,Windhövel U,Böger P,et al. Protection of photosynthesis against ultraviolet-B radiation by carotenoids in transformants of the cyanobacterium Synechococcus PCC7942[J]. Plant Physiol,1999,120(2):599-604.
[21] Götz T,Sandmann G,Römer S. Expression of a bacterial earotene hydroxylase gene(crtZ) enhances UV tolerance in tobascco[J]. Plant Physiol Biology,2002,50(1):127-140.
[22] Schafer L,Sandmann M,Woitsch S,et al. Coordinate up-regulation of carotenoid biosynthesis as a response to light stress in Synechococcus PCC7942[J]. Plant Cell and Environment,2006,29(7):1349-1356.
[23] Zhao Qing,Wang Gang,Ji Jing,et al. Over-expression of Arabidopsis thaliana β-carotene hydroxylase (chyB) gene enhances drought tolerance in transgenic tobacco[J]. Journal of Plant Biochemistry and Biotechnology,2014,23(2):190-198.
(责任编辑:田 军)
Overexpression of Lycium chinense Miller Phytoene Sythase (LmPSY)Gene to Enhance the Resistance of Eustoma grandiflorum
Ji Jing1,2,Cao Haiyan1,Wang Gang2,Liu Jie1,Li Zhaodi1,Wu Weidang2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. Research Institute of Genetic Engineering,Tianjin University,Tianjin 300072,China)
Carotenoids play an important role in plant tolerance to salt and high light,and phytoene synthase(PSY)is a key enzyme in carotenoids biosynthesis. Lycium chinense Miller phytoene sythase(LmPSY) gene was transferred to Eustoma grandiflorum to enhance the resistance of transgenic Eustoma grandiflorum. RT-qPCR results show that LmPSY expression had tissue specificity. High performance liquid chromatography results exhibit that the total carotenoid content of the transgenic plants was enhanced(1.3 fold) and zeaxanthin and lutein were produced in larger quantities (up to 1.1 fold). Under high light stress,fresh mass and dry mass of transgenic eustoma increased significantly compared with those of wide type(WT). Under 200 mmol/L NaCl stress, the amount of peoxidase(POD) and superoxide dismutase(SOD)in transgenic plants has increased significantly compared with those in WT. The photochemical efficiency(Fv/Fm)of transgenic plants increased by 8.0%—9.3%. These physiological and biochemical indices measured under light and salt stress conditions prove that overexpression of LmPSY gene could enhance the salt and high light tolerance of transgenic eustoma.
Eustoma grandiflorum;LmPSY;high light tolerance;salt tolerance
Q819
A
0493-2137(2015)03-0262-07
10.11784/tdxbz201312019
2013-12-06;
2014-01-20.
国家转基因生物新品种培育重大专项资助项目(2014ZX08003-002B);国家自然科学基金资助项目(31271793,31271419).
季 静(1965— ),女,博士,教授,jijingtjdx@163.com.
王 罡,wanggangtjdx@126.com.
时间:2014-03-20.
http://www.cnki.net/kcms/doi/10.11784/tdxbz201312019.html.
——辨别味之苦甜

