家蚕蛾吐出液溶茧酶的溶栓作用研究
王乃红宋丽新靳月琴李文利
(1山西省蚕业科学研究院,山西运城 044000;2大连理工大学生命与医药学院,辽宁盘锦 124211)
家蚕蛾吐出液溶茧酶的溶栓作用研究
王乃红1宋丽新2靳月琴1李文利2
(1山西省蚕业科学研究院,山西运城 044000;2大连理工大学生命与医药学院,辽宁盘锦 124211)
利用CM⁃Sepharose Fast Flow弱阳离子交换层析从家蚕蛾吐出液中收集得到溶茧酶。通过精氨酸酯酶活力测定其酶活力为11.92 U/mg,利用纤维蛋白原降解试验和纤维蛋白平板试验初步验证其具有溶栓作用。小鼠腹部皮肤皮内注射家蚕蛾吐出液溶茧酶试验发现,当每公斤体质量注射的酶剂量为0.25 μg/μL时,开始出现溶血;在小鼠体内溶栓试验中,每公斤小鼠体质量注射家蚕蛾吐出液溶茧酶的剂量分别为0(对照)、100、200、300、400 μg时,48 h后小鼠尾部血栓比例呈逐渐减小的趋势,去除率分别为(5.00±0.41)%、(16.67±0.21)%、(37.97± 0.74)%、(49.15±0.65)%、(74.67±0.62)%。
家蚕蛾;吐出液;溶茧酶;溶栓作用
血栓是导致世界各地心脑血管疾病患者发病率和死亡率较高的原因之一[1]。临床应用的药物可分为抗栓药物和溶栓药物两大类,其中抗血栓药物又可分为抗凝血药和抗血小板凝集药。目前,可以直接降解纤维蛋白的药物,如血纤维蛋白溶酶和蛇毒纤溶酶等越来越引起人们的关注,并试图通过研究增加其溶栓疗效和减少出血。Meiser等[2]从大椎蝽(Panstrongylus megistis)的下颚腺中分离得到一种具有纤溶活性的类胰蛋白酶[1],这表明一些昆虫的吐出液或许可以成为潜在的溶栓剂。
家蚕蛹羽化时蛾的吐出液能湿润茧层,溶解丝胶蛋白及部分丝素蛋白,使茧层松解,进而有助于蚕蛾拨开茧丝钻出蚕茧[3]。早在1966年,美国学者Fotis等[4]研究发现某些营封闭茧的昆虫,在成虫阶段分泌的吐出液中含有一种酶,这种酶的水解底物不只局限于丝胶,它是一种更具广泛性的蛋白水解酶,因此将其命名为溶茧酶(Cocoonase)。目前,溶茧酶的应用前景主要在缫丝工业中酶法脱胶、化妆品工业中酶法水解丝以及血栓治疗药物的开发[5]。虽然研究人员对多种溶茧酶进行了酶学性质的研究[4,6],但是对家蚕溶茧酶的溶血栓作用尚未见报道。
本研究从家蚕蛾吐出液中分离得到了家蚕溶茧酶,并测定了其精氨酸酯酶活性;通过纤维蛋白降解、小鼠体内溶栓等一系列试验证实,家蚕蛾吐出液中的溶茧酶具有溶栓功能,为新型溶栓药物的研究奠定了基础。
1 材料与方法
1.1 试验材料
家蚕蛹,蚕品种为871×872,由山西省蚕业科学研究院提供;SPF级健康雄性昆明种小鼠,由大连医科大学提供;CM-Sepharose Fast Flow(SPFF),购自GE公司;蛋白质分子量(低)标准、N-苯酰基-L-精氨酸乙酯(BAEE)、人纤维蛋白原、纤维蛋白、角叉菜胶、凝血酶,购自Sigma公司;AKTA explorer,购自美国Phamacia biotech公司;酶标仪(英国),购自Thermo scientific公司;紫外分光光度计(V-560),购自日本JASCO公司;ECP3000蛋白电泳仪、电泳槽,购自北京六一设备厂。
1.2 家蚕蛾吐出液溶茧酶的分离纯化
参照参考文献[7]的方法收集家蚕蛾吐出液,即将发育到后期的蚕蛹头朝下置于用塑料膜卷成的三角锥内,将三角锥倒立,插入1.5 mL离心管中,继续在室温培养;在蚕蛹羽化过程中收集家蚕蛾吐出液,置于-80℃贮存备用。CM⁃Sepharose Fast Flow弱阳离子交换层析:将收集的家蚕蛾吐出液12 000 r/min离心,15 min后收集上清液,用50 mM NaAC⁃HAC(醋酸—醋酸钠缓冲液)pH 5.8上样缓冲液稀释。先用双蒸水清洗离子交换柱,流速为1.0 mL/min,然后用A溶液(NaAc 1.361 g,加入400 mL双蒸水,用HAc调pH值至6.0,定容至500 mL;以下相同)平衡离子交换柱,待电导率持平时,将待纯化样品注入5.0 mL上样环,开始进样,流速为0.5 mL/min。上样完毕后,用A溶液再平衡离子交换柱,此过程中收集穿透峰流出液,待穿透峰和电导率再次持平后,用B溶液(NaAc 1.361 g、NaCl 29.250 g,加入400 mL双蒸水,用HAc调节pH值至6.0,定容至500 mL;以下相同)进行线性洗脱,浓度由0逐渐增大至50%,收集洗脱峰流出液,分别将穿透峰和洗脱峰进行SDS⁃PAGE电泳,并测定其酰胺酶活性。
1.3 Lowry法蛋白定量
试验采用Lowry法[8]对蛋白进行定量。
1.3.1 制作标准曲线 (1)用蒸馏水将标准血清蛋白配制成100 μg/mL的蛋白标准溶液,在96孔板上取11孔,按照表1平衡操作。(2)取24 μL A溶液和1.2 mL B溶液,混匀。各孔加入100 μL混合液,混匀,室温静置10 min。(3)各孔加入10 μL Folin-酚试剂,迅速混匀,室温静置30 min。(4)在酶标仪上测各孔吸光值(A750nm)。以各孔A750nm值为纵坐标,对应的蛋白浓度为横坐标,作图。

表1 标准血清蛋白配制表
1.3.2 家蚕蛾吐出液溶茧酶蛋白质浓度测定 根据1.3.1的方法,将家蚕蛾吐出液溶茧酶溶液用双蒸水溶解稀释10倍,测定纯化后的家蚕蛾吐出液溶茧酶浓度,根据下式计算样品的蛋白质浓度。
样品蛋白质浓度(μg/mL)=样品孔A750nm值的平均值对应的蛋白质浓度×样品稀释倍数
1.4 家蚕蛾吐出液溶茧酶中酰胺酶活力的测定
家蚕蛾吐出液溶茧酶中的酰胺酶活力的测定,采用合成底物苯甲酰-L-精氨酸乙酯盐酸盐(BAEE)法[9]。按1∶1比例加入BAEE底物溶液和50 mM Tris-HCl pH 8.0缓冲液,混匀后用作空白对照。取稀释10倍的酶液200 μL,加入到2.8 mL 0.5 mM BAEE底物溶液中,混匀后在253 nm处测其吸光值。酶活力单位计算如下:以时间(t)为横坐标,253 nm下的吸光值(A253nm)为纵坐标作图,在直线上任意2个时间点与相应的光吸收值做差(△A253nm)。BAEE酶的活力定义为在25℃下,每分钟内酶作用于底物所产生的吸光度增加0.001为1个活力单位(U)。酶活力单位计算公式如下。

1.5 家蚕蛾吐出液溶茧酶对纤维蛋白原和纤维蛋白的降解
1.5.1对纤维蛋白原的降解 取500 μL 0.2%纤维蛋白原溶液于1.5 mL离心管,加入50 μL纯化后的酶液,37℃温育。分别在2、4、6、8、10、12、24 h从反应体系中取出40 μL反应液,加入10 μL 5×loading buffer(3.1 mL 1M Tris-HCl(pH6.8)+65 mL 50%甘油+0.5 mL 1%溴酚兰+1.4 mL水),煮沸8 min终止反应。取未进行反应的纤维蛋白原溶液做对照与上述处理过的样品分别进行SDS⁃PAGE电泳,观察反应情况。
1.5.2 对纤维蛋白的降解 取5 mL 1%琼脂糖凝胶煮化后冷却,加入5 mL 0.4%人纤维蛋白原溶液混匀,再加入0.2 mL人凝血酶(100 U/mL)(0.1 mol/L HAC/NaAC,pH8.0)混匀,倒入一个10 cm Petri平皿中,室温静置1 h,打孔。加15 μL纯化后的酶溶液于平板上,37℃孵育24 h,并观察水解圈的大小。依据此法,观测到的清晰透明区域,即为纤维蛋白被水解的区域[10]。根据溶解面积的大小来确定家蚕蛾吐出液溶茧酶的纤溶活性强弱。
1.6 金属离子对纤维蛋白原降解的影响
取0.2%纤维蛋白原200 μL加入到7个1.5 mL的离心管中,分别加入纯化后的酶液20 μL及各种终浓度为10 mM的金属离子Cu2+、Mg2+、Ca2+、K+、Mn2+、Zn2+、Fe2+,对照组中分别加入0.2%纤维蛋白原200 μL和纯化后的酶液20 μL,37℃温育。分别在4 h和24 h从反应体系中取出50 μL反应液,加入10 μL 5×loading buffer,煮沸8 min终止反应。取上述处理过的样品进行SDS⁃PAGE电泳,与未进行反应的纤维蛋白原溶液对比,观察反应情况。
1.7 蛋白酶抑制剂对纤维蛋白原降解的影响
取0.2%纤维蛋白原200 μL和纯化后的酶液20 μL,分别加入到7个1.5 mL的离心管中,依次加入终浓度为10 mM的DTT、EDTA、β-巯基乙醇、咪唑和1 mM、0.1 mM的苯甲基磺酰氟(PMSF),对照组中分别加入0.2%纤维蛋白原200 μL和纯化后的酶液20 μL,37℃温育。分别在4 h和24 h从反应体系中取出50 μL反应液,加入10 μL 5×loading buffer,煮沸8 min终止反应。取上述处理过的样品进行SDS-PAGE电泳,与未进行反应的纤维蛋白原溶液对比,观察反应情况。
1.8 出血活性试验
根据Kondo等[11]的方法,分别将不同剂量的家蚕蛾吐出液溶茧酶(0.05、0.10、0.15、0.20、0.25、0.50 μg/μL)通过皮内注射的方法分别注入到小鼠(每公斤体质量注射18~22 g)的腹部皮肤中,对照组则注射100 μL生理盐水,2 h后,剥离小鼠背部皮肤,观察是否存在出血点及出血点直径的大小。
1.9 体内溶栓试验
1.9.1 小鼠尾静脉血栓模型的建立 在小鼠腰背部皮下注射0.2%角叉菜胶溶液100 μL/只,小鼠尾尖4~24 h期间出现暗红色血栓形成区,逐渐向尾根部扩大到一定范围,48~72 h后,经紫色变黑色,与正常尾部分界明显。
1.9.2 给药方法 将50只小鼠按体质量随机分为5组(n=10)。给对照组注射生理盐水100 μL,其余4组小鼠按每公斤体质量分别注射400、300、200、100 μg家蚕蛾吐出液溶茧酶,72 h后测量血栓形成的长度[12]。
2 结果与分析
2.1 家蚕蛾吐出液溶茧酶的分离纯化
通过AKTA纯化系统,利用CM-Sepharose Fast Flow弱阳离子交换层析分离纯化家蚕蛾吐出液,NaCl浓度为0.3 M洗脱后发现单一洗脱峰,分别对洗脱峰和穿透峰进行酶活性测定发现,该洗脱峰的蛋白具有精氨酸酯酶活性,SDS-PAGE电泳检测(图1)分析,蛋白条带为2条,经分析家蚕蛾吐出液溶茧酶信号肽的分子量为3.6 kD,此峰中的2种蛋白可视为同种蛋白质,冷冻干燥保存。

图1 家蚕溶茧酶分离纯化SDS-PAGE电泳结果
2.2 Lowry法蛋白定量
试验采用Lowry法对蛋白进行定量,以牛血清白蛋白为标准,在750 nm波长下测定蛋白的吸光值,以A750nm值为纵坐标,标准蛋白质含量为横坐标,绘制出标准曲线(图2)。同时将待测样品稀释至一定倍数,使其吸光值落在标准曲线范围内,通过标准曲线计算出样品蛋白浓度为745 μg/mL。
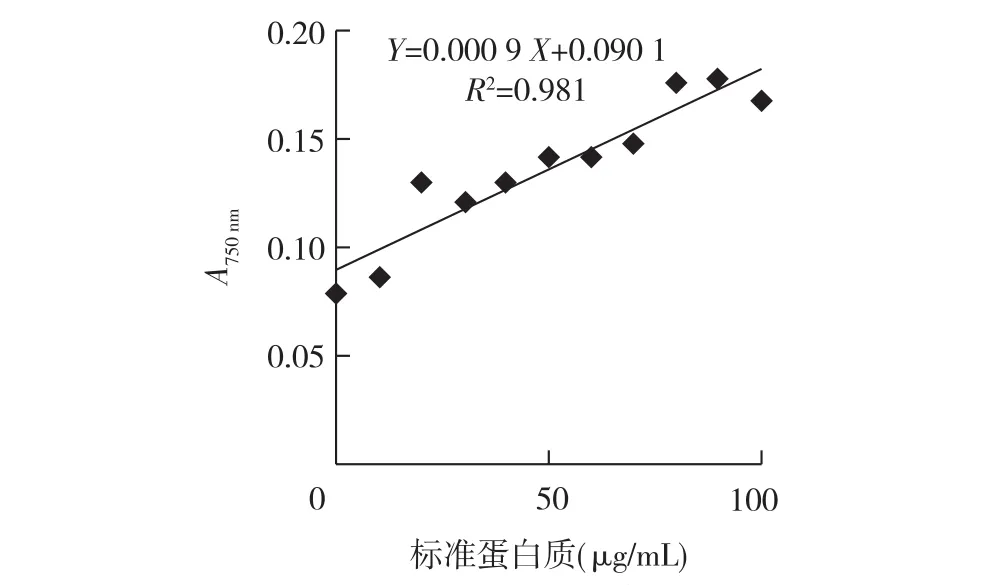
图2 Lowry法蛋白定量标准曲线
2.3 酰胺酶活力测定


图3 BAEE酶活力测定曲线
2.4 家蚕蛾吐出液溶茧酶对纤维蛋白原及纤维蛋白的降解

图4 家蚕蛾吐出液溶茧酶对纤维蛋白原(A)及纤维蛋白(B)的降解
将家蚕蛾吐出液溶茧酶与人纤维蛋白原混匀,37℃反应条件下,分别在2、4、6、8、10、12、24 h从反应体系中取出40 μL反应液,加入10 μL 5×loading buffer煮沸后SDS-PAGE电泳分析(图4)。纤维蛋白原的3条链,Aα⁃链的分子量为63.5 kD,Bβ⁃链的分子量为56.0 kD,γ⁃链的分子量为47.0 kD。随着反应时间的增加,纤维蛋白原的3条链逐渐被降解,其中优先降解Aα⁃链和Bβ⁃链,而对γ⁃链的降解则较缓慢(图4-A)。利用凝血酶的作用纤维蛋白原被降解成纤维蛋白,在平板内形成网状结构,家蚕溶茧酶平板明显出现透明圈(图4-B),说明家蚕蛾吐出液溶茧酶可以较好地降解纤维蛋白。
2.5 金属离子对纤维蛋白原降解的影响
将各金属离子(Cu2+、Mg2+、Ca2+、K+、Mn2+、Zn2+、Fe2+)按照终浓度10 mM加入到家蚕蛾吐出液溶茧酶与纤维蛋白原混合液中,37℃水浴,分别在4 h和24 h取样,SDS-PAGE电泳检测此降解作用的影响实验(图5-A、B)表明,Mg2+、Ca2+、K+几乎对酶的活性没有影响,而这3种离子正是金属蛋白酶活性所必需的;因此,可以证明家蚕蛾吐出液溶茧酶是非金属蛋白酶。

图5 金属离子对家蚕蛾吐出液溶茧酶降解纤维蛋白原的影响
2.6 蛋白酶抑制剂对纤维蛋白原降解的影响
将PMSF、咪唑、EDTA、β-巯基乙醇、DTT等酶抑制剂分别与酶液混合,使抑制剂终浓度为10 mM,37℃水浴4 h后SDS-PAGE电泳检测,结果如图6所示。从图6可知PMSF在2个剂量下均对酶活性产生较大的影响,而PMSF是典型的丝氨酸蛋白酶抑制剂;因此,家蚕蛾吐出液溶茧酶属于丝氨酸蛋白酶家族;另外,金属螯合剂EDTA对酶的活性也无太大的影响,更加说明溶茧酶不属于金属蛋白酶的范畴。2.7 小鼠腹部皮肤出血活性试验

图6 抑制剂对家蚕溶茧酶降解纤维蛋白原的影响(4 h)
利用小鼠腹部皮肤皮内注射的方法,每公斤体质量注入0.05、0.10、0.15、0.20、0.25、0.50 μg/μL不同剂量的家蚕蛾吐出液溶茧酶18~22 g,2 h后在注射点剥离周围的皮肤观察发现,当小鼠每公斤体质量注射的酶剂量为0.25 μg/μL时,开始出现溶血,直径约为5 mm,当剂量升高至0.50 μg/μL时,溶血直径达9 mm左右(图7)。
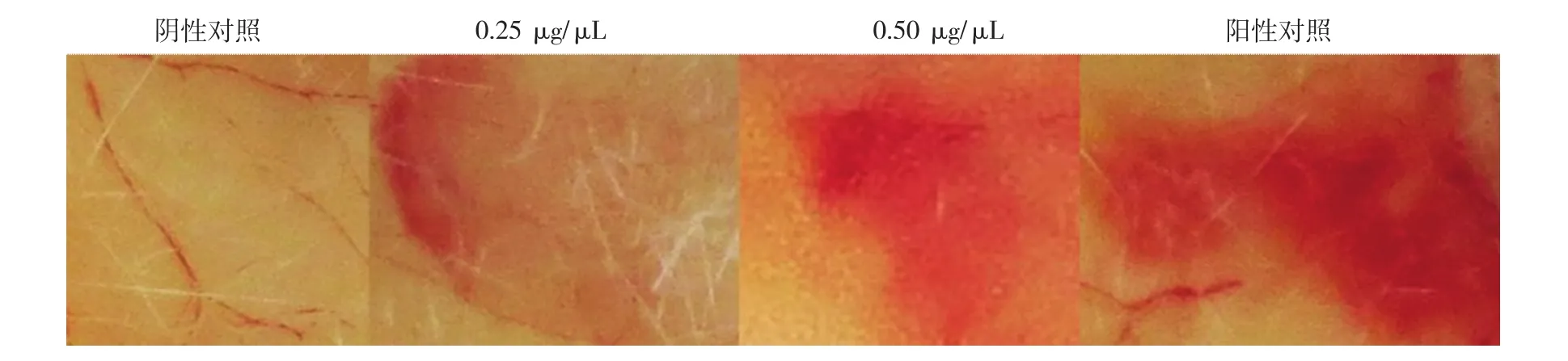
图7 小鼠腹部皮肤出血活性试验结果
2.8 小鼠体内溶栓试验
家蚕蛾吐出液溶茧酶在体内的溶栓效果通过角叉菜胶诱导的小鼠尾部血栓模型来表征,给药24 h和48 h后,不同剂量下小鼠尾部血栓长度,占小鼠尾巴出现血栓长度的比例均有明显的降低,且随着剂量的增大,溶栓率明显增高;当给小鼠每公斤体质量注射家蚕蛾吐出液溶茧酶分别为400、300、200、100、0(对照)μg,给药48 h后的结果显示(图8),给小鼠每公斤体质量注射400 μg家蚕蛾吐出液溶茧酶时的溶栓效率最大,去除率为(74.67±0.62)%;当给小鼠每公斤体质量注射剂量为300、200、100 μg时,去除率分别为(49.15±0.65)%、(37.97±0.74)%和(16.67± 0.21)%,而对照组的去除率仅为(5.00±0.41)%。

图8 角叉菜胶诱导的小鼠血栓模型体内溶栓结果(x±s)
3 讨论
对溶茧酶的研究多集中于20世纪60、70年代,包括对家蚕、印度柞蚕和多音天蚕等鳞翅目昆虫溶茧酶的研究[13]。然而对这几种昆虫的溶茧酶作用的研究也多集中于酶学性质的研究,如吐出器官的研究、精氨酸酯酶活力、丝氨酸或胰蛋白酶抑制剂对溶茧酶及其前体免疫沉淀反应的影响等等,但对溶茧酶溶栓效果的研究较少。
本试验利用CM-Sepharose Fast Flow弱阳离子交换层析分离纯化出家蚕蛾吐出液溶茧酶。这种酶具有精氨酸酯酶活力,属于丝氨酸蛋白酶家族、且为非金属酶;但Cu2+、Fe2+和Zn2+对酶活性均有不同程度的抑制作用,其作用机理尚待进一步研究。该蛋白酶活性还可被半胱氨酸还原性变性剂DTT显著抑制,推测可能是由于酶的二硫键遭到破坏,导致酶的空间结构发生改变,影响其活性位点与底物的结合,最终使酶活力下降。家蚕蛾吐出液溶茧酶首先降解纤维蛋白原的Aα-链和纤维蛋白原的Bβ-链,然后才降解纤维蛋白原的γ-链,初步证明了家蚕蛾吐出液溶茧酶具有溶栓作用。通过在小鼠体内的溶栓实验,进一步证明了这种溶栓作用。在出血活性安全的范围内,通过角叉菜胶诱导的小鼠尾部血栓模型溶栓发现,当注射剂量逐渐增大时,小鼠尾部血栓长度占整个尾巴长度的比例也逐渐降低,当小鼠每公斤体质量注射400 μg时,去除率为(74.67±0.62)%,说明家蚕蛾吐出液溶茧酶具有良好的溶栓效果。但是,其具体的作用机制尚不清楚,仍需要进一步的研究。
全球每年因脑血栓、脑梗塞、心肌梗塞、冠心病、动脉硬化等心脑血管疾病夺走1 200万人的生命,接近世界总死亡人数的1/4,成为人类健康的头号大敌[14]。目前治疗血栓的方法主要有外科手术法和药物治疗等,其中外科手术虽然可较快去除血栓,但危险性较大,适用于一些危机或突发状况;药物治疗则相对比较容易被人们所接受。目前治疗血栓的药物一般具有抗原性且半衰期短,使其应用给人们带来较大的风险。另外,蛋白质的水解产物所产生的活性物质,对人体的健康具有很大的作用,它具有促进矿物质吸收、促进淋巴细胞的增殖、免疫调节、抗菌、降血压和降血脂等生理功能[6]。因此,家蚕蛾吐出液溶茧酶的水解产物所产生的活性物质及其强烈的纤溶酶活力,在降血糖、降胆固醇及治疗血栓等方面将会发挥很大作用。
[1]李圆.柞蚕溶茧酶的分离纯化、酶学性质表征及其基因克隆与表达[D].大连:大连理工大学,2013.
[2]Meiser C K,Piechura H,Meyer H E,etal.A salivary serine protease of the haematophagous reduviid Panstrongylus megistus:Sequence characterization,expression pattern and characterization of proteo⁃lytic activity[J].nsect Molecular Biology,2010,19(3):409-421.
[3]祝元锋,王赵群,何宁佳,等.家蚕蛾吐出液的酶活性及蛋白质种类鉴定[J].蚕业科学,2014,40(3):452-457.
[4]Fotis C K,Alan M,Tartakoff,etal.Cocoonase iv.Preliminary char⁃acterization of a proteolytic enzyme from silkmoths[J].Journal of Biological Chemistry,1967,242(7):1 477-1 487.
[5]祝元锋,冯丽春,李傲祥.蚕蛾溶茧酶的研究进展[J].蚕学通讯,2009,29(1):27-32.
[6]范雨锁,张永根.活性肽的生物学作用研究概况[J].饲料博览,2007,3(7):25-28.
[7]王乃红,宋丽新,靳月琴,等.家蚕溶茧酶收集方法的建立及活性测定[J].北方蚕业,2013,34(3):9-12.
[8]李红兵,李宗让,王志玲,等.微量Lorry法测定蛋白质含量[J].生物化学与生物物理进展,1993,20(5):402-403.
[9]Blanco R M,Guisán G M.Protecting effect of competitive inhibitors during very intense insolubilized enzyme⁃activated support multipoint attachments:Trypsin(amine)⁃agarose(aldehyde)system[J].Enzyme and Microbial Technology,1988,10(4):227-232.
[10]Astrup T,Mullertz S.The fibrin plate method for estimating fibrinolytic activity[J].Arch Biochem Biophys,1952,40(2):346-351.
[11]Kondo H,Kondo S,Ikesawa I,etal.Studies on the quantitative method for determination of hemorrhagic activity of habusnake ven⁃om[J].Jpn J Med Sci Biol,1960,4(13):43-51.
[12]Bekemeier H,Hirschelmann R,Giessler A J.Carrageenin-induced thrombosis in rats and mice:a model for testing antithrombotic substances[J].Agents Actions,1985,16(5):446-451.
[13]王厚伟,张翠红,崔为正,等.家蚕蛾溶茧酶分泌器官及蛾吐出液的研究[J].蚕业科学,2005,31(2):136-140.
[14]徐依成,徐雪东,胡文立.溶血栓药物在急性脑梗死中的应用进展[J].中国新药与临床杂志,2008,27(5):365-368.
S881.2
A
1007-0982(2015)04-0048-06
2015-02-04;接受日期:2015-05-20
现代农业产业技术体系建设专项(编号CARS-22);山西省科技攻关计划项目(编号20120311025-3)。
王乃红(1964—),男,山西芮城,本科,高级农艺师。
Tel:13466945998,E⁃mail:wnh_1964@163.com
李文利,男,副教授。
Tel:13342277088,E⁃mail:biolwl@dlut.edu.cn
——大蚕蛾

