Cu-RE-Al2O3催化剂上CO2加氢制甲醇
赵锦波,于 杨
(1. 中国石油化工股份有限公司 科技部,北京 100728;2. 中国石化 南化集团研究院,江苏 南京 210048)
CO2加氢制甲醇被认为是“碳中立循环”的关键步骤[1],有利于推动能源紧张和环境破坏问题的解决。CO2分子呈化学惰性,因此CO2加氢制甲醇需要在催化剂存在下才能顺利进行[2]。其中,Cu基催化剂上CO2加氢制甲醇是目前研究的重点。
用于CO2加氢制甲醇的Cu基催化剂大体可分为两类:一类是含ZnO的Cu基催化剂,是目前研究较多的体系,如Cu-Zn-SiO2[3-4],Cu-ZnO-Al2O3[5-8],Cu-ZnO-ZrO2(CZA)[9-11],Cu-ZnO-TiO2[12],Cu-ZnO-CeO2[13]等;另一类是无ZnO的Cu基催化剂,如Cu-V2O5/γ-Al2O3[14-15],Cu-ZrO2/γ-Al2O3[16],Cu-La2O3-ZrO2[17]等。第一类催化剂可归属为对传统工业甲醇合成CZA催化剂的改进。第二类催化剂是对传统CZA催化 剂的突破,对无ZnO的Cu基催化剂在CO2加氢制甲醇反应中催化性能的尝试。如Guo等[17]采用尿素-硝酸盐燃烧法制备了Cu-La2O3-ZrO2催化剂,并考察了La含量对催化剂在CO2加氢制甲醇反应中性能的影响。他们提出了CO2加氢制甲醇在Cu基催化剂上遵循双功能活性中心的机理,即CO2转化率与催化剂上Cu的比表面积呈线性关系;甲醇的选择性与催化剂上适宜碱性位占总碱性位的比例呈线性关系。
稀土元素(RE)在地壳中的分布十分丰富[18],作为催化剂的载体或助催化剂在选择性加氢反应中也被广泛地研究[19-21]。如Yu等[22]研究发现,在Cu-CeO2-Al2O3催化剂上,顺酐常压气相加氢制γ-丁内酯的转化率和选择性均为100%;并通过控制催化剂中杂质Na的含量,可显著地提高催化剂的稳定性[23]。最近,Graciani等[24]通过实验和理论计算研究了Cu-CeOx-TiO2催化剂上CO2加氢制甲醇反应的情况。实验结果表明,Cu-CeOx-TiO2催化剂在CO2加氢制甲醇反应中具有非常高的活性,这种高活性来自于金属Cu和氧化物(主要是CeOx)之间的相互作用。
本工作采用共沉淀方法制备了RE(RE=Y,La,Ce,Dy或Ho)掺杂的Cu基催化剂,即Cu-REAl2O3催化剂(简称CREA催化剂),考察了这些催化剂在CO2加氢制甲醇反应中的催化性能和水热稳定性,以及温度和原料空速对反应的影响,并通过XRD、N2O分解、H2-TPR、CO2-TPD、Raman光谱等方法分析了催化剂的“构效关系”。
1 实验部分
1.1 催化剂的制备
CREA催化剂采用共沉淀法制备。常温下,根据催化剂中n(Cu)∶n(RE)∶n(Al)=2∶3∶5称取Cu、Al和相应的RE硝酸盐,溶于一定量去离子水中,并搅拌均匀,在剧烈搅拌下,用1 mol/L的Na2CO3溶液作为沉淀剂滴入上述混合硝酸盐溶液中至pH为8~9,搅拌老化30 min后过滤,用去离子水彻底离心洗涤滤饼,再用无水乙醇洗涤滤饼2次后抽滤,将滤饼置于120 ℃的烘箱中干燥过夜,最后将催化剂置于马弗炉中于400 ℃下焙烧2 h,得到CREA催化剂。将CREA催化剂压片、破碎至450~900 nm,备用。根据其中所含的稀土元素Y,La,Ce,Dy,Ho,催化剂分别命名为CYA,CLA,CCA,CDA,CHA。
1.2 催化剂的性能评价
CO2加氢反应在流动相固定床反应器内进行。催化剂用量2 mL,置于床层恒温段,催化剂两端填充450~900 nm高温处理过的石英砂。首先,催化剂在5%H2-95%N2(φ,下同)的混合气体中常压下升温还原,终温350 ℃;然后降温至240℃,并将还原气切换成空速为3 600 h-1的原料气(VH2∶VCO2∶VN2=69∶23∶8),且升压至5 MPa进行反应。反应稳定2 h后,放掉尾气出口处收集罐中被冷凝的液体产物,开始计时,每2 h取一次样并进行产物分析,共分析3次,取平均值作为催化剂的初活性。
用催化剂耐水热冲击实验来考察催化剂的水热稳定性。具体步骤:测定完催化剂的初活性后,降系统压力至常压,将原料气切换为纯N2,N2通过鼓泡40 ℃水后进入固定床反应器,并将温度升至350 ℃,维持上述条件10 h,然后在常压下用5%H2-95%N2的混合气体处理1 h后,恢复到反应压力5 MPa和反应温度240 ℃,并切换回原料气,采用测试催化剂初活性的方法测试催化剂经水热冲击后的活性。
反应尾气经冷凝后进行在线色谱分析(Agilent公司7890A型气相色谱仪,HP-AL/S色谱柱,FID和TCD检测),2 h内的液体产物采用离线色谱分析(Agilent公司7890A型气相色谱仪,HP-1NNOYX色谱柱,FID检测)。
以N2为内标,尾气中气体i(i为CO或CH4)的相对校正因子fi=φiAN2/φN2Ai,则有φi/φN2=ci/cN2=fiAi/AN2,则CO2转化率(X)和气体i的选择性(Si)分别见式(1)和式(2)。

式中,φi为气体i的体积分数;ci为气体i的浓度,mol/L;Ai为气体i的色谱峰面积;下角标中的f和t分别表示原料和尾气。
液体产物的分析结果表明,甲醇在有机物中的含量大于99.8%(w),因此其他液体有机产物可忽略不计,根据碳平衡,则甲醇选择性(SCH3OH)见式(3)。
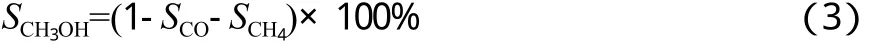
式中,SCO和SCH4分别为CO和CH4的选择性,%。
1.3 催化剂的表征
采用Bruker公司AXS D8 Focus型粉末X射线衍射仪对试样进行XRD表征,Cu Kα(λ=0.154 06 nm)射线,管电压40 kV,管电流40 mA。试样的平均晶粒尺寸利用Scherrer公式进行计算。
采用N2O吸附分解法测定Cu的比表面积,取200 mg催化剂,测定前催化剂先在5%H2-95%N2混合气中于350 ℃下还原,然后在N2中吹扫1 h后,降温至60 ℃,进行测定。该反应符合n(Cu)∶n(N2O)= 2的计量比,且Cu原子表面紧密排列密度为1.46×1019个/m2[25]。
H2-TPR表征在天津鹏翔科技有限公司的PX200型催化剂表征系统上进行。50 mg试样先用N2在350 ℃下吹扫1 h除去表面物理吸附的杂质气体,然后降至室温后,将N2切换为40 mL/min的5%H2-95%N2混合气体吹扫,平衡后以10 ℃/min的速率升至600 ℃,同时使用TCD记录H2消耗。
CO2-TPD分析在自行搭建的脱附装置上进行,采用Pfeiffer公司Vacuum Quadstar型质谱仪检测脱附气体信号。称取约100 mg试样,首先在5%H2-95%N2混合气体中程序升温还原,终温为350 ℃,然后切换为高纯H2吹扫1 h,降温至30 ℃,再将气体切换为CO2,吸附30 min后,在100 ℃下用N2吹扫至基线走平,之后以10 ℃/min的速率升至400 ℃。
试样的Raman光谱分析在Renishaw公司的inVia Reflex型显微Raman光谱仪(配有电荷耦合检测器)上进行。使用高功率半导体激光器,激光波长785 nm。测试均在室温、无水环境下进行。在显微镜下对试样取点分析,光斑约1 nm,入射光功率约3 mW。取样时间根据Raman散射强度而定,精确度约2 cm-1。
2 结果与讨论
2.1 催化性能
2.1.1 RE种类的影响
CREA催化剂在CO2加氢制甲醇反应中的催化性能见表1。由表1可见,CREA催化剂上CO2加氢制甲醇反应除得到甲醇外,还有CO和少量CH4生成。掺杂不同的RE,对Cu基催化剂上CO2转化率、甲醇选择性以及副产物CO和CH4的选择性的影响很大。不同催化剂上CO2转化率由高到低的顺序为:CLA>CCA>CYA>CHA>CDA;甲醇选择性由高到低的顺序为:CLA>CHA>CDA>CCA>CYA;甲醇收率由高到低的顺序为:CLA>CCA>CHA>CYA>CDA。在CLA催化剂上,CO2转化率、甲醇选择性和甲醇收率分别达到21.1%,68.2%,14.4%。

表1 CREA催化剂在CO2加氢制甲醇反应中的催化性能Table 1 Catalytic performances of Cu-Re-Al2O3(CREA)catalysts in the hydrogenation of CO2 to methanol
CO2加氢制甲醇反应体系涉及的反应主要有[26]:

上面两个热化学反应方程式表明,CO2加氢制甲醇反应产物中存在较多的水。此外,由于金属Cu的Hutting温度和Tamman温度较低[27],Cu基催化剂对“热”较敏感。据此,考察了CREA催化剂的耐水热冲击性能,实验结果见表2。

表2 CREA催化剂在CO2加氢制甲醇反应中的水热稳定性Table 2 Hydrothermal stability of the CREA catalysts in the hydrogenation of CO2 to methanol
由表2可见,经水热冲击后,各催化剂上甲醇收率明显下降,但甲醇收率高低的顺序未改变,表明催化剂间的相对催化性能的大小关系未变化。但经水热冲击后,每种催化剂上甲醇收率降低的程度不同,表明催化剂的水热稳定性是不同的。CREA催化剂的水热稳定性由高到低的顺序为:CLA>CHA>CDA>CYA>CCA。
2.1.2 反应温度的影响
CO2加氢反应中,甲醇合成反应为放热反应,逆水汽变换反应为吸热反应。此外,温度对反应速率和催化剂最佳工作状态也有直接影响。因此,以CLA催化剂为例,考察了反应温度对CO2加氢制甲醇反应的影响,实验结果见图1。由图1可见,随反应温度的升高,CO2转化率逐渐提高,这主要是因反应速率加快所致;甲醇选择性逐渐降低,这是由于随反应温度的升高,反应产物选择性受动力学影响逐渐减小,主要由热力学支配,而甲醇合成反应为放热反应,温度升高对该反应不利;甲醇收率则呈现先增大后降低的趋势,这是反应同时受动力学和热力学影响的结果[2]。当反应温度为240 ℃时,CLA催化剂上甲醇收率达到最大。
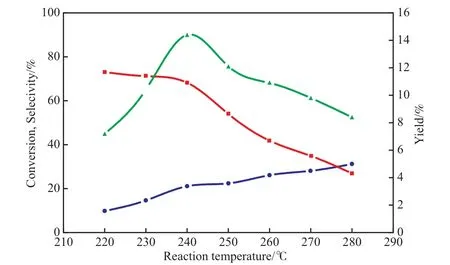
图1 CLA催化剂上反应温度对CO2加氢制甲醇催化性能的影响Fig.1 Effects of reaction temperature on the performances of the CLA catalyst in the hydrogenation of CO2 to methanol.
2.1.3 原料空速的影响
CLA催化剂上,原料空速对CO2加氢制甲醇反应的影响见图2。由图2可见,随原料空速的增大,CO2转化率逐渐降低,主要是由于反应物与催化剂的接触时间缩短所致[2];甲醇选择性也逐渐降低,表明甲醇选择性不仅受热力学影响,还受动力学影响,反应物与催化剂的接触时间缩短不利于甲醇的合成。上述结果导致甲醇收率也随原料空速的增大而逐渐降低。

图2 CLA催化剂上原料空速对CO2加氢制甲醇催化性能的影响Fig.2 Effects of GHSV of feed gas on the performances of the CLA catalyst in the hydrogenation of CO2 to methanol.
2.2 催化剂“构效关系”分析
2.2.1 XRD和N2O分解表征结果
焙烧后CREA催化剂的XRD谱图见图3。由图3可见,所有CREA催化剂的XRD谱图中均出现了CuO(PDF# 65-2309)的两个特征衍射峰,位于2θ=35.7°和38.9°处,分别对应着CuO的(111)和(111)两个晶面。所有焙烧后的CREA催化剂的XRD谱图中都有相应稀土氧化物的特征衍射峰。在CLA催化剂的XRD谱图上,除出现La2O3(PDF#02-0688)的特征衍射峰外,还出现了La2O2CO3(PDF# 48-1113)和CuLa2O4(PDF# 38-0709)两种化合物的特征衍射峰。La碳酸盐的存在表明La对CO2具有较强的结合能力。而Cu-La尖晶石物质的形成,表明La能与CuO产生强相互作用。在所有焙烧过的CREA催化剂的XRD谱图中均没有出现Al2O3的相关特征衍射峰,表明Al2O3以无定形状态存在[22]。

图3 焙烧后CREA催化剂的XRD谱图Fig.3 XRD patterns of the calcined CREA catalysts.
还原后CREA催化剂的XRD谱图见4。比较图3和图4可见,经5%H2-95%N2混合气体还原后,在所有CREA催化剂的XRD谱图上,CuO的特征衍射峰均消失,出现了金属Cu(PDF# 65-9026)的特征衍射峰,主要位于2θ=43.4°,50.6°,74.2°处,分别对应着Cu的(111),(200),(220)晶面,表明几种CREA催化剂中CuO被还原为Cu。还原后各CREA催化剂的XRD谱图中相应稀土氧化物的特征衍射峰没有变化。由图4还可见,在还原后CLA催化剂的XRD谱图中,CuLa2O4部分衍射峰消失,而La2O2CO3的特征衍射峰几乎未改变。以上分析结果表明,在还原条件下,部分CuLa2O4中的Cu2+被还原为Cu0。结合催化剂的水热稳定性可推断,这种活性Cu0由于受到临近La的稳定作用,从而使得CLA催化剂具有较好的水热稳定性。此外,还原后CREA催化剂中的Al2O3仍以无定形状态存在。

图4 还原后CREA催化剂的XRD谱图Fig.4 XRD patterns of the reduced CREA catalysts.
还原后CREA催化剂的部分物化性质见表3。

表3 还原后CREA催化剂的部分物化参数Table 3 Some physicochemical parameters of the reduced CREA catalysts
由表3可见,不同RE掺杂的Cu基催化剂,经还原后,催化剂体相金属Cu的晶粒尺寸略有不同,而催化剂上的Cu比表面积相差较大,Cu比表面积从大到小的顺序为:CCA>CLA>CYA>CHA>CDA。结合图1中催化剂的性能评价结果可看出,较大的Cu比表面积对提高CO2转化率有利,这与Martin等[28]的研究结论一致。但CLA和CCA两种催化剂的相对活性和Cu比表面积之间的关系却是一个例外,这表明影响CREA催化剂在CO2加氢制甲醇反应中催化性能的主要因素不只是催化剂上的Cu比表面积。
2.2.2 H2-TPR表征结果
焙烧后CREA催化剂的H2-TPR曲线见图5。由图5可见,焙烧后CLA催化剂的还原峰呈现明显的双峰特征,参考XRD表征结果可推断,低温主还原峰归属于CuO中Cu2+的还原,而高温肩峰归属于CuLa2O4中Cu2+的还原。其他焙烧后CREA催化剂的还原峰主要呈现单峰特征,其中,CDA和CHA两种催化剂的还原峰明显向高温方向偏移。

图5 焙烧后CREA催化剂的H2-TPR曲线Fig.5 H2-TPR curves of the calcined CREA catalysts.
2.2.3 CO2-TPD表征结果
还原后CREA催化剂的CO2-TPD曲线见图6。由图6可见,所有CREA催化剂表面 均存在α和β两种吸附CO2碱性位,脱附温度均高于200 ℃,都属于CO2的化学吸附。由于进行CO2-TPD表征时所用催化剂的质量相等,因此CO2-TPD谱图中脱附峰面积的大小直接反映相应碱性位数量的多少[17]。对比CREA催化剂α和β碱性位对应的脱附峰面积可见,自上而下,α和β两种碱性位对应的脱附峰面积均增大,且β碱性位对应的脱附峰明显向高温方向偏移,表明两种碱性位的数量逐渐增多,β碱性位的碱性逐渐增强。其中,CLA催化剂表面α和β碱性位的数量最多,β碱性位的碱性最强。结合还原后催化剂的Cu比表面积可以推测,在CO2加氢制甲醇反应中,CREA催化剂的活性受还原后催化剂表面的碱性位性质和Cu比表面积双重因素影响,即碱性位数量越多、Cu比表面积越大,相应催化剂上CO2的转化率越高。这就解释了为什么还原后CCA催化剂较CLA催化剂上的Cu比表面积大,但前者CO2转化率比后者低的原因,主要是后者催化剂表面碱性位数量较前者多所致。此外,对于CREA催化剂,催化剂表面β碱性位的碱性强度也可能对其在CO2加氢制甲醇反应中的催化性能有影响。

图6 还原后CREA催化剂的CO2-TPD曲线Fig.6 CO2-TPD curves of the reduced CREA catalysts.
2.2.4 Raman光谱
焙烧后CREA催化剂中CuO的Raman谱图见图7。

图7 焙烧后CREA催化剂中CuO的Raman谱图Fig.7 Raman spectra of CuO in the calcined CREA catalysts.
由图7可见,Raman谱图中含有两个CuO的 Raman特征峰。CuO的单斜结构具有的空间群对称[29],有12个带心光学声子模型(4Au+5Bu+Ag+2Bg)。在这12个模型中,只有Ag和2Bg具有Raman光学活性[30]。由图7可知,290 cm-1处对应的是Ag模型,而340 cm-1处对应的是Bg模型,Ag模型归属为CuO中O原子的振动。Lin等[31]认为,Raman峰位置和半峰宽的变化与应力诱导引起声子模型的移位及宽化有关。图7中,自下而上,从CYA催化剂到CLA催化剂,晶格畸变依次增大。杨序纲等[32]认为在复合材料(如混合金属氧化物)中,物质的Raman峰的宽化与该物质在材料中的无序性程度有关,Raman峰越宽化表明相应化合物的无序程度越高。因此,图7中自下而上,CREA催化剂中CuO的无序程度逐渐增大。综上分析可知,CREA催化剂中CuO晶格畸变和无序程度由高到低的顺序为:CLA>CHA>CDA>CCA>CYA。结合CREA催化剂在CO2加氢制甲醇反应中的催化性能可发现,CuO晶格畸变和无序程度的变化顺序与CREA催化剂上甲醇的选择性顺序是一致的,即CuO晶格畸变和无序程度越高,CREA催化剂上甲醇的选择性越高。
3 结论
1)在CO2加氢制甲醇反应中,CREA催化剂活性高低的顺序为:CLA>CCA>CYA>CHA>CDA;甲醇选择性高低的顺序为:CLA>CHA>CDA>CCA>CYA;水热稳定性高低的顺序为:CLA>CHA>CDA>CYA>CCA。
2)在CLA催化剂上,CO2加氢制甲醇的最佳反应温度为240 ℃;原料空速增大导致CO2转化率和甲醇选择性均下降,这主要是由于反应物与催化剂接触时间缩短所致。
3)催化剂活性除与还原后催化剂Cu比表面积有关外,还与催化剂表面碱性位数量有关。甲醇的选择性与CREA催化剂中CuO的晶格畸变和无序程度有关,CuO晶格畸变和无序程度越高,甲醇选择性越高。
[1]Olah G A,Goeppert A,Surya Prakash G K. Chemical Recycling of Carbon Dioxide to Methanol and Dimethyl Ether:From Greenhouse Gas to Enewable,Environmentally Carbon Neutral Fuel and Synthetic Hydrocarbons[J]. J Org Chem,2009,74(2):487 - 498.
[2]于杨,郝爱香,陈海波,等. TiO2助剂对Cu-ZnO/ZrO2催化剂催化CO2加氢制甲醇反应性能的影响[J]. 石油化工,2014,43(5):511 - 516.
[3]迟亚武,梁东白,徐长海,等. 预处理条件对用于CO2加氢的超细CuO-ZnO-SiO2催化剂性能的影响[J]. 分子催化,1996,10(6):423 - 429.
[4]迟亚武,梁东白,杜鸿章,等. 助剂对超细CuO-ZnO-SiO2催化剂性质和CO2加氢反应性能的影响[J]. 分子催化,1996,10(6):430 - 434.
[5]王丹君,陶芙蓉,赵华华,等. Cu/ZnO/Al2O3催化剂的共沉淀-蒸氨法制备及其对二氧化碳加氢制甲醇的研究[J]. 分子催化,2011,25(2):124 - 129.
[6]Wang Danjun,Tao Furong,Zhao Huahua,et al. Preparation of Cu/ZnO/Al2O3Catalyst for CO2Hydrogenation to Methanol by CO2Assisted Aging [J]. Chin J Catal,2011,32(9):1452 - 1456.
[7]Hong Zhongshan,Cao Yong,Deng Jingfa,et al. CO2Hydrogenation to Methanol over Cu/ZnO/Al2O3Catalysts Prepared by a Novel Gel-Network-Coprecipitation Method [J]. Catal Lett,2002,82(1/2):37 - 44.
[8]张鲁湘,张永春,陈绍云. 助剂TiO2对CO2催化加氢制甲醇催化剂CuO-ZnO-Al2O3性能的影响[J]. 燃料化学学报,2011,39(12):912 - 917.
[9]刘志铭,林国栋,张鸿斌. CO2加氢制甲醇用碳纳米管促进的高效新型CuO-ZnO-ZrO2基催化剂[J]. 厦门大学学报:自然科学版,2010,49(3):297 - 302.
[10]Arena F,Barbera K,Italiano G,et al. Synthesis,Characterization and Activity Pattern of Cu-ZnO/ZrO2Catalysts in the Hydrogenation of Carbon Dioxide to Methanol[J]. J Catal,2007,249(2):185 - 194.
[11]Guo Xiaoming,Mao Dongsen,Lu Guanzhong,et al. CO2Hydrogenation to Methanol over Cu/ZnO/ZrO2Catalysts Prepared via a Route of Solid-State Reaction[J]. Catal Commun,2011,12(12):1095 - 1098.
[12]温丽丹,李金来. Cu/Zn/TiO2负载型催化剂上CO2加氢合成甲醇[J]. 化学研究,2009,20(1):61 - 64.
[13]刘志坚,廖建军,谭经品,等. Ce2O3对Cu-ZnO催化剂性质和CO2加氢反应性能的影响[J]. 工业催化,2001,9(6):41 - 44.
[14]王仁国,陈彤,张国民,等. V助剂对CuO/Al2O3上CO2加H2合成甲醇的影响[J]. 天然气化工,1999,24(6):12 - 16.
[15]Zhang Yiping,Fei Jinhua,Yu Yingmin,et al. Study of CO2Hydrogenation to Methanol over Cu-V/γ-Al2O3Catalyst[J]. J Nat Gas Chem,2007,16(1):12 - 15.
[16]Zhang Yiping,Fei Jinhua,Yu Yingmin,et al. Methanol Synthesis from CO2Hydrogenation over Cu Based Catalyst Supported on Zirconia Modified γ-Al2O3[J]. Energy Convers Magage,2006,47(18/19):3360 - 3367.
[17]Guo Xiaoming,Mao Dongsen,Lu Guanzhong,et al. The Influence of La Doping on the Catalytic Behavior of Cu/ZrO2for Methanol Synthesis from CO2Hydrogenation[J]. J Mol Catal A,Chem,2011,345(1/2):60 - 68.
[18]刘光华. 稀土材料与应用技术[M]. 北京:化学工业出版社,2005:2 - 8.
[19]Han Xiaoxiang,Zhou Renxian,Zheng Xiaoming,et al,Effect of Rare Earths on the Hydrogenation Properties of p-Chloronitrobenzene over Polymer-Anchored Platinum Catalysts[J]. J Mol Catal A,Chem,2003,193(1/2):103 - 108.
[20]Branco J B,Balliver-Tkatchenko D,Matos A P D. Gas-Phase Hydrogenation of Propionitrile on Copper-Lanthanide Oxides[J]. J Mol Catal A,Chem,2009,307(1/2):37 - 42.
[21]Silvestre-Albero J,Coloma F,Sepúlveda-Escribano A,et al. Effect of the Presence of Chlorine in Bimetallic PtZn/CeO2Catalysts for the Vapor-Phase Hydrogenation of Crotonaldehyde[J]. Appl Catal,A,2006,304(2):159 - 167.
[22]Yu Yang,Guo Yanglong,Zhan Wangcheng,et al. Gas-Phase Hydrogenation of Maleic Anhydride to γ-Butyrolactone at Atmospheric Pressure over Cu-CeO2-Al2O3Catalyst[J]. J Mol Catal A,Chem,2011,337(1/2):77 - 81.
[23]Yu Yang,Zhan Wangcheng,Guo Yun,et al. Gas-Phase Hydrogenation of Maleic Anhydride to γ-Butyrolactone over Cu-CeO2-Al2O3Catalyst at Atmospheric Pressure:Effects of the Residual Sodium and Water in the Catalyst Precursor[J]. J Mol Catal A,Chem,2014,395:392 - 397.
[24]Graciani J,Mudiyanselage K,Xu Fang,et al. Highly Active Copper-Ceria-Titania and Copper-Ceria-Titania Catalysts for Methanol Synthesis from CO2[J]. Science,2014,345(6196):546 - 550.
[25]郝爱香,于杨,陈海波,等. 表面助剂改性Cu/ZnO/Al2O3甲醇合成催化剂性能的影响[J]. 物化化学学报,2013,29(9):2047 - 2055.
[26]郭晓明. 二氧化碳加氢合成甲醇铜基催化剂的研究[D]. 上海:华东理工大学,2011.
[27]Chu Zheng,Chen Haibo,Yu Yang,et al. Surface-Assisted Preparation of Cu/ZnO/Al2O3for Mehtnaol Synthesis from Syngas[J]. J Mol Catal,A,2013,366(1):48 - 53.
[28]Martin O,Pérez-Ramírez J. New and Revisited Insights into the Promotion of Methanol Synthesis Catalysts by CO2[J].Catal Sci Technol,2013,3(12):3343 - 3352.
[29]Åsbrink S,Norrby L-J. A Refinement of the Crystal Structure of Copper(Ⅱ)Oxide with a Discussion of Some Exceptional e.s.d.’s [J]. Acta Crystallogr,Sect B,Struct Sci,1970,26(1):8 - 15.
[30]Goldstein H F,Kim D,Yu P Y,et al. Raman Study of CuO Single Crystals[J]. Phys Rev B,Condens Matter,1990,41(2):7192 - 7194.
[31]Lin Yangu,Hsu Yukuei,Chen Sanyuan,et al. Microwave-Activated CuO Nanotip/ZnO Nanorod Nanoarchitectures for Efficient Hydrogen Production[J]. J Mater Chem,2011,21(2):324 - 326.
[32]杨序纲,吴琪琳. 拉曼光谱的分析与应用[M]. 北京:国防工业出版社,2008:107 - 129.

