补体因子D及脂联素在子痫前期孕妇胎盘组织 血清及尿液中的表达及相关性研究
潘亚萍,漆洪波,罗 欣,刘西茹(重庆医科大学附属第一医院产科,重庆400016)
子痫前期是妊娠期高血压疾病的一种,指妊娠20周以后出现的以高血压和蛋白尿为特点的一种全身性疾病,迄今为止仍是我国孕产妇及围生儿死亡的重要原因。既往研究证实,子痫前期与成人代谢综合征有诸多共同的病理生理特征,包括脂肪代谢异常、胰岛素抵抗和血液高凝状态,而这些异常状态可能与脂肪细胞因子的异常分泌相关,包括瘦素、脂联素(ADPN)、补体因子D(CFD)等[1-2]。子痫前期患者血清中ADPN水平降低,而CFD水平及其与ADPN的关系如何尚不清楚。本研究通过检测子痫前期孕妇胎盘组织、血清及尿液中CFD以及ADPN的水平,探讨其与子痫前期发病的相关性。
1 资料与方法
1.1 一般资料 选取 2014年3~9月在重庆医科大学附属第一医院产科住院行剖宫产术的子痫前期孕妇29例(子痫前期组),诊断标准参照《妇产科学》第8版全国统编教材,以及正常足月妊娠行择期剖宫产术的孕妇30例(正常妊娠组)为研究对象。两组均为单胎妊娠;既往无高血压、心脏病、肾脏病、糖尿病及甲状腺功能亢进等病史;无复发性自然流产、畸胎、死胎等不良孕产史;无吸烟、长期服用药物史。孕期无急、慢性感染性疾病;胎儿无畸形。两组孕妇年龄、体质量指数、孕产次、孕周、新生儿性别比较,差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 标本采集 入院后,于治疗及分娩前取孕妇的清洁中段尿4 mL,经4℃低温离心后将上清液移出。同时抽取孕妇空腹外周肘静脉血5 mL,离心分离收集血清。血清及尿液样品均转入-80℃冰箱保存待测。剖宫产术中胎盘娩出后5 min内,避开肉眼可见的钙化灶及坏死区,取胎盘母体面中央组织约1.0 cm3大小,PBS漂洗后立即置于液氮中保存,过夜后转入-80℃冰箱保存待测。
1.2.2 Western blotting检测胎盘组织CFD、ADPN蛋白的表达 严格按照蛋白提取试剂盒(海门碧云天生物技术研究所)说明书提取胎盘组织总蛋白。BCA法检测蛋白浓度(南京凯基生物技术研究所)。行SDS-PAGE电泳,将蛋白转移至PVDF膜(美国Millipore公司),置于含5%脱脂奶粉、0.1%吐温-20的枸橼酸盐缓冲液中,室温封闭1 h后,分别加入兔抗人CFD、ADPN单隆抗体(稀释浓度分别为 1∶500 和 1∶1 000,美国 Abacm 公司,美国Santa Cruz公司)、兔抗人β-actin单克隆抗体(稀释浓度为 1∶1000,美国 Santa Cruz公司),4 ℃孵育过夜。加入辣根过氧化物酶标记的羊抗兔IgG(稀释浓度为1∶1 000,北京中杉金桥生物技术有限公司)二抗,室温孵育1 h。加入ECL显色液(南京凯基生物技术有限公司),利用ChemiDoc XRS化学发光成像系统(美国Bio-Rad公司)检测蛋白质印迹条带灰度,用Quantity One 4.6.2版图像分析软件进行分析。
1.2.3 血清及尿液中CFD、ADPN水平检测 采用ELISA分别检测CFD和ADPN的水平。CFD ELISA检测试剂盒购自南京森贝伽生物科技有限公司,ADPN ELISA检测试剂盒购自深圳晶美生物有限公司,操作按说明书进行。所有标本均行3个复孔检测且为同批测定,取平均值为最终浓度,批内变异小于0.5%。
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,计量资料以ss表示,组间比较采用t检验,两变量之间的相关关系用Spearsman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组孕妇胎盘组织中CFD与ADPN表达水平比较 子痫前期组孕妇胎盘组织中CFD水平较正常妊娠组明显升高,而ADPN水平显著下降,差异均有统计学意义(P<0.05 或 0.01),见图 1。两组 Western blotting 结果见图2。

图1 两组蛋白相对表达量比较
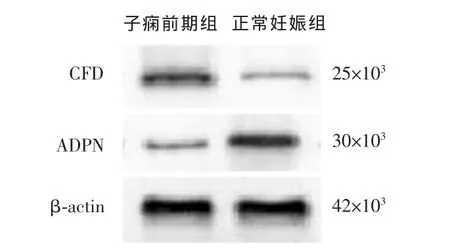
图2 Western blotting结果
2.2 两组孕妇血清中CFD与ADPN的水平比较 子痫前期组孕妇血清中的CFD水平显著高于正常妊娠组,而血清中ADPN的水平显著低于正常妊娠组,差异均有统计学意义(P<0.01)。见表 1。
表1 两组孕妇血清CFD与ADPN水平比较(ss)

表1 两组孕妇血清CFD与ADPN水平比较(ss)
注:与正常妊娠组比较,aP<0.05。
组别子痫前期组正常妊娠组n CFD(μg/mL)ADPN(ng/mL)29 30 1.83±0.59a 0.67±0.04 13.16±2.01a 80.68±1.27
2.3 两组孕妇尿液中CFD与ADPN的水平比较 子痫前期组孕妇尿液中的CFD水平显著高于正常妊娠组,而ADPN水平显著低于正常妊娠组,差异均有统计学意义(P<0.01)。见表 2。
表2 两组孕妇尿液中CFD与ADPN水平比较(ss,ng/mL)

表2 两组孕妇尿液中CFD与ADPN水平比较(ss,ng/mL)
注:与正常妊娠组比较,aP<0.05。
子痫前期组正常妊娠组ADPN 29 30 174.95±23.61a 43.27±16.59 2.40±0.86a 9.29±1.33
2.4 子痫前期孕妇胎盘组织、血清及尿液中CFD与ADPN的相关性 子痫前期孕妇胎盘组织中,CFD与ADPN 表达水平呈负相关(r=-0.82,P<0.05),血清中 CFD和 ADPN 呈负相关(r=-0.78,P<0.05),在尿液中,二者的关系也呈负相关(r=-0.63,P<0.05)。而在正常妊娠组中,胎盘组织、血清及尿液中的CFD与ADPN水平均无相关性(P>0.05)。
3 讨 论
3.1 子痫前期与代谢综合征 代谢综合征是以中心性肥胖、糖脂代谢紊乱、高血压为主要临床特点的一组严重影响健康的临床综合征,是引发心、脑血管事件的高危因素,也是成人致死和致残的主要原因[3]。近年来越来越多的证据显示,子痫前期与代谢综合征具有密切的关联,而且二者在发病机制和远期后遗症方面都存在明显的相似性,例如都存在胰岛素抵抗、血管内皮功能紊乱、高尿酸血症、高半胱氨酸血症及血栓前状态等[4-5]。因此有学者提出,妊娠期高血压疾病尤其是子痫前期可称之为妊娠期代谢综合征[6]。早期识别妊娠期代谢综合征有助于定义该类群体,因为这些女性不仅易发展为妊娠相关疾病状态,例如妊娠期高血压疾病、妊娠期糖尿病等,发生不良围生期结局的风险显著增高,而且其将来发生代谢性疾病和心血管疾病的危险性也显著增加[7]。近20年来对糖类及脂肪在妊娠期间代谢机制的传统观念正在不断地被修正,由此发现的一些脂肪因子,如瘦素、抵抗素、ADPN等,证实对妊娠期妇女的糖脂代谢存在不同程度的影响。而这些影响不仅作用于孕妇本身,对胎婴儿亦具有较大的影响[8],这也符合“成人疾病胎儿起源学说(DoHAD)”的观念,亟须引起产科学者重视。
3.2 CFD与子痫前期 CFD又称为降脂素,是第一个被认识的脂肪分泌蛋白,既往发现其在肥胖的啮齿类动物中表达降低,但并未引起广泛关注[9]。CFD是胰凝乳蛋白酶的丝氨酸蛋白酶家族的成员之一,参与调节补体激活的替代途径的关键步骤,并刺激三酰甘油在脂肪细胞中的积累,从而抑制脂肪分解。酰化刺激蛋白作为一种补体蛋白,经酶反应产生,其由脂肪组织分泌,在调节脂肪代谢和能量平衡方面发挥重要作用。一方面提高脂肪细胞捕获脂肪酸和合成三酰甘油的能力;另一方面通过抑制激素敏感脂酶的活性来抑制三酰甘油的分解。而在其形成过程中需要一种补体成分——CFD的参与[10]。越来越多的研究证实,CFD与肥胖、胰岛素抵抗、血脂异常及心血管疾病的发生呈正相关。这与本研究结果类似,在具有胰岛素抵抗及血脂代谢异常的子痫前期孕妇的血清及尿液中,CFD的水平显著高于正常妊娠者,由此提示,CFD的异常表达可能是引发子痫前期一个关键环节。
值得关注的是,CFD作为一个新的指标,已经被证实在宫颈鳞癌、胃肠道恶性肿瘤、口腔鳞癌等疾病中存在异常表达[11]。由于胎盘的滋养细胞具有与肿瘤细胞类似的侵袭能力[12],而本研究显示,CFD在子痫前期胎盘组织中存在异常的表达升高,因此,CFD是否作用于子痫前期的胎盘滋养细胞,参与调控滋养细胞侵袭能力损伤,从而造成“胎盘浅着床”,最终引发子痫前期,值得进一步研究。
3.3 ADPN与子痫前期 ADPN又称为ACRP30,是由脂肪细胞分泌的一种特异性蛋白。ADPN是迄今为止发现的唯一与肥胖呈负相关的细胞因子,有降低三酰甘油和血糖水平、改善胰岛素抵抗、保护血管内皮和抑制动脉粥样硬化等作用[13]。在肥胖者血清中,ADPN水平明显降低,并且其水平与体质量指数、脂肪百分比、腰臀比有着显著的相关性[14]。Machado等[15]发现,子痫前期患者血浆中ADPN水平明显低于正常孕妇,而重度子痫前期降低更明显,并且血浆ADPN水平与孕妇年龄、孕周、体质量指数、收缩压和尿蛋白成负相关。而另一项研究也证实,子痫前期患者的胎盘中ADPN及其受体存在异常的表达及调节[16]。本研究结果也表明,ADPN在子痫前期患者的胎盘组织、血清和尿液中的水平明显下降,与子痫前期的发生密切相关。同时通过相关性分析证实,在子痫前期孕妇的胎盘组织、血清和尿液中的CFD与ADPN水平均呈显著负相关性,但其具体的调节机制仍不清楚。同时低脂联素血症和高降脂素血症是否能作为敏感的子痫前期危险因子和判断病情预后的重要指标,还需大样本的进一步研究。需重点指出的是,由于尿液检测的方便性和无创性,联合检测孕妇尿液中的CFD与ADPN水平,有望成为一种新型、高效的预测早期诊断子痫前期的方法。
子痫前期的发生是一个多因素、分阶段动态发展的过程,其发病机制仍未完全阐明,而与糖脂代谢紊乱相关的脂肪细胞因子表达异常可能是导致其发病的重要环节。本研究通过检测子痫前期及正常晚期妊娠孕妇胎盘组织、血清及尿液中CFD与ADPN水平,初步探讨了二者在子痫前期发病中的作用,以期为子痫前期发病机制提供新的靶点和理论依据。同时依据二者在尿液中的异常表达,有望为子痫前期的早发现、早诊断提供新的预警机制。
[1]Drost JT,Maas AH,Holewijn S,et al.Novel cardiovascular biomarkers in women with a history of early preeclampsia[J].Atherosclerosis,2014,237(1):117-122.
[2]Büke B,Topçu HO,Y,et al.Comparison of serum maternal adiponectin concentrations in women with isolated intrauterine growth retardation and intrauterine growth retardation concomitant with pre-eclampsia[J].J Turk Ger Gynecol Assoc,2014,15(3):173-176.
[3]Zhang H,Sairam MR.Sex hormone imbalances and adipose tissue dysfunction impacting on metabolic syndrome;a paradigm for the discovery of novel adipokines[J].Horm Mol Biol Clin Investig,2014,17(2):89-97.
[4]乔宠,金峰,栾南南,等.子痫前期患者合并代谢综合征的发病相关因素初探[J].中国现代医学杂志,2009,19(16):2527-2530.
[5]Valdés E,Sepúlveda-Martínez A,Manukián B,et al.Assessment of pregestational insulin resistance as a risk factor of preeclampsia[J].GynecolObstet Invest,2014,77(2):111-116.
[6]罗欣,漆洪波.妊娠期高血压疾病与代谢综合征[J].中国实用妇科与产科杂志,2011,27(12):944-946.
[7]Al-Nasiry S,Ghossein-Doha C,Polman S,et al.Metabolic syndrome after pregnancies complicated by pre-eclampsia or small for gestational age:a retrospective cohort[J/OL].BJOG,2014-10-16[2014-11-01].http://www.ncbi.nlm.nih.gov/pubmed/?term:Al-Nasiry+S%2C+Ghossein-Doha+C%2C+Polman+S%2C+et+al.+Metabolic+Syndrome+after+pregnancies+complicated+by+pre-edampsia+or+small+for+gestational+age%3A+a+retrospective+cohort%5BJ%5D.+BJOG%2C+2014%2C+(10%)2C+16.
[8]Krause B,Sobrevia L,Casanello P.Epigenetics:new concepts of old phenomena in vascular physiology[J].Curr Vasc Pharmacol,2009,7(4):513-520.
[9]Mathews JA,Wurmbrand AP,Ribeiro L,et al.Induction of IL-17A precedes development of airway hyperresponsiveness during diet-induced obesity and correlates with complement factor D[J].Front Immunol,2014,5:440.
[10]Sivakumar K,Bari MF,Adaikalakoteswari A,et al.Elevated fetal adipsin/acylation-stimulating protein(ASP)in obese pregnancy:novel placental secretion via Hofbauer cells[J].J Clin Endocrinol Metab,2013,98(10):4113-4122.
[11]布威海丽且姆·阿巴拜科日,依米提·热合曼,阿丽叶古丽·艾皮热,等.CFD基因在宫颈鳞癌及癌前病变组织中的表达水平及意义[J].医学分子生物学杂志,2013,10(2):109-113.
[12]Zhang Z,Zhang L,Yang X,et al.Construction and validation of aplacental tissue microarray from specimens of well-documented preeclampsia patients[J].Placenta,2013,34(2):187-192.
[13]Minatoya M,Kutomi G,Shima H,et al.Relation of serum adiponectin levels and obesity with breast cancer:a Japanese case-control study[J].Asian Pac J Cancer Prev,2014,15(19):8325-8330.
[14]Al-Hamodi Z,Al-Habori M,Al-Meeri A,et al.Association of adipokines,leptin/adiponectin ratio and C-reactive protein with obesity and type 2 diabetes mellitus[J].Diabetol Metab Syndr,2014,6(1):99.
[15]Machado JS,Palei AC,Amaral LM,et al.Polymorphisms of the adiponectin gene in gestational hypertension and pre-eclampsia[J].J Hum Hypertens,2014,28(2):128-132.
[16]Tie WW,Yu HY,Chen J,et al.Expressions of adiponectin receptors in placenta and their correlation with preeclampsia[J].Reprod Sci,2009,16(7):676-684.

