甲醛致兔窦房结损伤模型的建立
刘学武,王小青,赵 丞,张 丹,李晓晖,姜德建
(1.中南大学药学院,长沙 430013;2.湖南省药物安全评价研究中心,长沙 410331)
甲醛致兔窦房结损伤模型的建立
刘学武1,2,王小青1,2,赵 丞2,张 丹2,李晓晖1,姜德建1,2
(1.中南大学药学院,长沙 430013;2.湖南省药物安全评价研究中心,长沙 410331)
目的建立甲醛诱导的兔窦房结损伤模型。方法采用40%甲醛溶液损伤兔窦房结,检测心率、窦房传导时间、窦房结恢复时间和校正窦房结恢复时间等指标,比较不同损伤方法、损伤程度、损伤持续时间等,并采用阳性药对模型进行验证。结果(1)损伤方法:湿敷法可通过时间及面积大小控制损伤程度;滴注法创伤小,可通过甲醛量来控制损伤程度,但易造成窦房结周围组织损伤;(2)损伤程度和维持时间:心率下降百分率小于基础心率的30%时,模型维持时间小于7d;下降至基础心率的30%~60%时,模型维持时间可达70d;下降大于60%基础心率的模型动物死亡率较高;(3)阳性药物的验证:阿托品和心宝丸均增加窦房结损伤模型心率,改善窦房结功能的作用。结论甲醛湿敷法建立兔窦房结损伤模型较滴注法可靠性更高,损伤程度宜将心率下降百分率控制在基础心率30%至60%之间,模型维持时间长且动物死亡率低。
兔;甲醛;窦房结损伤
病态窦房结综合症(简称病窦)是由于窦房结及其周围组织病变,导致窦房结冲动形成障碍和/或冲动传出障碍而产生心律失常(主要是窦性心动过缓、窦性停搏及窦房传导阻滞)和一系列临床表现的综合征,目前临床缺乏疗效确切的治疗药物[1-4]。建立病窦模型的方法包括有冷冻、注射、钳夹、电灼烧、甲醛损伤等方法,其中以甲醛损伤法最为常用[4-6]。甲醛损伤窦房结可用浸泡甲醛的纱布湿敷窦房结部位或采用微量注射器向窦房结位置注射微量的甲醛[4-13],但是尚无研究报道不同甲醛损伤方法的差异以及损伤程度与模型持续时间的关系。本实验采用家甲醛损伤模型,比较甲醛湿敷法和微量注射法建模的优缺点,并观察不同损伤程度兔病窦模型心脏电生理功能的动态变化,然后采用阳性药阿托品和心宝丸对模型的可靠性进行验证,以此建立甲醛致兔窦房结损伤模型。
1 材料和方法
1.1 材料
1.1.1 实验动物
兔36只,普通级,雌雄各半,体重2.0~3.6kg,购于武汉市万千佳科技有限公司【SCXK(鄂)2011-0011】;在湖南省药物安全评价研究中心普通环境饲养【SYXK(湘)2010-0008】。
1.1.2 主要试剂
心宝丸,由广东心宝制药有限公司生产,规格:60mg/粒,批号:20130604/20140201。阿托品片,山东仁和堂药业有限公司生产,规格:0.3mg/片,批号:130604。甲醛购自国药集团化学试剂有限公司;乌拉坦购自国药集团化学试剂有限公司。
1.1.3 主要仪器
B203LED型生物显微镜(重庆奥特光学仪器有限公司);DF-5A型心脏电生理刺激仪(苏州市东方电子仪器厂);BL420S生物机能实验系统(成都泰盟科技有限公司)。
1.2 方法
1.2.1 实验设计与分组
1.2.1.1 甲醛湿敷法和滴注法造模的比较
兔经耳缘静脉注射20%乌拉坦4~5mL/kg麻醉后固定,连接体表心脏Ⅱ导联。以第三肋骨水平为中心备皮、消毒后沿胸骨正中偏右2~3mm纵行切开皮肤约3cm,分离皮下组织及肌肉,切断第2~4肋骨,开胸并避免损伤右胸廓内动脉及右侧胸膜,经纵隔纵向剪开心包膜,暴露右心房,用注射器连接套管,深入心包膜腔内侧,轻轻吸取心包液。
心房调搏法测量窦房结功能:用7F四极食道电极导管(起搏电极)的起始端第1、2电极连接心脏电生理刺激仪,末端的第1电极连接于自制标测电极,放置于右心房高位,第2电极连接外接导线并插入胸部肌肉形成回路,进行心房调搏,测量兔造模前及造模后的窦房传导时间(sinoatrial conduction time,SACT)、窦房结恢复时间(sinus node recovery time,SNRT)、校正窦房结恢复时间(corrected sinus nodel recovery time,SNRTc)。
湿敷法[4-11]:用干棉签轻放于右心耳处,轻轻将心脏拨向左侧,暴露右心房与上腔静脉交界(窦房结区),用40%甲醛将棉签底部(3mm×3mm)充分浸润,轻轻送至窦房结区,并湿敷3~5min。当心率较湿敷前下降30%以上或出现窦性停搏、窦房阻滞或结性逸搏时取出棉签,观察心律变化情况。对未出现上述心律失常者则持续湿敷,并继续观察心律情况,如心率恢复到原心率的60%以上则需重新湿敷。1h后再次测量SACT、SNRT、SNRTc。
滴注法[4-11]:将自制标测电极一端连接于心脏V1导联,另一端放置于窦房结区,标测窦房结电图,并固定位置,然后将自制标测电极末端接上装有40%甲醛的微量注射器,弹丸样缓慢推注。当心率较注射前下降30%以上或出现窦性停搏、窦房阻滞或结性逸搏时暂停推注,观察心律变化情况。对未出现上述心律失常者则持续推注,最大量至0.03mL。1h后再次测量SACT、SNRT、SNRTc。
1.2.1.2 兔窦房结损伤模型损伤程度及维持时间的探索
湿敷法复制兔窦房结损伤模型:将模型按心率下降百分率分为3组,分别为小于30%基础心率组、30%~60%基础心率组、大于60%基础心率组。其中小于30%基础心率组的入选条件为造模后1h心率下降程度小于基础心率的30%,30%~60%基础心率组的入选条件为造模后1h心率下降程度为基础心率的30%~60%,大于60%基础心率组的入选条件为造模后1h心率下降大于基础心率的60%。测量各组兔造模前及造模后1h心率、SACT、SNRT、SNRTc,并分别于造模后第7、14、28、56、70天重复测量各组模型兔的心率。
1.2.1.3 阳性药物对兔窦房结损伤模型的影响
选取用40%甲醛湿敷制模法、心率下降百分比在30%~60%的模型,于手术后7d重新测量心率,并计算心动周期(sinus cardiac length,SCL),选取心动周期的延长(△SCL)≥100ms的模型兔24只,按心率分层随机分为模型对照组、阿托品组(0.13mg/kg)、心宝丸组(78mg/kg),每组8只。另取8只兔,作为假手术组,仅打开胸腔,剪开心包膜,不进行甲醛湿敷。每日给药前将心宝丸、阿托品片(研磨成粉)用蒸馏水配制成相应浓度药液,各组兔按5mL/kg灌胃给予相应剂量药液,假手术组、模型对照组灌胃给予等体积蒸馏水,1次/天,连续28d。测量各组兔给药前及给药第14、28天的心率、SACT、SNRT、SNRTc。
1.2.2 检测指标
1.2.2.1 心率
分别测量兔造模前及造模后心率,并根据心率计算心率下降百分率、SCL及△SCL。心率下降百分率=(基础心率-造模后心率)÷基础心率×100%;SCL(ms)=1000×60÷心率;△SCL=造模后SCL-造模前SCL。
1.2.2.2 窦房结功能
以高于心率的刺激频率进行心房调搏,测量兔SACT、SNRT、SNRTc,具体测量方法如下:
SACT:参考Narula法[5,12,16]测定SACT,起搏电压3.0mV,脉宽10ms,采用高于基础心率10%的频率作为刺激频率。将起搏电极放置于右心房高位,连续刺激8次,并在心电图上计算SACT,SACT=(A2~A3)/2-(A1~A1)/2,其中A1为短促起搏前窦性P波;A2为末个起搏脉冲,A3为起搏后恢复的第1个P波;A1~A1为基本窦性周期,A2~A3为起搏后窦性节律恢复时间,1min后重复测量一次,取两次测量的平均值作为SACT。
SNRT:参考S1S1超速抑制分级递增法[5,12,17-18]测量SNRT,起搏电压3.0mV,脉宽10ms,分别采用高于基础心率20%、40%、60%、80%的频率作为刺激频率,将起搏电极放置于右心房高位,连续刺激15s,每次刺激间隔30s以上。以末次刺激至窦房结功能恢复(体表心电图上表现为起搏后的窦性P波)的间期为S1P,取四次刺激最长的S1P作为SNRT。
SNRTc:SNRTc=SNRT-SCL。
1.3 统计方法
采用SPSS16.0进行统计分析,统计学意义的水平设定为P<0.05。计量资料采用均数±标准差(±ss)。两两配对资料采用配对t检验;多重随机分组资料,用Leven’s test方法检验正态性和方差齐性。如果符合正态性和方差齐性,用单因素方差分析(One-way ANOVA)和post Hoc LSD进行统计分析;如果不符合正态性和方差不齐,则用Kruskal-Wallis检验。如果Kruskal-Wallis检验有统计学意义(P<0.05),则用Dunnett’s Test(非参数方法)进行比较分析。
2 结果
2.1 兔窦房结损伤造模模型方法确定
采用滴注法制备甲醛窦房结损伤模型时,因窦房结的位置不是平行于水平面,标测电极导管固定于窦房结上,并缓慢推注40%甲醛溶液时,由于心脏的跳动,且心脏表面是光滑的,甲醛溶液不能吸附于窦房结表面,容易流动至心脏的其它部位而引起损伤。另外窦房结电图的测量容易受到周围组织电信号的干扰,且不同文献报道的窦房结电图存在一定程度的变异[5,11,14-15]。以上原因导致滴注法复制兔窦房结损伤模型有一定困难。采用湿敷法造模时,将浸有甲醛溶液的棉签附着于窦房结区,对窦房结组织造成持续的损伤,且可通过湿敷时间及湿敷面签的面积大小来控制损伤程度,造模后心率显著下降,SACT、SNRT、SNRTc显著延长(图1)。
2.2 兔窦房结损伤模型损伤程度及维持时间的确定
如表1所示,与造模前比较,小于30%基础心率组、30%~60%基础心率组、大于60%基础心率组家兔造模1h后SACT、SNRT、SNRTc均显延长,提示窦房结功能低下。

注:A:造模前SACT(19.3ms);B:造模前SNRT(245ms),SNRTc=35ms;C:造模1h后SACT(45.3ms);D:造模1h后SNRT(570ms),SNRTc=210ms。图1 窦房结损伤模型窦房结功能的变化Note:A:SACT(19.3ms)before modeling;B:SNRT(245ms)and SNRT(35ms)before modeling;C:SACT(45.3ms)after modeling 1 hour;D:SNRT(570ms)and SNRT(210ms)after modeling 1 hour.Fig.1 The changes of sinus node function in sinoatrial node damage models
表1 不同损伤程度窦房结损伤模型窦房结功能的比较(±ss,n=3)Tab.1 The comparisons of sinus node function in different injury degree sinoatrial node damage models(±ss,n=3)

表1 不同损伤程度窦房结损伤模型窦房结功能的比较(±ss,n=3)Tab.1 The comparisons of sinus node function in different injury degree sinoatrial node damage models(±ss,n=3)
注:与造模前比较▲P<0.05,▲▲P<0.01。Note:▲P<0.05,▲▲P<0.01,compared with premodeling.
组别Group SNRT(ms) SNRTc(ms) SACT(ms)造模前Before modeling造模后1 h After modeling for 1 hour造模前Before modeling造模后1 h After modeling for 1 hour造模前Before modeling造模后1 h After modeling for 1 hour小于30%基础心率组Less than 30%of basic heart rate group 300.0±31.2 393.3±29.3▲ 59.7±9.2 110.3±18.5▲▲ 16.7±9.0 40.6±9.4▲▲30%-60%基础心率组30%-60%of basic heart rate group 290.0±27.8 685.0±227.0▲▲ 66.0±21.6 207.2±90.4▲▲ 18.9±5.5 69.9±21.2▲▲大于60%基础心率组More than 30%of basic heart rate group 277.3±46.8 906.7±141.9▲▲ 50.7±12.1 275±73.7▲▲ 13.3±7.6 103.3±27.9▲▲
如表2、表3所示,分别重复测量小于30%基础心率组、30%~60%基础心率组、大于60%基础心率组兔造模后第7、14、28、46、70天的心率,其中小于30%基础心率组兔于造模后第7天心率即明显上升,与造模前比较无明显差异,且△SCL小于100ms,不符合窦房结损伤模型的成模标准,故停止对小于30%基础心率组兔进行造模后的重复测量;30%~60%基础心率组兔造模后第7、14、28、46、70天的心率虽有一定恢复,但均显著低于造模前心率(P<0.01),且△SCL均大于100ms,符合窦房结损伤模型的成模标准;大于60%基础心率组兔造模后第7天心率显著低于造模前心率(P<0.01),且△SCL均大于100ms,但在造模7d后死亡,大体解剖可见动物全身水肿,可能与局部损伤过于严重,引起兔心衰所致。
表2 不同损伤程度窦房结损伤模型心率的变化(±ss,n=3)Tab.2 The changes of heart rate in different injury degree sinoatrial node damage models(±ss,n=3)
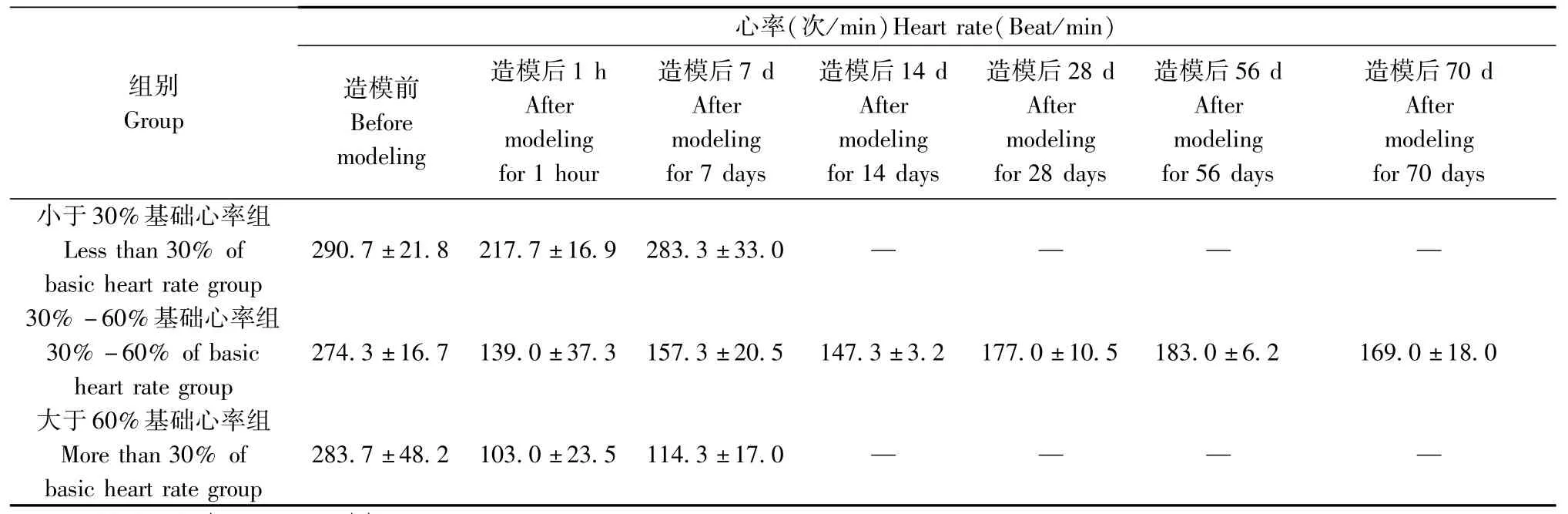
表2 不同损伤程度窦房结损伤模型心率的变化(±ss,n=3)Tab.2 The changes of heart rate in different injury degree sinoatrial node damage models(±ss,n=3)
注:与造模前比较▲P<0.05,▲▲P<0.01。Note:▲P<0.05,▲▲P<0.01,Compared with premodeling.
组别Group心率(次/min)Heart rate(Beat/min)造模前Before modeling造模后1 h After modeling for 1 hour造模后7 d After modeling for 7 days造模后14 d After modeling for 14 days造模后28 d After modeling for 28 days造模后56 d After modeling for 56 days造模后70 d After modeling for 70 days小于30%基础心率组Less than 30%of basic heart rate group 290.7±21.8 217.7±16.9 283.3±33.0 ― ― ― ―30%-60%基础心率组30%-60%of basic heart rate group 274.3±16.7 139.0±37.3 157.3±20.5 147.3±3.2 177.0±10.5 183.0±6.2 169.0±18.0大于60%基础心率组More than 30%of basic heart rate group 283.7±48.2 103.0±23.5 114.3±17.0 ― ― ― ―
表3 不同损伤程度窦房结损伤模型心动周期的变化(±ss,n=3)Tab.3 The changes of cardiac cycle in different injury degree sinoatrial node damage models(±s,n=3)

表3 不同损伤程度窦房结损伤模型心动周期的变化(±ss,n=3)Tab.3 The changes of cardiac cycle in different injury degree sinoatrial node damage models(±s,n=3)
组别Group心率下降百分率(%)Percentage decrease in heart rate(%)△SCL(ms)造模后7 d After modeling for 7 days造模后14 d After modeling for 14 days造模后28 d After modeling for 28 days造模后56 d After modeling for 56 days造模后70 d After modeling for 70 days小于30%基础心率组Less than 30%of basic heart rate group 25.1±0.8 6.5±16.0 ― ― ― ―30%-60%基础心率组30%-60%of basic heart rate group 49.6±11.4 166.3±48.0 188.1±10.7 120.5±23.9 108.9±3.8 108.9±3.8大于60%基础心率组More than 30%of basic heart rate group 63.9±2.0 317.3±80.8 ― ― ― ―
表4 兔窦房结损伤模型给药前心率及△SCL的变化(±ss,n=8)Tab.4 The changes of heart rate and△SCL before treatment compared in sinoatrial node damage models(±ss,n=8)

表4 兔窦房结损伤模型给药前心率及△SCL的变化(±ss,n=8)Tab.4 The changes of heart rate and△SCL before treatment compared in sinoatrial node damage models(±ss,n=8)
注:与造模前比较▲▲P<0.01,与假手术组比较++P<0.01。Note:▲▲P<0.01,compared with premodeling,++P<0.01,compared with sham group.
组别Group剂量(mg/kg)Dose(mg/kg)造模前心率(次/mim)Heart rate before modeling( Beat/min)心率下降百分率(%)Percentage decrease of heart rate(%)给药前心率(次/mim)Heart rate before treatment(Beat/min)△SCL(ms)假手术组Sham operated group ― 286.8±18.0 ― 281.9±20.0 ―模型对照组Model control group ― 291.6±36.1 36.0±3.4 169.9±23.1++▲▲ 150.8±37.4阿托品组Atropine group 0.13 278.7±29.9 38.7±8.4 171.5±20.1++▲▲ 149.0±38.9心宝丸组Xinbao pill group 78 271.3±25.5 38.6±10.4 170.5±21.1++▲▲ 140.0±39.2
2.3 心宝丸及阿托品对兔窦房结损伤模型的影响
如表4、5所示,与假手术组比较,其它各组兔给药前心率显著下降(P<0.01),且造模后心率下降百分率均在30%~60%范围内;各给药组兔△SCL均大于100ms,且给药前心率均较造模前显著降低(P<0.01);各组兔组间进行比较,给药前心率及△SCL无明显差异;与模型对照组比较,心宝丸组及阿托品组兔给药14、28d后心率均显著升高(P<0.05或P<0.01)。
如表6所示,与假手术组比较,模型对照组兔SACT、SNRT、SNRTc均显著延长(P<0.01),提示窦房结损伤模型复制成功;与模型对照组比较,心宝丸组及阿托品组兔给药28d后SACT、SNRT、SNRTc均显著缩短(P<0.05或P<0.01)。
表5 兔窦房结损伤模型给药后心率的变化(±ss,n=8)Tab.5 The changes of heart rate compared in sinoatrial node damage models after treatment(±ss,n=8)

表5 兔窦房结损伤模型给药后心率的变化(±ss,n=8)Tab.5 The changes of heart rate compared in sinoatrial node damage models after treatment(±ss,n=8)
注:与假手术组比较++P<0.01,与模型对照组比较*P<0.05,**P<0.01。Note:++P<0.01,compared with sham group,*P<0.05,**P<0.01,compared with model group.
组别Group剂量(mg/kg)Dose(mg/kg)给药前心率(次/mim)Heart rate before treatment(Beat/min)给药14 d心率(次/mim)Heart rate after 14 days treatment(Beat/min)给药28d心率(次/mim)Heart rate after 28 days treatment(Beat/min)假手术组Sham operated group ― 281.9±20.0 285.6±16.0 282.0±15.2模型对照组Model control group ― 178.5±44.7++ 178.8±27.9++ 180.0±40.8++阿托品组Atropine group 0.13 171.3±38.4++ 212.1±34.4* 226.6±31.4*心宝丸组Xinbao pill group 78 177.3±28.5++ 259.5±30.8** 239.4±5.0**
表6 兔窦房结损伤模型给药后窦房结功能的变化(±ss,n=8)Tab.6 The changes of sinus node function compared in sinoatrial node damage models after treatment(±ss,n=8)

表6 兔窦房结损伤模型给药后窦房结功能的变化(±ss,n=8)Tab.6 The changes of sinus node function compared in sinoatrial node damage models after treatment(±ss,n=8)
注:与假手术住比较++P<0.01,与模型对照组比较*P<0.05,**P<0.01。Note:++P<0.01,compared with sham group,*P<0.05,**P<0.01,compared with model group.
组别Group剂量(mg/kg)Dose(mg/kg) SACT(ms) SNRT(ms) SNRTc(ms)假手术组Sham operated group ― 19.6±16.7 274.0±59.3 76.0±67.5模型对照组Model control group ― 103.6±65.9++ 574.4±190.6++ 200.5±69.2++阿托品组Atropine group 0.13 77.2±26.1* 376.9±71.5* 146.0±68.2*心宝丸组Xinbao pill group 78 46.9±21.0** 333.4±56.4** 121.3±74.9*
3 讨论
动物病窦模型对研究病窦的发生机制及其临床防治有重要意义。我们通过比较两种方法(甲醛湿敷法和滴注法)建立兔窦房结损伤模型,发现滴注法虽充分利用了窦房结电图的特异性,角度新颖,且对兔创伤相对较小,但同样存在窦房结电图的测量相对困难,容易受到心脏其它部位类似波形的干扰,造模损伤程度不易控制等缺点。湿敷法虽然对兔创伤大,但便于控制模型的损伤程度。然而不管采用何种方法复制窦房结损伤模型,其成模标准均以多样本兔的实验组与对照组之间的统计学差异来确定。但对某一个体动物模型成功建立的标志目前尚无可供参考的标准,具体体现在模型复制过程中,甲醛湿敷后动物心率较湿敷前下降百分率各家说法不一,损伤后期则通常以心动周期延长(△SCL)≥100ms作为模型成功标准。临床对病态窦房结综合征患者的需通过窦房结功能结合长时间的心率监测进行诊断,但是在兔实验时,样本数量大,如需对窦房结功能监测,只能通过开胸或经颈静脉插入导管进行测量,工作量大,且势必对模型造成持续性的损伤,不利于药物的疗效的评价。故心率的动态监测在评价模型的发展及药物的疗效方面就显得尤为重要。我们试图通过观察不同损伤程度的模型各时间点的心脏电生理功能变化,并总结出心率下降百分率(损伤程度)、△SCL及模型维持时间三者之间的关系,为新药研究的试验设计提供依据。研究结果表明,采用甲醛湿敷法复制兔窦房结是可行的,造模后心率下降百分率与△SCL大小有一定的一致性,心率下降百分率大于30%基础心率的模型△SCL均大于100ms,SACT、SNRT、SNRTc较造模前均显著延长,且造模后模型的心率(147.3±3.2次/min~183.0±6.2次/min)、SACT(69.9±21.2ms)、SNRT(685.0±227.0ms)、SNRTc(207.2±90.4ms)与文献报道的结果(心率:150~170ms;SACT:40~80ms;SNRT:400~500ms;SNRTc:90~120ms)基本一致。并且上述结果在阳性药物验证试验中得到了证实,损伤程度大于30%时即可预测模型的△SCL将大于100ms;同时心率下降百分率为30%~60%基础心率的模型维持时间可达70d,但当心率下降百分率大于60%基础心率时,由于局部损伤较大,动物不易存活,故造模时需控制损伤程度小于60%基础心率。
综上所述,甲醛诱导兔窦房结损伤是研究病窦综合征较好的动物模型。在采用甲醛建立兔病窦模型时,可将损伤程度心率下降百分率控制在30%~60%基础心率作为模型成功的评判标准。
[1]苏定冯.心血管药理学[M].北京:人民卫生出版社,2011.
[2]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2010.
[3]苗明三.常用医药研究动物模型[M].北京:人民卫生出版社,2007.
[4]耿乃志,张守红.手术法建立窦房结损伤模型研究进展[J].现代临床医学,2009,35(2):83-85.
[5]耿乃志.复心脉方对病态窦房结综合征家兔模型HR、SNRT、SACT影响的实验研究[D].黑龙江:黑龙江中医药大学,2008:1-146.
[6]刘如秀,王妮娜,李汇博,等.康心复律方对病态窦房节综合征家兔窦房结电生理功能影响[J].中国中西医结合杂志,2011,31(8):1118-1121.
[7]于阳,曲秀芬,刘丽,等.起搏治疗对心脏自主神经基质改变的实验研究[J].中华心律失常学杂志,2011,15(6):430-434.
[8]周圣华,宋治远.窦房结组织急性受损后电生理功能改变的动态观察[J].中国心脏起搏与心电生理杂志,2004,18(2):127-129.
[9]刘宇.通阳活血方对受损兔窦房结细胞起搏电流电生理及信号转导机制研究[D].北京:中国中医研究院,2014:1-108.
[10]刘燕青.HCN4在微波辐射致大鼠窦房结损伤中的作用研究[M].中国人民解放军军事医学科学院,2013,1-110.
[11]Liu RX,Wang YL.Comparative study between original and traditional method in establishing a chronic sinus node damage model in rabbit[J].Journal of Applied Physiology,2012,113(10):1802-1808.
[12]Geng N,Jiang N,Peng C,et al.Sodium hydroxide pinpoint pressing permeation method for the animal modeling of sick sinus syndrome.[J].International Heart Journal,2015,56(4):1-5.
[13]Feng XY,Ling TK.Influence of racemic higenamine on the sinus node.[J].Experimental and Therapeutic Medcine,2013,5(2):591-595.
[14]唐海沁,朱怀玺.窦房结电图在射频消融术中实验研究[J].临床中老年保健,2001,4(2):103-105.
[15]许原.食管心脏电生理检测窦房结功能[J].心电图杂志,2014,3(2):108-111.
[16]Narula OS,Shantha N,Vasquez M,et al.A new method for measurement of sinoatrial conduction time[J].Circulation Research,1978,58:705-714.
[17]Cramer M,Siegal M,Bigger JT,et al.Characteristics of extracellular potentials recorded from the sinoatrial pacemaker of the rabbit[J].Circulation Research,1974,35:935-947.
[18]Hugh C,Miller,Harold C,et al.Measurement of sinoatrial conduction time by premature atrial stimulation in the rabbit[J].Circulation Research,1977,41:292-300.
Establishment of formaldehyde-induced sinoatrial node damage model in rabbits
LIU Xue-wu1,2,WANG Xiao-qing1,2,ZHAO Chen2,ZHANG Dan2,LI Xiao-hui1,JIANG De-jian1,2
(1.School of Pharmaceutical Sciences,Central South University,Changsha 430013;2.Hunan Provincial Research Center for Safety Evaluation of Drugs,Changsha 410331)
ObjectiveTo establish formaldehyde-induced sinoatrial node damage model in rabbit.Methods40%formaldehyde were used to damage the sinoatrial node area of rabbits.The parameters including heart rate,sinoatrial conduction time,sinus node recovery time,and the corrected sinus node recovery time were measured after formaldehydeindeced damage.The diferences of the methods,degrees and duration of formaldehyde-indeced damage were compared,and the reabilities of models were confirmed by positive control drug in the experiments.Results(1)Damage method:In formaldehyde wet compressing method,the damage degree can be controled by regulating the compressing timing and area.Comparing to the former,the less injuries was caused and the damage degree could be controlled by regulating the drip speed of formaldehyde in the formaldehyde drip method;but it tends to injure the surrounding tissue of the sinus node.(2)Damage degree and mantainance of the model:the damages only maintained less than 7 days,when the percentage of heart rate decreased less than 30%of basic heart rate,and its lasted more than 70 days,when the percentage of heart rate decreased to 30%~60%of basic heart rate,but the heart rate decreased more than 60%of basic heart rate would lead tohigher death rate.(3)Verification of positive drugs:both atropine and xinbao pill could increase the heart rates of sinoatrial node damage model,and improve the sinus function.ConclusionsFormaldehyde wet compressing method has more reabilites than formaldehyde drip method,and the percentage decreased in heart rate of damage degree should be controlled between 30%to 60%of basic heart rate,so that the duration of models are longer,and the death rates are lower.
Rabbit;Formaldehyde;Sinoatrial node damage model
R-332
A
1671-7856(2015)11-0021-07
10.3969.j.issn.1671-7856.2015.11.006
湖湘青年科技创新人才基金(2014)。
刘学武(1988-),男,在读硕士,研究方向为心血管药理学。E-mail:liuxuewu@hnse.org。
姜德建(1979-),男,博士,研究员,研究方向新药药理学和毒理学。E-mail:jiangdejian@hnse.org。
﹞2015-09-14

