茜素黄R与溶菌酶作用方式的光谱法研究
马越,欧亮龙,王兴明
(1.洛阳轴研科技股份有限公司,河南 洛阳,471039; 2.洛阳轴承研究所有限公司,河南 洛阳 471039;3.西南科技大学 材料科学与工程学院化学系,四川 绵阳 621010)
茜素黄R与溶菌酶作用方式的光谱法研究
马越1,欧亮龙2,王兴明3
(1.洛阳轴研科技股份有限公司,河南 洛阳,471039; 2.洛阳轴承研究所有限公司,河南 洛阳 471039;3.西南科技大学 材料科学与工程学院化学系,四川 绵阳 621010)
在接近生理条件下,采用UV-Vis光谱、荧光光谱、热力学等方法研究了有机小分子茜素黄R(AYR)与溶菌酶(Lys)的作用机理.研究表明,AYR与Lys作用摩尔比为AYR∶Lys=5∶1,摩尔吸光系数εAL=3.87×105L·mol-1·cm-1,说明AYR对Lys具有荧光猝灭特性,作用模式为静态猝灭,通过热力学实验可知,两者之间的作用方式主要是疏水作用和范德华力作用.
茜素黄R; 溶菌酶; 作用机制
茜素黄 R 是一种茜草类有机小分子植物染料,研究发现这种小分子可作为生物探针来探究蛋白质的结构也可以通过研究两者之间的相互作用来深入了解蛋白质的生物功能[1].研究茜素黄R与溶菌酶蛋白质之间的相互作用方式,在新型抗癌药物的选择、抗癌功能的缓释改良以及抗病毒作用机理等方面有重要应用和理论意义.
1 实验部分
1.1 仪器与试剂
溶菌酶(Lysozy me), 分析纯, 上海伯奥生物科技有限公司; 茜素黄R (Alizarin Yellow R), 分析纯, 成都科龙化工试剂厂; Tris生物缓冲溶液,自制; UV-2102-PCS型紫外可见分光光度计, 上海尤尼科有限公司; FL-4500型荧光光谱仪, 日本日立公; pHS-2C型酸度计, 成都方舟科技开发公司.
1.2 实验方法
当小分子与蛋白质发生相互作用时,紫外吸收光谱会发生一定的变化,这是由于蛋白质的构象发生了变化[2].本实验以光谱法获得AYR与Lys作用的摩尔比,AYR-Lys复合物的摩尔吸光系数,结合过程的热力学性质变化等参数,并对AYR与Lys间的作用机制进行了研究.
2 结果与讨论
2.1 紫外光谱法研究茜素黄R与溶菌酶的摩尔比
本文利用紫外光谱的摩尔比法,具体操作为:固定茜素黄R溶液的浓度,然后逐渐加入溶菌酶(Lys)溶液,扫描AYR-Lys体系的紫外可见光谱图,如图1所示.由图1可知,随着溶菌酶(Lys)溶液的加入,在206 nm左右处,茜素黄R(AYR)的吸收光谱的吸光度出现了规律性的增加并且可以看出存在有一定程度的红移,而在280 nm左右处的比较弱的一个紫外吸收峰同样也出现了吸光度增强的现象.这种现象的原因是由于Lys与AYR之间发生了相互作用[3-5],对206 nm处的的吸光度作摩尔比图1,得出nAYR∶nLys=5∶1.根据Beer定律A=εALbcAL其中εAL是AYR-Lys的摩尔吸光系数,cAL是AYR-Lys的浓度.由图1计算得到εAL=3.87×105L·mol-1·cm-1.

λ/(nm)
图1AYR对Lys紫外吸收光谱的影响
Fig.1InfluenceofLysonUV-VisabsorptionspectraofAYR(pH7.40)cAYR= 6.40×10-6mol/L;cLys= 4.80×10-5mol/Lλ/(nm)
图2AYR对Lys荧光光谱的影响
Fig.2TheFlourescencespectracurveofAYRtoLys(pH7.40)cLys= 1.00×10-5mol/L;cAYR= 1.50×10-3mol/L
2.2 AYR和Lys的荧光猝灭机理及其猝灭常数
通过AYR加入到Lys溶液的荧光光谱图2可知AYR能够对Lys产生荧光猝灭,进一步说明两者能够发生作用.利用温度对反应平衡的影响,通过荧光发射强度与组份浓度的关系,作不同温度下F0/F~cAYR的变化图,根据Stern-Volmer方程[6](1).
F0/F=1+KSV[R]=1+Kq×τ0×[R]
(1)
其中F0代表Lys与AYR体系里没有猝灭剂AYR时体系的荧光值,F是每加入一次猝灭剂AYR时的荧光值.[R]为加入体系里AYR的现时浓度.KSV即动态猝灭常数,它表示蛋白质分子与AYR分子相互扩散与相互碰撞的过程达到平衡时的量与效的关系.Kq即动态荧光猝灭速率,在此阐述的是Lys和AYR的扩散与碰撞对蛋白质的荧光时间衰减的速率影响.τ0是没有猝灭剂存在的时候,体系荧光分子的平均寿命,本文中荧光分子的平均寿命取值为10-8s[7].静态猝灭常数KLB则可以用Lineweaver-Burk[8]双倒数公式(2)来表示,这其中F、F0、R与之前所描述的相同,只是在这里进行了倒数处理.
(2)
当温度变化时(285.65K及310.15K)按照光度滴定法向Lys中逐渐加入AYR测量其荧光变化,数据通过公式(1)与(2)分别绘制Stern-Volmer和Lineweaver-Burk曲线图3和4线性相关拟合后得到直线方程、相关系数等见表1.
根据图3和图4,再结合表1,计算得到室温下KSV=1.6599×104L·mol-1,又因为KSV=Kq·τ0,而且荧光物质的τ0=10-8s,所以计算得到Kq=1.6599×1012L·mol-1·s-1.一般情况下,各种的荧光猝灭剂的最大扩散猝所产生的灭常数等于2×1010L·mol-1·s-1[7],通过比较可以看出AYR对Lys的荧光猝灭常数远大于扩散所产生的Kq值,因此可以得出结论,即AYR对Lys的荧光猝灭是以形成AYR-Lys复合产物的方式进行的,即静态荧光猝灭.

图3AYR与Lys作用的Stern-Volmer曲线(477nm)
Fig.3TheStern-VolmerplotsofAYRvsLys(477nm)cLys= 1.00×10-5mol/L;cAYR= 1.50×10-3mol/L
图4 AYR与Lys作用的双倒数曲线(477 nm)
Fig.4 The Double reciprocal plots of AYR vs Lys (477 nm)cLys= 1.00×10-5mol/L;cAYR= 1.50×10-3mol/L
表1 AYR与Lys相互作用的线性方程和相关系数

Table 1 Regression equations and interrelated coefficients of the AYR vs Lys
根据Lineweaver-Burk曲线得出的方程,可以计算得到AYR对Lys的荧光猝灭常数KLB=1.09×104L·mol-1.
2.3 AYR与Lys的结合常数和相互作用的热力学函数
Ross[9]等人通过对大量的实验结果进行统计,总结出了判断生物大分子与一些有机小分子结合时的作用力类型和生物大分子自身作用力类型的热力学规律,由图4中直线的斜率和截距计算得到285.65K和310.15K时AYR与Lys的结合常数,KLB, 285.65K=1.09×104L·mol-1和KLB, 310.15K=9.71×103L·mol-1,由于温度变化范围不大,而且焓变对温度变化所造成的误差很小,可以忽略不计,所以本章实验中做了近似处理,认为反应的ΔrHm是一个固定的值,所以可以根据热力学公式(3)-(5)计算表观焓变ΔrHm,表观熵变ΔrSm和表观吉布斯自由能ΔrGm.结果见表2
(3)
(4)
(5)
表2AYR和Lys结合常数和热力学参数

Table 2 The binding constants and the thermodynamic parameters of AYR and Lys
从表2可以看出,AYR与Lys在相互作用时,吉布斯自由能和焓变都为负值,说明作用过程是一个放热的自发进行的过程,又由于熵值是正的,这是由于疏水作用,所以AYR与Lys的作用方式是疏水作用.
2.4AYR与Lys-CBBG-250体系的相互作用
CBBG-250(G-250)即考马斯亮蓝,它是一种碱性条件下呈蓝色的染料,分子中包含有磺酸基,被用作测定蛋白质的含量,其功能在于,能和蛋白质通过范德华力相互结合形成一种蓝色的复合物[10].
这种复合物的颜色深浅与蛋白质的含量成定量的关系.当在Lys-CBBG-250体系中加入AYR,AYR就会在和蛋白质发生作用时与CBBG-250发生竞争.从这种竞争可以了解到AYR与Lys的相互作用方式.
具体实验方法是,固定Lys-CBBG-250的摩尔比,然后向含不同量CBBG-250的Lys中加入AYR,扫描荧光光谱,结果如图5.

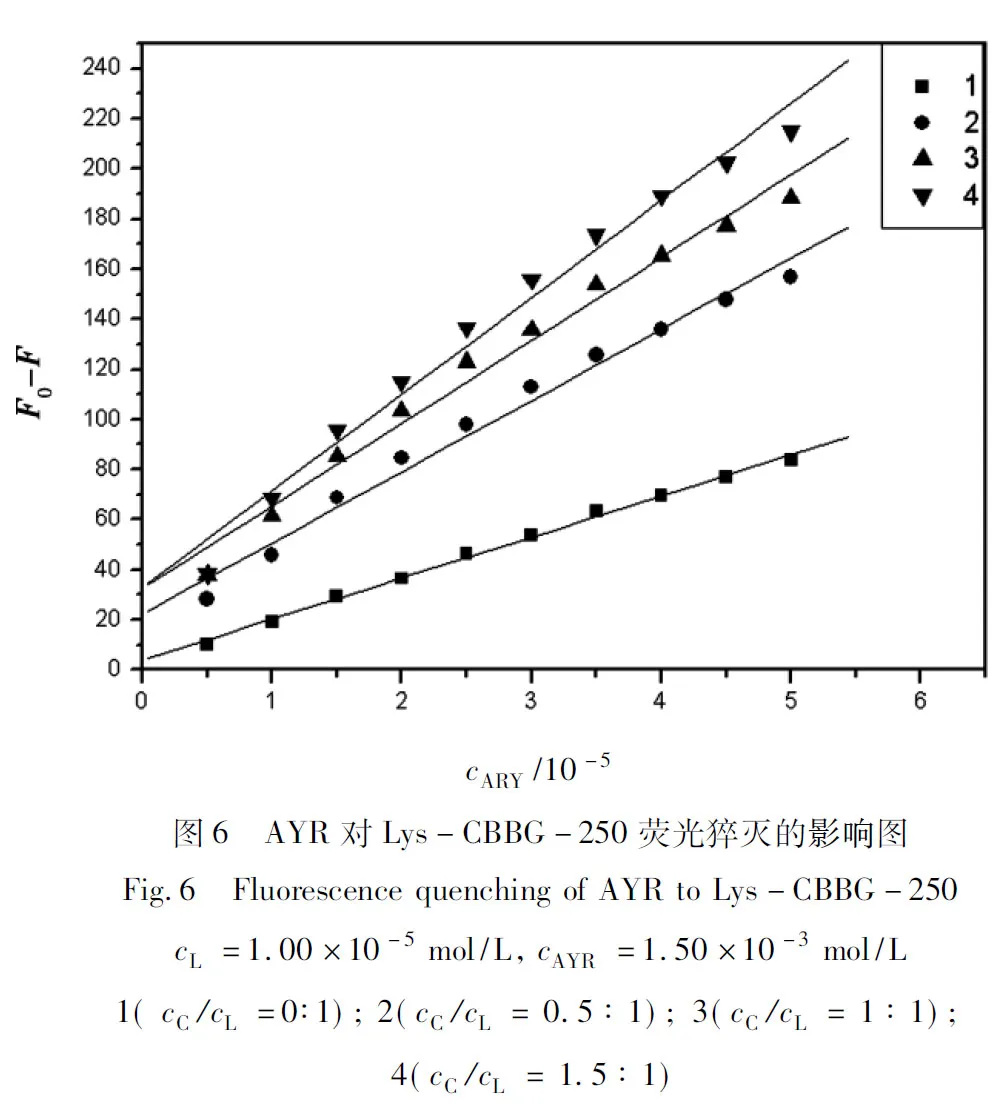
对图中数据进行线性回归结果见图6,线性方程和相关系数见表3从数据可以看出AYR对Lys-CBBG-250体系具有荧光猝灭作用,这可能是由于AYR与CBBG-250发生竞争,将CBBG-250替换出来,形成荧光强度更低的AYR-Lys复合物,从而导致荧光强度降低的现象,说明AYR与Lys之间存在范德华力.
表3AYR与Lys-CBBG-250相互作用的线性方程和相关系数
Table3RegressionequationsandinterrelatedcoefficientsoftheAYRandLys-CBBG-250
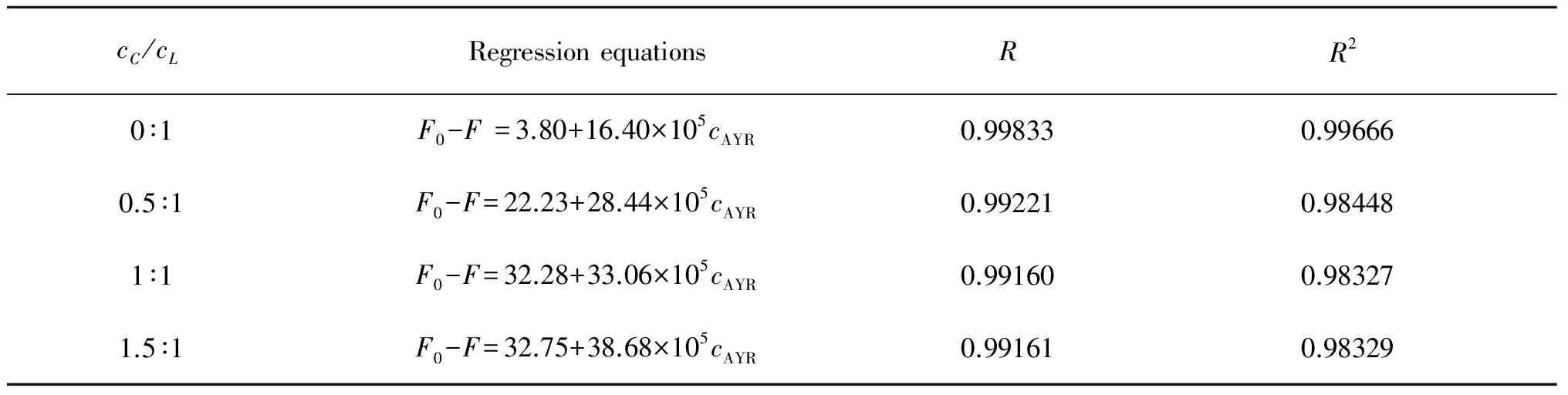
cC/cLRegressionequationsRR20∶1F0-F=3.80+16.40×105cAYR0.998330.996660.5∶1F0-F=22.23+28.44×105cAYR0.992210.984481∶1F0-F=32.28+33.06×105cAYR0.991600.983271.5∶1F0-F=32.75+38.68×105cAYR0.991610.98329
3 结 论

[1]胡亚敏, 蒋琪英, 张欢, 等.碱性介质中茜素黄R与牛血清蛋白相互作用研究[J].西南科技大学学报, 2007, 22(3):14-19.
[2]陶慰孙, 李惟, 姜涌明.蛋白质分子基础(第2版)[M].北京:高等教育出版社, 1995.
[3]Hu YJ, Liu Y, Wang JB, Xiao XH, et al.Study of the interaction between monoammonium glycyrrhizinate and bovine 5erunl albumin[J].Journal ofPharmaceutical and Biomedical Analysis, 2004, 36:915-919.
[4]刘嫒, 谢孟峡, 康娟.三七总皂甙对牛血清白蛋白溶液构象的影响[J].化学学报, 2003, 61:1305-1310
[5]He WY, Xue CX, Fu ZD, et al.Effect of chineses medicine alpinetin on the structure of human serum albumin[J].Bioorganic&Medicinal Chemistry, 2005, 13:1837-1845.
[6]Lakowicz JR.Principles of Fluorescence Spectroscopy [M].2ed.New York:Kluwer Academic Publishers/Plenum Press, 1999.
[7]张欢, 王兴明, 王清成, 等.碱性介质中茜素黄R与牛血清白蛋白作用的荧光法研究[J].光谱学与光谱分析, 2006, 26(8):1508-1512.
[8]He LL, Wang X, Liu B, et al.Interaction Between Ranitidine Hydrochloride and Bovine Serum Albumin in Aqueous Solution[J].J.Solution.Chem., 2010, 39:654- 664.
[9]Ross DP, Subramanian S.Thermodynamics of Protein Association Reactions:Forces Contributing to Stability[J].Biochemistry, 1981, 20 (11):3096—3099.
[10] 周先碗, 胡晓倩.生物化学仪器分析与实验技术[M].北京:化学工业出版社, 2002:24.
[责任编辑:徐明忠]
Study on the interaction between alizarin yellow R and lysozyme by spectrometry
MA Yue1,OU Lianglong2,WANG Xingming3
(1.Luoyang Bearing Science&Technology Co.,Ltd., Luoyang 471039, China;2.Luoyang Bearing Research Institute, Luoyang 471039, China; 3.Department of Chemistry, School of Materials Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China)
The mechanism of interaction between alizarin yellow R and lysozyme has been investigated by UV spectroscopy, fluorescence spectroscopy, thermodynamics, etc.The results indicate that the molar ratio of AYR and Lys is 5∶1, the molar absorption coefficient is εAL=3.87×105L·mol-1·cm-1.The action type of AYR and Lys is static quenching.The thermodynamic experiment shows that the main effect of is hydrophobic effect and van der Waals force.
alizarin yellow R; lysozyme; mechanism
2015-05-30
马越 (1988-),女,安徽合肥人,洛阳轴研科技股份有限公司助理工程师,硕士,主要从事分析化学的研究.
O
A
1672-3600(2015)12-0041-05

