茯砖茶中氯氰菊酯降解“金花菌”的降解特性及途径*
邓维琴,李金永,刘书亮,姚开,李建龙,胡凯弟,张梦梅,周康,韩新锋
1(四川农业大学食品学院四川 雅安,625014)2(四川大学轻纺与食品学院,四川 成都,610065)
氯氰菊酯(cypermethrin,CY)等拟除虫菊酯类农药是农业中使用较广的杀虫剂,在控制危害棉花、水果、蔬菜等的害虫方面发挥着至关重要的作用,已成为一种主要的杀虫剂,逐渐替代了对人体毒害较大的有机磷等杀虫剂[1]。尽管拟除虫菊酯类农药被认为是一类较为安全的杀虫剂,但是近年来拟除虫菊酯类农药的残留引起了越来越多的环境问题和人类的健康问题[2-3]。已有研究显示,拟除虫菊酯类农药可能造成神经毒性[4]、生殖毒性[5-7]、内分泌干扰毒性[8]、免疫毒性[9]或基因毒性[10]等。另外,拟除虫菊酯已被研究认为是一种致癌物质[11]。因此,减少或消除环境和农产品中拟除虫菊酯农药残留已成为目前的研究热点。
生物降解是一种安全有效的方法[12-13]。目前筛选出能有效降解氯氰菊酯的菌株主要有金色链霉菌(Streptomycesaureus)[14-15]、微 球 菌 (Micrococcus sp.)[13]、地衣芽孢杆菌(Bacillus licheniformis)[16]、黑曲霉(Aspergillus niger)[17]、蜡状芽孢杆菌(Bacillus cereus)[18]等,这些菌株大多来源于农药厂污水或被污染的土壤,相关研究大多为菌株的筛选及降解氯氰菊酯的特性方面。针对菌株降解氯氰菊酯途径的研究较少,许育新等[19]研究发现CY的降解产物3-苯氧基苯甲酸(3-phenoxybenzoic acid,3-PBA)和 DCVA;CHEN等[14]通过气相-质谱联用仪(GC-MS)分析得出3-PBA和3-苯氧基苯甲醛是CY降解的中间产物;仅Tallur等[13]通过薄层层析法、红外光谱及质谱鉴定了微球菌Micrococcus sp.CPN1降解CY的中间代谢产物,并检测了各反应所需的酶活性,推测了该菌株降解CY的途径,即通过水解羧酸酯键将氯氰菊酯分解为DCVA和氰基-3-苯氧基苯甲醇,氰基-3-苯氧基苯甲醇进一步转化为3-PBA,3-PBA二苯醚键断裂后分解为原儿茶酸和苯酚。
目前关于有益真菌降解CY的研究尚鲜见报道,仅见王志龙[17]报道了源于砖茶的黑曲霉YAT可有效降解CY。本研究将课题组从茯砖茶中筛选的1株可有效降解 3-PBA 的“金花菌”[20]——冠突散囊菌(Eurotium cristatum)ET1[21]作用于 CY,发现其对 CY也具有较强的降解能力。因此,本文研究了菌株ET1对CY的降解特性及途径,为降低或消除环境和农产品中残留CY提供了良好菌源和理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
冠突散囊菌(Eurotium cristatum)ET1,四川农业大学食品微生物室保藏。
1.1.2 培养基
马铃薯葡萄糖培养基(PD)、基础盐培养基(MM)[17];PDA:PD培养基中加入2%的琼脂;含CY的PD培养基(PD-CY):在PD中加入0.2%的Tween 80,121℃灭菌15 min后在无菌条件下加入CY至所需浓度。
1.1.3 试剂
氯氰菊酯标准品(99.7%,国家标准物质中心);3-苯氧基苯甲酸(98%,美国Sigma公司);3-苯氧基苯甲醛(97%,美国Sigma公司);苯酚(99%,国家标准物质中心);检测用乙腈(色谱纯99.99%,德国CNW Technologies GmbH);提取用乙腈(分析纯,上海星可生化有限公司)。
1.1.4 主要仪器
LC-10A2010C HT型液相色谱仪(包括可变波长紫外检测器(UV)LC-solution1.1色谱工作站),日本岛津公司;GC-MS(Agilent-7890A-5975C),美国 Agilent公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 冠突散囊菌ET1生长及降解曲线的测定
在无菌条件下将筛选的冠突散囊菌ET1划线于PDA斜面,30℃培养84 h,无菌生理盐水洗下菌苔混匀制成种子液(孢子浓度约为8.0×108CFU/mL)。
将冠突散囊菌ET1种子液按5%体积比的接种量分别接种于PD和PD-CY液体培养基(CY质量浓度50 mg/L)中,分装30 mL/瓶,以接种等量的无菌生理盐水作空白对照,于30℃、180 r/min振荡培养,分别在 0、1、2、3、4、5、6、7、8 d 取整瓶培养液,测定冠突散囊菌ET1生物量及CY残留质量浓度,供试菌生物量(g/L)以干重计,即将培养液过滤后取菌丝体于80℃干燥至恒质量,记录质量。
CY的提取与测定方法如下:
培养后取整瓶培养液,加入等体积乙腈,超声(40 kHz、300 W,30 min)辅助提取培养液中 CY,取2.0 mL提取液用乙腈定容至10 mL,混匀,12 000 r/min离心10 min,上清液用0.45 μm有机相滤膜过滤,弃去初滤液,HPLC检测续滤液中CY残留质量浓度[22-23]。
色谱条件:色谱柱为Sepax GP-C18柱(150 mm×4.60 mm,5.0 μm);流动相为乙腈和超纯水(83∶17,V/V);检测波长210 nm;柱温25℃;流速1.0 mL/

式中:c0,空白对照中CY总质量浓度,mg/L;c,样品培养液中CY残留质量浓度,mg/L。
1.2.2 冠突散囊菌ET1对CY降解动力学特性的分析
1.2.2.1 底物浓度对冠突散囊菌ET1降解CY速率的影响
将菌株ET1种子液按体积比5%接种量接种至初始CY质量浓度分别为20、50、100 mg/L的PD培养基中(pH 6.0),30℃,180 r/min振荡培养,分别在0、1、2、3、4、5、6、7、8 d 取样测定 CY 的残留质量浓度,以一级动力学方程拟合实验数据。
1.2.2.2 温度对冠突散囊菌ET1降解CY速率的影响
将菌株ET1种子液按体积分数5%接种量接种至初始CY质量浓度为50 mg/L的PD培养基中(pH 6.0),分别在 25、30、35 ℃,180 r/min 振荡培养,分别在 0、1、2、3、4、5、6、7、8 d 取样测定 CY 的残留质量浓度,以一级动力学方程拟合实验数据。
1.2.2.3 初始pH对冠突散囊菌ET1降解CY速率的影响
将菌株ET1种子液按体积分数5%接种量接种至初始CY质量浓度为50 mg/L的pH值分别为5.0、6.0、7.0的PD培养基中,30℃,180 r/min振荡培养,分别在 0、1、2、3、4、5、6、7、8 d 取样测定 CY 的残留质量浓度,以一级动力学方程拟合实验数据。
1.3 冠突散囊菌ET1降解CY途径分析
1.3.1 GC-MS法分析冠突散囊菌ET1降解CY的中间产物
将冠突散囊菌ET1种子液按体积分数5%接种量分别接种至30 mL PD-CY(50 mg/L)中,30℃、180 r/min 振荡培养,分别于 0、1、2、3、4、5、6、7、8 d 取整瓶培养液,加入等体积乙腈,超声(40 kHz、300 W,30 min)辅助提取培养液中 CY,12 000 r/min离心10 min,收集上清液,混合各时间点样品,用旋转蒸发器浓缩至干,适量乙腈(HPLC)重溶后,加入适量无水Na2SO4除水24 h,12 000 r/min离心10 min,上清液用0.45 μm有机相滤膜过滤,弃去初滤液,取续滤液供GC-MS分析检测。
GC-MS检测条件:色谱柱HP-5MS(30 m×0.25 mm,0.25 μm),载气为氦气,GC 柱箱温度为 90.0℃,进样口温度为250.0℃,进样量为1 μL,压力为min;进样量 10 μL。107.4 kPa,总流量为 6.0 mL/min,柱流量为 1.50 mL/min,线速度为45.3 cm/s,吹扫流量为3.0 mL/min,分流比为1.0。
1.3.2 冠突散囊菌ET1对模式底物的利用情况
分别将3-苯氧基苯甲醛、3-PBA和苯酚添加到MM和PD中,使其质量浓度分别为50 mg/L。将菌株ET1种子液以5.0%接种量分别接种于MM-模式底物和PD-模式底物培养基中,并以接种等量的无菌生理盐水作空白对照。30℃、180 r/min振荡培养5 d,HPLC法检测各培养液中模式底物的降解情况。
模式底物HPLC检测色谱条件[22]:色谱柱Sepax GP-C18柱(150 mm × 4.60 mm,5.0 μm);流动相 A:pH 2.5的磷酸水溶液,B:乙腈。梯度洗脱:0~10 min,45% ~ 85%B(V/V);10 ~ 18 min,85%B(V/V);柱温25℃,流速1.0 mL/min,检测波长为210 nm,进样量为10 μL。
2 结果与分析
2.1 冠突散囊菌ET1的生长曲线及对CY的降解曲线
比较菌株ET1在PD和PD-CY中的生长情况(图1),ET1在PD-CY与PD中的生长趋势大致相同,最终细胞干重相差较小(4.50 g/L左右),表明CY对菌株ET1的生长影响较小。

图1 冠突散囊菌ET1的生长曲线及对CY的降解曲线Fig.1 The growth curve and biodegradation curve to CY of E.cristatum ET1
图1显示了冠突散囊菌ET1在PD-CY中对CY的降解情况,ET1从第1天开始对CY有降解,在2~6 d CY降解速率增长相对较快,6天后降解率变化较小,培养8天对CY的降解率为57.93%。与其生长曲线作对比看出,ET1对CY降解与其生长情况是同步的。
2.2 冠突散囊菌ET1降解CY的动力学特性
2.2.1 底物浓度对冠突散囊菌ET1降解CY速率的影响
不同CY质量浓度下冠突散囊菌ET1对CY降解速率的影响见表1,不同底物质量浓度下菌株ET1对CY降解符合一级反应动力学方程。底物浓度在20~100 mg/L CY半衰期变化相对较大。
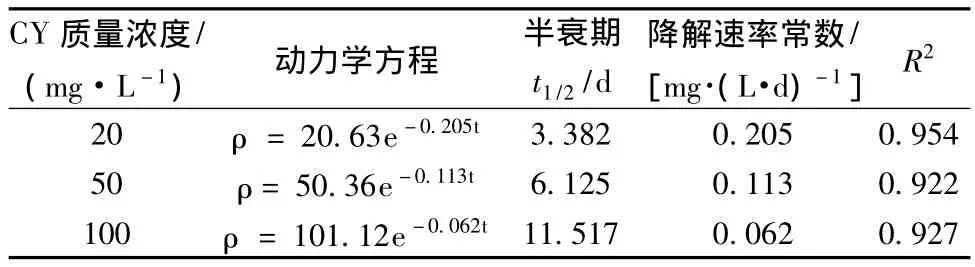
表1 不同底物浓度下冠突散囊菌ET1降解CY的动力学方程Table 1 Kinetics equations for CY degradation at different CY concentrations by E.cristatum ET1
2.2.2 温度对冠突散囊菌ET1降解CY速率的影响
温度对冠突散囊菌ET1 CY降解的影响见表2,不同温度条件下菌株ET1对CY降解符合一级反应动力学方程。在25~35℃,CY半衰期变化不大,25℃条件下ET1降解CY的半衰期略短。

表2 不同温度条件下冠突散囊菌ET1对CY的降解动力学方程Table 2 Kinetics equation of degradation of CY at different temperatures by E.cristatum ET1
2.2.3 初始pH对冠突散囊菌ET1降解CY速率的影响
初始pH对冠突散囊菌ET1降解CY的影响见表3,不同初始pH条件下菌株ET1对CY降解符合一级反应动力学方程,初始pH为6.0时,ET1降解CY的半衰期最短。

表3 不同pH条件下冠突散囊菌ET1对CY的降解动力学方程Table 3 Kinetics equation of degradation of CY at different pH by E.cristatum ET1
在测试的CY质量浓度、温度、pH值范围内,CY半衰期为3.382~11.517 d,受底物浓度影响较大,CY质量浓度在20~100 mg/L范围内,CY半衰期变化较大,随着CY质量浓度的增加,其半衰期相应地延长,温度和pH对CY半衰期的影响相对较小。
2.3 冠突散囊菌ET1降解CY途径
2.3.1 冠突散囊菌ET1降解CY的中间产物
将ET1经PD-CY培养获得的不同时间点的混合样品进行GC-MS检测,结果如图2所示。

图2 冠突散囊菌ET1的PD-CY培养体系各时间点混合样品中CY代谢产物的质谱图Fig.2 GC-MS spectras of metabolites from mixed samples taken from PD-CY cultures for E.cristatum ET1 at different time
结果表明,GC-MS检测到中间产物3-苯氧基苯甲醛和苯酚。3-PBA是大多数拟除虫菊酯类农药的主要降解中间产物之一[14,24],可能是样品在检测过程中,由于高温或电离等原因3-PBA被加氢转化为3-苯氧基苯甲醛[25],所以GC-MS测定时未检测到3-PBA。所以判定ET1降解CY的中间产物有3-PBA、3-苯氧基苯甲醛、苯酚。
2.3.2 冠突散囊菌ET1对模式底物的利用情况
冠突散囊菌ET1对3-苯氧基苯甲醛、3-PBA和苯酚等模式底物的利用结果见表4。由表4可知,菌株ET1在MM中不能生长,对各模式底物不能降解;而在PD中,ET1对各模式底物都有降解能力,表明菌株ET1不能直接利用各中间产物作为碳源生长,需要外加碳源才能对其进行降解。

表4 冠突散囊菌ET1对模式底物的降解情况Table 4 Utilization of model substrates by E.cristatum ET1
2.3.3 冠突散囊菌ET1降解CY途径分析
根据Tallur等[13]对氯氰菊酯及其中间产物3-PBA降解途径的研究结果,结合本文对冠突散囊菌ET1降解CY产物的GC-MS检测结果,以及其对模式底物利用情况的分析结果,推测菌株ET1对CY的降解途径可能见图3。

图3 冠突散囊菌ET1降解CY的可能途径Figure.3 Proposed pathway for the biodegradation of CY by E.cristatum ET1
CY在冠突散囊菌ET1酯酶的作用下,CY分子中间酯键断裂生成DCVA和α-氰基-3-苯氧基苄醇,α-氰基-3-苯氧基苄醇极不稳定,自发通过反应生成3-苯氧基苯甲醛,在脱氢酶的作用下,3-苯氧基苯甲醛转化为3-PBA,3-PBA的醚键断裂产生苯酚,苯酚可被菌株ET1利用降解。
目前关于微生物降解3-PBA的途径已有部分研究,Tallur等[13]从3-PBA的降解产物检测到苯酚,认为3-PBA二苯醚键断裂直接分解生成苯酚和原儿茶酸,原儿茶酸和苯酚进一步降解,原儿茶酸苯环断裂生成直链烯酸。Chen等[26]研究发现,3-PBA在加氧酶的作用下可以转化为3-(2-羟基苯氧基)苯甲酸,进一步转化为原儿茶酸、苯酚和3,4-二甲氧基苯酚;Tang等[27]通过研究证明,3-PBA在鞘氨醇单胞菌SC-1的作用下通过加羟脱羧反应转化为羟基二苯醚,其醚键断裂生成苯酚和邻苯二酚。因此,3-PBA在冠突散囊菌ET1的作用下醚键断裂分解为苯酚和何种物质以及苯酚的进一步降解途径还需要进一步研究。
3 讨论与结论
目前关于微生物修复食品中拟除虫菊酯及其中间产物3-PBA的研究尚为鲜见。从食品原料中筛选安全无毒的降解菌株,揭示菌株的降解途径和降解机理,判断菌株对农药的降解是否完全、降解产物是否无毒,对食品中拟除虫菊酯类农药的降解及消除具有重要意义。
来源于茯砖茶的“金花菌”——冠突散囊菌(Eurotium cristatum)ET1在测试条件下菌株ET1可有效降解20~100 mg/L质量浓度范围内的CY,8 d对50 mg/L CY降解率达到57.93% ,且在25℃、pH 6.0的条件下,ET1降解50 mg/L CY的半衰期最短,为6.104 d。研究证明3-PBA、3-苯氧基苯甲醛和苯酚是菌株ET1降解CY的中间产物,菌株ET1在PD中,对各产物都有降解能力。本文初步推导了菌株ET1降解CY为3-PBA,再进一步降解得到苯酚,苯酚可被利用的降解途径。本文研究结果为菌株ET1对被氯氰菊酯及其中间产物3-PBA污染的环境(土壤、水体等)或者农产品的修复以及其相关降解途径的研究提供了数据参考。
[1] Katsuda Y.Development of and future prospects for pyrethroid chemistry[J].Pesticide Science,1999,55(8):775-782.
[2] Cuthbertson A G S,Murchie A K.Ecological benefits of Anystis baccarum in an orchard ecosystem and the need for its conservation[J].International Journal of Environmental Science & Technology,2010,7(4):807 -813.
[3] Cuthbertson A G S,Blackburn L F,Northing P,et al.Chemical compatibility testing of the entomopathogenic fungus Lecanicillium muscarium to control Bemisia tabaci in glasshouse environment[J].International Journal of Environmental Science & Technology,2010,7(2):405 -409.
[4] Shafer T J,Meyer D A,Crofton K M.Developmental neurotoxicity of pyrethroid insecticides:critical review and future research needs[J].Environmental Health Perspectives,2005,113(2):123 -136.
[5] YUAN C,WANG C,GAO S,et al.Effects of permethrin,cypermethrin and 3-phenoxybenzoic acid on rat sperm motility in vitro evaluated with computer-assisted sperm analysis[J].Toxicology in Vitro,2010,24(2):382 -386.
[6] JI G,XIA Y,GU A,et al.Effects of non-occupational environmental exposure to pyrethroids on semen quality and sperm DNA integrity in Chinese men[J].Reproductive Toxicology,2011,31(2):171 -176.
[7] Lavado R,Li J,Rimoldi J M,et al.Evaluation of the stereoselective biotransformation of permethrin in human liver microsomes:Contributions of cytochrome P450 monooxygenases to the formation of estrogenic metabolites[J].Toxicology Letters,2014,226(2):192 - 197.
[8] JIN Y,WANG L,RUAN M,et al.Cypermethrin exposure during puberty induces oxidative stress and endocrine disruption in male mice[J].Chemosphere,2011,84(1):124-130.
[9] JIN Y,ZHENG S,FU Z.Embryonic exposure to cypermethrin induces apoptosis and immunotoxicity in zebrafish(Danio rerio)[J].Fish & Shellfish Immunology,2011,30(4):1 049-1 054.
[10] Ansari R A,Rahman S,Kaur M,et al.In vivo cytogenetic and oxidative stress-inducing effects of cypermethrin in freshwater fish,Channa punctata Bloch[J].Ecotoxicology and Environmental Safety,2011,74(1):150 - 156.
[11] Shukla Y,Yadav A,Arora A.Carcinogenic and cocarcinogenic potential of cypermethrin on mouse skin[J].Cancer Letters,2002,182(1):33 -41.
[12] CHEN S,YANG L,HU M,et al.Biodegradation of fenvalerate and 3-phenoxybenzoic acid by a novel Stenotrophomonas sp.strain ZS-S-01 and its use in bioremediation of contaminated soils[J].Applied Microbiology and Biotechnology,2011,90(2):755 - 767.
[13] Tallur P,Megadi V,Ninnekar H.Biodegradation of cypermethrin by Micrococcus sp.strain CPN 1[J].Biodegradation,2008,19(1):77 -82.
[14] CHEN S,GENG P,XIAO Y,et al.Bioremediation of βcypermethrin and 3-phenoxybenzaldehyde contaminated soils using Streptomyces aureus HP-S-01[J].Applied Microbiology and Biotechnology,2012,94(2):505 -515.
[15] Halden R U,Tepp S M,Halden B G,et al.Degradation of 3-phenoxybenzoic acid in soil by Pseudomonas pseudoalcaligenes POB310(pPOB)and two modified Pseudomonas strains[J].Applied and Environmental Microbiology,1999,65(8):3 354 -3 359.
[16] 赖文,刘书亮,赵楠,等.氯氰菊酯高效降解菌的筛选鉴定及其降解特性[J].食品科学,2012,33(21):157-163.
[17] 王志龙,刘书亮,姚开,等.一株氯氰菊酯降解真菌的筛选鉴定及其降解特性研究[J].环境科学学报,2013,33(6):1561-1569.
[18] 曲杰,王海胜,史延华,等.氯氰菊酯降解菌株L12的分离鉴定及降解特性[J].微生物学报,2011,54(4):510-517.
[19] 许育新,李晓慧,张明星,等.红球菌CDT3降解氯氰菊酯的特性及途径[J].中国环境科学,2005,25(4):399-402.
[20] 丁婷,吕嘉枥.茯砖茶中”金花”菌的研究进展[J].食品工业科技,2012,33(1):419 -420.
[21] 李金永,刘书亮,姚开,等.茯砖茶中降解3-苯氧基苯甲酸的“金花菌”筛选及其降解特性[J].食品与发酵工业,2013,39(10):45 -51.
[22] 赵楠,刘书亮,赖文,等.HPLC-UV法测定微生物降解体系中3-苯氧基苯甲酸含量[J].食品科学,2011,32(14):181-184.
[23] LIU S,YAO K,JIA D,et al.A pretreatment method for HPLC analysis of cypermethrin in microbial degradation systems[J].Journal of Chromatographic Science,2012,50(6):469-476.
[24] McCoy M R,YANG Z,FU X,et al.Monitoring of total type II pyrethroid pesticides in citrus oils and water by converting to a common product 3-phenoxybenzoic acid[J].Journal of Agricultural and Food Chemistry,2012,60(20):5 065-5 070.
[25] 阮丽琴,史良伟.间苯氧基苯甲酸催化加氢合成间苯氧基苯甲醛[J].莆田学院学报,2005,12(2):43-45.
[26] CHEN S,HU W,XIAO Y,et al.Degradation of 3-phenoxybenzoic acid by a Bacillus sp.[J].PloS One,2012,7(11):1-12.
[27] TANG J,YAO K,LIU S,et al.Biodegradation of 3-phenoxybenzoic acid by a novel Sphingomonas sp.SC-1[J].Fresenius Environmental Bulletin,2013,22(5):8 256 -8 262.

