不同胁迫处理方法对西兰花茎中硫苷和异硫氰酸盐含量的影响*
李丽倩,韩勇斌
(南京农业大学食品科学技术学院,江苏南京,210000)
硫代葡萄糖苷(简称硫苷)是一种含硫的次级代谢产物,是一组含硫化合物的总称,广泛存在于十字花科植物中,根据其支链种类的不同,硫苷分为脂肪族、芳香族和吲哚型3大类[1-4]。流行病学研究发现经常食用辣根、日本辣根、芥末、苷蓝、花椰菜和包心菜等十字花科蔬菜能够降低人类患肺癌和肠道癌风险。现代研究发现硫苷本身化学性质稳定,无生物活性,当植物受损伤,细胞遭到破坏,液泡内的硫苷就会与黑芥子酶相遇,发生降解生成异硫氰酸酯(ITCs),具有较强的抗癌活性[5-10]。该降解过程及产物组成受抗坏血酸浓度[9]、温度[11]、酸碱度[12]等多种因素的影响。目前对硫苷降解的研究多见于辣根[13]、西兰花的花[14-15]等植物中,而鲜见对西兰花茎硫苷降解的研究报道。
西兰花(Brasica oleracea L.var.italica Plench)在我国大面积种植,是主要的蔬菜之一,为世界公认的最具营养的蔬菜之一。但在收获季节,大量的西兰花的茎没有得到有效地利用,基于采摘后的新鲜植物材料的细胞仍然有代谢活性,对外界刺激具有一定的反应能力[16],本研究以采摘后的西兰花茎为研究对象,通过构建逆境条件,首次研究机械切分、低温胁迫、抗坏血酸、Zn2+、pH、热激胁迫处理下,西兰花的茎中硫苷的降解和异硫氰酸盐的含量,旨在探索西兰花茎中富集异硫氰酸盐的条件。
1 材料和方法
1.1 材料与试剂
新鲜的西兰花茎:西兰花品种为“优秀”,于2013年11月采摘于江苏省南京市溧水西兰花基地,减震塑料泡沫包装,2 h内运至南京农业大学食品院实验室,选取自花柄部起始向下9 cm为实验所用部分,经自来水冲洗后,除去粗糙的外皮,再用去离子水清洗、晾干后备用。
抗坏血酸、硫酸锌、柠檬酸,上海光华科技有限公司;柠檬酸钠,上海振兴化工厂。均为分析纯。
1.2 仪器与设备
722S型分光光度计,上海精密科学仪器有限公司;DYY-6B稳压稳流电泳仪,北京市六一仪器厂;HHS型电热恒温水浴锅,北京试验仪器厂;DHG-9030A型电热恒温干燥箱,上海恒科技公司;微量进样器,上海医用激光仪器厂;电热吹风,广州雅达科技电子有限公司;冰箱,青岛海尔股份有限公司。
1.3 实验方法
(1)机械切分处理:将西兰花茎纵向切成长(cm)×宽(cm)×厚(cm)为:1.0×0.2×0.5(C1),1.5 ×0.5×0.5(C2),2.0 × 1.0×0.5(C3),3.5×1.0×0.5(C4)大小,以完整未切分茎(C0)为对照,切分后在室温下放置10min。
(2)低温胁迫处理:将清洗、切分成3.5 cm×1.0 cm×0.5 cm(长×宽×厚)后的西兰花茎放于玻璃器皿中用保鲜膜覆盖,放置于4℃冰箱中,与此同时在室温下作对照,每隔2 h取样。
(3)浸泡处理:将清洗、切分3.5 cm×1.0 cm×0.5 cm(长×宽×厚)后的西兰花茎分别浸没于以下溶液中,固液比为1∶20(m∶m),浸泡时,杯口封闭。所有操作在室温(25℃)下进行。
(A)ZnSO4溶液:0、50、100、150、200 μmol/L 浸泡2 h(pH为6.86)。
(B)磷酸-柠檬酸缓冲液:pH 5.0、6.5、7.0、7.5、8.0,浸泡2h;以清水浸泡(pH值7.0)为对照。
(C)抗坏血酸溶液:0、50、100、150、200 μmol/L浸泡2 h(pH为6.86)。
(4)热激处理:将清洗、切分3.5 cm×1.0 cm×0.5 cm(长×宽×厚)后的西兰花茎分别置于25、30、55、85、100℃水浴中,放置 2 h。
经上述处理后的样品,冷冻干燥后研磨,测定各样品中硫苷和异硫氰酸盐的含量。
1.4 测定指标与方法
硫苷含量采用氯化钯法[17]测定,单位为 μmol/100g(以西兰花茎干重质量计),异硫氰酸盐(以干重质量计)采用二氯甲烷法[18]测定,单位为mg/g(以西兰花干重质量计)。
1.5 数据统计与分析
实验设 3次重复,每次 3个平行。采用SPSS16.0软件处理实验数据,进行方差分析和显著性检验(P<0.05)。
2 结果与分析
2.1 机械切分对西兰花茎中硫苷和异硫氰酸盐含量的影响
由图1(A)可知,C1、C2与对照组C0中的硫苷的含量没有显著差异(P>0.05),但C3和C4与C0中的硫苷含量差异显著(P<0.05)。当西兰花茎切分为(cm)为1.0 cm ×0.2 cm×0.5 cm时,茎中硫苷的含量最低,为对照组中硫苷含量的76.34%。
由图1(B)可知,与对照相比,西兰花茎切分尺寸较大时异硫氰酸盐含量变化并不明显,但切分为为1.5 cm×0.5 cm×0.5 cm时,茎中异硫氰酸盐含量变化显著(P<0.05)。当切分尺寸为(cm)为1.0×0.2×0.5时,西兰花茎中异硫氰酸盐的含量为653.74 mg/gDW,是对照组(321.84 mg/gDW)的2.03倍。

图1 机械切分处理对西兰花茎中硫苷(A)和异硫氰酸盐(B)含量的影响Fig.1 Effect of mechanical cut size on glucosinolate(A)and isothiocyanates(B)contents(B)in broccoli stems
2.2 低温胁迫处理对西兰花茎中硫苷和异硫氰酸盐含量的影响
由图2(A)可以看出,在25℃和4℃条件下,随着存放时间的延长,西兰花茎中硫苷的含量均会减少,但是4℃条件下降低速度明显低于常温条件下(P<0.05),这种差异随着低温放置时间的延长而更加明显。在4℃下放置8 h后的西兰花茎中硫苷含量(16.87 μmol/100 gDW)是对照组中硫苷含量(9.46 μmol/199 gDW)的1.7倍。
由图2(B)可知,在常温和4℃的条件下,西兰花茎中异硫氰酸盐的含量变化显著(P<0.05),25℃条件下异硫氰酸盐增加的量明显高于4℃条件下增加的量,但在4℃条件下放置4 h后异硫氰酸盐含量变化不再显著。放置8 h后,25℃条件下西兰花茎异硫氰酸盐的含量(600.54 mg/gDW)是4℃条件异硫氰酸盐下异硫氰酸盐含量(515.54 mg/gDW)的1.16倍。
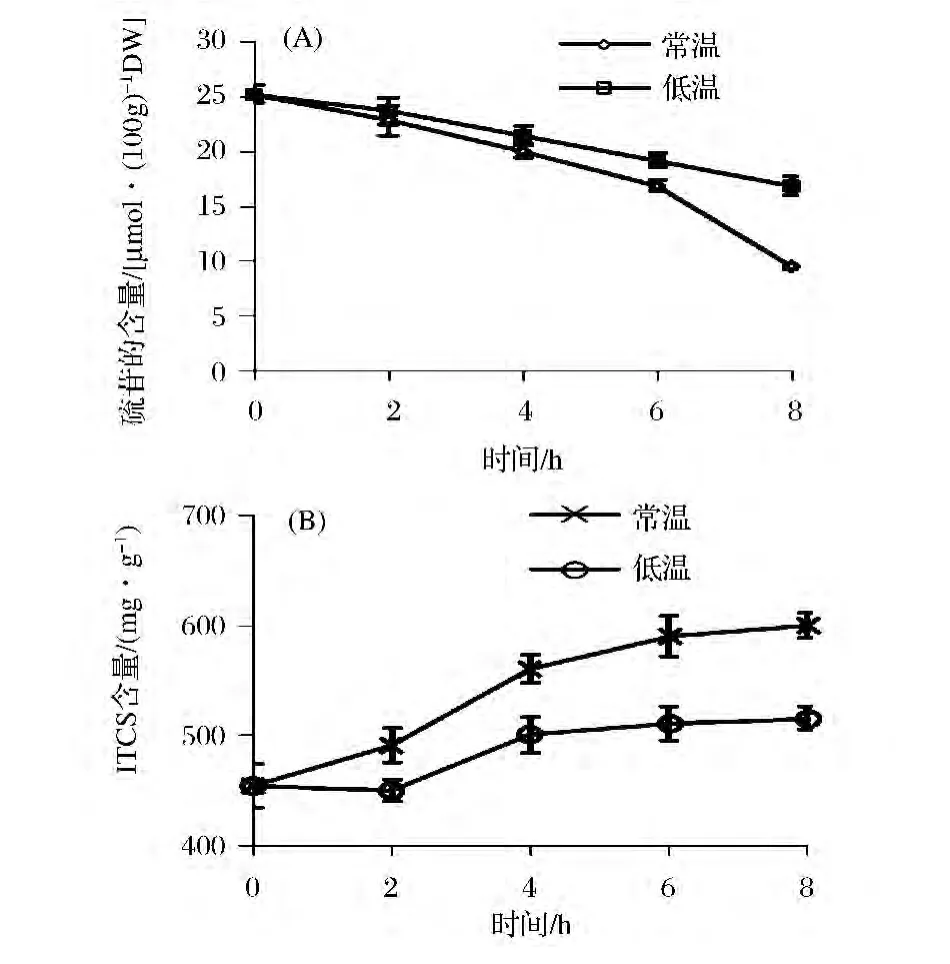
图2 低温胁迫对西兰花茎中硫苷(A)和异硫氰酸盐(B)含量的影响Fig.2 Changes of glucosinolate(A)and(B)contents in broccoli stems stored at 25℃and 4℃ over time
2.3 锌盐浸泡处理对西兰花茎中硫苷和异硫氰酸盐含量的影响
由图3(A)可知,随着Zn2+浓度增加,西兰花茎中硫苷含量呈先下降后增加的趋势,但均显著低于对照组(P<0.05)。当 Zn2+浓度为100 μmol/L时,硫苷的含量降低至最低,为19.09 μmol/100 gDW,比对照组降低了30.23%。
由图3(B)可知,随着Zn2+浓度的增加西兰花茎中异硫氰酸盐含量呈先增加后降低的趋势,但均显著高于对照组(P<0.05),当 Zn2+浓度为100 μmol/L时,异硫氰酸盐含量达到最大,为608.32 mg/gDW,比对照组增加了28.38%,随后异硫氰酸盐的含量开始降低。
2.4 不同pH缓冲液对西兰花茎中硫苷和异硫氰酸盐含量的影响
由图4(A)可知,随着pH升高,西兰花茎中硫苷含量呈先下降后增加的趋势,但均显著低于对照组(P<0.05)。当pH为7.5时,硫苷的含量最低,为19.65 μmol/100gDW。
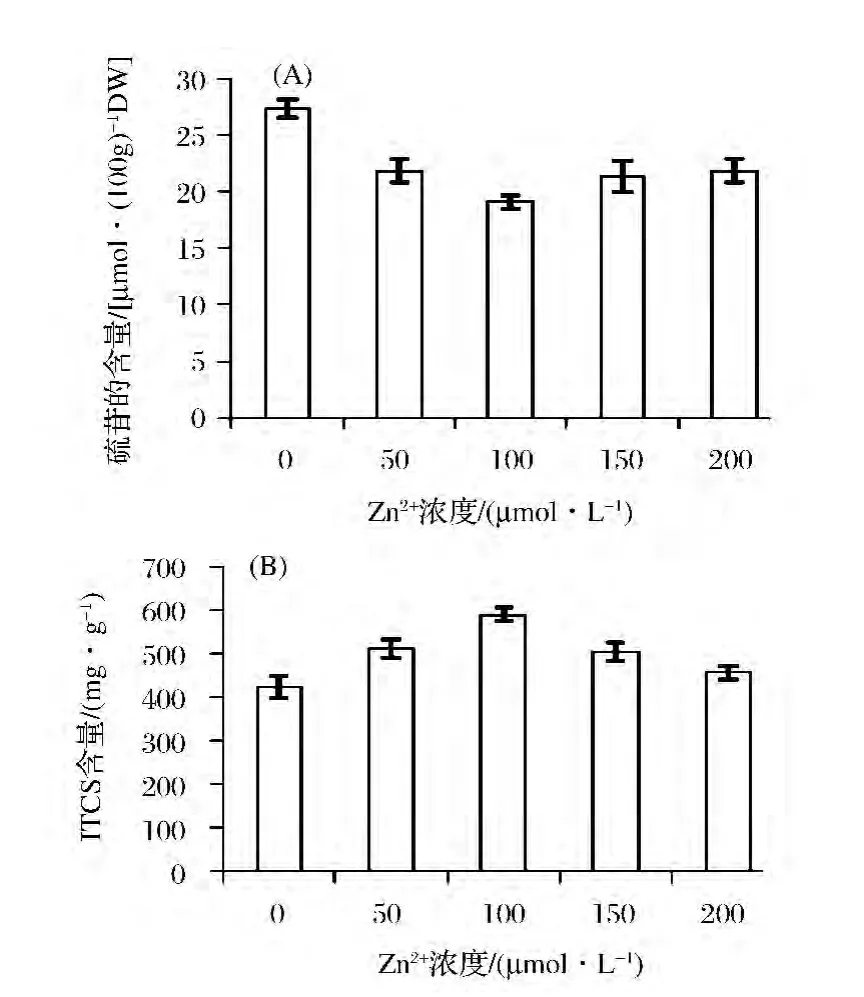
图3 不同浓度Zn2+对西兰花茎中硫苷(A)和异硫氰酸盐(B)含量的影响Fig.3 Effect of different Zn2+concentration on the glucosinolate(A)and isothiocyanates(B)contents in broccoli stems

图4 不同pH对西兰花茎中硫苷(A)和异硫氰酸盐(B)含量的影响Fig.4 Effect of different pH value on the glucosinolate(A)and isothiocyanates(B)contents in broccoli stems
由图4(B)可知,在不同pH缓冲液处理下,异硫氰酸盐含量呈先下降后增加再降低的趋势,但与对照组都有显著差异(P<0.05)。pH较低时不利于异硫氰酸盐的生成,当pH值逐渐升高到7时,异硫氰酸盐的含量达到最高,为654.36 mg/gDW,为对照组的1.42倍,随后下降。
2.5 抗坏血酸处理对西兰花茎中硫苷和异硫氰酸盐含量的影响
由图5(A)可知,随着抗坏血酸浓度的增加西兰花茎中硫苷的含量呈逐渐增加的趋势,但都显著低于对照组(P<0.05)。当抗坏血酸的浓度为50 μmol/L时,西兰花茎中硫苷的含量达到最低为9.96 μmol/100gDW,为对照组的45.67%。
由图5(B)可知,随着抗坏血酸浓度的增加西兰花茎中异硫氰酸盐含量呈逐渐降低的趋势,但都显著高于对照组(P<0.05)。当抗坏血酸的浓度为50 μmol/L时,西兰花茎中异硫氰酸盐的含量达到最高为291.06 mg/gDW,为对照组的1.97倍。

图5 不同的抗坏血酸浓度对西兰花茎中硫苷和异硫氰酸盐含量的影响Fig.5 Effect of different ascorbic acid concentrations glucosinolates and isothiocyanates contents in broccoli stems
2.6 热激处理对西兰花茎中硫苷和异硫氰酸盐含量的影响
由图6(A)可知,当温度为35、55℃时,西兰花茎中硫苷的含量与对照组相比显著降低(P<0.05),当温度为85、100℃时,与对照组相比硫苷的含量显著升高。当温度为35℃时,硫苷的含量最低为26.44 μmol/100gDW,与对照组相比降低了16.12%。
由图6(B)可知,当温度为35、55℃时,有利于西兰花茎中异硫氰酸盐的生成,当温度为85、100℃时,异硫氰酸盐的含量明显低于其他实验组,当温度为35℃时,异硫氰酸盐的含量为597.13 mg/gDW,为对照组的1.20倍,为100℃时异硫氰酸盐含量的1.80倍。
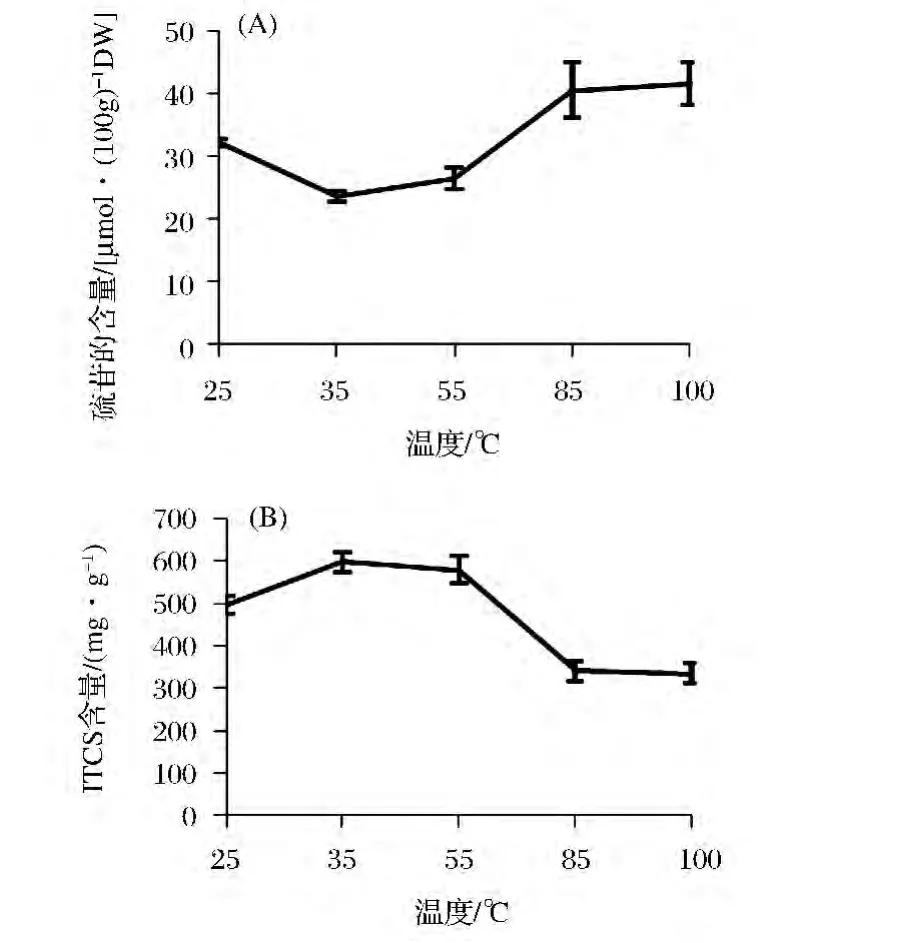
图6 不同温度对西兰花茎中硫苷(A)和异硫氰酸盐含量(B)的影响Fig.6 Effects of different temperatures on the glucosinolates and isothiocyanates contents in broccoli stems
3 讨论
机械损伤影响硫苷降解以及异硫氰酸盐的生成,本实验研究不同机械切分大小对西兰花茎中硫苷和异硫氰酸盐含量的影响,结果表明机械切分有利于硫苷降解生成异硫氰酸盐,并且随着机械切分程度的加深作用更加明显,这与田红霞等人对拟南芥莲座叶外叶的研究结果一致[19]。机械损伤可以使细胞破碎,使细胞当中的黑芥子酶与液泡中的硫苷相遇,使硫苷在酶的作用下降解生成具有热辣气味的风味物质,包括异硫氰酸酯和腈类等物质[20]。
低温贮藏为西兰花茎营造了逆境条件,本实验研究在4℃条件下不同贮藏时间对西兰花茎中硫苷和异硫氰酸盐含量的影响,结果表明低温抑制硫苷的降解和异硫氰酸盐的生成。主要是因为在低温条件下黑芥子酶的活性降低,硫苷降解生成异硫氰酸盐的过程受阻。
pH缓冲液的浸泡处理使西兰花茎处于不同的酸碱环境中,实验结果表明,本研究选取的pH范围内有利于硫苷的降解,在pH值为7的条件下有利于异硫氰酸盐的生成,这与SHEN[21]等人的研究结果相同。在酸性的条件下硫苷虽然降解,但是生成的物质为腈类和硫氰酸盐为主,并不生成异硫氰酸盐[21]。
Zn2+、抗坏血酸溶液浸泡在为西兰花茎创建了低氧腌渍逆境的条件下,同时也提供Zn2+和抗坏血酸。本实验结果表明较低浓度的Zn2+和抗坏血酸对硫苷的降解和异硫氰酸盐的生成有促进作用,而较高浓度的Zn2+和抗坏血酸则有一定的抑制作用。丁艳[22]在油菜籽饼粕中硫苷降解稳定性的研究中以及王向阳[23]在西兰花中硫苷降解的稳定性的研究中得出相似的结论。主要原因是因为Zn2+和抗坏血酸对黑芥子酶活性的影响具有双面性[24-25],即低浓度的Zn2+和抗坏血酸增加黑芥子酶的活性,高浓度Zn2+和抗坏血酸降低黑芥子酶的活性。
热激处理使西兰花茎处于逆生长条件下,实验结果表明温度在较底范围内,随着温度的升高,黑芥子酶的活性升高,有利于硫苷的降解,在较高温度范围内,随着温度的升高,酶的活性逐渐降低,硫苷的降解受到抑制,当温度达到85℃时,黑芥子酶在短时间内失活,硫苷的酶降解无法进行。虽然有研究表明硫苷除酶降解以外也可以进行热降解,但是需要较高的温度或较长的时间[25-27]。
机械切分、冷激、热激、不同pH值溶液和不同浓度的Zn2+、抗坏血酸溶液浸泡处理对西兰花茎中的硫苷和异硫氰酸盐的含量都有明显的影响。机械切分、适宜的热激Zn2+、抗坏血酸以及酸碱度都有利于硫苷的降解和异硫氰酸的生成,而低温抑制硫苷的降解。可以根据这些特性处理西兰花茎使得其中的异硫氰酸盐得到富集。
[1] 李晨,薛峰,缪文华.硫甙葡萄糖苷降解研究进展[J].食品科学,2010,31(9):313-317.
[2] 王忠英,王向阳.硫代葡萄糖苷及其降解产物异硫代氰酸盐[J].食品化学,2005,25(4):342-344
[3] 钱骅,赵伯涛,黄晓穗.西兰花中β-硫甙葡萄糖苷总量的测定[J].中国野生植物资源,2008,27(2):52-53
[4] Burow M,ZHANG Z Y,Ober J A,et al.ESP and ESM1 mediateindol-3-acetonitrile production from indol-3-ylmethyl glucosinolate in Arabidopsis[J].Phytochemistry,2008,69(3):663-664.
[5] 张清峰,姜子涛.辣根等十字花科蔬菜中硫甙水解产物异硫氰酸酯的生物活性[J]食品研究与开发,2005.26(3):83-87
[6] Jain M G,Hislop G T,Howe G R,et al.Plant food,antioxi dants,and prostate cancer risk:findings from case cpmtrp;stidoes om Canada[J].Nutr Cancer,1999,34:173 - 174
[7] Conhen J H,Kristal A R,Stanford J L.Fruit and vegetaleientakes and protate cancer risk[J].J Natl Cancer Inst,2000,92:61 -68.
[8] Michaud D S,Spiegelman D,Clinton S K,et al.Fruit and vegetable intake of bladder cancer in a male prospective cohort[J].J Natl Cancer Inst,1999,91:605 - 613.
[9] Delaquis P J,azza G.Antimicrobial properties of iso-thiocyanates in food preservation[J] Food Techology,1995,49:73-79
[10] Tawfiq N,Heaney R k,Plumber J A,et al.Dietary glucosinolates as bloking agents against carcinogenesis:glucosinolates breakdown products assessed by induction of quinine reductase activity in murine hepalclc7 cells[J].Carcinogenesis,1995,16:1 191 -1 194.
[11] JIANG Zitao,LI Rong,YU J C.Pungent components fromthioglucosides in Armoracia rusticana grown in China,obtained by enzymatic hydrolysis[J].Food Technol Biotechnol,2006,44(1):41-45.
[12] SHEN L Q,SU G Y,WANG X Y.Endogenous and exogenousenzymolysis ofvegetable-sourced glucosinolates and in uencing factors[J].Food Chemistry,2009,8(3):1-2.
[13] 张清峰,姜子涛,张云华.辣根中异硫氰酸酯的水解稳定性研究[J].食品科学,2005.26(11);125-127
[14] Lüthy B,Matile P H.The mustard oil bomb:rectified analysis of the subcellular organization of the myrosinase system[J].Biochem Physiol Pflanz,1984,179:5 -12.
[15] Grob K,Matile P H.Compartmentation of ascorbic acid in vacuoles of horseradish root cells.Note on vacular peroxidase[J].Zeitschrift für Pflanzenphysiologie,1980,98(3):235-243.
[16] 赵艳,蔣予箭.采摘后芦笋中γ-氨基丁酸生物合成影响因素的初步研究[J].食品研究与开发,2007,9(28):14-17
[17] 甘莉,金良,邹国玲.氯化钯法测定硫代葡萄糖甙含量的最佳测定条件探讨[J],华中农业大学学报,1999,18(6);592-595
[18] 陈虹霞,王成章,叶建中,等.辣根硫甙葡萄糖水解工艺比较及其水解产物的结构鉴定[J].林业化学与工业.2009,29(2);100-104
[19] 田云霞,戴邵军,陈学思,等.机械损伤对拟南芥莲座叶芥子油含量和组成的影响[J].生态学报,2009.29(4);1647-1654
[20] Bones A M,Rossiter J T.The myrosinase-glucosinolate system,its organization and biochemistry[J].Physiologia Plantarum,1996,97:204-205.
[21] SHEN L Q,SU G Y,WANG X Y.Endogenous and exogenous enzymolysis of vegetable-sourced glucosinolates and in uencing factors[J].Food Chemistry,2009,8(3):1-2.
[22] 丁艳,曹蓉等,油菜籽饼粕中硫苷的酶解条件优化及降解产物分析[J]中国农业科学,2014,47(2);383 -393
[23] 王向阳,周蓉.西兰花中提取的萝卜硫苷的稳定性的研究[J]食品科技,2009,12(34);250-252
[24] Pan S Y,Hydamaka A,Kuo A.Horseradish flavor formation optimization[J].Transactions of the CSAE,2003,19(5):141-145.
[25] Macleod A J,Rossiter J T.Non-enzymic degradation of 2-hydroxybut-3-enylglucosinolate(progoitrin)[J].Phytochemistry,1986,25:855 -858.
[26] Oerlemans K,Barrett D M.Thermal degradation of glucosinolates in red cabbage[J].Food Chemistry,2006,95:19-29
[27] Bones A M,Rossiter J T.The enzymic and chemically induced decomposition of glucosinolates[J].Phytochemistry,2006,67:1 053-1 067.

