肥胖对小鼠肝脏铁代谢调控分子hepcidin、lipocalin-2和ferroportin-1表达的影响
张万山,李 蔓,高 倩,王 辰,魏守刚
(1.首都医科大学公共卫生学院儿少卫生与妇幼保健学系,北京 100069; 2.首都医科大学,环境毒理学北京市重点实验室,北京 100069)
肥胖对小鼠肝脏铁代谢调控分子hepcidin、lipocalin-2和ferroportin-1表达的影响
张万山1,2,李 蔓1,2,高 倩1,2,王 辰1,2,魏守刚1,2
(1.首都医科大学公共卫生学院儿少卫生与妇幼保健学系,北京 100069; 2.首都医科大学,环境毒理学北京市重点实验室,北京 100069)
目的通过建立高脂饮食诱导的肥胖动物模型,观察肥胖对小鼠肝脏中铁代谢相关调控分子铁调素(hepcidin)、脂质运载蛋白-2(lipocalin-2,LCN2)和膜铁输出蛋白-1(ferroportin-1,FPN1)mRNA及蛋白表达的变化,初步探讨肥胖影响肝脏铁代谢相关分子表达调控的机制。方法将4~6周龄C57BL/6J小鼠随机分为正常对照组和膳食诱导的肥胖模型组,每组10只,对照组给予正常饲料喂养,肥胖组给予高脂饲料喂养,实验饲喂周期为15周。建模成功后取小鼠肝脏,采用实时荧光定量PCR法检测小鼠肝脏中铁代谢相关调控分子hepcidin、LCN2和FPN1 mRNA的表达,并应用Western Blot法检测小鼠肝脏LCN2和FPN1蛋白的表达。结果 与对照组小鼠比较,肥胖模型组小鼠肝脏hepcidin mRNA表达水平显著升高,差异具有统计学意义(P<0.05),而LCN2和FPN1 mRNA及蛋白表达水平差异无统计学意义(P>0.05)。结论肥胖可以显著上调小鼠肝脏hepcidin的表达,而对肝脏铁代谢相关调控分子LCN2和FPN1的表达并无显著影响。故还不能够认为肥胖可以影响肝脏铁代谢调控分子lipocalin-2和ferroportin-1的表达,进而导致细胞摄取及释放铁的能力发生障碍,使得机体对铁的需求不能满足要求,出现铁代谢功能紊乱,导致肥胖性铁缺乏的发生,而是通过上调肝脏hepcidin表达直接或间接影响其他铁代谢相关调控分子或者存在更为复杂的调控机制,这仍需我们进一步的实验研究及探索。这也为进一步研究肥胖对肝脏铁代谢相关调控分子表达的影响及引起铁缺乏的机制提供了理论和实验基础。
肥胖;铁代谢;铁调素;脂质运载蛋白-2;膜铁输出蛋白-1
随着现代居住条件的改善、交通的发展、加之学习负担的加重,学生进行户外活动、体育锻炼、做家务等身体活动的时间越来越少,这就导致机体摄入的总能量与身体活动消耗的总能量不平衡,使得我国儿童青少年超重和肥胖流行日趋严重,已经成为影响我国儿童青少年身心健康的重要问题[1]。铁是人体内含量最丰富的必需微量元素,是维持生命的主要物质之一,具有重要生理功能,儿童缺铁除导致贫血外,还使运动能力低下、体温调节不全、智力发育障碍、免疫力下降等。肥胖和铁缺乏是我国乃至全球儿童面临的两大公共卫生问题,许多研究提示肥胖存在着铁代谢的异常,早在1960年代,就有学者发现青少年血清铁水平的下降与肥胖密切相关[2-3],而近年来的许多研究发现,肥胖患者比正常体重人群更易发生铁缺乏、缺铁性贫血从而加重对健康的危害[4],并且肥胖与铁缺乏集于一身,会使儿童受到双重健康危害[5],例如运动能力下降和认知功能受损程度远大于任何一种因素单独存在时[6-8]。因此防治肥胖性铁缺乏、缺铁性贫血成为当前急需解决的课题。
在机体铁稳态的调节中,hepcidin、lipocalin-2和ferroportin-1起着调节机体铁代谢平衡的作用。hepcidin主要在肝细胞中合成,之后分泌至血液将体内铁需要的信号传至小肠,参与机体铁稳态的调控[9]。ferroportin-1在脾和肝脏的巨噬细胞等都有表达,是重要的跨膜铁输出分子,参与机体的铁吸收和巨噬细胞对铁的再循环等过程[10]。lipocalin-2广泛分布于人体各种组织,包括肺,肝脏的脂肪细胞和巨噬细胞,lipocalin-2可结合转运小分子铁化合物到细胞膜,从而激活或抑制铁应答基因[11]。
目前有研究证实肥胖可以使小鼠十二指肠铁代谢相关调控分子二价金属离子转运体(divalent metal transporter 1,DMT1)和FPN1表达下降,进而肠上皮细胞吸收和释放铁的能力减弱,造成机体不能满足对铁的需求,导致肥胖性铁缺乏的发生[12],然而有关肥胖对肝脏铁代谢相关调控分子表达影响的机制研究较少,相关铁代谢分子相互作用方式尚不清楚。因此本实验旨在通过构建高脂膳食诱导的肥胖动物模型,观察肥胖对肝脏铁代谢相关调控分子hepcidin、LCN2和FPN1表达的影响,初步探讨维持机体铁代谢稳态的分子调控机制,为进一步研究及有效预防和治疗肥胖性铁代谢障碍提供理论机制基础。
1 材料和方法
1.1 动物分组及处理
健康野生型C57BL/6J小鼠4~6周龄20只(雌性),体重10~14 g,由军事医学科学院实验动物中心提供【SCXK(军)2012-0004】。实验动物饲养于首都医科大学实验动物中心【SYXK(京)2010-0022】无特定病原体(specific-pathogen free,SPF)级动物房。随机分为两组:高脂膳食组、普通膳食组,每组10只。普通膳食组饲以SPF级普通饲料,高脂膳食组饲以SPF级高脂饲料(由军事医学科学院实验动物科学部生产)。高脂饲料配方为:猪油10%、基础饲料79%、蛋黄粉10%、胆固醇1%。两组小鼠均自由饮水,饲养期15周,每周称量体重一次,比较两组动物体重差异并计算模型组动物肥胖度,最终建立肥胖动物模型。动物实验符合《实验动物管理条例》,并经首都医科大学伦理委员会认可。
建模成功后,用10%水合氯醛400 mg/kg体重腹腔注射麻醉小鼠并固定于固定板上,腹部采用75%酒精及碘伏消毒,行纵行切口开腹暴露腹腔,迅速取肝脏组织,使用生理盐水冲洗后转移至冻存管内放入液氮中,随后转入-80℃冰箱保存备用。
1.2 RT-PCR法检测小鼠肝脏hepcidin、LCN2和FPN1 mRNA表达量
取冻存组织80±5 g,用超纯RNA提取试剂盒(CWbio.Co.Ltd,Cat#CW0581)提取总 RNA。取5μL RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性。用DNaseⅠ试剂盒(CWbio.Co.Ltd,Cat# CW2090)对RNA中残留的基因组DNA进行消化处理。处理后的总RNA样本用HiFi-MMLVcDNA第一链合成试剂盒(CWbio.Co.Ltd,Cat#CW0744)进行反转录,严格按照使用说明进行实验操作。
应用 ABI 7500型荧光定量 PCR仪(美国Applied Biosystems公司),按照Ultra SYBR Mixture PCR试剂盒(With ROX)(CWbio.Co.Ltd,Cat# CW0956)进行扩增。扩增反应体系为20 μL:2× UltraSYBR Mixture 10 μL,上游引物0.4 μL(浓度10μM/mL),下游引物0.4 μL(浓度10 μM/mL),cDNA 2μL。扩增程序为:95℃预变性10 min,(95℃15 s,60℃ 60 s)×45个循环,每个样本同时做3个重复。β-actin上游引物序列为 5'-GCC TTC CTT CTT GGG TAT-3',下游引物序列为5'-GGC ATA GAG GTC TTT ACG G-3',hepcidin上游引物序列为5'-TGC CTG TCT CCT GCT TCT CCT CC-3',下游引物序列为5'-TCG CAA TGT CTG CCC TGC TTT C-3',lipocalin-2上游引物序列为5'-CAC GGA CTA CAA CCA GTT CG-3',下游引物序列为5'-TGA TGT TGT CGT CCT TGA GG-3',ferroportin-1上游引物序列为5'-CCC TTC CGC ACT TTC CGA AT-3',下游引物序列为5'-GAG AAT AGA CCA GTC CGA ACA AGG C-3'。实验结果采用2-△△CT法进行数据的相对定量分析,即△Ct=Ct目的基因-Ct内参基因;△△CT=△Ct实验组- △Ct基准组。
1.3 Western Blot法检测小鼠肝脏LCN2和FPN1蛋白表达量
应用RIPA试剂提取小鼠肝脏组织蛋白,BCA法测定蛋白浓度,并用RIPA试剂调整蛋白浓度为4 mg/mL,煮沸变性5 min。根据目的蛋白的分子量,配制12%的分离胶,待检测蛋白样品上样量为20 μg/孔,300 mA恒流,转移至0.45 μm孔径NC膜,转膜时间1 h,转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。将膜完全浸没3%BSATBST中室温轻摇30 min进行封闭,然后加入兔抗LCN2、FPN1多克隆抗体(英国 Abcam公司,1∶2000)室温孵育10 min,放4℃过夜。第二天取出膜使用TBST洗膜5次(3 min/次)后加入1∶5000辣根过氧化物酶(HRP)标记的山羊抗兔IgG(H+L)抗体(北京天德悦生物科技有限公司)室温轻摇40 min,洗膜6次(3 min/次),使用ECL加到膜上后反应3~5 min,胶片曝光,显影 2 min,定影。以GAPDH鼠单抗作为内参,重复试验3次。胶片曝光结果扫描输入计算机后,用Totallab quant凝胶定量分析软件进行处理,以目的蛋白与内参蛋白的积分光密度(integral optical density,IOD)比值表示相对表达水平。
1.4 统计分析
2 结果与分析
2.1 肥胖动物模型的构建
肥胖动物模型组与对照组小鼠,分别饲喂高脂饲料及普通饲料,每周称量体重,自第三周起肥胖模型组小鼠体重较对照组小鼠体重出现明显增长,具有显著性差异,且随着干预时间延长,两组的体重差异逐渐增大,至干预第15周,肥胖模型组和对照组小鼠平均体重分别为34.08±1.28 g和24.50 ±0.85 g(图1)。依据肥胖度计算公式计算肥胖模型组每只小鼠的肥胖度:肥胖度(%)=(模型组实际体重 -对照组平均体重)/对照组平均体重 × 100%,结果肥胖模型组全部小鼠体重均高于对照组小鼠平均体重的20%,且最轻体重小鼠肥胖度为27.65%,故可以判定肥胖动物模型建立成功。
2.2 RT-PCR相对定量结果分析
通过超纯RNA提取试剂盒提取小鼠肝脏组织样本中总RNA后,利用分光光度计检测提取RAN的纯度,结果表明各样本的OD值A260/280均处于1.9~2.1之间,说明RNA纯度较高。分别取5 μL各样本 RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性,可见28s rRNA、18s rRNA和5s rRNA三条条带,无明显拖带,且28S条带相比18S的条带亮度高2倍,说明RNA完整性好,没有被降解(图2)。

图1 肥胖模型组与对照组小鼠各周平均体重Fig.1 Body weight in different weeks of different groups

图2 肝脏样本RNA凝胶电泳图Note:1,2,3:control group;4,5,6:model group.Fig.2 The gel electrophoresis figure of the liver RNA
应用ABI 7500型荧光定量PCR仪,分别对内参基因引物和目的基因引物进行扩增,同时在60℃~95℃进行融解曲线分析,仪器自动绘制出对应的内参基因标准曲线和目的基因的标准曲线,各标准曲线的相关系数(R2)均达到0.99,说明线性相光度很高,且扩增效率均在90%以上,溶解曲线呈单峰,即各基因均为特异性扩增。根据实时荧光定量PCR原始检测结果,按照2-△△ct相对定量计算公式,计算出各样品的目的基因相对定量结果。经统计分析可知,与对照组比较,肥胖模型组小鼠 hepcidin mRNA的相对表达水平显著升高,差异具有统计学意义(P<0.05),而LCN2和FPN1 mRNA的相对表达水平差异不具有统计学意义(P >0.05)(图3)
2.3 Western Blot相对定量结果分析
小鼠肝脏样本进行目的蛋白的Western Blot检测,所得胶片扫描结果见图4。利用分析软件进行
每个条带的灰度值分析,然后利用目的蛋白的灰度值除以内参蛋白的灰度值以校正误差,所得结果即为样本目的蛋白的相对表达量,由图5可知模型组小鼠与对照组小鼠目的蛋白LCN2和FPN1的相对表达量差异不具有统计学意义(P>0.05)。

图3 两组小鼠肝脏LCN2、FPN1和hepcidin mRNA相对表达量Note:*compared with control group P<0.05,#compared with control group P>0.05.Fig.3 The mRNA relative expression of LCN2,FPN1 and hepcidin in liver of two group mice
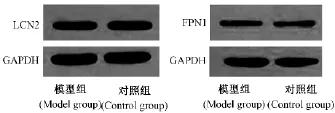
图4 Western Blot胶片扫描条带Fig.4 The film scanning strip of western blot

图5 两组小鼠肝脏LCN2和FPN1蛋白的相对表达量Note:#compared with control group P >0.05.Fig.5 The protein relative expression of LCN2 and FPN1 in liver of the two groups mice
3 讨论
肥胖是指进食热量多于身体消耗量并以脂肪形式储存于体内,当体脂增加使体质量超过标准体质量20%或BMI>24 kg/m者称为肥胖症。肥胖症是多种慢性非传染性疾病的危险因子,如高血压、糖尿病、冠心病、脑血管疾病、慢性肾脏病等,同时也给社会带来了巨大的疾病负担。因此,防治肥胖症具有十分重要的意义。肥胖动物模型是研究肥胖及其相关疾病发病机制的主要工具,其中与人类肥胖最为接近的高脂饮食诱导营养性肥胖动物模型的应用最为广泛[13],而在国内外很多相关研究中,由于C57BL/6J小鼠对高脂饮食又较为敏感,故常被采用。因此,本实验采用C57BL/6J小鼠作为研究对象建立高脂饮食诱导的肥胖动物模型,以高脂组体质量超过对照组平均体质量20%,且差异有统计学意义为标准,判断肥胖动物模型是否构建成功。
在机体整体铁稳态调节中,体内铁的代谢平衡主要依靠肠道对铁吸收的调节,而在分子水平,机体内铁的平衡则主要依赖于多种铁代谢调节分子调控的影响,如肠铁吸收和释放铁主要依赖于十二指肠上皮细胞的铁相关蛋白的介导,而其中起关键调节作用的分子为DMT1和FPN1,并有研究证实在肥胖状态下DMT1和FPN1表达下降,使得肠上皮细胞吸收和释放铁的能力减弱,造成机体不能满足对铁的需求,导致肥胖性铁缺乏的发生[12]。然而在肥胖状态下,是否也存在对肝脏中铁代谢相关调控分子hepcidin、LCN2和FPN1类似的调控机制和结果呢?目前国内外有关肥胖对肝脏铁代谢相关调控分子影响及相互作用机制的研究还不甚清楚。作为机体铁稳态的调节因子,hepcidin、LCN2和FPN1起着调节机体铁代谢平衡的作用。hepcidin是2000年发现的一种在肝脏合成并富含半胱氨酸的抗菌多肽,之后分泌至血液,将体内铁需要的信号传至小肠,参与机体铁稳态的调控,其表达受机体信号因子以及炎症、低氧等疾病状态的影响[14],hepcidin是主要的铁调节激素,炎症性贫血的关键调节剂、铁代谢和固有免疫之间联系的桥梁,在机体铁代谢平衡的调节中起关键作用。Pigeon等[15]在寻找与小鼠肝铁负荷增多相关基因时,明确铁调素是机体铁稳态调控中一种重要的调节因子。FPN1(2000年发现)在成熟的十二指肠绒毛上皮细胞基底面、脾和肝的巨噬细胞等都有表达,是一种重要跨膜的铁输出蛋白,是铁离子释放的唯一出口,负责将细胞内的铁转运出细胞,有研究表明,hepcidin表达增加时,可结合FPN1,促使其在溶酶体内内化和降解,从而有效阻止细胞内铁的排出;相反,hepcidin表达减少时,以允许大部分铁通过FPN1流出,来维持细胞外正常的铁浓度[16]。LCN2主要是由脂肪组织分泌的脂肪细胞因子之一,广泛分布于人体各种组织,包括肺、肝脏、胸腺、肾脏、小肠、脂肪细胞以及巨噬细胞,有研究发现肝脏以及脂肪组织可能是肥胖状态下循环中过多的LCN2的主要来源,LCN2具有铁代谢相关运铁蛋白功能,可结合转运小分子铁化合物到细胞膜,从而激活或抑制铁应答基因,体外研究也证明,LCN2能增强细胞铁吸收能力[17]。
综上所述,本实验通过构建高脂膳食诱导的肥胖动物模型,观察肥胖对肝脏铁代谢相关调控分子hepcidin、LCN2和FPN1表达的影响,初步探讨维持机体铁代谢稳态的分子调控机制。本次实验实时荧光定量 PCR结果表明,肥胖模型组小鼠肝脏hepcidin表达水平显著高于对照组,而hepcidin作为一种肝脏分泌的负性铁调节因子,Nicolas等[18]发现USF2基因敲除的小鼠,其下游的hepcidin基因不表达,造成肝脏和胰脏铁大量积累,并与遗传血色病(hereditary haemochromatosis,HH)、HFE、β2-M缺陷小鼠相似 (Fleming 2001,Ahmad 2002);然而hepcidin转基因小鼠的肝脏,由于过早、过多的表达hepcidin,导致了铁的严重缺乏而造成贫血。且近期的一项研究也证实肥胖会下调机体十二指肠DMT1和FPN1的表达,进而导致铁吸收不良[12],因此可以证明肥胖可以显著上调肝脏hepcidin的表达,进而造成机体铁代谢功能紊乱,造成铁缺乏的发生。而肝脏铁代谢相关调控分子LCN和FPN1的表达水平在模型组与对照组间并无显著性差异,表明肝细胞摄取及释放铁的能力并无明显变化,故还不能够认为肥胖可以影响肝脏铁代谢调控分子LCN2和FPN1的表达,进而导致细胞摄取及释放铁的能力发生障碍,使得机体对铁的需求不能满足要求,出现铁代谢功能紊乱,导致肥胖性铁缺乏的发生,而可能是通过上调肝脏hepcidin表达直接或间接影响其他铁代谢相关调控分子或者存在更为复杂的调控机制,这仍需我们进一步的实验研究及探索。这也为进一步研究肥胖对肝脏铁代谢相关调控分子表达的影响及引起铁缺乏的机制提供了理论和实验基础。
[1]马军,蔡赐河,王海俊.1985-2010年中国学生超重与肥胖流行趋势[J].中华预防医学杂志,2012,46(9):776-780.
[2]Wenzel B J,Stults H B,Mayer J.Hypoferraemia in obese adolescents[J].The Lancet,1962,280(7251):327-328.
[3]SELTZER C C,MAYER J.Serum Iron and Iron-Binding Capacity in Adolescents II.Comparison of Obese and Nonobese Subjects[J].The American Journal of Clinical Nutrition,1963,13(6):354-361.
[4]Nead K G,Halterman J S,Kaczorowski J M,et al.Overweight children and adolescents:a risk group for iron deficiency[J].Pediatrics,2004,114(1):104-108.
[5]Manios Y,Moschonis G,Chrousos G P,et al.The double burden of obesity and iron deficiency on children and adolescents in Greece:the Healthy Growth Study[J].Journal of Human Nutrition&Dietetics,2013,26(5):470–478.
[6]Cepeda-Lopez A C,Osendarp S J M,Melse-Boonstra A,et al.Sharply higher rates of iron deficiency in obese Mexican women and children are predicted by obesity-related inflammation rather than by differences in dietary iron intake[J].The American journal of clinical nutrition,2011,93(5):975-983.
[7]Saloojee H,Pettifor J M.Iron deficiency and impaired child development:the relation may be causal,but it may not be a priority for intervention[J].BMJ:British Medical Journal,2001,323(7326):1377.
[8]Farr S A,Yamada K A,Butterfield D A,et al.Obesity and hypertriglyceridemia produce cognitive impairment[J].Endocrinology,2008,149(5):2628-2636.
[9]付丽娟,段相林,钱忠明,等.铁代谢与铁调素 hepcidin[J].生理科学进展,2005,36(3):233-236.
[10]李静,钱忠明,常彦忠,等.膜铁转运蛋白Ferroportin 1的研究进展[J].生理科学进展,2005,35(4):349-351.
[11]Wu G,Li H,Zhou M,et al.Mechanism and clinical evidence of lipocalin-2 and adipocyte fatty acid-binding protein linking obesity and atherosclerosis[J].Diabetes/metabolism Research&Reviews,2013,30(6):447-456.
[12]高倩,李蔓,张万山,等.肥胖对小鼠十二指肠 DMT1和FPN1表达的影响[J].中国比较医学杂志,2014,24(9):18-22.
[13]汤锦花,严海东.营养性肥胖大鼠模型的建立及评价[J].同济大学学报:医学版,2010,31(1):32-34.
[14]Rochette L,Gudjoncik A,Guenancia C,et al.The ironregulatory hormone hepcidin:A possible therapeutic target[J].Pharmacology&Therapeutics,2014:35-52.
[15]Pigeon C,Ilyin G,Courselaud B,et al.A new mouse liverspecificgene, encoding a protein homologous to human antimicrobial peptide hepcidin,is overexpressed during iron overload[J].Journal of biological chemistry,2001,276(11): 7811-7819.
[16]王书敏,于鹏,段相林,等.膜铁转运蛋白1,铁调素的靶分子[J].生物物理学报,2006,22(1):12-18.
[17]Wang Y,Lam K S L,Kraegen E W,et al.Lipocalin-2 is an inflammatory marker closely associated with obesity,insulin resistance, and hyperglycemia in humans[J]. Clinical chemistry,2007,53(1):34-41.
[18]G N,M B,I D,et al.Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2( USF2) knockout mice[J].Proceedings of the National Academy of Sciences,2001,98(15):8780-8785.
Effects of obesity on the expression of hepcidin,lipocalin-2 and ferroportin-1 related with iron metabolism of mice’s liver
ZHANG Wan-shan1,2,LI Man1,2,GAO Qian1,2,WANG Chen1,2,WEI Shou-gang1,2
(1.Department of Maternal,Child and Adolescent Health,School of Public Health,Capital Medical University,Beijing 100069,China; 2.Beijing Key Laboratory of Environmental Toxicology,Capital Medical University,Beijing 100069,China)
Objective We established the animal models of obesity induced by high-fat diet,in order to study the mRNA and protein expression of regulation molecules related with iron metabolism about hepcidin,lipocalin-2(LCN2),ferroportin-1(FPN1)in obese mice’s liver and the molecular regulation mechanism.Methods C57BL/6J(4~6 weeks)mice were randomly divided into control group and obesity model group,each group of ten.The obesity group were fed with a high-fat diet and the control group were given the normal diet for lasting 15 weeks.After we successfully established the obesity animal model,the expression level of hepcidin,LCN2 and FPN1 mRNA in the liver were measured by Real-time fluorescent quantitative PCR method and the protein expression level of LCN2 and FPN1 were measured by Western-Blot.Results Compared with the control group,the expression level of hepcidin mRNA in the liver was increased in obesity group(P<0.05),however,the expression level of LCN2,FPN1 was no significant difference(P>0.05).Conclusion Obesity can increase the expression of hepcidin mRNA,however,there was no significantly effect on the expression of LCN2,FPN1.So,we can’t think that obesity can affect the expression of LCN2 and FPN1,lead to the ability of cells uptake and release iron abnormal,then appear iron metabolism disorders.As a result,leading to iron deficiency.Maybe obesity can affect other regulatory molecules related with iron metabolism through up-regulation the expression of Hepcidin or the more complex regulatory mechanisms.We still need further experimental research and exploration.This research also provides the basis of theoretical and experimental for the further study the effects of obesity on the expression of regulation molecules related with iron metabolism in obesity mice’s liver and the mechanism of iron deficiency.
Obesity;Iron metabolism;Hepcidin;Ferroportin-1;Lipocalin-2
R-332
A
1671-7856(2015)07-0001-06
10.3969.j.issn.1671.7856.2015.007.001
国家自然科学基金资助项目(81373020);北京市自然科学基金资助项目(7112014)。
张万山(1987-),男,硕士,主要从事肥胖与铁缺乏及肝脏铁代谢相关调控分子影响机制的研究,E-mail:wanshan0822@ 163.com。
魏守刚(1965-),男,教授,主要从事儿童期慢性病预防控制,E-mail:shangwei@ccmu.edu.cn。
2015-07-02

